Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.25 no.1 Bogotá Jan./June 2007
FITOMEJORAMIENTO, RECURSOS GENÉTICOS Y BIOLOGÍA MOLECULAR
Cristina Diazgranados1 y Alejandro Chaparro2
1 Grupo de Ingeniería Genética de Plantas, Departamento de Biología, Universidad Nacional de Colombia, Bogotá. e-mail: ecdiazg@unal.edu.co
2 Profesor asistente, Director Grupo de Ingeniería Genética de Plantas, Departamento de Biología, Universidad Nacional de Colombia, sede Bogotá. e-mail:achaparrog@unal.edu.co
Resumen: En el presente estudio se obtuvo un 46% de regeneración en explantes sin cocultivo de Solanum phureja (Juzet et Buck) variedad Yema de huevo clon 1 con la utilización del medio CIP-MS suplementado con reguladores de crecimiento (2 mg· L-1 ZR, 0,02 mg· L-1 ANA, 0,02 mg· L-1 AG3). A fin de mejorar los porcentajes de regeneración se modificó la proporción citoquininas:auxinas del CIP-MS obteniéndose un 55% de formación de callo con concentraciones de 2 mg· L-1 ZR y 0,04 mg· L-1 ANA. Posteriormente se evaluó el efecto de tres concentraciones de ácido giberélico (0,02 mg· L-1, 0,05 mg· L-1 y 0,1 mg· L-1) obteniéndose un 87,6% de callogénesis y un 48,6% de regeneración mediante la utilización de un medio que contenía 2 mg· L-1 ZR, 0,04 mg· L-1 ANA, 0,02 mg· L-1 AG3 en explantes bajo condiciones de cocultivo. Estos resultados fueron corroborados en un segundo ensayo de regeneración bajo condiciones de cocultivo con Agrobacterium tumefaciens cepa LBA4404 transformada mediante el vector binario pNOV022, de lo cual se obtuvieron porcentajes de callogénesis y regeneración muy similares. Previamente se reportó un promedio de 4 ± 3,3 regenerantes por callo utilizando entrenudos de S. phureja mientras en este estudio se obtuvieron 15,2 ± 3 regenerantes por callo.
Palabras clave: auxinas, citoquininas, callogénesis, cultivo de tejidos.
Abstract: A 46% of regeneration was obtained for explants without co-cultive using the CIP-MS medium (2 mg· L-1 ZR, 0,02 mg· L-1 ANA, and 0,02 mg· L-1 AG3) developed in the International Potato Center. In order to improve the regeneration percentages, it was modified the proportion cytokinins:auxins of the CIP-MS medium, obtaining 55% callus formation having a concentration of 2 mg· L-1 ZR and 0.04 mg· L-1 ANA. Afterwards the effect of gibberellic acid was evaluated in this medium with 3 concentrations (0.02, 0.05, and 0.1 mg· L-1) obtaining 87.6% callus formation and 48.6% regeneration using the medium 2 mg· L-1 ZR, 0,04 mg· L-1 ANA, 0.02 mg· L-1 AG3 in explants under co-cultive conditions. This results were corroborated in a second regeneration assay under the co-cultive conditions with Agrobacterium tumefaciens LBA4404 transformed by the binary vector pNOV022: similar callus formation and regeneration percentages where obtained. It has been reported an average 4 ± 3.3 regenerants/ callus using S. phureja stems, whereas, in the present research, an average of 15.2 ± 3 regenerants/callus was reported.
Key words: auxins, cytokinins, callus formation, tissue culture.
Fecha recepción: 13 de junio de 2006 Aceptado para publicación: 06 de junio de 2007Introducción
SOLANUM PHUREJA es uno de los recursos genéticos colombianos de mayor importancia si se considera su alto valor nutricional, cualidades culinarias, economía y su alto potencial de exportación como producto exótico (Porras, 2000). Debido a estas características Colombia solicitó y obtuvo la exclusión de Solanum phureja del Tratado Internacional sobre Recursos Fitogenéticos (TIRF) de la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), que fue ratificado por 48 países y entró en vigencia a partir de julio de 2004. En el Anexo 1 del artículo 11 de dicho tratado se encuentra el listado de cultivos con acceso facilitado del género Solanum y se excluye la especie S. phureja (FAO, 2001).
A pesar de ser cultivada en otros países andinos como Perú, Ecuador y Bolivia S. phureja no se explota allí comercialmente en el nivel que lo hace Colombia, que es su principal productor, con cerca de 150.000 toneladas por año que representan del 10 al 12% de la papa cultivada en Colombia, y una área de siembra de 25.000 hectáreas aproximadamente (Porras, 2000; Ghislain y Zhang, 2001). La variedad que más se cultiva es la Yema de huevo, aunque en 2005 se liberaron las variedades Colombia, Latina y Paisa por parte del Programa de Mejoramiento de Papa de la Universidad Nacional de Colombia (CEVIPAPA, 2005). El presente trabajo se desarrolló con el clon 1 de la variedad Yema de huevo que en adelante se denominará Clon 1. El cultivo de la papa criolla es atacado por un gran número de insectos plaga y enfermedades que afectan su producción y su calidad; los agricultores acuden al uso de gran cantidad de plaguicidas químicos que representan casi el 20% de los costos totales de producción del cultivo, siendo por tradición la única alternativa de control ante los problemas fitosanitarios (Porras, 2000; López y Espítia, 2000).
Es necesario desarrollar herramientas biotecnológicas para el cultivo S. phureja, tanto para aprovechar la exclusión del TIRF, como para proponer alternativas de solución a los problemas productivos. Debido a esto, se trabajó en el establecimiento de sistemas de mantenimiento in vitro, así como en la micropropagación y regeneración con y sin cocultivo con Agrobacterium tumefaciens, a fin de preparar las condiciones para futuros sistemas de transformación de plantas en esta especie.
El cultivo de tejidos aplica el principio de la ‘totipotencia celular’ para regenerar plantas a partir de células aisladas no diferenciadas, órganos u otros tejidos vegetales, recurriendo a la capacidad de éstos para desdiferenciarse, rejuvenecerse y rediferenciarse nuevamente hasta formar una planta entera. Este principio sólo puede hacerse evidente en presencia de un medio de cultivo adecuado, en el que los reguladores de crecimiento juegan un papel importante al ser los principales agentes de estas transformaciones celulares (Slater et al., 2003; Akbar y Hakoomat, 2004). La totipotencia está determinada por la plasticidad de las células vegetales que, debido a su naturaleza, han desarrollado una gran habilidad para soportar condiciones extremas y expresan su potencial si se aplican los estímulos correctos. Las condiciones necesarias para una regeneración eficiente varían entre las diferentes células y tejidos de la planta, así como entre especies y cultivares (Slater et al., 2003; Akbar y Hakoomat, 2004).
Materiales y métodos
Los experimentos se desarrollaron en el Laboratorio de Biología Molecular y Cultivo de Tejidos del Grupo de Ingeniería Genética de Plantas de la Universidad Nacional de Colombia (IGP-UN), sede Bogotá, adscrito al Departamento de Biología de la Facultad de Ciencias, y en el Laboratorio de Biotecnología de la Facultad de Agronomía de la Universidad Nacional de Colombia, sede Bogotá.
Obtención de explantes
En trabajos anteriores realizados por el IGP-UN se determinó que los explantes más apropiados y que ofrecen mejores resultados para procesos de regeneración de brotes son los entrenudos de material in vitro del Clon 1 de S. phureja con una longitud entre 0,5 y 1 cm, provenientes de plántulas entre cuatro y cinco semanas de edad (Beaujean et al., 1998; Carvajal, 2004).
Medios de regeneración
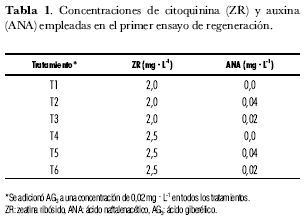
A partir de un medio de regeneración desarrollado en el Centro Internacional de la Papa (CIP) por el Dr. M. Ghislain, que se basa en el medio MS (Murashige y Skog, 1962) y que fue suplementado con reguladores de crecimiento, el cual fue probado en estudios realizados anteriormente (Carvajal, 2004), se buscó su optimización a fin de que ofreciera mejores resultados para la regeneración de brotes de plantas de S. phureja. A tal fin se realizó un ensayo en el que se probaron diferentes concentraciones de los reguladores de crecimiento zeatina ribósido (ZR, citoquinina) y ácido naftalenacético (ANA, auxina) con los que se suplementó el medio CIP-MS. En este primer ensayo de regeneración se evaluaron seis tratamientos con diferentes concentraciones, cada tratamiento constó de tres réplicas cada una con 20 explantes (tabla 1).
En la siguiente fase se escogió el tratamiento en el que mejores resultados de regeneración se observaron entre los seis tratamientos probados anteriormente y, bajo condiciones de cocultivo con A. tumefaciens, se evaluaron tres concentraciones diferentes de ácido giberélico (AG3): 0,02 mg· L-1; 0,05 mg· L-1 y 0,1 mg· L-1. Cada tratamiento contó con siete repeticiones y cada repetición con 15 explantes. El medio de regeneración que mejores resultados arrojó en este ensayo fue complementado con 50 mg· L-1 de ácido ascórbico para evitar la oxidación del material. Con este medio se realizó un segundo ensayo que permitió corroborar los resultados obtenidos en el primer ensayo, a partir de cual se pudo obtener una segunda población de plantas regeneradas co-cultivadas. En este segundo ensayo de regeneración se dividió el proceso en dos etapas con el fin de asegurar mayores porcentajes de regeneración. Se partió de 180 explantes de entrenudo repartidos en 12 réplicas, cada una con 15 explantes.
Condiciones de regeneración
Los explantes se mantuvieron en frascos de vidrio con el sistema tapa-tapón que consiste en una tapa metálica con un orificio que se sella con un tapón de gasa y algodón, metodología recomendada por Chaparro (1999). Los tratamientos fueron almacenados en un cuarto de crecimiento bajo las normas de bioseguridad requeridas, a una temperatura de 20 ± 3 ºC y un fotoperíodo de 16/8 horas. Cada tres semanas se transfirieron los explantes a medios de cultivo nuevos para evitar el agotamiento de los nutrientes y los reguladores de crecimiento. Los tratamientos se evaluaron semanalmente respecto de las siguientes variables: número de explantes con callo, número de callos con regenerantes, porcentaje de oxidación y porcentaje de clorosis.
Cocultivo
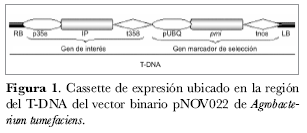
Esta fase corresponde a las primeras etapas de los procesos de transferencia de genes a genomas vegetales. Para el cocultivo se usó el microorganismo A. tumefaciens cepa LBA4404 que contiene el plásmido residente pAL4404, el cual fue transformado con el vector binario pNOV022 (Santos, 2003) que contiene la construcción quimérica p35S–IP–t35S—pUBQ–pmi–tNos (figura 1); esta cepa fue cedida por el Departamento de Agricultura de los Estados Unidos (USDA). Las condiciones del cocultivo se estandarizaron a partir de la metodología propuesta por Franco (1995) para lograr la transformación de S. phureja. Una vez obtenidos los explantes de entrenudos se transfirieron a una caja de Petri con medio MS líquido suplementado con asetosiringona a una concentración de 20 mg· L-1 y una concentración bacteriana de 1:50 de A. tumefaciens, manteniéndolos en agitación continua por 30 minutos a temperatura ambiente (Franco, 1995; Chaparro, 1999). Posteriormente, los explantes se secaron sobre papel filtro para luego colocarlos en el medio de regeneración que se complementó con el antibiótico cefatoxime a una concentración de 250 mg· L-1 a fin de inhibir el crecimiento A. tumefaciens en el medio de regeneración (Brasileiro, 1998; Dale y Hampson, 1995).
Análisis estadístico
El análisis de los datos se realizó mediante el paquete estadístico SAS® mediante análisis de varianza de una sola vía y la prueba de diferenciación de medias de Tukey.
Resultados y discusión
Obtención de explantes
Según estudios previos desarrollados por Carvajal (2004) se determinó que el mejor tipo de explantes para ser utilizados en procesos de transformación del clon 1 eran los provenientes de entrenudos. En este estudio se pudo confirmar que los entrenudos son mucho más manejables y sufren menos daños durante la manipulación lo que permite lograr mejores resultados en los procesos de formación de callo. Además, se encontró que la longitud de explantes más apropiada está entre 0,5 y 1 cm: si la longitud es mayor tienden a oxidarse y si es menor, la manipulación se hace difícil y se dañan fácilmente.
Cocultivo
La concentración bacteriana de 1:50 (Agrobacterium/medio MS) fue utilizada con muy buenos resultados debido a que, después del proceso de cocultivo, los explantes no mostraron daños de oxidación o clorosis, alteraciones frecuentes cuando las concentraciones de bacterias son altas. Esta concentración posibilitó usar un periodo de cocultivo directo de los explantes con la bacteria de 30 minutos con agitación constante que no ocasionaba daño a los explantes, los cuales presentaban un aspecto sano y color verde claro. Con base en estos resultados se estableció un protocolo sencillo sin recurrir a un período extra de cocultivo en medio sólido. Se consideró la recomendación de Carvajal (2004) de trabajar sólo con cocultivo líquido, puesto que observó que después de una fase de cocultivo sólido los explantes se afectan severamente por la presencia de A. tumefaciens perdiendo su viabilidad a los pocos días debido a altos porcentajes de oxidación y clorosis.
Ensayos de regeneración
En esta etapa de la investigación se determinaron las concentraciones de reguladores de crecimiento (citoquinina: zeatina ribósido, ZR; auxina: ácido naftalenacético, ANA; ácido giberélico, AG3) a utilizar en el medio de regeneración CIP-MS que permitieran obtener resultados significativos en cuanto la formación de callo, callos regenerados y número de regenerantes.
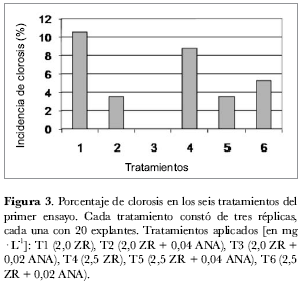
Primer ensayo de regeneración: efecto de ZR y ANA en la formación de callo. Se tomaron como variables de evaluación la incidencia de oxidación y de clorosis, así como la formación de callo, las cuales se midieron en términos de porcentaje como el número de explantes que presentaron el efecto biológico (oxidación, clorosis, callogénesis) sobre el número de explantes totales sometidos al tratamiento (figura 2 y tabla 1).

La aparición de la clorosis en los explantes es un factor determinante en la pérdida de unidades experimentales por lo que su control es fundamental para asegurar el éxito del ensayo. Según los análisis estadísticos no hubo diferencias significativas entre los tratamientos evaluados. Sin embargo, son notorias las diferencias en los porcentajes de incidencia de clorosis entre los tratamientos: en el T1 se perdió el 10% de los explantes, mientras que en el T3 no se observó pérdida de unidades experimentales por esta causa. Así, la ausencia de ANA en el medio de cultivo (T1 y T4) aumenta los porcentajes de clorosis mientras que a mayor concentración de ANA la clorosis disminuye (T2 y T5) (figura 3 y tabla 1). Ello se puede deber a que ANA induce la proliferación celular y la elongación de las células vegetales (Azcón-Bieto y Talón, 1993; Kamara-Keita, 2001), lo que permite una mejor absorción de los nutrientes por parte del explante y una consecuente reducción de la clorosis.
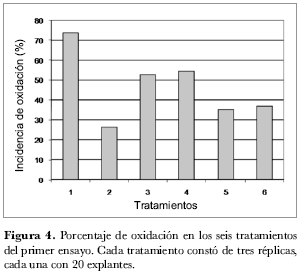
En todos los tratamientos evaluados en este ensayo se observaron diferentes niveles de oxidación: el T1 presentó el mayor nivel de oxidación con 73,68% en comparación con el T2 que presentó un nivel de oxidación de 26,31%, el menor entre los tratamientos (figura 4). Los tratamientos T1 y T2 tienen la misma concentración de ZR pero difieren en la concentración de ANA (tabla 1): el T1, que no tenía esta hormona en el medio de cultivo, presentó el porcentaje más alto de oxidación de todo el ensayo, lo que permitiría proponer que la presencia de ANA en el medio juega un papel importante en cuanto a la disminución de la oxidación en los explantes. Esto se puede deber a la acción que esta auxina ejerce sobre las células vegetales que favorece la regeneración del tejido vascular (Salisbury y Ross, 1992; Booker et al., 2003). Adicionalmente, se observó que una concentración alta de ZR ayuda a disminuir el porcentaje de oxidación, como en los tratamientos 4, 5 y 6. En los tratamientos T3 y T4 se observó un porcentaje de oxidación similar, alrededor del 55%, pese a que las concentraciones de las dos hormonas empleadas en los tratamientos eran diferentes (figura 4 y tabla 1): esto confirma que la interacción entre ZR y ANA influye directamente en la respuesta de los tejidos vegetales. En las plantas las hormonas no actúan independientemente, siendo eficaces a concentraciones internas muy bajas cercanas a 1µM (Salisbury y Ross, 1992).
En el análisis estadístico de la variable ‘formación de callo’ se encontró que el T3 difiere significativamente del resto de los tratamientos con un porcentaje de formación de callo de 80%, mientras que el T2 presentó 55%, el segundo porcentaje más alto. Como se observa en la figura 5, T1 y T4, que carecían de ANA en el medio de cultivo, presentaron los porcentajes más bajos en formación de callo, mientras que los tratamientos T5 y T6 que tenían una concentración de ZR alta presentaron también disminución de la callogénesis. Con base en lo anterior se puede inferir que el aumento de la concentración de ANA en el medio de cultivo contribuye a la formación de callo por un efecto fisiológico favorable para la diferenciación y la división celular; así mismo, que el efecto del ANA es más notorio que el producido por la ZR (Azcon-Bieto y Talon, 1993; Ferreira y Kieber, 2005).
En la figura 5 y tabla 1 se puede notar que una concentración mayor de ZR, independientemente de la concentración de ANA usada, no contribuye a la diferenciación del explante en callo. Así, la concentración de 2,5 mg· L-1 de ZR logró un promedio de 9% de formación de callo en los tratamientos en que fue empleada, mientras que una concentración de ZR menor aumentó la formación de callo en 11,3% en promedio. Este fenómeno se puede deber a que se requiere de un balance apropiado entre auxinas y citoquininas, como reguladores de crecimiento, para que la formación de callo tenga lugar; así mismo, concentraciones altas de auxinas favorecen la formación y el vigor de los callos (Roca et al., 1993).
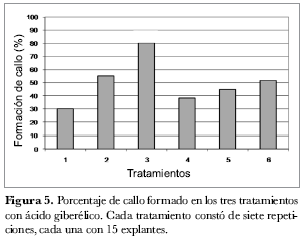
Teniendo en cuenta los resultados de las variables evaluadas se concluye que, bajo las condiciones de este ensayo, el tratamiento T2 con una concentración de 2 mg· L-1 de ZR y 0,04 mg· L-1 de ANA es el más promisorio de los tratamientos para el proceso de regeneración de explantes de S. phureja, ya que presentó la máxima formación de callo sin pérdidas ocasionadas por clorosis, presentando en conjunto mejores características que los otros tratamientos evaluados.
Efecto del AG3 en la regeneración. Se seleccionó el mejor tratamiento resultante del ensayo anterior (T2: 2,0 mg· L-1 de ZR y 0,04 mg· L-1 de ANA) y se combinó con tres concentraciones diferentes de AG3 (0,02, 0,05 y 0,1 mg· L-1) para evaluar su acción sobre los explantes en la formación de regenerantes (figura 6). Se tomaron en cuenta las siguientes variables: ‘porcentaje de explantes con callo’ y ‘número de callos con regenerantes’ (Francis y Sorrell, 2000), así como Montoya y Peña (2005) encontraron que el AG3 cumple un papel importante en la regeneración de plántulas a partir de callos, lo cual fue comprobado en esta investigación.
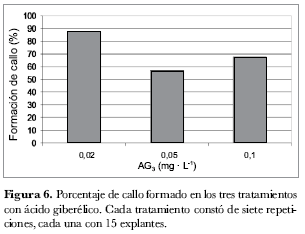
Según los análisis estadísticos, se presentaron diferencias significativas entre los tratamientos respecto del porcentaje de explantes que formaron callo; así, la variación de la concentración de AG3 influyó en la generación de callos a partir de los explantes sembrados, independientemente de las concentraciones de ZR y ANA presentes en el medio. La menor concentración de AG3 (0,02 mg· L-1) permitió el mayor porcentaje de formación de callo con 87,5%; con 0,1 mg· L-1 AG3 presentó 67% y con 0,05 mg· L-1 AG3 alcanzó 57% (figura 6). Las giberelinas son moléculas muy activas que con pocos microgramos, e incluso con nanogramos, son capaces de inducir distintos efectos fisiológicos (Azcón-Bieto y Talón, 1993); es posible que por esta razón, y también por interacción con los otros factores de crecimiento, sólo se necesito una concentración baja para contribuir a la formación de callo debido a su capacidad de inducir la división celular.
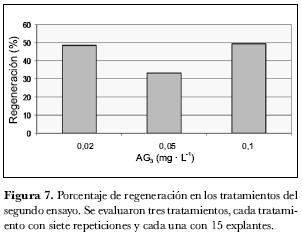
Con respecto a la variable ‘callos con regenerantes’, es decir formación de callo, no se encontraron diferencias significativas entre los tratamientos. No obstante, los tratamientos 0,02 y 0,1 mg· L-1 AG3 presentaron en promedio casi 20% más de callos con regenerantes. Como se observa en la figura 7, tanto el aumento como la disminución de la concentración de AG3 influyó en el aumento de callos con regenerantes. Esto se debe a la capacidad de las giberelinas de actuar directamente sobre el ciclo celular induciendo a las células a sintetizar DNA, facilitando así la división celular específicamente en los meristemos subapicales, lo que influye directamente sobre el crecimiento y elongación de tallos (Azcón-Bieto y Talón, 1993). En este ensayo se encontró 48,6% de regeneración de callo en el tratamiento con 0,02 mg· L-1 AG3 , 33% en el tratamiento con 0,05 mg· L-1 AG3 y 49% en el tratamiento con 0,1 mg· L-1 AG3; como se observa el último tratamiento obtuvo la mayor formación de regenerantes por callo, pero evaluando los porcentaje de formación de callo el tratamiento que reúne mejores resultados es el tratamiento T1 con 0,02 mg· L-1 AG3. De lo anterior se puede deducir que una proporción de hormonas ZR:ANA:AG3 de 100:2:1 resulta apropiada para la formación de regenerantes bajo estas condiciones (figura 2). Este ensayo permitió obtener 520 regenerantes.
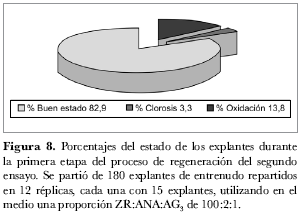
Segundo ensayo de regeneración. El segundo ensayo se dividió en dos fases con el fin de asegurar mayores porcentajes de regeneración. La primera fue la fase de formación de callo que se prolongó a lo largo de cuatro semanas en las cuales se evaluaron las variables ‘formación de callo’, ‘porcentaje de clorosis’ y ‘porcentaje de oxidación’. Se partió con 180 explantes de entrenudo repartidos en 12 réplicas, cada una con 15 explantes. Del total de explantes utilizados, 3,3% presentó clorosis y se perdieron por esta causa; 13,8% de explantes sufrió oxidación y de éstos 9,4% murieron, mientras que los demás explantes que presentaron oxidación se recuperaron (figuras 8 y 9). De los 180 explantes iniciales 157 sobrevivieron y presentaron formación de callo en muy buen estado, observándose 87,2% de formación de callo. La formación de callo comenzó a principios de la semana dos, durante la semana tres aumentó y en la semana cuatro se observaron los primeros brotes.
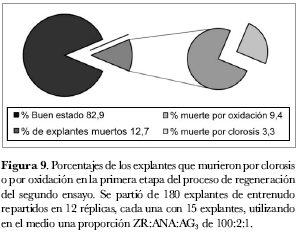
La segunda etapa del ensayo fue la fase de obtención de regenerantes; para ello se usaron tres réplicas cada una con 10 callos escogidos entre los 157 obtenidos en la primera etapa. Esta segunda etapa se prolongó por 15 semanas más, durante las cuales se evaluaron las variables ‘oxidación’, ‘número de callos con regenerantes’ y ‘número de regenerantes por réplica’.
Con respecto al porcentaje de oxidación observado en este ensayo se encontró que en la semana cero fue de 10% y fue aumentando progresivamente hasta alcanzar 100% de oxidación en el total de los explantes. El punto máximo de oxidación se dio en la semana 7 y se mantuvo hasta finalizar el ensayo en la semana 15, pero la oxidación que se presentó fue leve, lo cual contribuyó a que el desarrollo de los regenerantes no se viera afectado.
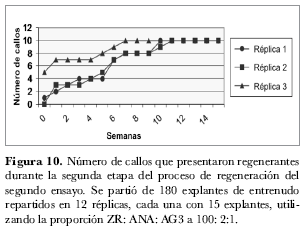
El número de callos que presentaron regenerantes fue aumentando paulatinamente. Como se observa en la figura 10, desde el primer momento la réplica tres mostró mayor número de callos con regenerantes a lo largo de todo el proceso; así mismo, a partir de la semana 11 todos los callos del ensayo presentaron formación de regenerantes aunque el número de regenerantes por callo varió.
El número de regenerantes por réplica fue incrementándose progresivamente cada semana a partir de la semana cero, como se observa en la figura 11, tendencia que presentó una estabilización entre las semanas 11 a 13, reactivándose a partir de la semana 14 cuando el aumento fue casi del doble en la formación de regenerantes (figura 11).
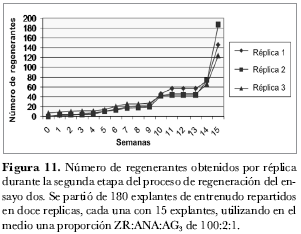
Al finalizar la semana 15 se observaron un total de 457 regenerantes obtenidos a partir de 30 explantes colocados inicialmente; así, el promedio de regenerantes por callo fue de 15,2 ± 3,1. De acuerdo con lo reportado por Ducreux et al. (2005), el número de regenerantes por callo fue de 4 ± 3,3 utilizando entrenudos. Según estos resultados el sistema de regeneración reportado en esta investigación es más eficiente. Se puede afirmar que dividiendo el proceso en dos etapas se hace más eficiente el sistema de regeneración, ya que se asegura que todos los explantes que pasan a la segunda etapa ya presentan formación de callo.
Conclusiones
Se optimizó el sistema para la regeneración de plantas de Solanum phureja mediante el desarrollo de un medio de regeneración con un balance adecuado de los reguladores de crecimiento ZR, ANA y AG3 en una proporción 100:2:1, en condiciones de temperatura de 21 ± 3°C, humedad relativa de 65% y fotoperíodo 16/8. El porcentaje de formación de callos mediante la utilización del medio reportado fue de 87,6% en el primer ensayo y 87,2% en el segundo ensayo, mientras que el porcentaje de regeneración fue de 48,6% en el primer ensayo y de 100% sobre los callos seleccionados en el segundo ensayo, lo que demuestra la efectividad del procedimiento en dos fases para la obtención de plántulas regeneradas. Estos resultados favorecen estudios posteriores de transformación de plantas, pues la formación de callos es uno de los principales factores que influyen en dicho proceso y tradicionalmente ha sido un limitante. El tipo de explante, la calidad y el origen del mismo tienen efectos notorios en los procesos de regeneración, lo que se manifiesta en la obtención de un material vegetal con muy buenas características fenotípicas, disminuyendo las pérdidas por clorosis temprana y los efectos letales de la oxidación.
Agradecimientos
Los autores expresan su agradecimiento por la financiación de la investigación y su apoyo al Centro Virtual de Investigación de la Cadena Agroalimentaria de la Papa (CEVIPAPA) y a la Universidad Nacional de Colombia, en especial al Departamento de Biología, Facultad de Ciencias, sede Bogotá y al Grupo de Ingeniería Genética de Plantas de la Universidad Nacional de Colombia (IGP-UN).
Literatura citada
Akbar A. y A. Hakoomat. 2004. Effect of culture medium in potato. Biotechnology 3(2), 187-193. [ Links ]
Azcón-Bieto, J. y M. Talón. 1993. Fisiología y bioquímica vegetal. Editorial McGraw-Hill Interamericana, Nueva York. pp. 285-326. [ Links ]
Beaujean, A., R. Sangwan, A. Lecardonnel y B.S. Sangwan-Norreel. 1998. Agrobaterium-mediated transformation of three economically important potato cultivars using sliced internodal explants: an efficient protocol of transformation. J. Exptl. Bot. 49(326), 1589-1595. [ Links ]
Booker, J., S. Chatfield y O. Leyser. 2003. Auxin acts in xylem-associated or medullary cells to mediate apical dominance. Plant Cell 15, 495-507. [ Links ]
Brasileiro, A. 1998. Co-cultura com linhagens desarmadas de Agrobacterium. pp. 111-125. En: Brasileiro, A. y V. Carneiro (eds.). Manual de transformação genética de plantas. EMBRAPA-SPI/ EMBRAPA-Cenagen, Brasilia. 310 p. [ Links ]
Carvajal, D. 2004. Estudios orientados a la transformación de papa criolla (Solanum phureja) mediada por Agrobacterium tumefaciens. Trabajo de Grado. Departamento de Biología, Universidad Nacional de Colombia, Bogotá. 65 p. [ Links ]
Centro Virtual de Investigación de la Cadena de la Papa (CEVIPAPA). 2005. Tres nuevas variedades de papa criolla gracias a los desarrollos en genética. En: http://www.cevipapa.org.co/news. php?id=102. 1 p.; consulta: junio 2006. [ Links ]
Chaparro, A.1999. Efeitos pleiotrópicos em plantas transgénicas de batata (Solanum tuberosum L.) Cv. Bintje associados à expressão da leghemoglobina de soja no interior dos cloroplastos. Tese (Doutor em Agronomia, Área de Concentração: Genética e Melhoramento de Plantas). Escola Superior de Agricultura "Luiz de Queiroz", Universidade de São Paulo, São Paulo. 103 p. [ Links ]
Dale, P. y K. Hampson. 1995. An assessment of morphogenic and transformation efficiency in a range of varieties of potato (Solanum tuberosum L.) Euphytica 85, 101-108. [ Links ]
Ducreux, L., W. Morris, M. Taylor y S. Millam. 2005. Agrobacterium mediated transformation of Solanum phureja. Plant Cell Rep. 24,10-14. [ Links ]
FAO. 2001. Tratado Internacional sobre los Recursos Fitogenéticos para la Alimentación y la Agricultura. Departamento de Agricultura. En: Organización de las Naciones Unidas para la Alimentación y la Agricultura, ftp://ext-ftp.fao.org/ag/cgrfa/it/ ITPGRs.pdf. 27 p.; consulta: junio 2006. [ Links ]
Ferreira, F. y J. Kieber. 2005. Cytokinin signaling. Current Opinion Plant Biol. 8, 518-525. [ Links ]
Francis, D. y D. Sorrell. 2000. The interface between the cell cycle and plant growth regulators: a mini review. Plant Growth Regulat. 33, 1-12. [ Links ]
Franco, L. 1995. Obtención de plantas transgénicas de Solanum phureja variedad 'Yema de huevo' (papa criolla) transformadas con el gen de la proteína de la cápside del virus del enrollamiento de la hoja de papa -PLRV-. Tesis de Magíster en Bioquímica. Facultad de Ciencias - Facultad de Medicina, Universidad Nacional de Colombia, Bogotá. 104 p. [ Links ]
Ghislain, M. y D. Zhang 2001. Genetic diversity analysis in a cultivated andean potato, S. phureja Juz. et Buck. Program 2. Perú. 8 p. [ Links ]
Kamara-Keitça, A. 2001. Nutrición, regulación del crecimiento y desarrollo vegetal. Intrakam, S.A. de C.V. Buenavista. pp. 3-14. [ Links ]
López, A. y E. Espitia. 2000. Plagas y beneficios en el cultivo de la papa en Colombia. CORPOICA, Bogotá. 35 p. [ Links ]
Montoya, D. y J. Peña. 2005. Estudios orientados al mejoramiento de las técnicas de regeneración en Papa criolla Solanum phureja. Trabajo de grado, Facultad de Agronomía, Universidad del Tolima, Ibagué. 46 p. [ Links ]
Murashige, T. y F. Skog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15, 473-497. [ Links ]
Porras, P. 2000. Guía para la papa criolla. Clon 1. En: Papas colombianas con el mejor entorno ambiental, 2 edición. FEDEPAPA, Bogotá. pp. 44-47, 65-69. [ Links ]
Roca, W., L. Mruginski, R. Linz y R. Jarret. 1993. Regeneración de plantas en el cultivo de tejidos. Cultivo de tejidos en la agricultura. Primera edición. Publicaciones CIAT, Cali. pp. 143-157. [ Links ]
Salisbury, F. y C. Ross. 1992. Fisiología vegetal. Primera edición. Grupo Editorial Iberoamericana, Madrid. pp. 395-435. [ Links ]
Santos F. 2003. Transformación de Agrobacterium tumefaciens cepa LBA4404 con el vector binario pNOV022, selección in vitro y caracterización molecular. Trabajo de grado. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. 46 p. [ Links ]
Slater, A. y N. Scott y M. Fowler. 2003. Plant biotechnology: The genetic manipulation of plants. Plant Tissue Cult. 26, 35-56. [ Links ]














