Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.25 no.1 Bogotá Jan./June 2007
PROPAGACIÓN Y CULTIVO DE TEJIDOS
Albeiro Hernán Chamorro1, Sonia Liceth Martínez2, John Cristhian Fernández3 y Teresa Mosquera4
1 Ingeniero agrónomo, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. e-mail: albeiro_chamorro@yahoo.es
2 Estudiante de Ingeniería Agronómica, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. e-mail: slmartinezf@unal.edu.co
3 Estudiante de Maestría en Fisiología de Cultivos, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. e-mail: jrfernandezl@unal.edu.co
4 Profesora asociada, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. e-mail:tmosquerav@unal.edu.co
Fecha de recepción: 6 de abril de 2005. Aceptado para publicación: 06 de junio de 2007
Resumen: Se evaluaron diferentes concentraciones de reguladores de crecimiento en las fases de multiplicación y enraizamiento in vitro de Limonium var. Misty blue, las cuales son bajas en esta especie. Se trabajó con material in vitro donado por la Empresa La Plazoleta Ltda. Se evaluaron diferentes tipos y concentraciones de citoquininas (kinetina, KIN; 6-bencilaminopurina, BAP; y thidiazuron, TDZ) en la fase de multiplicación y dos tipos de auxinas (ácido indolacético, AIA; y ácido indolbutírico, AIB) a diferentes concentraciones en la fase de enraizamiento in vitro. En la fase de multiplicación los mejores resultados fueron obtenidos con el uso del medio de cultivo MS (Murashige y Skoog, 1962) suplementado con KIN o BAP a 0,5 mg· L-1 durante un período de cuatro (4) semanas. Se encontró que concentraciones altas de las citoquininas evaluadas en este trabajo inducen desdiferenciación celular y reducen la tasa de multiplicación, especialmente el TDZ a 0,1 mg· L-1. En la fase de enraizamiento in vitro se obtuvieron buenos resultados manteniendo las plántulas por un período de tres (3) semanas en medio MS (1962) suplementado con AIB en concentraciones entre 0,5 y 1,0 mg· L-1, lo cual consiguió un sistema radical adecuado para su posterior endurecimiento. En presencia de AIA no se formaron raíces en ninguna de las concentraciones evaluadas.
Palabras clave: sistema radical, citoquininas, auxinas, thidiazuron.
Abstract: This research was carried out in order to evaluate the effect of different concentrations of plant growth regulators on in vitro multiplication and rooting of Limonium var. Misty Blue, which are low in this specie. The plant material was provided by La Plazoleta Ltda Company. There were evaluated different types and concentrations of cytokinin (kinetin- KIN, benzylaminopurine-BAP, thydiazuron-TDZ) during the multiplication phase, as well as two types of auxins (indolacetic acid-IAA, and indolbutyric acid- IBA) at different concentrations during the in vitro rooting phase. In the multiplication period, the best results were obtained using the MS (Murashige y Skoog, 1962) supplemented with 0.5 mg· L-1 KIN or BAP for a period of four weeks. High concentrations of cytokinins induced cellular dedifferentiation and reduced multiplication rate, especially TDZ at 0.1 mg· L-1. In the in vitro rooting phase, there were accomplished remarkable results when plantlets were kept on MS medium supplemented with IBA at 0.5 mg· L-1 and 1.0 mg· L-1 for three weeks, obtaining a root system, which was adequate for plant acclimatation. With the IAA, there was no root formation at any of the evaluated concentrations.
Key words: root system, cytokinin, auxin, thydiazuron.
Introducción
LA INDUSTRIA DE LA FLORICULTURA es una de las más exitosas dentro del sector agropecuario colombiano y constituye una producción destinada a mercados extranjeros, especialmente a los Estados Unidos. Colombia es el segundo exportador mundial de flores frescas cortadas después de Holanda y el 86% de la producción tiene lugar en la Sabana de Bogotá (ASOCOLFLORES, 2004).
La tendencia actual de los mercados extranjeros es la compra de bouquets, mercado que día a día crece como estrategia para aumentar el consumo de flores durante el año (Pohmer, 2004). La combinación de especies y colores variados tiene aceptación en el mercado internacional y le da valor agregado al producto final, razón por la cual las empresas floricultoras requieren de varias especies, dentro de la cuales está Limonium var. Misty blue.
El género Limonium pertenece a la familia Plumbaginaceae y está representado por cerca de 300 especies, de las cuales aproximadamente 20 tienen fines comerciales (Barbieri et al., 2000). Limonium ‘Misty blue’ pertenece a la serie Misty, que es un híbrido entre L. latifoliumx L. bellidifolium; tiene un tallo prácticamente carente de hojas, con lo cual desaparece el olor característico del L. latifolium sin perder la altura y rigidez del L. bellidifolium (Lijalad, 1993). El Limonium es una flor que se usa sola o en combinación con otras para formar bouquets. Tiene gran duración en florero y las flores pasan del estado fresco al estado deshidratado con pequeños cambios en el color (Stephen et al., 1986).
El uso de la micropropagación permite a los floricultores introducir rápidamente productos nuevos con una serie de ventajas tales como la propagación de material limpio, lo que hace que esta técnica presente grandes posibilidades de uso en la agricultura y, en especial, en la propagación masiva de plantas ornamentales (Boon, 1991). Así, como en el caso de otras especies ornamentales, la micropropagación de Limonium es una herramienta para obtener rápidamente grandes cantidades de material vegetal para el mercado.
La estrategia para obtener un producto vegetal in vitro óptimo depende de lograr un sistema que permita la selección de material en campo con excelentes condiciones agronómicas y, posteriormente, desarrollar un protocolo de laboratorio que en cada una de sus fases -introducción, multiplicación, enraizamiento y endurecimiento-, conduzca a producir material vegetal de excelente calidad sanitaria, genética y fisiológica.
En el caso de la propagación de Limonium se establecieron inicialmente protocolos de propagación para L. sinuatum (Harazy, 1985), posteriormente aparecieron protocolos para algunos híbridos interespecíficos en L. caspia, L. otolepis, L. dumosum (Ruffoni y Mascarello, 2000).
Para algunos clones de L. latifolium se han reportado tasas de multiplicación altas con el uso de 1,0 mg· L-1 benciladenina (BA) y reduciendo la concentración de sacarosa a 20 g· L-1 (Vitti, 2000 citado por Ruffoni y Mascarello, 2000).
En Colombia, la propagación de Limonium ‘Misty blue’ se hace a partir de la introducción al laboratorio de yemas florales, las cuales pasan por un proceso de desinfección, para luego obtener plántulas que serán la base para la multiplicación. La variedad presenta problemas para la multiplicación in vitro a causa de la utilización de protocolos para otros clones; por ejemplo, las tasas de multiplicación son bajas (1,5 brotes en cuatro semanas), lo que no permite disponer del volumen de plantas deseado en corto tiempo; además, presenta un bajo enraizamiento o en algunos casos no hay formación de raíces. En consecuencia, el objetivo de este trabajo fue evaluar diferentes concentraciones de reguladores de crecimiento en la multiplicación y enraizamiento in vitro de Limonium ‘Misty blue’.
Materiales y métodos
Materiales
Para esta investigación se trabajó con material in vitro de Limonium ‘Misty blue’ donadas por la Empresa La Plazoleta Ltda. Se utilizaron materiales, reactivos, equipos e instalaciones del Laboratorio de Biotecnología Vegetal de la Facultad de Agronomía de la Universidad Nacional de Colombia en Bogotá.
Metodología
Teniendo en cuenta que Limonium ‘Misty blue’ presenta baja tasa de multiplicación in vitro se diseñaron ensayos para evaluar el efecto de algunas citoquininas sobre la multiplicación. El material vegetal donado se cultivo en medio sólido MS (Murashige y Skoog, 1962) durante tres semanas con el propósito de obtener plántulas para las pruebas posteriores. Los ensayos para multiplicación y enraizamiento se realizaron en medio MS con adición de 30 g· L-1 de sacarosa, 100 mg· L-1 de inositol y 0,1 mg· L-1 de tiamina, el pH se ajustó a 5,8. Las condiciones de cultivo en el cuarto de crecimiento fueron: fotoperiodo de 16 horas con luz blanca fría e intensidad de 4000 Lux, temperatura promedio de 20ºC y humedad relativa promedio de 70%. El tiempo de evaluación para cada ciclo de multiplicación fue de cuatro semanas y para el de enraizamiento, tres.
Efecto de algunas citoquininas en la multiplicación de Limonium var. Misty blue
Se utilizó un diseño completamente aleatorio y la variable evaluada fue número de nudos a fin de calcular la tasa de multiplicación. Se establecieron diez repeticiones por tratamiento, cada unidad experimental consistió en un frasco de 125 mL con cinco propágulos, para un total de 50 propágulos por tratamiento. La tasa de multiplicación se calculó así:
Efecto independiente de thidiazuron, benzilaminopurina y kinetina sobre la multiplicación
Las citoquininas thidiazuron (TDZ), benzilaminopurina (BAP) y kinetina (KIN) han sido reportadas como fuertes inductores de brotes (Huetteman y Preece, 1993; Krikorian, 1995; Ruffoni y Mascarello, 2000). En este sentido, se evaluaron los reguladores de crecimiento TDZ a concentraciones de 0,01, 0,05 y 0,1 mg· L-1, BAP a 0,5, 1,0 y 2,0 mg· L-1 y KIN a 0,5, 1,0 y 2,0 mg· L-1. Con base en información previa de micropropagación habitual de Limonium‘Misty blue’ en Colombia, se utilizó el tratamiento con BAP a 1,0 mg· L-1 como testigo relativo.
Debido a que a nivel comercial la producción in vitro de Limonium ‘Misty blue’ no se mantiene de forma constante, los tratamientos se evaluaron por varios ciclos de cultivo para observar su comportamiento en el tiempo como respuesta a los tratamientos planteados. Para los ensayos con TDZ, BAP y KIN se realizaron tres subcultivos consecutivos cada cuatro semanas.
Efecto de la interacción de kinetina y ácido indol-acético sobre la multiplicación
Con el propósito de evaluar la interacción de una citoquinina con una auxina para promover la formación de nudos y la elongación de propágulos, se evaluó KIN a concentraciones de 0,5, 1,0 y 2,0 mg· L-1 en interacción con AIA a concentraciones de 0,01 y 0,05 mg· L-1 para un total de seis (6) tratamientos. Este ensayo tuvo dos ciclos consecutivos con una duración de cuatro semanas cada uno.
Efecto independiente de dos auxinas en el enraizamiento
Se evaluaron los reguladores de crecimiento ácido indolacético (AIA) a concentraciones de 0,05, 0,1, 0,5 y 1,0 mg· L-1 y ácido indolbutírico (AIB) a concentraciones de 0,5, 1,0, 2,0 y 3,0 mg· L-1. El testigo fue el tratamiento libre de reguladores de crecimiento. Se realizaron cinco repeticiones por tratamiento, cada unidad experimental con tres propágulos, para un total de 15 propágulos por tratamiento. El material se incubó en cuarto de crecimiento durante tres semanas.
Resultados
Efecto del thidiazuron sobre la brotación
Con la concentración de 0,01 mg· L-1 de TDZ se obtuvo una tasa de multiplicación de 2,6 en un periodo de cuatro semanas siendo la tasa de multiplicación más alta en este regulador (tabla 1). Los tratamientos en los cuales se evaluaron concentraciones de 0,05 y 0,1 mg· L-1 presentaron tasas de multiplicación menores que oscilaron entre 1,1 y 1,8.
Se utilizaron diez (10) réplicas por tratamiento para un total de 50 propágulos por tratamiento. En la tabla 1, los valores de las columnas 6, 7 y 9 son los valores promedio de cada tratamiento y los valores de las columnas 8 y 10 son los promedios acumulados de los ciclos 1-2 y 1-2-3, respectivamente (tabla 1).
La concentración más alta de TDZ evaluada en este trabajo (0,1 mg· L-1) presentó las tasas de multiplicación más bajas, de 1,5 en el primer ciclo y 1,1 en el tercer ciclo. En esta concentración (0,1 mg· L-1) se observó una fuerte tendencia de los tejidos a la desdiferenciación y a formar callo en la base del propágulo (figura 1a).
Efecto de la kinetina sobre la multiplicación
A medida que aumenta la concentración de KIN, la tasa de multiplicación se incrementa (tabla 1) pero el vigor de los brotes disminuye. Los brotes que muestran mejor calidad en su forma y tamaño de hoja corresponden al tratamiento con la concentración más baja de kinetina evaluada: 0,5 mg· L-1 (figura 1b). A través del tiempo dentro de este mismo tratamiento no se observó tendencia en el cambio de esta tasa de multiplicación.
En concentración de 2,0 mg· L-1 de KIN durante los tres ciclos se obtuvo una tasa de multiplicación entre 2,6 y 2,7 de forma constante (tabla 1), no se presentó disminución en la brotación a través del tiempo y el vigor de los brotes también se mantuvo constante.
Efecto de la benzilaminopurina sobre la multiplicación
En la concentración de 0,5 mg· L-1 de BAP se presentó la tasa de multiplicación más alta (tabla 1). En esta concentración la tasa de multiplicación en el primer ciclo fue 2,8, en el segundo 3,1 y en el tercero 2,9. Los brotes mostraron buen tamaño de hojas, coloración más verde y brotes mejor formados con respecto a las concentraciones más altas evaluadas de este regulador (figura 1c).
Al aumentar la concentración de BAP disminuyó la tasa de multiplicación (tabla 1) y la calidad. Con 2,0 mg· L-1 de BAP la tasa de multiplicación es de 1,9 para cada ciclo de cultivo. A través del tiempo dentro de la misma concentración, la tasa de multiplicación se mantiene constante, pero se observa proliferación de brotes pequeños que no llegan a diferenciarse completamente.
Efecto de la interacción de kinetina y ácido indolacético sobre la multiplicación
Los tratamiento 12, 14 y 15 obtuvieron tasas de multiplicación promedio de 2,5 (tabla 1) lo que es inferior a los valores obtenidos con las citoquinas evaluadas individualmente. A través del tiempo no hubo variaciones evidentes en la tasa de multiplicación, lo que indica que este material vegetal responde de manera constante a la aplicación exógena de estos dos reguladores.
Efecto de los ácidos indolbutírico e indolacético en la formación de raíces in vitro
El efecto del ácido indolabutírico (AIB) sobre el número de raíces fue directamente proporcional a la concentración del regulador (tabla 2). A 0,5 mg· L-1 de AIB se observó el desarrollo de 21 raíces en promedio por brote, mientras que a 3 mg· L-1 de AIB se desarrollaron 52 raíces promedio por brote, con valores intermedios de 28 y 35 a 1 y 2 mg· L-1, respectivamente. El ácido indolacético (AIA) no tuvo efecto sobre el número de raíces.
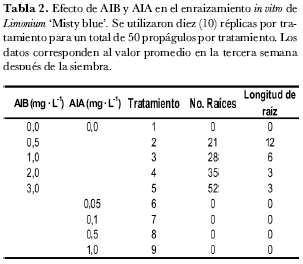
El efecto de AIB sobre la longitud de raíces fue inversamente proporcional a la concentración del regulador (tabla 2). A 0,5 mg· L-1 de AIB la longitud promedio de las raíces fue de 12 mm, mientras que a 3 mg· L-1 la longitud fue de 3mm, con valores intermedios de 6 y 3 a 1 y 2 mg· L-1 respectivamente. AIA no tuvo efecto en la longitud de las raíces.
Discusión
La tasa de multiplicación de brotes se puede optimizar sustancialmente con la adición en el medio nutritivo de concentraciones apropiadas de citoquininas con o sin una auxina (Bhojwani y Razdan, 1996).
Las citoquininas generalmente se utilizan en bajas concentraciones para estimular la proliferación de tejidos y en concentraciones más elevadas para desencadenar la neoformación de yemas sobre callos (Margara, 1988). Las citoquininas más usadas comúnmente son las purinas substituidas (KIN y BAP), aunque algunas ureas substituidas como el TDZ, también tienen actividad como citoquinina, la mayor propiedad de estas citoquininas es estimular la división celular (Krikorian, 1995). Las citoquininas son capaces de estimular la síntesis de ARN y proteínas (Weaver, 1982). Al parecer, en cultivo de tejidos, las citoquininas actúan incrementando la rapidez de la síntesis de proteínas, algunas de las cuales podrían ser enzimas o proteínas estructurales necesarias para la mitosis (Salisbury y Ross, 1994).
En la presente investigación, se obtuvieron tasas de multiplicación apropiadas para Limonium ‘Misty blue’, especialmente a 0,5 mg· L-1 de BAP y KIN en medio MS suplementado con 3% de sacarosa. De manera similar, Sydney et al. (2000) observaron los mejores resultados en la multiplicación de Limonium latifolium (Kuntze) a 0,7 mg· L-1 de BAP en medio MS. Xiao y Kozai, (2006) reportaron que 0,25 mg· L-1 de BAP en medio MS sin azúcar, y utilizando un material poroso de soporte (florialite), produjo resultados óptimos y comparables con un medio suplementado con sacarosa 3% y solidificado con agar en la multiplicación de Limonium latifolium, lo que sugiere posibles alternativas a los resultados del presente estudio.
Los valores de la tasa de multiplicación entre TDZ (0,01 mg· L-1), KIN (0,5 mg· L-1) y BAP (0,5 mg· L-1) fueron cercanos, fenómeno que también se observó en Limonium cavanillesii (Erben) cuya tasa de multiplicación tuvo los valores más altos al utilizar KIN (2 a 5 mg· L-1), BAP (0,1 mg· L-1) y TDZ (5 mg· L-1) sin diferencias significativas entre ellos (Amo e Ibáñez 1998). Sin embargo, los resultados en Limonium ‘Misty blue’ indican que a través del tiempo hay variación cualitativa en respuesta a TDZ y BAP y variación cuantitativa en respuesta a TDZ. Barlow (1987), citado por Garcidueñas y Ramírez (1993), afirma que en ocasiones diversas hormonas determinan efectos similares, pero hay momentos del desarrollo en la que sobre sus propiedades comunes cada hormona suscita una respuesta específica.
La combinación de AIA y KIN a las diferentes concentraciones utilizadas en este estudio, presentaron resultados similares e incluso inferiores a los obtenidos con la utilización de citoquininas únicamente. Esto sugiere que el balance hormonal de Limonium ‘Misty blue’ en la fase de multiplicación no hace necesaria la adición de auxinas. En contraste, Huang et al. (2000) obtuvieron resultados óptimos en la multiplicación de brotes adventicios de Limonium wrightii (Hance) Ktze con 2 mg· L-1 de BA más 2 mg· L-1 de ANA en medio MS suplementado con sacarosa 3%.
Los resultados obtenidos en esta investigación muestran que las concentraciones más bajas de las citoquininas usadas son más eficientes en la proliferación de brotes en Limonium ‘Misty blue’; el aumento en la concentración conduce a desdiferenciación de los brotes y pérdida de la calidad. Es posible que se acelere el proceso de división celular (mitosis), lo que conduce a la inducción de callo y, por lo tanto, se reduce la tasa de multiplicación como consecuencia de la desdiferenciación. Esto es más evidente en TDZ (0,1 mg· L-1) que en BAP (2 mg· L-1) y KIN (2 mg· L-1). Según Mok et al. (1982) citados por Huetteman y Preece (1993), el TDZ es la más potente de las fenilureas: usado en cultivo de tejidos vegetales tiene alta acción citoquinina con respecto a las citoquininas convencionales como la zeatina (ZEA), BAP y KIN. Según Victor et al. (1999), el modo de acción del TDZ puede ser atribuido a la capacidad de inducir acumulación de citoquininas y aumentar la acumulación y traslocación de auxinas dentro de tejidos expuestos a TDZ (Murch y Saxena., 2001).
Prathanturarug et al. (2003) reportaron que la exposición de explantes a altas concentraciones de citoquininas como KIN, BAP, 2-ip y TDZ disminuye el incremento en la proliferación de brotes en Curcuma longa, de manera similar, las más altas concentraciones usadas en el presente estudio, en donde BAP y especialmente de TDZ produjeron menores tasas de multiplicación, tendencia a desdiferenciación y formación de callosidades.
Según Kim et al. (1997); Chand et al. (1999), altos niveles de TDZ causan anormalidades o son tóxicos. Adicionalmente, otros estudios reportan resultados similares, Olivera et al. (2000) quienes trabajaron con KIN, BA y TDZ en Gerbera jamesoni, observaron que los brotes obtenidos con KIN presentaron buen aspecto y tamaño, en tanto que, en los tratados con BA y TDZ el desarrollo fue menor, además, los tratamientos con TDZ indujeron formación de callo y deformación de brotes.
El efecto de TDZ, sobre los propágulos de Limonium‘Misty blue’ que fueron sometidos a varios subcultivos consecutivos, redujo la tasa de multiplicación a través del tiempo. La alta resistencia a la degradación que tiene el TDZ por acción de la enzima citoquinina oxidasa (Mok et al., 1987 citado por Cruz et al., 2003), puede inactivar o limitar las respuestas de las citoquininas (Kaminek y Armstrog, 1990 citados por Cruz et al., 2003), esto sugiere que la acción citoquinina de TDZ disminuye con el tiempo lo que se vio reflejado en esta investigación.
En el enraizamiento in vitro de Limonium ‘Misty blue’ se evidenció claramente que la auxina que permite formación de raíces es AIB, mientras que AIA no induce raíces en este material. La concentración de 3 mg· L-1 de AIB indujo un promedio de 52 raíces por brote en un periodo de tres semanas, pero con una longitud de 3 mm en promedio por planta. En contraste, a 0,5 mg· L-1 de AIB la longitud promedio de raíces por planta fue de 12 mm con 26 raíces por planta. Asociando longitud y número de raíces, las concentraciones posibles de AIB para la fase de enraizamiento de Limonium ‘Misty blue’ oscilan entre 0,5 y 1,0 mg· L-1 lo que garantiza entre 21 y 28 raíces por brote con una longitud entre 6 y 12 mm. Estas concentraciones son acordes a las encontradas en investigaciones con plantas cercanas. Sydney et al. (2000) determinaron que 1 mg· L-1 de AIB es apropiado para la fase de enraizamiento in vitro de Limonium latifolium (KUNTZE) y (Huang et al. (2000) reportaron en Limonium wrightii (Hance) Ktze, que el enraizamiento in vitro de brotes adventicios se logró exitosamente con AIB a 1,2 mg· L-1.
Según los resultados obtenidos en esta investigación, para el manejo comercial de la multiplicación in vitro de Limonium ‘Misty blue’ se recomienda BAP o KIN a 0,5 mg· L-1 cada una. El BAP ofrece una tasa de multiplicación que oscila entre 2,8 y 3,1 y la KIN entre 2,2 y 2,3 en un periodo de cuatro semanas. La calidad de los propágulos es mejor con KIN que con BAP. Para el enraizamiento in vitro la mejor opción es utilizar AIB en concentraciones entre 0,5 y 1 mg· L-1. Con esto se pueden tener brotes de Limonium ‘Misty blue’ con un sistema radical adecuado para adaptación.
Agradecimientos
Los autores expresan sus agradecimientos a la Empresa La Plazoleta Ltda., por la donación del material vegetal para llevar a cabo esta investigación.
Literatura citada
Amo, J. y M. Ibáñez, 1998. Micropropagation of Limonium cavanillesii Erben, a threatened statice, from inflorescence stems. Plant Growth Regulat. 24, 49-54. [ Links ]
ASOCOLFLORES. Estadísticas. 2004. En: http://www.asocolflores. org/info/info.php; consulta: marzo 2005. [ Links ]
Barbieri, G., S. De Pascale, R. Paradiso, E. Farina, C. Dalla Guda, C. Cervelli y E. Scordo. 2000. Tecniche di produzione e coltivazione dei Limonium ornamentali speciale Limonium. Flortecnica 5, 89-96. [ Links ]
Bhojwani, S. y M. Razdan. 1996. Plant tissue culture: Theory and practice, a revised edition. Elsevier, Ámsterdam. 766 p. [ Links ]
Boon, H. 1991. Escenario global de la floricultura para el año 2000. Revista Asocolflores 28, 7-9. [ Links ]
Chand, H. M. Pearson y P. Lovell. 1999. Rapid vegetative multiplication in Colocasia esculenta (L) Schott (taro). Plant Cell Tissue Organ Cult. 55, 223-226. [ Links ]
Cruz, I. A. Angarita y T. Mosquera. 2003. Inducción de embriogénesis somática en Alstroemeria spp. Agron. Colomb. 21(3), 121- 128. [ Links ]
Garcidueñas, M. y H. Ramírez, 1993. Control hormonal del desarrollo de la planta: fisiología, tecnología y experimentación. Segunda edición. Editorial Limusa, México D.F. 53 p. [ Links ]
Harazy, A., B. Leshem, A. Cohem. 1985. In vitro propagation of Statice as an aid breeding. HortScience 20 (3), 361-362. [ Links ]
Huang, C., M. Hsieh, W. Hsieh, A. Sagare, H. Tsay. 2000. In vitro propagation of Limonium wrightii (Hance) ktze. (Plumbaginaceae), an ethnomedicinal plant, from shoot-tip, leaf and inflorescence-node explants. In vitro Cell. Dev. Biol. Plant 36, 220-224. [ Links ]
Huetteman, C. y Preece, J. 1993. Thidiazuron, a potent cytoquinin for woody plant tissue culture. Plant Cell Tissue Organ Cult. 33, 105-119. [ Links ]
Kim, M., H. Sommer, B. Bongarten y S. Merkel. 1997. High frequency induction of adventitious shoots from hypocotyl segments of Liquidambar styraciflua L. by thidiazuron. Plant Cell Rpt. 16, 536-540. [ Links ]
Krikorian, A.D. 1995. Hormones in tissue culture and micropropagation. En: Plant hormones physiology, biochemistry and molecular biology. Kluwer Academic Publishers. Dordrech, Boston, London. pp. 774-79. [ Links ]
Lijalad, C. 1993. Limonium. En: Hortalizas, flores y plantas ornamentales. Ediciones de Horticultura 84, pp. 29-35. [ Links ]
Margara, J. 1988. Multiplicación vegetativa y cultivo in vitro. Ediciones Mundi-Prensa. Madrid. pp. 27-30, 71-118. [ Links ]
Murashige, T. y F. Skoog, 1962. A revised medium for rapid growth and bioassays with tobacco tissues cultures. Physiol. Plant 15, 473-479. [ Links ]
Murch, S. y P. Saxena. 2001. Molecular fate of thidiazuron and its effects on auxin transport in hypocotyls tissues of Pelargonium X hortorum Bailey. Plant Growth Regulat. 35, 269-275. [ Links ]
Olivera, V., M. Gutiérrez, J. Gutiérrez y M. Andrade. 2000. Cultivo in vitro de Gerbera (Gerbera jamesonii H. Bolus) y su aclimatación en invernadero. Bioagro 12(3), 75-80. [ Links ]
Pohmer, S. 2004. Bouquets colombianos conquistan a Estados Unidos. En: Información Preferencial Flores, (septiembre 14), pp. 6-7. [ Links ]
Prathanturarug, S., N. Soonthornchareonnon, W. Chuakul, Y. Phaidee, B. Ruffoni y C. Mascarello. 2000. La propagazione dei Limonium ornamentali speciale Limonium. Flortecnica 5, 101- 110. [ Links ]
Ruffoni B. y C. Mascarello. 2000. Germinazione in vivo e in vitro del seme di Limonium. Flortecnica 5, 28-30. [ Links ]
Salisbury, F. y C. Ross, 1994. Fisiología vegetal. Grupo Editorial Iberoamerica S.A., México DF. 759 p. [ Links ]
Stephen, M., R. Butcher, J. Bicknell, F. Seelye y K. Borst. 1986. Propagation of Limonium peregrinum. The International Plant Propagators Society (Combined proceedings of annual meetings) 3, 448-450. [ Links ]
Sydney, C., L. Rodrigues y A. Kämpf. 2000. In vitro propagation of Limonium latifolium Kuntze (Plümbaginaceae). Cienc. Rural. 30, 4. [ Links ]
Victor, J., B. Murthy, S. Murch, S. Krishnaraj y P. Saxena. 1999. Role of endogenous purine metabolism in thidiazuron induced somatic embryogenesis of peanut (Arachis hypogaea L.). Plant Growth Regul. 28, 41-47. [ Links ]
Weaver, R. 1982. Reguladores de crecimiento de las plantas en la agricultura. Editorial Trillas, México D.F. 622 p. [ Links ]
Xiao, Y. y T. Kozai, 2006. In vitro multiplication of statice plantlets using sugar-free media. Scientia Hort. 109, 71-77. [ Links ]














