Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.25 no.1 Bogotá Jan./June 2007
Luz Edith Argel1, Mauricio Marín2, José Miguel Cotes3, Sonia Jaramillo 4 y Edgar Guzmán5
1 Auxiliar de investigación, Facultad de Ciencias, Universidad Nacional de Colombia, Medellín. e-mail: leargel@unalmed.edu.co
2 Profesor asistente, Facultad de Ciencias, Universidad Nacional de Colombia, Medellín. e-mail: mamarinm@unalmed.edu.co
3 Profesor asistente, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. e-mail: jmcotes@unalmed.edu.co
4 Profesora asociada, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. e-mail: sjaramal@unalmed.edu.co
5 Investigador, División Técnica Bayer CropScience, Colombia. e-mail: edgar.guzman@bayercropscience.com
Fecha de recepción: 13 de abril de 2006. Aceptado para publicación: 06 de junio de 2007
Resumen: El Mildeo velloso es uno de los mayores limitantes del cultivo de la rosa en Colombia. Esta enfermedad es causada por el Oomycete holobiótrofo Peronospora sparsa que fue detectado en la década de 1970 en la Sabana de Bogotá. En los últimos años su efecto negativo sobre la floricultura aumentó conduciendo a los cultivadores al empleo excesivo de fungicidas con acción sistémica, muchos de los cuales no cuentan con estudios de líneas base de sensibilidad ni con el diseño de estrategias anti-resistencia apropiadas. A fin de determinar el grado de sensibilidad de diez aislamientos de P. sparsa al fungicida fenamidone, representante del grupo de resistencia cruzada QoI, se realizaron pruebas de sensibilidad in vitro y evaluaciones moleculares. Los resultados muestran que este patógeno presenta un alto grado de sensibilidad a dicha molécula (EC50 promedio: 0,51 mg· L-1) y que no hay evidencia de la presencia de las mutaciones puntuales G143A y F129L asociadas con fenotipos resistentes a QoI. Este estudio aporta las bases para el desarrollo de una metodología de detección molecular de individuos con resistencia a fungicidas QoI que puede ser utilizada para monitorear las poblaciones del patógeno en nuestro medio.
Palabras clave: citocromo b, EC50, fungicidas QoI, Mildeo velloso, mutación puntual.
Abstract: Rose downy mildew caused by Peronospora sparsa is a disease of increasing importance for the Colombian flower industry. The disease was first reported in the 1970's and, during the last years, its aggressiveness has increased dramatically. This has meant that an increasing and unacceptable number of fungicide applications are required to control it. This situation has a negative impact on the environment and public health, and requires a program to manage fungicide resistance, including participation of flower growers, fungicide companies, government agencies, and research institutions. The aim of this study was to build up a baseline of sensitivity of P. sparsa isolates to fenamidone, a systemic QoI fungicide, in order to support chemical strategies used to control P. sparsa, and specifically those directed to avoid a loss of sensitivity to these fungicides. The results were linked to the presence of point mutations in the cytochrome b gene, which have previously been linked to resistance to these fungicides. Fungicide evaluations showed a high level of sensitivity of P. sparsa isolates to fenamidone (EC50: 0.51 mg· L-1), which was linked to the absence of point mutations G143A and F129L in the cytochrome b gene. A test is currently being designed to monitor QoI fungicide sensitivity in P. sparsa populations in the rose growing regions of Colombia.
Key words: cytochrome b, EC50, QoI fungicides, Downy mildew, punctual mutation.
Introducción
COLOMBIA ES EL SEGUNDO exportador de flores en el mundo, con una participación cercana al 14% del mercado internacional y un área cultivada de 6.544 ha con diversas variedades de rosas, claveles, crisantemos y al menos otras quince especies de plantas ornamentales (ASOCOLFLORES, 2005). El cultivo de rosas representael 48% de las exportaciones de este sector, de manera que constituye la base fundamental de la floricultura del país. La producción de rosas se ve afectada por diferentes factores bióticos y abióticos, entre los que sobresalen las plagas y enfermedades como los más limitantes, destacándose en los últimos años el Mildeo velloso, causado por el Oomycete Peronospora sparsa (Arbeláez, 1999). Este patógeno fue originalmente reportado en Inglaterra en 1862 y se detectó en Colombia en la década de 1970, ocasionando daños menores en los cultivos de rosas de la Sabana de Bogotá (Horts, 1983; Gómez, 2004).
El problema del Mildeo velloso en Colombia se ha incrementado durante el último lustro a tal punto que, bajo condiciones de alta susceptibilidad de las variedades sembradas, las pérdidas ocasionadas por esta enfermedad se estiman en un 10% de la producción bruta anual (Gómez y Arbeláez, 2005). Son varias las hipótesis que plantean los investigadores y productores de rosas como las causas del resurgimiento del Mildeo velloso en Colombia; entre otras se destacan la introducción y siembra de nuevas variedades de rosa susceptibles al patógeno, los cambios climáticos asociados con el calentamiento global, la modificación de los sistemas de producción de flores y el uso indiscriminado de fungicidas sistémicos para su control (Arbeláez, 1999; Ayala et al., 2005).
El aumento del nivel de enfermedad del Mildeo velloso de la rosa ha incrementado los costos de producción en este cultivo; ello ha precipitado un empleo excesivo de productos fungicidas y a su aplicación calendario, llegando incluso a encontrarse cultivos en los cuales se realizan tres aplicaciones por semana, con las graves consecuencias ambientales, de salud pública y de selección de variantes resistentes del patógeno que esto implica. Entre los fungicidas empleados para el control del Mildeo velloso se destacan fosetil-al, iprovalicarb, propineb, dimetomorf, cimoxanil, oxadixil, metalaxil y más recientemente el fenamidone (Quiroga, 2004; Waltera et al., 2004).
El fungicida fenamidone pertenece al grupo químico de las imidazolinonas, el cual presenta como modo de acción la inhibición de la respiración mitocondrial al bloquear el transporte de electrones a nivel de la ubihidroquinona en el complejo III (citocromo-Coxidoreductasa), también llamado ‘complejo bc1', razón por la que se incluye como fungicida del grupo QoI (por quinone outside inhibitors) con las estrobilurinas (azoxistrobin, picoxistrobin, piraclostrobin, kresoximmetilo, trifloxistrobin, metominostrobin, fluoxastrobin) y oxazolidinedionas (Genix y Villier, 2003; Neuburger et al., 2003; FRAC, 2005a). Su acción es especialmente eficaz contra un gran número de patógenos de la clase Oomycetes como Plasmopara viticola, Phytophthora infestans y varias especies de Peronospora; así mismo, también controla algunos Ascomycetes (Mycosphaerella spp., Venturia inaequalis) y hongos mitospóricos (Alternaria sp.) (Mercer y Latorse, 2003). El fenamidone es eficiente tanto a nivel preventivo como curativo, ya que actúa sobre diferentes sitios del ciclo de vida de los hongos y pseudo-hongos que controla. En el caso de los Oomycetes inhibe la liberación de zoosporas y la germinación directa a partir de esporangios, presentando también un efecto antiesporulante y una alta acción translaminar (Mercer y Latorse, 2003).
A pesar de que la comercialización de los fungicidas QoI es relativamente reciente, el reporte de aislamientos resistentes de hongos y pseudo-hongos a QoI se ha venido incrementando rápidamente en diferentes cultivos (Blumeria graminis f.sp. tritici en trigo; P. viticola en vid; V. inaequalis en manzano) debido a su mecanismo de acción único, a la ocurrencia de resistencia cruzada entre fungicidas QoI y a la carencia de prácticas adecuadas para su utilización (Neuburger et al., 2003; FRAC, 2006).
La resistencia a fungicidas QoI se ha asociado con la presencia de mutaciones puntuales en el gen citocromo b en aislamientos de diferentes hongos, detectándose inicialmente en individuos con fenotipos resistentes de Saccharomyces cerevisiae (Di Rago et al., 1995) y confirmándose en los fitopatógenos B. graminis f.sp tritici y Pseudocercospora cubensis en cultivos de trigo y cucurbitáceas, respectivamente (Sierotski et al., 2000; Ishii et al., 2001). En dichos estudios se han identificado cerca de 11 mutaciones potencialmente asociadas con resistencia a QoI, además de un posible mecanismo de detoxificación que está mediado por un sistema de respiración alterno como respuesta a la inhibición de la cadena de transporte de electrones (Zheng et al., 2000; Sierotzki et al., 2000). Investigaciones posteriores han determinado que los fenotipos resistentes se encuentran estrechamente asociados con la sustitución del aminoácido guanina por citosina en el codón 143 (GGT) que codifica para el aminoácido glicina de la proteína citocromo b (Sierotzki et al., 2000; Zheng et al., 2000; Ishii et al., 2001; Sirven y Beffa, 2003). Una segunda mutación que induce al cambio de fenilalamida por leucina en el codón 129 también se ha asociado con la resistencia a dichos fungicidas en Pyricularia grisea (Farman, 2001), Pythium aphanidermatum (Bartlett et al., 2002) y V. inaequalis (Zheng y Köller, 1997).
El efecto detrimental que ocasiona el fenómeno de resistencia a fungicidas sobre el ambiente, la salud pública y la economía de las regiones agrícolas, trasciende el ámbito de las compañías productoras de agroquímicos y se constituye en un problema social con profundos efectos, tanto sobre las poblaciones rurales más vulnerables, como sobre los consumidores concentrados en los centros urbanos. En este escenario se requiere la cooperación de entidades de investigación y organismos de control del Estado para diseñar estrategias anti-resistencia, es decir, que prevengan en campo el desarrollo de mecanismos de resistencia a los fungicidas QoI por parte de los Oomicetos. Dichas estrategias se basan en la realización de estudios regionales de eficacia de fungicidas bajo las condiciones propias de cada agroecosistema, la determinación de líneas base de sensibilidad y la ejecución de investigaciones que predigan el riesgo biológico de la aparición de poblaciones de fitopatógenos resistentes a los fungicidas, en especial aquellos susceptibles de generar resistencia cruzada (Köller, 2001; Damicone, 2004).
Debido a la carencia de información sobre la efectividad del fungicida fenamidone para el control del Mildeo velloso de la rosa en Colombia se determinaron los niveles de sensibilidad a este fungicida en 10 aislamientos de P. sparsa procedentes de la Sabana de Bogotá y el Norte de Antioquia. Dichas evaluaciones se acompañaron del análisis molecular para detectar la presencia de las mutaciones G143A y F129L en el gen citocromo b, asociadas con fenotipos resistentes a fungicidas QoI en otros patógenos.
Materiales y métodos
Obtención de aislamientos
Esta investigación se desarrolló en los laboratorios de Estudios Moleculares y de Biología Celular y Molecular de las facultades de Ciencias y Ciencias Agropecuarias, Universidad Nacional de Colombia, en Medellín. Las plantas de rosa empleadas para el mantenimiento de P. sparsa fueron sembradas en los predios de la universidad y los aislamientos del pseudo-hongo se obtuvieron a partir de folíolos de rosa con síntomas de Mildeo velloso en cultivos ubicados en la Sabana de Bogotá (Bogotá D.C., Cogua, Cota, Gachancipá, Suba, Suesca, Tenjo) y el Oriente (Carmen de Viboral, La Unión) y Norte (San Pedro de los Milagros) de Antioquia.
Mantenimiento del patógeno
Debido a la condición holobiótrofa de P. sparsa es necesario mantener de manera permanente los aislamientos del hongo sobre material vegetal; para esto se utilizaron hojas jóvenes provenientes de plantas de rosa variedad Charlotte, la cual es altamente susceptible a la enfermedad. La purificación de los aislamientos del oomiceto se realizó mediante el paso de un pincel fino humedecido por el envés a partir de folíolos obtenidos en el campo con signos del patógeno, y su posterior contacto con folíolos de rosa sanos en estado joven, previamente desinfestados mediante lavado con abundante agua destilada y una solución de hipoclorito de sodio al 1% durante 1 min. Los folíolos inoculados fueron mantenidos en cajas de Petri plásticas acondicionadas como cámaras húmedas, con el haz dirigido hacia la base e incubadas en un fitotrón (Indulab® CAB-30, Medellín, Colombia) a 18°C, humedad relativa entre 90 y 100% y 12 horas de luz/oscuridad por 7 días. Este procedimiento se repitió hasta obtener suficiente material del pseudohongo para la extracción de ADN y la realización de las pruebas de sensibilidad.
Niveles de sensibilidad de Peronospora sparsa al fungicida fenamidone
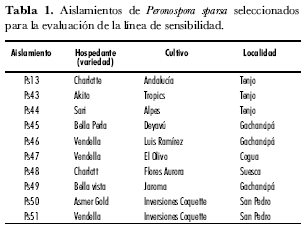
Para la construcción de la línea de sensibilidad al fungicida fenamidone se seleccionaron 10 aislamientos de P. sparsa representantivos de las diferentes zonas de colección (tabla 1). Se utilizó un diseño completamente al azar con arreglo factorial 10x7 y tres repeticiones. La unidad experimental estuvo conformada por una caja de Petri con cuatro discos de hoja de 14 mm proveniente de folíolos jóvenes de plantas de rosa de la variedad Charlotte. El primer factor corresponde a los 10 aislamientos y el segundo a siete concentraciones del fungicida (0; 1,5; 3; 6; 12; 25 y 50 mg· L-1), las cuales fueron definidas siguiendo una escala exponencial con su límite superior basado en la dosis recomendada en campo. El experimento completo fue repetido dos veces en el tiempo para mejorar la precisión de la información obtenida.
Los discos fueron sumergidos en cada una de las dosis durante 1 min, para luego ser localizados en cajas de Petri con medio de sobrevivencia suplementado con 2 mg· L-1 de kinetina e incubados durante 24 horas bajo las condiciones antes descritas. Para el establecimiento de la dosis del tratamiento control (0 mg· L-1) se sumergieron los discos de hoja en agua destilada estéril y se inocularon en forma similar a los demás tratamientos.
Para la inoculación del patógeno se colectaron en agua destilada estéril los esporangios desarrollados luego de siete días de incubación, preparándose suspensiones de 40,000 esporangios/mL, mediante el empleo de un hematocitómetro. Posteriormente, una gota de 10 µL de las concentraciones citadas fue depositada en el centro de cada disco foliar y las cajas fueron incubadas durante 8 días, período después del cual se evalúo sobre cada disco el porcentaje de área foliar afectada con Mildeo velloso por comparación con una escala 0-5, en donde 0 se refiere a la ausencia de síntomas y 5 a un porcentaje de área foliar afectada superior a 50% (Mercer y Latorse, 2003).
Para el análisis estadístico del experimento se procedió a codificar los valores discretos de la escala de severidad en una escala porcentual que indica el área foliar afectada, donde los intervalos 0-1 corresponde a valores de 0 a 12,5%; 1-2, 12,5 a 25%; 2-3, 25 a 37,5%; 3-4, 37,5 a 50% y 4-5, 50 a 100%. Inicialmente se realizó un análisis de varianza combinado considerando un modelo mixto donde los efectos fijos fueron aislamiento y dosis, y los efectos aleatorios fueron la variación entre experimentos, entre cajas de Petri dentro de experimentos, y las interacciones del efecto de los experimentos con los aislamientos y las dosis. Fue considerada la heterogeneidad de varianzas dentro de cada uno de los experimentos. Se obtuvieron las medias ajustadas por mínimos cuadrados y su respectivo error estándar para cada uno de los aislamientos en cada una de las dosis. Con estos valores se realizó la estimación de la EC50 ponderada por el recíproco del error estándar para cada uno de los aislamientos mediante el procedimiento PROBIT de SAS System v. 8,2® (SAS, 1999). Adicionalmente se obtuvieron los intervalos de confianza al 95%.
Para verificar la acción del fungicida como antiesporulante se realizó el conteo de esporangios por dosis y por aislamiento en cada uno de los experimentos, y se obtuvieron los promedios de estos valores.
Evaluación del producto comercial Mildex®
Con fines comparativos se realizó un experimento en el cual se evaluó el nivel de sensibilidad al fungicida Mildex® -que tiene como formulación comercial 44,4 g· kg-1 del ingrediente activo (i.a.) fenamidone y 667 g· kg-1 de fosetil-al- de dos aislamientos de P. sparsa que presentaron los mayores y menores valores EC50 en la evaluación de la línea base. Los procedimientos de aplicación del fungicida, inoculación y análisis estadístico, fueron similares a los descritos anteriormente, con la variación de la utilización del producto comercial Mildex® como fuente para la obtención de las seis dosis de i.a. fenamidone, indicadas anteriormente y la realización de un diseño completamente al azar con arreglo factorial 4x7.
Extracción del ADN de Peronospora sparsa
Con el objeto de relacionar los resultados obtenidos en la evaluación de la línea base con la secuencia de nucleótidos de la región del gen citocromo b en la que previamente se han identificado mutaciones puntuales asociadas con el grado de sensibilidad a fungicidas QoI de hongos y pseudo-hongos (Sierotski et al., 2000; Sirven y Beffa, 2003), se seleccionaron los tres aislamientos que presentaron los menores valores de EC50 y los tres aislamientos con menor grado de sensibilidad al fungicida fenamidone a fin de proceder al análisis molecular de la región mitocondrial del gen citocromo b. En la extracción del ADN de cada aislamiento se tomaron las estructuras somáticas y reproductivas del pseudo-hongo mediante la aplicación directa de 150 µL de buffer de extracción (CTAB 2%, NaCl 1.4 M, EDTA 20 mM, Tris-HCl 100 mM pH 8,0) sobre el tejido foliar afectado y la obtención de dicha suspensión con la ayuda de una micropipeta, para proceder a su maceración física mediante un pistilo estéril y su posterior incubación al baño María a 65°C por 10 min. Luego se adicionó un volumen de fenol:cloroformo, se centrifugó a 13.000 rpm por 10 min y se realizó un lavado adicional con 1 volumen de cloroformo. El sobrenadante fue transferido a otro tubo Eppendorf y los ácidos nucleicos fueron precipitados durante 2 horas a –20°C con 0,6 volúmenes de isopropanol y 0,1 volúmenes de acetato de sodio 3 M, colectandose por centrifugación a 13.000 rpm por 30 min. El micro-pellet obtenido fue lavado con 100 µL de etanol al 70%, secado al vacío en un equipo Speed Vac® (Eppendorf 5301, Hamburgo, Alemania) y resuspendido en 20 µL de agua bidestilada estéril.
Confirmación molecular de la naturaleza del ADN recuperado
Debido a la condición holobiótrofa de P. sparsa, y a la baja cantidad de material biológico utilizado para la extracción de ADN, fue necesario confirmar la naturaleza del ADN extraído utilizando los primers específicos para P. sparsa PS3 (5' ATT TTG TGC TGG CTG GC 3') y PSI (5' TGC CAC ACG ACC GAA GC 3') diseñados previamente por Aegerter et al. (2002) para amplificar las regiones ITS1, 5.8S e ITS2 de este pseudohongo. Las reacciones de PCR incluyeron 0,1 µM de cada primer, 1 U de Taq ADN polimerasa recombinante (Fermentas, Vilnius, Lituania); 0,2 mM de cada dNTP, 1X de buffer de enzima (100 mM Tris-HCl (pH 8,8); 500 mM KCl; 0,8% Nonidet P40); 2 mM MgCl2, 5 µL de una dilución 1/10 de ADN y un volumen total de reacción de 25 µL.
Las condiciones de amplificación consistieron en una desnaturalización inicial a 94 °C por 3 min, seguida por 35 ciclos de 94°C por 2 min, 60°C por 1,3 min, 72°C por 2,5 min y un período final de extensión a 72°C por 7 min, utilizándose un termociclador PTC-100® (MJ. Research, INC., Whaltam, EUA). Luego de la reacción se tomaron 5 µL de los productos y se separaron por electroforesis en gel de agarosa al 1,5% suplementado con 3 µL de bromuro de etidio (10 mg· mL-1). La visualización de las bandas se realizó bajo luz ultravioleta utilizando el sistema digital de análisis BioDoc Analyze® (Biometra, Hamburgo, Alemania). Cinco de los productos de PCR obtenidos en igual número de aislamientos fueron purificados mediante el kit Wizard PCR Preps ADN Purification System® (Promega, Madison, EEUU) para proceder a su secuenciación directa en ambas direcciones utilizando un secuenciador ABI Prism 3730xl® (PE Applied Biosystems) de la compañía Macrogen (Corea del Sur) con los primers PS1 - PS3 y el kit Big Dye Terminator Cycle Sequencing Ready Reaction® (PE Applied Biosystems, Foster City, California, EUA). Las secuencias obtenidas fueron editadas con la ayuda del software EDITSEQ ® y se compararon, utilizando el programa BLAST (2006), frente a aquellas reportadas para P. sparsa en las bases de datos moleculares.
Análisis de la secuencia parcial del gen citocromo b
La amplificación del gen citocromo b se realizó empleando los primers: CB1 (5'ATT TTT TTG GAT TCG GTT CG 3') y CB2 (5'GTT TTC ATT GGA TTT GCT TC 3') reportados por Sirven y Beffa (2003) como específicos para Oomycetes; éstos amplifican una región de aproximadamente 700 pb que contiene los codones 129 a 146, en la cual se han detectado mutaciones asociadas con resistencia a fungicidas QoI. Las reacciones se realizaron en un termociclador PTC-100® (MJ Research, Inc.) y consistieron de una desnaturalización inicial a 94ºC por 3 min, seguida por 35 ciclos de 94ºC por 1,3 min., 52ºC por 1,3 min, 72ºC por 2 min y una extensión final a 72ºC por 10 min.
Las condiciones del PCR, corrido electroforético y secuenciación fueron similares a las descritas anteriormente, con la excpeción de los primers utilizados (CB1 y CB2). Las secuencias obtenidas fueron editadas con la ayuda del software Editseq® y se compararon utilizando el programa BLAST (2006) con aquellas del gen citocromo b previamente depositadas en las bases de datos moleculares para otros Oomycetes. Las secuencias consenso se ensamblaron utilizando el programa MegAlign® y se tradujeron a secuencia de aminoácidos.
Resultados
Aislamientos
Los procedimientos presentados en la sección de materiales corresponden a los consolidados de una serie de variantes metodológicas que fue necesario evaluar en esta investigación. En total se colectaron 143 muestras con síntomas de Mildeo velloso en 15 variedades comerciales de rosa, de las cuales fue posible la obtención de 51 aislamientos del patógeno.
Establecimiento de los niveles de sensibilidad de P. sparsa al fungicida fenamidone
La acción del fungicida fenamidone sobre el desarrollo de la sintomatología del Mildeo velloso en los discos de hoja inoculados fue evidente y gradual con el aumento de las dosis evaluadas. Por su parte, en el tratamiento control la severidad del patógeno alcanzó valores en la escala que oscilaron entre 3 y 4 (37,5% y 50% en la escala transformada) para todos los aislamientos, en el tratamiento con la dosis 1,5 mg· L-1 dicha severidad se redujo a valores de la escala de 2 a 3 (25% a 37,5%); cuando se evaluó la dosis de 6 mg· L-1, no sobrepasó el nivel 2 (12,5 a 25%) de la escala. Las dosis del fungicida superiores a 12 mg· L-1 fueron efectivas para reducir la severidad del Mildeo velloso a valores entre 0 y 1 (0% a 12,5%) (figura 1).
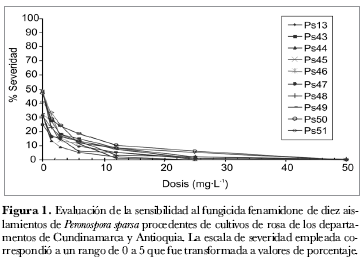
En el análisis de la esporulación del patógeno se determinó que en promedio, para el tratamiento control, se produjeron entre 10.500 esporangios/mL-1 (aislamiento Ps48) y 82.500 esporangios/mL-1 (aislamiento Ps13), niveles que se redujeron con el aumento de la dosis del fungicida, a tal punto que, a 12 mg· L-1, solamente tres aislamientos esporularon (aislamientos Ps13, Ps45 y Ps50); a 25 mg· L-1 ninguno de ellos logró esporular. El efecto antiesporulante del fenamidone se confirma al observar que el aislamiento Ps13, que produjo un mayor número de esporangios en el tratamiento control, al ser sometido a las dosis de 1,5 µg· mL-1 y 3 µg· mL-1, redujo su nivel promedio de esporulación en 74 y 81%, respectivamente (figura 2). Cuando se calcularon los valores de EC50, se encontró que éstos oscilaron entre 0,29 (aislamiento Ps44) y 0,83 mg· L-1 (aislamiento Ps46), siendo el promedio para todos los aislamientos de 0,51 mg· L-1 (figura 3).
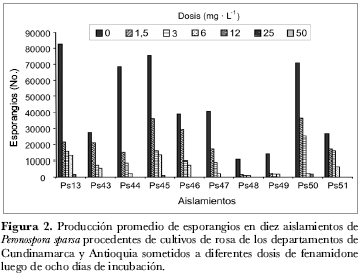
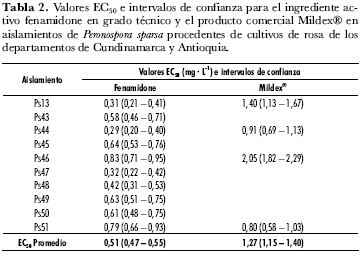
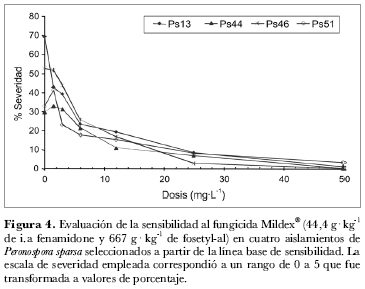
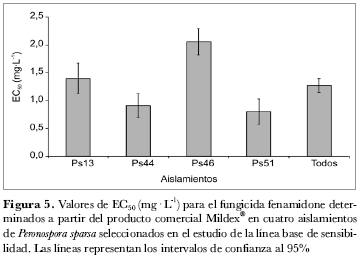
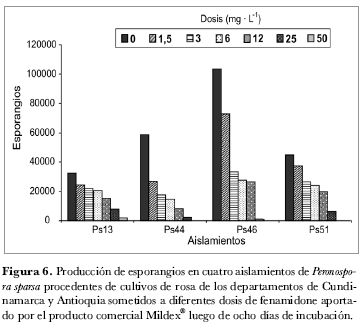
La evaluación de la acción del fenamidone a partir de la formulación comercial Mildex® en los cuatro aislamientos seleccionados, resultó con un patrón similar al encontrado cuando se evaluó el ingrediente activo (tabla 2). Sin embargo su eficacia fue menor, ya que las dosis que redujeron el nivel de severidad a valores de 1 en la escala utilizada, fueron 25 mg· L-1 para los aislamientos Ps13, Ps46, Ps51 y 12 mg· L-1 para el aislamiento Ps44 (figura 4). Este resultado se reflejó en el cálculo de los valores de EC50, que alcanzaron un promedio de 1,3 µg· mL-1 y oscilaron entre 0,8 (aislamiento Ps51) y 2 mg· L-1 (aislamiento Ps46) (figura 5). Un situación similar se encontró al evaluar el grado de esporulación, en este caso, ninguno de los cuatro aislamientos detuvo la producción de esporangios a 25 mg· L-1, e incluso el aislamiento Ps13 produjo en promedio 2.000 esporangios/mL-1 cuando se sometió a la mayor dosis (50 mg· L-1) (figura 6).
Confirmación molecular de la naturaleza del ADN recuperado
La metodología de extracción de ácidos nucleicos empleada resultó eficiente para obtener la calidad adecuada de ADN requerida para realizar la prueba de PCR específica, en la que se obtuvo un amplicón de aproximadamente 700 pb en los diez aislamientos utilizados en este estudio. La secuenciación de estos fragmentos permitió confirmar la identidad de la especie Peronospora sparsa como agente causal del Mildeo velloso de la rosa en Colombia (número de accesión GenBank DQ887772).
Análisis de la secuencia parcial del gen citocromo b
La utilización de los primers CB1 y CB2 bajo las condiciones de PCR descritas permitió la amplificación específica de un amplicón de 625 pb. Dicha región fue confirmada mediante secuenciación directa como perteneciente al gen citocromo b del genoma mitocondrial (número de accesión GenBank DQ887773). El análisis mediante BLAST de la secuencia de nucleótidos permitió determinar que existía un alto porcentaje de similitud entre las regiones correspondientes a las posiciones 14- 112 (94%), 187-397 (93%) y 430-523 (91%) de los aislamientos de P. sparsa secuenciados y las regiones del ADN mitocondrial 11428- 11526 nt, 11601-11811 nt, 11844-11937 nt, del Oomycete P. infestans. Así mismo, se encontró que la región analizada presenta un alto nivel de similitud con secuencias disponibles del citocromo b en los Oomycetes fitopatógenos Hyaloperonospora parasitica (valor E: 4 x 10-79, para 205 nt), Phytophthora megasperma (valor E: 9 x 10-77 para 205 nt) y Plasmopara viticola (valor E: 9 x 10-46, para 205 nt). Cuando la comparación de la porción del gen citocromo b se realizó con base en la secuencia de aminoácidos los valores de similitud fueron de 96% (valor E: 9 x 10-105), presentándose 177 identidades de los 183 aminoácidos, lo cualdemuestra el alto grado de conservación que presenta la proteína codificada por dicho gen y sustenta su utilidad como un marcador del nivel de sensibilidad de los Oomycetes a los fungicidas QoI.
El estudio detallado de la región del gen citocromo b, en la cual se han detectado en hongos mutaciones asociadas a fenotipos resistentes a fungicidas QoI, evidenció la ausencia de las mutaciones G143A y F129L en todos los aislamientos evaluados, lo cual coincide con el alto nivel de sensibilidad presentado por todos los aislamientos de P. sparsa evaluados, tanto en el estudio de la línea base, como en el proceso de crecimiento bajo dosis subletales (figura 7).

Discusión
En esta investigación se evaluó el nivel de sensibilidad de P. sparsa, agente causal del Mildeo velloso de la rosa, a la molécula fenamidone, representante del grupo de fungicidas de resistencia cruzada QoI. Se encontró que las poblaciones de este patógeno tienen un alto nivel de sensibilidad a dicho i.a. y que no se presentan mutaciones asociadas con la resistencia a QoI en diez aislamientos de P. sparsa obtenidos de diferentes cultivos de rosa del país.
Para la realización del estudio fue necesario el establecimiento y estandarización de diversas metodologías fitopatológicas y moleculares aplicables a hongos y pseudo-hongos obligados bajo las condiciones propias de nuestro medio, estableciéndose las bases experimentales para el desarrollo de futuras investigaciones con este grupo de agentesfitopatógenos. En este sentido, procesos como el de purificación y mantenimiento de aislamientos de P. sparsa bajo condiciones de laboratorio presentaron gran dificultad y exigieron la aplicación de diferentes estrategias metodológicas para su estandarización. Aunque en la literatura mundial existen reportes de trabajos similares realizados con mildeos vellosos (Peronospora destructor, Plasmopara viticola, Pseudoperonospora cubensis) (Michelmore et al., 1988, Kamoun, 2003), las metodologías allí establecidas no correspondían totalmente a las condicionesde este trabajo. Afortunadamente, los trabajos previos desarrollados en Colombia para P. sparsa por Arbeláez (1999), Gómez (2004) y Filgueira (2004) ofrecieron un adecuado punto de partida que condujo a adaptaciones experimentales como la implementación de cámaras húmedas mediante el empleo de agar-agua y rejillas plásticas inmersas en una lámina de agua; inoculación del patógeno utilizando una suspensión de esporangios a partir de volúmenes de 250 µL, previa generación de microlesiones mediante un pincel fino y el mantenimiento del patógeno bajo condiciones de luminosidad constante, 18°C y HR superior al 80%. Así mismo, se adaptó una metodología eficiente de extracción de ADN a partir de modificaciones de los protocolos de Lindqvist-Kreuze et al. (2002) y Tian et al. (2004) y se estandarizó la técnica de PCR específica para amplificar las regiones nuclear del rDNA y mitocondrial del citocromo b.
De un total de 143 muestras sintomáticas colectadas se logró la purificación de 51 aislamientos representativos de las principales regiones cultivadoras de rosa de la sabana de Bogotá y Antioquia. Debido al carácter holobiótrofo de P. sparsa, por motivos logísticos no fue posible el mantenimiento de dicha colección en el laboratorio, pero si lo fue el almacenamiento de su ADN para estudios genéticos posteriores. En esta investigación dicho procedimiento se realizó y su utilidad se hizo evidente en un primer trabajo desarrollado por Ayala et al. (2005), en el cual se estudió el nivel de variabilidad genética de 40 aislamientos de P. sparsa mediante marcadores moleculares RAPD y PCR-RFLP de regiones ITS, encontrándose que en Colombia este patógeno presenta una estructura genética fundamentalmente clonal.
La utilización del par de primers PS1 y PS3 diseñados por Aegerter et al. (2002) para amplificar en forma específica el ADN ribosomal de la región ITS de P. sparsa, resultó una técnica adecuada para confirmar al agente causal del Mildeo de la rosa en Colombia como perteneciente a esta especie, además de garantizar que el ADN extraído procedía del pseudo-hongo y evaluar la utilidad del ADN en amplificaciones de PCR. De esta forma se complementó el reporte de Arbeláez (1999) quien había identificado a P. sparsa en cultivos de rosa basado en características morfológicas; confirmación que se hacía necesaria debido a que las especies de género Peronospora presentan un alto grado de evolución convergente (Riethmüller et al., 2002; Göker et al., 2003).
La acción fungicida del fenamidone sobre P. sparsa fue evidente, disminuyendo gradualmente, tanto la severidad de Mildeo velloso sobre los discos de hoja inoculados, como el nivel de producción de esporangios del patógeno, con el aumento de las dosis de esta molécula química. Diferentes investigaciones realizadas por compañías productoras de fungicidas QoI (Mercer y Latorse, 2003; Sirven y Beffa, 2003; FRAC, 2005a) e investigadores independientes (Farman, 2001; Bartlett et al., 2002; Neuburger et al., 2003) han determinado que este grupo químico es una alternativa eficiente para el manejo de algunos Ascomycetes, hongos mitospóricos y Oomycetes fitopatógenos en diversos cultivos.
Para nuestro conocimiento, este trabajo representa el primer reporte publicado de una línea de sensibilidad a dichos fungicidas en el patógeno P. sparsa y, por tanto, no es posible la comparación de estos resultados con poblaciones del pseudohongo procedentes de otras regiones geográficas; sin embargo, existen reportes en los Oomycetes P. viticola y P. infestans, de los que se puede deducir que las poblaciones colombianas de P. sparsa son significativamente más susceptibles a dicho i.a.: en este estudio se encontró un muy bajo valor de EC50 (0,51 mg· L-1) en contraste con los rangos de 2,6 a 4 mg· L-1 reportados para P. viticola; de 12 a 19 mg· L-1 para P. infestans en Europa (Latorse y Gonzalez-Hilt, 2003); y de 1,83 a 2 mg· L-1 encontrados por Argel et al. (2004) y Escudero et al. (2005) para P. infestans en Colombia.
Cuando se evaluó la acción del fenamidone bajo su formulación comercial (Mildex®), se encontró que los valores de EC50 para los cuatro aislamientos de P. sparsa incluidos en este experimento aumentaron en cerca del 100%; además, la acción antiesporulante del fungicida se redujo notablemente con respecto a la prueba en la que se utilizó el i.a. en grado técnico. Este hecho puede ser un indicativo del efecto que sobre la sistemicidad del i.a. fenamidone presenta el fungicida acompañante fosetil-al, el cual requiere del sistema vascular de la planta para su translocación; allí es escindido generándose fosfanato, una molécula antifúngica e inductora de resistencia en las plantas (Guest, 2006). Debido a que en el presente experimento se emplearon discos de hoja, es explicable entonces la reducción de la capacidad de translocación translaminar del producto comercial Mildex ®. Sin embargo, la efectividad de la formulación se ajusta a las recomendaciones de la FRAC (2006) en el sentido que el fungicida acompañante (fosetil-al) al poseer un modo de acción diferente al fungicida principal (fenamidone), amplía el espectro de control del producto químico a aquellos individuos que presentan pérdida de sensibilidad al producto inhibidor de QoI.
La secuenciación de una porción del gen mitocondrial citocromo b, en la que se han reportado las mutaciones puntuales asociadas con fenotipos resistentes a fungicidas QoI (Sierotzki et al., 2000; FRAC, 2005b), permitió confirmar los resultados obtenidos en la prueba de sensibilidad, ya que no se detectaron las mutacionesG143A y F129L en ninguno de los aislamientos de P. sparsa evaluados, ni en otras posiciones de la porción secuenciada del gen citocromo b.
Recientemente Fisher y Meunier (2005) realizaron un estudio tendiente a re-examinar la asociación de mutaciones puntuales con la ocurrencia de fenotipos resistentes de los hongos Saccharomyces cerevisiae y Pneumocystis carinii a partir de la inducción dirigida de mutaciones puntuales, encontrando que los mutantes G143A presentaban un aumento en sus valores EC50 de 16 a 400 veces dependiendo del i.a. QoI, mientras que en aquellos con la mutación F129L, dicho incremento osciló entre 2 y 12 veces. Según FRAC (2005b), las mutaciones G143A se han encontrado en 17 de 23 hongos fitopatógenos evaluados con fenotipos resistentes, mientras que la mutación F129L sólo se ha reportado en tres de ellos. Un hecho significativo del estudio de Fisher y Meunier (2005) fue la observación que la ocurrencia de estas mutaciones no induce efectos adversos sobre la actividad del complejo bc1 de los patógenos resistentes, de tal manera que éstos mantienen su competitividad ecológica invariable, lo cual representa un alto riesgo desde el punto de vista de su control.
El empleo de la técnica basada en PCR para la determinación de fenotipos de P. sparsa resistentes a fungicidas QoI presenta un alto potencial desde el punto aplicado, debido a que no se requiere del mantenimiento del patógeno bajo condiciones de laboratorio. Estas pruebas se han incorporado en forma rutinaria en la evaluación de los niveles de sensibilidad de poblaciones de fitopatógenos de importancia económica en diferentes regiones del mundo (FRAC, 2006) e incluyen el empleo de enzimas de restricción cuyos sitios de reconocimiento están ubicados en los lugares donde ocurren las mutaciones asociadas con resistencia, así como el uso de sistemas de PCR en tiempo real basados en SYBR Green I o en sondas fluorescentes TaqMan®, que permiten cuantificar la frecuencia de individuos resistentes en una población (Gisi et al., 2002; Fraaije et al., 2002; Sirven et al., 2002; Sirven y Beffa, 2003).
Conclusiones
A partir de los resultados encontrados en esta investigación se confirma la utilidad que presentan los fungicidas QoI para el control del Mildeo velloso de la rosa en Colombia. La permanencia del nivel de sensibilidad de las poblaciones del patógeno al fenamidone dependerá de un empleo adecuado y oportuno de estas moléculas químicas por parte de los cultivadores de rosa. En este sentido, la FRAC (2006) presenta una guía completa de recomendaciones tendientes a evitar la presión de selección que induzca la ocurrencia de mutantes con resistencia a QoI; por su parte, en el presente estudio se ofrece una base metodológica para implementar un sistema de diagnóstico molecular basado en PCR-RFLP que puede ser empleado en el monitoreo constante de la sensibilidad de las poblaciones de P. sparsa en las diferentes regiones cultivadoras de rosa del país.
Agradecimientos
Para la realización de este estudio se contó con la colaboración del personal del Laboratorio de Estudios Moleculares de la Universidad Nacional de Colombia, en Medellín; contamos con el aporte económico de la Dirección de Investigación de la Universidad Nacional de Colombia, Sede Medellín (DIME) a través del proyecto Quipú 30802871 y con la cofinanciación de la compañía Bayer CropScience através del convenio interinstitucional Quipú 20301005378.
Literatura citada
Aegerter, B.J., J.J. Núñez y R.M. Davis. 2002. Detection and management of Downy mildew in rose Rootstock. Plant Dis. 86, 1363-1368. [ Links ]
Arbeláez, G. 1999. El Mildeo velloso del rosal ocasionado por Peronospora sparsa Berkeley. Acopaflor 6, 37-39. [ Links ]
Argel, L.E., S. Jaramillo, J.G. Morales, B. Jacqmin y E. Guzmán. 2004. Línea base de sensibilidad de Phytophthora infestans al fenamidone (S)-5-metil-2-metilltio-5-fenil-3-fenilamino-3,5- dihidroimidazol-4-uno en Colombia. En: Memorias XXI Congreso de la Asociación Latinoamericana de la Papa (ALAP). 7 a 12 de marzo de 2004. Valdivia. [ Links ]
ASOCOLFLORES. 2005. Datos de interés del sector floricultor. En: http://www.asocolflores.org/info/info_datosin.php; consulta: marzo 2005. [ Links ]
Ayala, V.M., S. Jaramillo y M. Marín. 2005. Caracterización molecular de aislamientos de Peronospora sparsa en cultivos de rosa de la Sabana de Bogotá y el Oriente Antiqueño. Trabajo de grado, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. 27 p. [ Links ]
Bartlett, D.W., J.M. Clough, J.R. Godwin, A.A. Hall, M. Hamer y B. Parr-Dobrzanski. 2002. Review. The strobilurin fungicides. Pest Mgt. Sci. 58, 649-662. [ Links ]
BLAST. 2006. En: http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi; consulta: mayo 2006. [ Links ]
Damicone, J. 2004. Fungicide resistance management. En: Oklahoma Cooperative Extension Service OSU Extension Facts F-7663. http://pearl.agcomm.okstate.edu/plantdiseases/f-766.htm.; consulta: noviembre de 2004 [ Links ]
Di Rago, J.P., D.S. Hermann-Le, F. Paques, J. Risler, P. Netter y P.P. Slonimski. 1995. Genetic analysis of the folded structure of yeast mitochondrial cytochrome b by selection of intragenic second-site revertans. J. Mol. Biol. 248, 804-811. [ Links ]
Escudero, R.M., S. Jaramillo, J.M. Cotes y M. Marín. 2005. Secuencia parcial del gen citocromo b de Phytophthora infestans y su realación con la resistencia al fenamidone. Trabajo de grado, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. 27 p. [ Links ]
Farman, M.L. 2001. The molecular basis of field resistance to QoI fungicides in Pyricularia grisea. Phytopathology 91, 110 (abstr). [ Links ]
Filgueira, J.J. 2004. Estudio microscópico del desarrollo biológico de Peronospora sparsa en rosa bajo condiciones controladas. En: Memorias XXV Congreso ASCOLFI. 11 a 13 de agosto de 2004. Palmira. [ Links ]
Fisher, N. y B. Meunier. 2005. Re-examination of inhibitor resistance conferred by Qo-site mutations in cytochrome b using yeast as a model system. Pest Mgt. Sci. 61, 973-978. [ Links ]
Fraaije, B.A., J.A. Butters, J.M. Coelho, D.R. Jones y D.W. Hoollomon. 2002. Following the dynamics or strobilurin resistance in Blumeria graminis f. sp. trici using quantitative allele-specific realtime PCR measurements with the fluoresente dye SYBR Green I. Plant Pathol. 51, 45-54. [ Links ]
FRAC. 2005a. FRAC fungicide group names and codes. Complex III of fungal respiration: ubiquinol oxidase, Qo site. En: http://www.frac.info; consulta: agosto 2005. [ Links ]
FRAC. 2005b. Mutations associated with QoI-resistance (Updated 11- Oct-2005) En: http://www.frac.info; consulta: marzo de 2005. [ Links ]
FRAC. 2006. QoI Working Group. En: http://www.frac.info; consulta: marzo 2006. [ Links ]
Genix, P. y A. Villier. 2003. Fenamidone inhibits mitochondrial respiration, a property n ot shared by its metabolites. Pflanzenschutz- Nachrichten Bayer 56, 444-448. [ Links ]
Gisi, U., H. Sierotzki, A. Cook y A. McCaffery. 2002. Mechanisms influencing the evolution of resistance to Qo inhibitor fungicides. Pest Mgt. Sci. 58, 859-867. [ Links ]
Göker, M., H. Voglmayr, A. Riethmüller, M. Weiß y F. Oberwinkler. 2003. Taxonomic aspects of Peronosporaceae inferred from Bayesian molecular phylogenetics. Can. J. Bot. 81, 672-683. [ Links ]
Gómez, S. 2004. Determinación de componentes de la biología de Peronospora sparsa Berkeley, y caracterización de la respuesta de tres variedades de rosa a la infección del patógeno bajo condiciones de laboratorio e invernadero. Tesis de Maestria. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. 69 p. [ Links ]
Gómez, S. y G. Arbeláez. 2005. Efecto de la temperatura en el periodo de latencia y producción de esporangios de Peronospora sparsa Berkeley en tres variedades de rosa. Agron. Colomb. 23, 239-245. [ Links ]
Guest, D.D. 2006. Fosetyl-Al, control of plant diseases utilizing the plant's own defence mechanisms. En: Acta Hort. 166: Propagation of ornamentals plants, http://www.actahort.org/books/166/166_7.htm p166; consulta: marzo 2006. [ Links ]
Horst, R.K. 1983. Compendium of rose diseases. The American Phytopathologycal Society. St. Paul. [ Links ]
Ishii, H., B.A. Fraaije, T. Sugiyama, K. Noguchi , K. Nishimura, T. Takeda, T. Amano y D.W. Hollomon. 2001. Occurrence and molecular characterization of strobilurin resistance in cucumber Powdery mildew and Downy mildew. Phytopathol. 91, 1166-1171. [ Links ]
Kamoun, S. 2003. Minireviews molecular genetics of pathogenic Oomycetes. Eukaryotic Cell 2, 191-199. [ Links ]
Köller, W. 2001. Fungicide resistance. Encyclopedia of Plant Pathology 2, 483-488. [ Links ]
Latorse, M. P. y E. Gonzalez-Hilt. 2003. Sensitivity base line and resistance monitoring on Plasmopara viticola and Phytophthora infestans. Pflanzenschutz-Nachrichten Bayer 56, 511-522. [ Links ]
Lindqvist-Kreuze, H., H. Koponen, y J. Valkonen. 2002. Variability of Peronospora sparsa (syn. P. rubi) in Finland as measured by amplified fragment length polymorphism. Europ. J. Plant Pathol. 108, 327-335. [ Links ]
Mercer, R.T. y M.P. Latorce. 2003. Fungicidal properties of the active ingredient fenamidone. Pflanzenschutz-Nachrichten Bayer 53, 465-476. [ Links ]
Michelmore, R.W; T. Ilott, S.H Hulbert y B. Farrara. 1988. The downy mildews. Adv. Plant Pathol. 6, 55-76. [ Links ]
Neuburger, M., R. Beffa y A. Villier. 2003. Mode of action of fenamidone: similarities and differences with known QoI. Pflanzenschutz- Nachrichten Bayer 56, 449-464. [ Links ]
Quiroga, B. 2004. Evaluación de la eficacia de cuatro fungicidas aplicados al suelo y al follaje para el control de Mildeo velloso, ocasionado por Peronospora sparsa, en un cultivo comercial de rosa, variedad Charlotte. Trabajo de grado. Facultad de Agronomía. Universidad Nacional de Colombia, Bogotá. 48 p. [ Links ]
Riethmüller, A., H. Voglmayr, M. Göker, M. Weiß y F. Oberwinkler. 2002. Phylogenetic relationships of the downy mildews (Peronosporales) and related groups based on nuclear large subunit ribosomal DNA sequences. Mycologia 94, 834-849. SAS Institute Inc. 1999. SAS/STAT® User's Guide, Version 8.2, Cary, NC. [ Links ] [ Links ]
SAS Institute Inc. 1999. SAS/STAT® User's Guide, Version 8.2, Cary, [state]NC.
Sierotzki, H., J. Wullschleger y U. Gisi. 2000. Point mutation in cytochrome b gene conferring resistance to strobilurin fungicides in Erysiphe graminis f. sp. tritici field Isolates. Pesticide Biochem. and Physiol. 68, 107-112. [ Links ]
Sirven, C. y R. Beffa. 2003. Resistance to Fenamidone: Monitoring by real-time quantitative PCR on Plasmopara viticola. Pflanzenschutz- Nachrichten Bayer 56, 523-532. [ Links ]
Sirven, C., E. Gonzalez, E. Buffer, M.P. Latirse y R. Beffa. 2002. PCR based method for detecting mutation allele frequencies for QoI resistance in Plasmopara viticola. Proc. Brighton Conf. Pest Disease. Brithish Crop Protection Council, Farnhan, U. K. pp. 823-828. [ Links ]
Tian, C.M, Y.Z. Shang, J.Y. Zhuang, Q. Wang y M. Kakishima. 2004. Morphological and molecular phylogenetic analysis of Melampsora species on poplars in China. Mycoscience 45, 56-66. [ Links ]
Waltera, M., P. Harris-Virginb, W. Thomasc, G. Tated, N.W. Waiparaa y G. Langforda. 2004. Agrochemicals suitable for downy mildew control in New Zealand boysenberry production. Crop Protection 23, 327-333. [ Links ]
Zheng, D. y W. Köller. 1997. Characterization of the mitochondrial cytochrome b gene from Venturia inaequalis. Current Genet. 32, 361-366. [ Links ]
Zheng, D., G. Olaya y W. Köller. 2000. Characterization of laboratory mutants of Venturia inaequalis resistant to the strobilurin-related fungicides kresoxim-methyl. Current Genet. 38, 143-155. [ Links ]














