Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.25 no.2 Bogotá July/Dec. 2007
Andrea Díaz1, Gerardo Cayón2 y John Jairo Mira3
1 Ingeniera agrónoma, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. andreadiazismael@gmail.com
2 Profesor asociado, Facultad de Agronomía, Universidad Nacional de Colombia. dgcayons@unal.edu.co
3 Director Centro de Investigaciones del Banano (Cenibanano) Augura, Carepa. jmira@augura.com.co
Fecha de recepción: junio 22 de 2007. Aceptado para publicación: octubre 1 de 2007
RESUMEN
La mancha de madurez de los frutos de banano es un desorden fisiológico causado por una absorción baja de calcio por parte de la planta en épocas secas. Varios reportes científicos demuestran la relación estrecha de la enfermedad con las deficiencias de calcio en épocas de sequía. La fertilización y el comportamiento del calcio con respecto a otros nutrientes del suelo son también factores que inciden en la mancha de madurez, incidencia que es reducida con fertilizaciones de nitrato de calcio. Se analizan las funciones del calcio en la planta, su participación en la división y extensión celulares, el balance hídrico de las células, el envío de señales de respuesta a un estímulo externo y sus funciones estructurales en las paredes y membranas celulares. Se discute el papel del calcio en el cultivo de banano, su movilidad en el suelo, la relación que tiene con otras bases, el proceso de asimilación a través de las raíces y su relación con la incidencia de la mancha de madurez de los frutos.
Palabras clave: fisiología de plantas, nutrición mineral, absorción de nutrientes, deficiencia de minerales, fertilización.
ABSTRACT
The maturity bronzing in banana fruits is a physiological disorder caused by a low calcium uptake by the plant in dry season. Several scientific reports demonstrated the close relationship of the disease with the calcium deficiencies during drought seasons. The fertilization and behavior of calcium with respect to other soil nutrients contributed to the incidence of maturity bronzing, indicated that the incidence is reduced with calcium nitrate fertilizations. The role of calcium in plants, its participation in cellular division and extension, hydric balance of cells, signalling cascade as response to an external stimulus, and its structural functions in the cellular walls and membranes are analyzed. The role of calcium in banana culture, its mobility in soil, relationship with other bases, the process of Ca assimilation through the roots, and its relationship with the incidence of maturity bonzing of fruits are discussed.
Key words: plant physiology, mineral nutrition, nutrient absorption, deficiency of mineral nutrients, fertilization.
Introducción
En el cultivo del banano, la deficiencia de calcio durante las fases de diferenciación floral y desarrollo de los frutos induce la aparición de un desorden fisiológico que se identifica en los frutos por un bronceado pardo claro a rojizo, cuya presencia es castigada en el momento de la selección de los frutos para la exportación. Dicho desorden se conoce como mancha de madurez (Daniells et al., 1992) y se caracteriza porque en meses posteriores a veranos prolongados o intensos se incrementa la fruta rechazada, siendo el calcio un elemento regulador en la calidad del fruto (Segura, 2003; Daniells, 1985). El porcentaje de pérdida de fruta por ha y año atribuido a este defecto está en un rango de 3 a 5% del total de las pérdidas en épocas de incidencia baja y del 18% en épocas de incidencia alta (Díaz, 2004, 2005). Los análisis de suelos de la zona de Urabá (Colombia) muestran que el 68% de las fincas bananeras tiene una relación baja Ca/Mg, 26% media y 6% alta (Ospina, 2000). Además, se encuentran concentraciones altas de calcio, pero no necesariamente esos valores expuestos en los análisis coinciden con las cantidades que presenta la planta, es decir, con la cantidad real de calcio absorbido por la misma, especialmente en épocas de verano, cuando la humedad en el suelo disminuye y consigo el movimiento de calcio en el perfil (Finck, 1988; Guerrero et al., 1999).Lo anterior confirma la poca movilidad del calcio en el suelo y su baja absorción en la planta, sumado a factores como el antagonismo con otros elementos, condiciones físicas y químicas del suelo y desarrollo de las raíces (Guerrero, 1991). Las relaciones de equilibrio que deben guardar el Ca, Mg y K son esenciales para una buena asimilación de nutrientes en la planta y tienen una analogía estrecha con la cantidad de calcio cambiable en el suelo (Turner y Bull, 1970; Guerrero, 1991; Guerrero et al., 1999; Espinosa y Mite, 2002). La capacidad de absorción de las raíces de banano guarda una relación estrecha con el sistema foliar exuberante de la planta, pero el desarrollo radical no guarda proporción con el tamaño de la planta; por tanto, es necesario suplir las demandas de algunos elementos con fertilizantes minerales (Jurado y Vargas, 1977; Soto, 2001; Guerrero, 2004b).
Los niveles freáticos presentes en la zona de Urabá y la compactación de los suelos por ciertas prácticas de cultivo limitan el crecimiento normal de las raíces en época lluviosa (Vallejo 1997, Jurado y Vargas 1977). Según Mejía et al. (1995) en estos suelos se presentan arcillas tipo 2:1 predominando micas, vermiculitas y motmorillonitas, con alta capacidad de intercambio catiónico (CIC) y altos contenidos de Ca, P y K lo cual ha contribuido a desbalances iónicos en el suelo (Rojas, 2001; Estrada, 2001). En el norte de Queensland (Australia), el defecto por mancha de madurez o bronceado de la madurez, es un problema de importancia económica para los productores de banano desde 1960. El primer trabajo realizado para estudiar este problema fue realizado por Campbell y Williams (1976), quienes empezaron a identificar factores asociados a este, descartando la presencia de virus, patógenos o insectos. A partir de 1980 se incrementa el interés por resolver e investigar la causa de la mancha y, actualmente, se conoce un poco más sobre el comportamiento de este fenómeno y su relación con el clima, el diámetro de los dedos y la influencia que tiene el calcio (Daniells, 1985; Williams et al., 1990).
En la zona de Urabá, la presencia marcada de meses secos (enero-marzo), fincas sin sistemas de riego y desequilibrios catiónicos en el suelo que limitan la entrada de calcio a la planta, son factores que han venido aumentando progresivamente. Dichos factores han contribuido a que la mancha de madurez se presente con mayor incidencia en los últimos años, especialmente en plantaciones que no se preparan para veranos prolongados. Datos promediados del año 2003 en fincas del norte, centro y sur del eje bananero (Río Grande, El Cortijo y La Segunda) y comunicación verbal con productores y administradores de otras fincas, demuestran la presencia de la mancha de madurez en la zona y su relación con la transición de verano a invierno (Díaz, 2005).
Sintomatología
En los frutos de banano la mancha de madurez se presenta en las células epidérmicas de la cáscara, en la parte superior de los dedos (figura 1). La mancha se asemeja a un bronceado de color marrón claro a rojizo y se encuentra, en mayor proporción, en las extremidades de las manos (Williams et al., 1990). Las células más alargadas son sensibles al rompimiento de las paredes y desintegración de las membranas celulares, por tanto, los dedos con la mayor elongación y curvamiento presentan primero los síntomas de la mancha de madurez. Cuando la planta emite la bacota, las células epidermales de los frutos se organizan paralelamente a la longitud de los dedos. La cera epicuticular es la encargada de dar rigidez a las células y aparece en los primeros 14 a 28 días después de la emergencia del racimo, en consecuencia, durante este periodo, la deficiencia de calcio es más crítica. A los 42 días de emergido el racimo las paredes presentan fracturas que varían en tamaño y profundidad; posteriormente se presenta decoloración del contenido citoplasmático de las células que luego se esparcen en los espacios intercelulares (Williams et al., 1988).
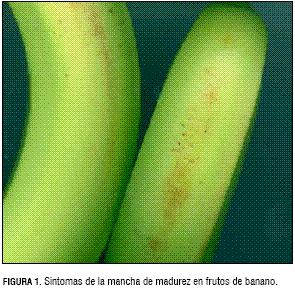
La relación de los síntomas con el calcio se da porque, en la medida en que las deficiencias del nutriente se presentan en los frutos, las membranas pierden su propiedad de expandirse y se desintegran fácilmente (Marschner, 1986). Cuando el rompimiento de las paredes y desintegración de las membranas se lleva a cabo, el fluido interno de las células queda en los espacios intercelulares de la epidermis. La dopamina es un producto de la oxidación del fluido de las células que genera la coloración marrón claro a rojiza mostrando el bronceado denominado mancha de madurez (Segura, 2003; Williams et al., 1990; Daniells, 1985).
En banano, la diferenciación floral se da en el interior del cormo, formándose la inflorescencia o bacota, la cual inicia su desarrollo al ascender desde la base del cormo hacia el sistema foliar; en este momento, la cáscara de los frutos ya ha culminado la división celular e inicia su expansión con el llenado del fruto. Cuando la pulpa aumenta su tamaño, las células de la cáscara que están deficitarias en Ca2+ se desintegran y manifiestan el bronceado (Segura, 2003). Varios trabajos (Campbell y Williams 1976; Daniells et al., 1987), demuestran que el diámetro de los dedos está directamente relacionado con la severidad de la mancha de madurez, razón por la cual la fruta se corta con 12 ó 13 semanas de maduración. Estudios realizados en Panamá (Segura, 2003) coinciden con el comportamiento de la mancha de madurez en la zona de Urabá, estableciéndose que los meses de julio, agosto y septiembre son los de mayor incidencia de la enfermedad al ser la fruta que creció durante un periodo de sequía marcado (febrero y marzo).
Funciones del calcio en las plantas
El calcio es un elemento estructural en la planta ya que constituye la lámina media, las paredes y membranas de la célula y, además, participa en la división y extensión celulares, influye en la compartimentalización de la célula, modula la acción de hormonas y señales, estabiliza la pared y membrana, y contribuye al equilibrio iónico de la célula (Marschner, 1986). Para la compartimentalización de la célula, la distribución del calcio se da según la cantidad de iones Ca2+ absorbidos por la raíz. Cuando hay una buena absorción, la mayor proporción de calcio total está en la lámina media, seguido por las membranas, los organelos y por último el citosol. Las concentraciones en el citosol son de 0,1 a 0,2 μM, mientras que en los vacuolos se encuentra 105 veces más, en el cloroplasto presenta un rango de 6,5 a 15 nM y en el estroma 2,4 a 6,3 μM (Marschner, 1986). En el apoplasto las concentraciones son más altas que en cualquier otro organelo, lo cual es lógico al saber que es la vía en donde este elemento se mueve mejor a través de toda la planta (White, 1998); sin embargo, el Ca2+ no se encuentra libre en el apoplasma sino que está unido en un 51% a pectatos, 27% al agua soluble, 17% a fosfatos, 4% a oxalatos y 1% en forma residual (Marschner, 1986). Las concentraciones bajas de calcio en el citosol se dan porque las membranas tienen una baja permeabilidad al elemento (Marschner, 1986), lo cual es importante porque actúa como mensajero secundario dado por estímulos externos, inducen respuestas fisiológicas y permite el flujo del Ca2+ hacia todas las células de la planta (Sanders et al., 2002; White, 2001).
Cuando las concentraciones de calcio libre en el citosol aumentan, la acción de las membranas es remover este elemento hacia el apoplasma o acumulado en los organelos por medio de bombas de Ca-ATPasa, manteniendo así concentraciones bajas en el citosol. Las diferentes concentraciones de calcio en el citoplasma y apoplasma permite que haya diferenciación entre cada uno de ellos y, por ende, la compartimentalización (Marschner, 1986). Otra de las funciones del calcio es generar estabilización de la pared y las membranas celulares mediante su interacción con el ácido péptico que está entre la pared celular y la lámina media. Esta reacción genera el pectato de calcio o pectinas, las cuales confieren estabilidad e integridad a la pared celular y, en general, a todos los tejidos de la planta (Salisbury y Ross, 1994) que a menudo son degradadas por la poligaracturonasa generando una desintegración de la pared celular. El calcio también inhibe drásticamente la acción de la poligaracturonasa, porque los niveles altos de calcio en el apoplasma de las células generan mayor proporción de pectatos y así mayor resistencia a la desintegración de las paredes (Marschner, 1986; Romeis et al., 2001; García, 2001; Uhm et al., 2002).
En las membranas, el calcio cumple un rol estabilizador gracias a los grupos fosfato y carboxilo de los fosfolípidos y a proteínas de la superficie de la membrana. Deficiencias de este elemento ocasionan la desintegración de todos los componentes de estas, principalmente los cuerpos lipídicos (Salisbury y Ross, 1994). Otras de sus funciones en la membrana son regular el flujo de solutos e inhibir el escape de los mismos del citoplasma al apoplasto u organelos así como proteger bajo condiciones de estrés (Marschner, 1986; White, 2000). Este elemento influye en el crecimiento radical por su participación en la división y extensión de las células que componen este sistema, por tanto, una disminución o ausencia de calcio en la solución del suelo conduce a un detenimiento del crecimiento de las raíces. Cuando el Ca que está unido a las pectinas del apoplasto se desprende por acción de las auxinas, los iones Ca2+ quedan libres y activan canales en la membrana que permiten la entrada de solutos y, por consiguiente, la extensión celular (Sanders et al., 2002). Cuando se inicia la entrada de solutos en la célula, los iones Ca2+ también entran generando un aumento del calcio citoplasmático (Cacit), el cual permite que se genere la síntesis de precursores que conducen a la secreción de calcio al apoplasma y a los organelos (White, 2000; Thuleau et al., 1998); esta secreción se da mediante vesículas en la pared celular, las cuales también están constituidas por calcio, y cuya función es mantener la polarización de la célula y no permitir la entrada de iones e inhibidores de crecimiento en sentido basípeto (Marschner, 1986).
El equilibrio iónico y la osmorregulación también son controlados por el calcio. En los vacuolos es donde se almacena la mayor proporción de Ca2+, lo cual contribuye al balance entre cationes y aniones orgánicos e inorgánicos de la célula. Cuando se aumentan los niveles de calcio en el citoplasma, muchos de estos aniones se precipitan al vacuolo en forma de oxalatos de calcio permitiéndose así mantener una osmorregulación de la célula (Kordyum, 2003; Griffiths y Parry, 2002). El movimiento estomatal también es regulado por el Ca ya que en las células guardas este ión actúa como mensajero secundario al inducir señales de respuesta por medio del ácido abscisico (ABA) cuya acción depende de la cantidad de calcio entrante a las células guardas. Según White (2000) y Grabov y Blatt (1998), la entrada de Ca2+ y ABA a través de la membrana genera una hiperpolarización de la célula al aumentarse las concentraciones de Cacit; este aumento produce una respuesta en el cierre de los estomas, pues se induce la salida de iones de potasio y cloro al apoplasma y vacuolos donde finalmente las células pierden turgencia reduciendo la apertura del ostíolo (Evans et al., 2001; White, 2000).
La señalización del calcio en la planta, una de las funciones más estudiada, ocurre porque la inducción de señales se da por estímulos en la planta que pueden activar canales de calcio en las membranas, incrementando así la entrada de Ca2+ en el citoplasma (Bush, 1995). La entrada de iones Ca2+ ocasiona un aumento del Cacit y este, a su vez, genera cascadas de respuesta, por lo cual se le denomina mensajero secundario (Sanders et al., 2002; Giraudat, 1995). Según Yang y Poovaiah (2003) las señales recibidas en la membrana son transmitidas por el calcio que hay en el retículo endoplasmático y el vacuolo hacia unas proteínas del citoplasma llamadas calmodulinas (CaM) y proteínas dependientes de Ca-kinasas (CDPK). Las CaM siempre están unidas a cuatro iones de Ca2+, por tanto, la concentración de Ca2+ en el citoplasma determina una mayor o menor acción de las proteínas ante cualquier tipo de señal (Marschner, 1986). Cuando los iones de Ca2+ se ubican sobre la membrana plasmática se inicia la señalización y se activan canales de calcio que permiten la entrada o salida de dicho catión además del potasio y cloro; este tipo de canales también se presentan en los vacuolos, retículo endoplasmático, cloroplasto y núcleo (White y Davenport, 2002; Grabov y Blatt, 1998; White, 2000; Sanders et al., 2002). Algunas de las funciones principales que tienen estos canales es mantener la polarización de las células, permitir el intercambio catiónico con otros elementos e inducir una reacción a diferentes estímulos, especificándose una reacción diferente a cada tipo de canal (Kordyum, 2003; White y Davenport, 2002; Thuleau et al., 1998).
En la membrana celular se distinguen diferentes tipos de canales de calcio, entre los cuales se incluyen los que activan la hiperpolarización, activadores de la depolarización, canales mecano-sensitivos, de cationes incentivados por voltaje (VIC), de cationes rectificadores de salidas (KORC o NORC) y rectificadores de mensajeros secundarios (Sanders et al., 2002; White, 1998). Los canales activadores de la depolarización generan señales primitivas universales y son los que activan todos los demás canales al recibir el estímulo (Thuleau et al., 1998). Los activadores de la hiperpolarización permiten la entrada de Ca2+ en células de la raíz, lo que genera la división y elongación de las células de este sistema (Evans et al., 2001; White, 2000; Grabov y Blatt, 1998).
Los canales mecano-sensitivos permiten la regulación del turgor de las células y determinan la alometría, expansión celular y morfogénesis. Los KORK controlan la salida de iones de Ca2+ teniendo propiedades de autorregulación (White, 2000). Los canales VIC mantienen constante las concentraciones del Cacit por cargas de voltaje y los canales activadores de mensajeros secundarios participan principalmente en respuestas de defensa (Yang y Poovaiah, 2003; White y Davenport, 2002; Uhm, et al., 2002; Thuleau et al., 1998).
Absorción y movimiento del calcio en la planta
El calcio es absorbido por la planta en forma de ión Ca2+. El calcio presenta una alta densidad de carga neta en su superficie, lo que le permite unirse a las moléculas de agua, es decir, como ión hidratado se absorbe con más lentitud que un catión monovalente (Salisbury y Ross, 1994; White y Davenport, 2002), por lo cual la entrada de Ca2+ a la célula es exclusivamente por medio de canales en la membrana. Según White (2001) el movimiento del calcio en la raíz se da primero por vía apoplasto hasta llegar a las células endodermales y cuando los iones de Ca2+ no pueden superar la barrera física de la endodermis por dicha vía, entran a las células por medio de canales que les permiten continuar el trayecto hasta el xilema; sin embargo, la movilidad a través del simplasto sigue siendo restringida por las concentraciones bajas de Cacit, inhibiendo así las corrientes citoplasmáticas de dicho catión (Thuleau et al., 1998). En la raíz, la permeabilidad de las células endodermales al Ca2+ varía según el estado de maduración que presenten.
Estados inmaduros son muy permeables al paso de Ca2+, pero en la medida en que haya acumulación de polímetros de suberina alifática, lignina y carbohidratos en el interior de las paredes circundantes de las células se genera una baja permeabilidad al calcio y otros solutos (White, 2001); así, el máximo reparto del calcio hacia el xilema se da en la zona apical de la raíz. Cuando el elemento ya ha sido absorbido por las raíces es transportado hacia las hojas en el interior de la planta a lo largo de la corriente de transpiración a través de los vasos xilemáticos (Salisbury y Ross, 1994). Así, el proceso para que el calcio pueda moverse mejor en el xilema es el intercambio con grupos moleculares cargados negativamente, como las pectinas y ligninas (Cardona, 2002). El movimiento del calcio en la planta se da exclusivamente por la corriente xilemática desde las raíces hacia órganos como las hojas y frutos. Las hojas, en comparación con los frutos, presentan una mayor tasa de transpiración y, por tanto, la llegada de Ca2+ es mayor en dichos tejidos y menor en los frutos (Marschner, 1986). El porcentaje de calcio que llega al fruto ocurre, principalmente, durante las primeras etapas de crecimiento, lo cual corresponde al periodo en que el xilema es el principal proveedor de agua y solutos (Segura, 2003; Clover, 1991).
En la medida en que el fruto se desarrolla, los conductos floemáticos de dicho órgano aumentan con respecto a los xilemáticos y el suministro de nutrientes se da principalmente por la savia floemática (Marschner, 1986; Clover, 1991); por esta razón se afirma que el fruto es el órgano de la planta que se desarrolla en el menor tiempo y en muchos casos la demanda de calcio no alcanza a ser suplida durante la expansión celular (Cardona, 2002). Trabajos realizados en tomate (Clover, 1991; Cardona, 2002) demuestran que la distribución del calcio dentro del fruto no es uniforme por la distribución de la relación xilema/floema y la tasa de expansión del fruto. En banano, la mayor tasa de expansión del fruto se da en la zona más curvada de los dedos (longitud interna) que es precisamente donde primero se manifiesta un bronceado rojizo atribuido a las deficiencias de calcio, desorden que recibe el nombre mancha de madurez (Segura, 2003; Williams et al., 1990; Daniells, 1985; Williams et al., 1988).
La deficiencia de calcio en los frutos de banano, tomate y otras especies se debe al mal funcionamiento de las membranas deficitarias de este elemento lo cual genera un desorden de la compartimentalización de las células y deterioro de todas las endomembranas y el plasmalema (White, 2000; Williams et al., 1988; Marschner, 1986), la pared celular empieza a tornarse oscura y aparecen aberturas a través de ella (Williams et al., 1990; Daniells et al., 1992).
El calcio en las plantas de banano
En la planta de banano, las mayores concentraciones de Ca2+ se encuentran en el pecíolo, las hojas y el seudotallo y, a medida que la planta crece, dichas concentraciones aumentan, principalmente al final del ciclo vegetativo (Guerrero, 1991; Clavijo, 1994; Soto, 2001); por el contrario, durante el crecimiento de los frutos, las concentraciones de calcio disminuyen (Cardona, 2002), indicando que el llenado del fruto se da principalmente por el floema por lo cual la acumulación de calcio es baja en este órgano. Así, los síntomas de deficiencia son más pronunciados en los sitios de división y extensión celular en los frutos en formación. Los síntomas de deficiencia en el banano se manifiestan primero en las hojas más jóvenes, iniciándose un aumento del espesor de las nervaduras secundarias o laterales; posteriormente, aparecen escoriaciones superficiales que toman un color pardo rojizo culminando en un estado necrótico que coincide con la deformación de la hoja, dando una apariencia de hoja en forma de sierra (López y Espinosa, 1995; Soto, 2001; López et al., 2001). El raquitismo vegetativo en banano también se da por deficiencias de calcio, ya que induce una reducción de la emisión foliar, acompañado de una descenso en la longitud de las hojas ya emitidas (López et al., 2001), las raíces son más cortas, muy ramificadas y más susceptibles a nemátodos y ataques fungosos (Soto, 2001; Marschner, 1986). La asimilación de calcio es baja en los frutos de banano en comparación con las hojas, porque el poco calcio asimilado directamente del suelo se desvía principalmente hacia las hojas por su mayor capacidad transpiratoria (Clover, 1991); así, es de esperar que las concentraciones de este elemento sean muy variables y poco sensibles al suministro de fuentes solubles y poco solubles dirigidas al suelo (Chacín et al., 1999, Guerrero et al., 1999; Guerrero 2004a).
Fertilización con calcio y mancha de madurez
El calcio como elemento estructural en la planta tiene funciones importantes en el crecimiento y cumple un papel fundamental en el mantenimiento de la condición fitosanitaria del cultivo por su acción protectora contra algunos patógenos. La mancha de madurez es un claro ejemplo del comportamiento del calcio en los frutos y la planta, demostrando que el elemento estructural de las células también participa en funciones de regulación hídrica de las células, señalización, crecimiento y división celular. Así, se ha podido comprobar que existe una relación de la mancha de madurez con las deficiencias de calcio en los frutos de banano en épocas de verano, que coinciden con el periodo de formación y elongación de los frutos. La posición de la mancha de madurez coincide con las células que más se alargan durante el crecimiento de los dedos y que posteriormente se desintegran por la ausencia o deficiencia de calcio en las paredes y la lámina media en estos tejidos (Segura, 2003; Díaz, 2005). Por esto, el síntoma se atribuye a deficiencias de Ca que hay durante la diferenciación floral y, posteriormente, durante el crecimiento rápido de los dedos (Campbell y Williams, 1978; Daniells et al., 1992; Segura, 2003). La fertilización es otro factor importante en la presencia de la mancha de madurez y se ha observado que cuando el Ca, Mg, B y Cu se encuentran en menor concentración en los frutos hay mayor incidencia del bronceado (Campbell y Williams, 1978). La disponibilidad de calcio depende del pH del suelo y puede ser reducida cuando este se encuentra por debajo de 5,5 (Parra et al., 2006). Según Bayona (1983) las fuentes más utilizadas en el eje bananero son úrea y KCl, y como fuentes de calcio la cal y el yeso que se emplean como enmiendas en el suelo y no como fertilizantes. Otras fuentes como nitrato o sulfato de calcio son más solubles y se utilizan en menor proporción. El aporte de calcio de cada fuente difiere según el portador, es así como el nitrato de calcio aporta un 27% de CaO, mientras que la cal 40% y el yeso 33% de CaO (Inpofos, 2004).
En un estudio realizado en Gran Enano en la zona de Urabá con tres fuentes de calcio, se observó que las plantas de banano respondieron positivamente a la fertilización con calcio aumentando el vigor del seudotallo, mayor área foliar, mayor peso de racimo, mejor calibración de frutos y mayor ratio (Parra et al., 2006). Los trabajos de García (2001) demuestran que las aplicaciones de nitrato de calcio en los frutos de tomate disminuyen la pudrición apical de los mismos, fenómeno también atribuido a deficiencias de calcio en el fruto. Otros trabajos en banano han demostrado que temperaturas altas, intensidad lumínica alta, corriente de aire baja y humedad relativa alta en la zona limítrofe de la hoja aumentan considerablemente la incidencia de la mancha de madurez (Campbell y Williams, 1976; Daniells, 1992), lo cual se debe, probablemente, a que se inhibe la tasa de transpiración y hay menos flujo de calcio en la planta, principalmente hacia el fruto (Campbell y Williams, 1976; Daniells et al., 1987).
Díaz et al. (2006) estudiaron en tres fincas de la zona de Urabá el efecto del nitrato de calcio (220 g) disuelto en agua (100 cm3) inyectado en el seudotallo de plantas de banano recién cosechadas, cuyos puyones estuvieran próximos a la diferenciación floral (1,8-2,0 m). Se encontró una relación marcada entre la dosis de calcio aplicada y la incidencia de la mancha de madurez, pero no hubo diferencias entre tratamientos con respecto al peso del racimo, número de manos, número de dedos de la segunda mano y longitud del dedo central de dicha mano; por lo que se presume que esas variables son poco sensibles. Resultados similares son reportados por Campbell y Williams (1978), quienes demostraron que la relación entre el calcio y los frutos de banano se da principalmente por la presencia de la mancha de madurez y no en el aumento de la producción. La tabla 1 muestra que la fruta perdida y la incidencia de la mancha de madurez en las manos y frutos de los racimos fue menor con las aplicaciones de Ca(NO3)2.

En los tratamientos con 200 y 400 kg·ha-1 se presentó la menor incidencia de mancha de madurez, lo cual sugiere que las aplicaciones de estas dosis del fertilizante en épocas de verano y bajo suministro de agua, contribuyen de manera significativa a la disminución de la mancha de madurez. García y Mora (2006) también estudiaron la respuesta del banano a la aplicación de una fuente de calcio hidrosoluble (Nitrabor®) (0, 117, 234 y 351 kg·ha-1·año-1). El porcentaje de incidencia de mancha de madurez en los racimos disminuyó por la aplicación de calcio, siendo significativamente menor en las dosis de 234 y 351 kg·ha-1 (figura 2) lo cual, posiblemente, se debió a la activación o incremento de alguna respuesta de defensa en las plantas al aumentar el nivel de Ca disponible en el suelo.
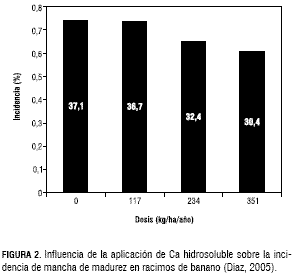
Es clara la relación entre el contenido de calcio en la planta y la incidencia de la mancha de madurez y que las plantas de banano se predisponen a dicho desorden fisiopatogénico por ciertas condiciones ambientales, principalmente en épocas de precipitación baja. Como elemento estructural y promotor en la activación de algunas enzimas que participan en la defensa contra algunos patógenos y desórdenes fisiológicos, el calcio puede actuar como amplificador de ciertas señales de defensa contra la mancha de madurez e incrementar la velocidad de respuesta de la planta frente a la incidencia. La fertlización con fuentes de calcio se presenta como una alternativa para proteger el cultivo del banano y reducir la incidencia de este desorden fisiológico de los frutos.
Literatura citada
Bayona, R. 1983. Correlación lineal entre fertilización con N, P, K y la cantidad de cajas de banano en Urabá. Revista Augura 9(2), 21-31. [ Links ]
Bush, D.S. 1995. Calcium regulation in plant cells and its role in signaling. Annu. Rev. Plant Physiology Plant Mol. Biol. 46, 95-122. [ Links ]
Campbell, S.J. y W.T. Williams. 1976. Factors associated with maturity bronzing of banana fruit. Aust. J. Expt. Agr. Animal Husbandry 16, 428-432. [ Links ]
Campbell, S.J. y W.T. Williams. 1978. Mineral relationships in maturity bronzing of banana fruit. Aust. J. Expt. Agr. Animal Husbandry, 18, 603-608. [ Links ]
Cardona, C.E. 2002. Efecto de la aplicación foliar de Ca sobre la incidencia de la pudrición apical y la calidad de los frutos de tomate (Lycopersicon esculentum Mill). Trabajo de maestría. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. 87 p. [ Links ]
Chacín, J., M. Moreno, L. Fernández y A. del Villar. 1999. Efecto de la fertilización potásica, cálcica y magnésica sobre el contenido de nutrientes del fruto del banano (Musa AAA, subgrupo Cavendish, clon Gran Enano). Revista de la Facultad de Agronomía 16(1), 102-113. [ Links ]
Clavijo, J. 1994. Metabolismo de los nutrientes en las plantas. pp. 13- 28. En: Silva, F. (ed.). Fertilidad de suelos: Diagnóstico y control. Sociedad Colombiana de la Ciencia del Suelo, Bogotá. [ Links ]
Clover, A. 1991. A new theory on calcium transport. Grower, 8-11. [ Links ]
Daniells, J.W. 1985. The maturity bronzing disorder of banana fruit. Queensland Agr. J. 111, 239-240. [ Links ]
Daniells, J.W., B.J. Watson, P.J. OFarrell y J.C. Mulder. 1987. Soil water stress at bunch emergence increases maturity bronzing of banana fruit. Queensland J. Agr. Animal Sci. 44(2), 97-100. [ Links ]
Daniells, J.W., A.T. Lisle, y P.J. OFarrell. 1992. Effect of bunchcovering methods on maturity bronzing, yield, and fruit quality of bananas in North Queensland. Aust. J. Expt. Agr. 32, 121-125. [ Links ]
Díaz, A.C. 2004. Influencia del Ca sobre la mancha de madurez en frutos de banano en la zona de Urabá. Boletín Técnico Cenibanano 6, 1-3. [ Links ]
Díaz, A.C. 2005. Respuestas fisiológicas, productivas y de calidad del banano (Musa AAA cv. Gran enano) a la aplicación de Ca en la zona de Urabá. Trabajo de grado. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. 55 p. [ Links ]
Díaz, A.C., J.J. Mira, y D.G. Cayón S. 2006. Aplicaciones de calcio para el control de la mancha de madurez en banano. p. 310. En: XVII Reunión de la Asociación para la Cooperación en Investigaciones de Banano en el Caribe y en América Tropical (ACORBAT). Memorias. Joinville, Brasil. [ Links ]
Evans, N.H., M.R. McAinsh y A.M. Hetherington. 2001. Calcium oscillations in higher plants. Current Opinion Plant Biol. 4, 415-420. [ Links ]
Espinosa, J. y F. Mite. 2002. Estado actual y futuro de la nutrición y fertilización del banano. Informaciones Agronómicas del Instituto de la Potasa y el Fósforo 48, 5. [ Links ]
Estrada, G. 2001. Disponibilidad del calcio, magnesio y azufre, su análisis en los suelos y plantas y su interpretación. pp. 85-104. En: Silva, F. (ed.). Los elementos secundarios (Ca, Mg, S) y el silicio en la agricultura. Sociedad Colombiana de la Ciencia del Suelo, Bogotá. [ Links ]
Finck, A. 1988. Fertilizantes y fertilización. Fundamentos y métodos para la fertilización de cultivos. Reverté S.A., Barcelona. pp. 181-242. [ Links ]
García, J. 2001. Importancia del Ca en la resistencia de las plantas a enfermedades. pp.72-84. En: Silva, F. (ed.). Los elementos secundarios (Ca, Mg, S) y el silicio en la agricultura. Sociedad Colombiana de la Ciencia del Suelo, Bogotá. [ Links ]
García, J. y I. Mora. 2006. Efecto del calcio soluble en rendimiento e incidencia de sigatoka negra y mancha de madurez en banano. p. 377. En: XVII Reunión de la Asociación para la Cooperación en Investigaciones de Banano en el Caribe y en América Tropical (ACORBAT). Memorias, Joinville, Brasil. [ Links ]
Giraudat, J. 1995. Abscisic acid signaling. Current Opinion Cell Biol. 7, 232-238. [ Links ]
Grabov, A. y M.R. Blatt. 1998. Membrane voltage initiates Ca2+ waves and potentates Ca2+ increases whit abscisic acid in stomatal guard cell. Plant Biol. 95, 4778-4783. [ Links ]
Griffiths, H. y M.A.J. Parry. 2002. Plant responses to water stress. Ann. Bot. 89, 801- 802. [ Links ]
Guerrero, R. 1991. Fertilización de cultivos en clima cálido. Monómeros Colombo-Venezolanos, Venezuela. 300 p. [ Links ]
Guerrero, R., J. Gadbán y J. Ospina. 1999. Significado de algunas variables edáficas de fertilidad sobre los componentes de productividad del banano para la exportación (Clon Gran enano) en un inseptisol de Ciénaga (Magdalena) Colombia. Sociedad Colombiana de la Ciencia del Suelo 29(2), 120-124. [ Links ]
Guerrero, R. 2004a. El diagnóstico cuantitativo de la fertilidad del suelo. Edición Monómeros Colombo-Venezolanos, Barranquilla. 4 p. [ Links ]
Guerrero, R. 2004b. Propiedades generales de los fertilizantes. Manual técnico. Monómeros Colombo-Venezolanos, Barranquilla. 46 p. [ Links ]
Inpofos. 2004. Fuentes de nutrientes. potash y phosphate Institute. En: Northern Latin America. www.inpofos.org; consulta: 18 de mayo de 2004. [ Links ]
Jurado, R. y A. Vargas. 1977. Discusión de los resultados de algunos análisis de suelos de la zona bananera de Urabá, Antioquia. Revista Augura 2(7), 11-21. [ Links ]
Kordyum, E.L. 2003. Calcium signaling in plant cell in altered gravity. Institute of Botany of the National Academy of Sciences of Ukraine 32(8), 1621-1630. [ Links ]
López, A., A. Vargas, J. Espinosa y R. Vargas. 2001. Guía de campo. Síntomas de deficiencias nutricionales y otros desórdenes fisiológicos en el cultivo de banano (Musa AAA). Instituto de la Potasa y el Fósforo, Quito. 53 p. [ Links ]
López, A. y J. Espinosa. 1995. Manual de nutrición y fertilización del banano. Instituto de la Potasa y el Fósforo, Quito. 76 p. [ Links ]
Marschner, H. 1986. Mineral nutrition of higher plants. Academic Press, Londres. pp. 7-73, 285-299. [ Links ]
Mejía, G.A., G.J. Elejalde y F. Monroy. 1995. Caracterización agronómica de la producción bananera entre 1993 y 1995 y fertilidad de los suelos de Urabá entre 1985 y 1995. Asociación de Bananeros de Colombia (Augura), Medellín. 93 p. [ Links ]
Ospina, O. 2000. El yeso (sulfato de Ca ) como fertilizante y enmienda de suelos. Cales Río Claro, Apartadó, Colombia. 68 p. [ Links ]
Parra, L.F., A.C. Díaz, J.J. Mira y D.G. Cayón S. 2006. Respuesta en desarrollo y rendimiento de banano (Musa AAA Simmonds) a la aplicación de calcio. p. 370. En: XVII Reunión de la Asociación para la Cooperación en Investigaciones de Banano en el Caribe y en América Tropical (ACORBAT). Memorias. Joinville, Brasil. [ Links ]
Rojas, L. 2001. Calcio y magnesio en suelos ácidos tropicales. pp. 13-23. En: Silva, F. (ed.). Los elementos secundarios (Ca, Mg, S) y el silicio en la agricultura. Sociedad Colombiana de la Ciencia del Suelo, Bogotá. [ Links ]
Romeis, T., A.A. Ludwiig, R. Martin y J.D.G. Jones. 2001. Calciumdependent kinases play an essential role in a plant defense response. EMBO J. 20(20), 5556- 5567. [ Links ]
Salisbury, F. y C. Ross. 1994. Fisiología Vegetal. Cuarta edición. Grupo Editorial Iberoamérica S.A. México, D.F. pp. 3-177. [ Links ]
Sanders, D., J. Pelloux, C. Brownlee y J.F. Harper. 2002. Calcium at the crossroads of signaling. Plant Cell S401-S417. [ Links ]
Segura, A. 2003. Factores que determinan la incidencia de la mancha de madurez. Documento sin publicar.
Soto, M. 2001. Bananos, cultivo y comercialización. Litografía e Implante Lil., Costa Rica. 1985 p. [ Links ]
Thuleau, P., J.I. Schroeder y R. Ranjeva. 1998. Recent advances in the regulation of plant calcium channels: evidence for regulation by G- proteins, the cytoskeleton and second messenger. Current Opinion Plant Biol. 1, 424- 427. [ Links ]
Turner, D.W. y J.H. Bull. 1970. Some fertilizer problems with bananas. Agr. Gaz. NSW 81, 365-367. [ Links ]
Uhm, K.H., I.P. Ahn, S. Kim y Y.H. Lee. 2002. Calcium/ Calmodulindependent signaling for penetration development in Colletotrichum gloesporoides. Biochem. Cell Biol. 93(1), 82-87. [ Links ]
Vallejo, G.G. 1997. Factores que afectan la productividad del cultivo del banano en Urabá y sugerencias para su mejoramiento. p. 107. En: Memorias. Seminario manejo integral y sostenible de la fertilización en banano, buscando competitividad mundial y rentabilidad. Apartadó, Antioquia. [ Links ]
White, P.J. 1998. Calcium channels in plasma membrane of root cell. Ann. Bot. 81, 173-183. [ Links ]
White, P.J. 2000. Calcium channels in higher plants. Biochemical et Biophysical Acta 1465, 171-189. [ Links ]
White, P.J. 2001. The pathways of calcium movement to the xylem. J. Expl. Bot. 52(358), 891-899. [ Links ]
White, P.J. y R.J. Davenport. 2002. The voltage- independent cation channel in the plasma membrane of wheat roots in permeable to divalent cations and be involved in cytosolic Ca2+ homeostasis. Plant Physiol. 130, 1386-1395. [ Links ]
Williams, M.H., M. Vesk y M.G. Mullins. 1988. Characteristics of the surface of banana peel in cultivars susceptible and resistant to maturity bronzing. Can. J. Bot. 67, 2154-2160. [ Links ]
Williams, M.H., M. Vesk y M.G. Mullins. 1990. Development of the banana fruit and occurrence of the maturity bronzing disorder. Ann. Bot. 65, 9-19 [ Links ]
Yang, T. y B.W. Poovaiah. 2003. Calcium/calmodulin- mediated signal network in plants. Trends Plant Sci. 8(10), 505-512. [ Links ]














