Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.25 no.2 Bogotá July/Dec. 2007
Mecanismos de adaptación de maíz asociado a Glomus spp. en suelos con bajo fósforo disponible
Gabriel Roveda1 y Cristina Polo2
1 Investigador, Corporación Colombiana de Investigación Agropecuaria (Corpoica), Centro de Investigación Tibaitatá, vía Mosquera (Cundinamarca). groveda@corpoica.org.co / groveda@gmail.com
2 Microbióloga, Pontificia Universidad Javeriana, Bogotá.
Fecha de recepción: mayo 22 de 2007. Aceptado para publicación: octubre 1 de 2007
RESUMEN
La deficiencia de fósforo es uno de los mayores limitantes para la productividad agrícola en el trópico. Esta investigación está orientada a estudiar los mecanismos de adaptación de maíz asociado a Glomus spp. La investigación se realizó bajo condiciones controladas en los laboratorios del Corpoica. El diseño experimental utilizado fue bloques completos al azar, con seis tratamientos y seis repeticiones: tres tratamientos con 1, 40 y 100 mg·kg-1 de P en el suelo y los anteriores niveles de P más Glomus spp. Los resultados experimentales confirman una disminución en área foliar y materia seca relacionadas con bajo P en suelo, 20 días de la emergencia. Como mecanismos de adaptación a las deficiencias de P, las plántulas traslocan carbohidratos a la raíz en detrimento de las hojas, esto modifica el balance de la materia seca. Este mecanismo fue evidente a 10 días después del estrés. Plantas asociadas a Glomus presentaron mayores tasas de crecimiento, nutrición mineral (N, P, K, Ca, Mg, S) y concentración de azúcares en tejido, debido al papel P en la síntesis de carbohidratos. Plantas micorrizadas aumentaron los niveles de proteínas en tejido, con 1 y 40 mg·kg-1 de P en suelo. Los resultados sugieren que Glomus spp. contribuye con la síntesis de proteínas de estrés en planta, por déficit de P en el suelo. El estrés conduce a la expresión diferencial de la información genética, produciendo cambios en la síntesis de nuevas proteínas, llamadas micorrizinas, las cuales posiblemente dotan a las plantas con la capacidad de adaptación al estrés.
Palabras clave: suelos tropicales, deficiencia de fósforo, micorrizas, síntesis de proteínas.
ABSTRACT
Phosphorus deficiency is a major limitation to agricultural productivity in tropical regions. This research was addressed to study the mechanisms of maize adaptation in relation to Glomus spp. The research was conducted under controlled conditions in the laboratories of Corpoica, Colombia. The experimental design consisted in completely randomized blocks with six treatments and six replicates: three treatments with different levels of available phosphorus in soil (1, 40 y 100 mg·kg-1) and the other three with the same P levels plus Glomus spp. The experimental results confirmed a reduction in leaf area and dry matter related to low P levels in soil at 20 days after seedling emergence. As an adaptation mechanism for P deficiency, the seedlings transferred the carbohydrates to the roots at the expense of leaves, thus, modifying the balance of dry matter. This mechanism was evident 10 days after the stress application. Plants associated with Glomus spp. had the highest growth rates, mineral nutrition (N, K. P, Ca, Mg, and S), and sugar concentration in tissue, due to the importance of P in the synthesis of carbohydrates. Plants associated with mycorrhizal fungus increased the protein levels in tissue when amended with 1 and 40 mg·kg-1 of P in soil. The results suggest that Glomus spp. contributed to the synthesis of stress proteins because of soil phosphorus deficiency. The stress allows the differential expression of genetic information in the synthesis of new proteins called mycorrhizines, which are probably involved in the adaptation mechanisms of plants to stress.
Key words: tropical soils, phosphorous deficiency, mycorrhizal fungus, protein synthesis.
Introducción
Los ambientes tropicales se caracterizan por presentar severas restricciones para el desarrollo agrícola, como la baja disponibilidad de nutrientes esenciales en el suelo. La deficiencia de fósforo inorgánico en el suelo produce diversas respuestas en plantas que dependen de la fuente, duración y severidad del estrés, además de la etapa de desarrollo de la planta y del tipo de célula u órgano involucrado. Estas respuestas se expresan a diversos niveles de complejidad: celular, metabólico, morfológico, fisiológico, bioquímico y molecular (Boucher et al., 1999; Mollier y Pellerin, 1999; Pellerin y Mollier, 2001; Jain et al., 2007). Investigaciones realizadas en plantas de maíz demuestran que niveles deficientes de fósforo inorgánico en el suelo causan disminución en el área foliar, como consecuencia de una reducción en la oferta de carbohidratos, dado que la mayoría de estos compuestos son requeridos por la raíz. Este mecanismo de compensación ocurre pocos días después de la deficiencia de fósforo (Atkinson, 1973; Fredeen et al., 1989; Rao y Terry, 1989; Pellerin y Mollier, 2001).Por otro lado, mayores niveles de fósforo disponible en el suelo incrementan el peso seco de la planta y promueven el crecimiento radical debido a las mayores tasas en el crecimiento de raíces centrales y laterales. Esta proliferación de raíces está relacionada con una mayor elongación y producción de pelos radicales (Peck et al., 1988; Russo y Pappelis, 1995). En condiciones de estrés, las plantas presentan cambios en crecimiento y morfología que se relacionan con alteraciones en el metabolismo y en la composición bioquímica de las plantas. Plantas en asocio con microorganismos del suelo (micorrizas arbusculares) han desarrollado estrategias de adaptación, las cuales han sido el resultado de complejos procesos evolutivos (Sanders, et al., 1996). Resultados experimentales muestran cómo plantas de maíz micorrizadas, acumulan azúcares al ser sometidas a temperaturas bajas, sequía y niveles bajos de radiación, esta condición mejora la capacidad para soportar estrés (Boucher et al., 1999).
Los mecanismos de adaptación al estrés causan modificaciones en la expresión de la información genética, produciendo cambios en los productos génicos, incluyendo mRNA y proteínas. Como respuesta se sintetizan proteínas específicas, llamadas proteínas de estrés, las cuales posiblemente dotan a las plantas con la capacidad de adaptación por medio de ajustes fisiológicos y bioquímicos. La síntesis de proteínas en plantas puede ser específica para un estrés particular, como aquellas que son inducidas por déficit hídrico (Riccardi et al., 1998). Sin embargo, muchas de las proteínas son comunes y pueden ser sintetizadas bajo más de un tipo de estrés (Taiz y Zeiger, 1998). Esta investigación estuvo orientada a mejorar la comprensión de los mecanismos de adaptación de las plantas de maíz asociadas con Glomus spp. al crecer en suelos con deficiencias de fósforo inorgánico, a través del estudio de los cambios morfológicos, fisiológicos y bioquímicos, entre los que se destacan la determinación de azúcares y proteínas de estrés.
Materiales y métodos
Diseño experimental
La investigación se realizó bajo condiciones controladas en los laboratorios e invernaderos del Centro de Investigaciones Tibaitatá de Corpoica. El diseño experimental usado fue bloques completos al azar, con seis tratamientos y seis repeticiones, de la siguiente manera: tres tratamientos con diferentes niveles de fósforo disponible en el suelo 1, 40 y 100 mg·kg-1 y tres tratamientos con las anteriores concentraciones de fósforo en el suelo, más la aplicación de micorrizas arbusculares del género Glomus spp.
Preparación del sustrato e inoculante
El sustrato utilizado consistió en una mezcla de suelo y cascarilla quemada, en una proporción 3:1 (V:V), respectivamente. El inóculo empleado en este ensayo se obtuvo del Banco de Germoplasma del Programa Nacional de Recursos Biofísicos de Corpoica, Tibaitatá, el cual tiene una presentación sólida que consiste en una mezcla de suelo, raíces colonizadas, hifas y esporas.
Siembra e inoculación
Se plantaron semillas pregerminadas del híbrido Corpoica Turipaná H-112, en materas plásticas con capacidad de 2 kg, previamente desinfectadas con una solución de hipoclorito de sodio al 5% y enjuagadas con abundante agua estéril. El sustrato homogenizado fue fertilizado con superfosfato triple hasta alcanzar las siguientes concentraciones 1, 40 y 100 mg·kg-1 de fósforo disponible en el suelo, mientras que los tratamientos inoculados contenían aproximadamente 200 esporas de Glomus spp. por matero, donde se sembró a razón de una semilla por matero.
Condiciones experimentales y manejo agronómico
Las plantas crecieron bajo invernadero a una temperatura promedio de 20,3 °C, con temperaturas máximas de 28,31 °C y mínimas de 13,8 °C y una humedad media relativa promedio de 74%. Las aplicaciones de riego (agua estéril) fueron controladas con el fin de evitar el encharcamiento y de mantener la humedad cercana a la capacidad de campo. Adicionalmente, se aplicaron fertilizantes en forma de soluciones nutritivas, para garantizar cubrir los requerimientos nutricionales del maíz. La solución nutritiva utilizada fue la propuesta de Mollier y Pellerin (1999) para maíz, que consiste en una mezcla de elementos esenciales, exceptuando el fósforo, el cual se adicionó en forma de superfosfato triple, según el tratamiento. La solución nutritiva fue aplicada con una frecuencia aproximada de 48 horas, en una dosis de 30 mL por matera.
Sistema de muestreo y variables analizadas
Se realizaron dos muestreos destructivos a los 20 y 30 días después de la emergencia (dde), para variables a nivel morfológico y bioquímico, de la siguiente manera. Variables morfológicas: número de hojas, área foliar total (usando el medidor de área foliar Leaf Area Meter CI-202), peso fresco y seco de hojas y raíz, a una temperatura de 65 °C durante 72 horas. Variables bioquímicas: se determinaronlas concentraciones de nutrientes, azúcares y proteínas en tejido vegetal. Los nutrientes analizados fueron: fósforo y nitrógeno, según la metodología de Calderón y Pavlova (2001). La cuantificación de fósforo se realizó por colorimetría y la concentración de nitrógeno se determinó por el método de Kjeldahl, teniendo en cuenta la metodología de AOAC. Mientras que la extracción y cuantificación de azúcares totales se realizó por el método de Somogyi-Nelson. Finalmente, las proteínas totales se determinaron por Bradford e identificación por electroforesis SDS PAGE. A nivel simbiótico se determinó el porcentaje de colonización de micorrizas usando el método de Trouvelot et al. (1986), que cuantifica la frecuencia de micorrización (%F), es decir, el número de raíces colonizadas con relación al total de raíces por planta e intensidad de micorrización (%M), que indica el porcentaje de colonización por raíz; estas variables se analizaron a los 30 días después de la siembra y se refieren al sistema radical en sus totalidad.
Análisis estadístico
El procesamiento estadístico se realizó utilizando la versión 8 de Statistical Analisys System (SAS) y consistió en un análisis de varianza (Anova) con niveles de significancia de (P < 0,05 y P < 0,01), posteriormente se aplicó la prueba de rangos múltiples de Duncan a cada una de las variables estudiadas con un nivel de significancia de (P < 0,05). Finalmente, para el estudio de las interacciones entre los factores gradiente de fósforo y micorrización se utilizaron contrastes ortogonales.
Resultados y discusión
Los resultados experimentales de las tablas 1, 2, 3 y 4 muestran los valores promedios de las variables analizadas de acuerdo con la fuente de variación (disponibilidad de fósforo en el suelo y efecto de la inoculación con micorrizas arbusculares) y el nivel de significancia según el análisis de varianza Anova, la prueba de rangos múltiples de Duncan y contrastes ortogonales.
Los resultados confirman un disminución en el área foliar relacionada con la baja disponibilidad de fósforo en el suelo, en ambos muestreos (20 y 30 dde). Esta disminución del área foliar se relaciona con reducciones en la acumulación de materia seca, tanto en hojas como en raíz, lo que sugiere que plantas de maíz, bajo condiciones de estrés por fósforo, reducen el crecimiento vegetal debido al decrecimiento del P inorgánico en las hojas (Usuda y Shimogawara, 1995). La mayor área foliar y acumulación de materia seca, en hojas y en raíz ocurre en plantas bajo la mayor concentración de fósforo disponible en el suelo (100 m·kg-1), con relación a la concentración media de 40 mg·kg-1 de fósforo, y estas a su vez con el testigo con solo 1 mg·kg-1 de fósforo en el suelo. Estas diferencias fueron altamente significativas (P < 0,01) según la Anova y la prueba de rangos múltiples de Duncan (p < 0,05). Es importante destacar que ambos factores fueron analizados por separado, debido a que no se detectaron diferencias en su interacción (tabla 1).
Adicionalmente se evaluó el índice raíz/parte aérea de la planta, con el propósito de determinar el balance en el crecimiento vegetal a través de la distribución de la materia seca. Los resultados muestran diferencias significativas (P < 0,01) entre tratamientos de acuerdo al Anova, debido a la disponibilidad de fósforo en el suelo, pero no debido a la inoculación con Glomus spp., tanto a los 20 como a los 30 días después de la emergencia. La relación fue inversa, entre el índice y la concentración de fósforo en el suelo. Los mayores valores se obtuvieron a más bajas concentraciones de fósforo. Este mecanismo de compensación ocurrió pocos días después de la deficiencia de fósforo en la planta, debido a que una gran cantidad de carbohidratos son traslocados a la raíz en detrimento de las hojas, resultado que ha sido reportado por otros investigadores (Atkinson, 1973; Fredeen et al., 1989; Rao y Terry, 1989; Pellerin y Mollier, 2001). Sin embargo, es importante destacar que esta situación solo persiste máximo durante 10 días, dado que cuando las plantas fueron evaluadas a los 30 dde, el efecto desaparece y ocurre una mayor acumulación de la materia seca en raíces con relación a la parte aérea de la planta; es decir, que el balance del crecimiento de la planta cambia nuevamente, posiblemente por el agotamiento que sufre la planta como consecuencia de la disminución del fósforo disponible.
La asociación maíz con micorrizas arbusculares, del género Glomus, muestra mayores índices de crecimiento en plantas, expresados en biomasa (materia seca y área foliar), como consecuencia de una mejor nutrición mineral por parte del hospedero, especialmente relacionada con el fósforo, que indujo a un estímulo en el crecimiento vegetal. Estas diferencias fueron significativas según el análisis de varianza y la prueba de rangos múltiples de Duncan (P < 0,05). Plantas de maíz micorrizadas presentan mayores concentraciones de azúcares totales y reductores, que aquellas no micorrizadas. Estas diferencias estuvieron incrementadas con los niveles de fósforo disponible en el suelo, especialmente en los azúcares totales, donde los niveles más altos de fósforo disponible (100 mg·kg-1) fueron superiores al nivel intermedio (40 mg·kg-1), y estos a su vez al testigo (1 mg·kg-1), de acuerdo con la prueba de rangos múltiples de Duncan (tabla 2). Estos resultados muestran que tanto la concentración de fósforo como la asociación simbiótica con micorrizas contribuyen con la concentración de azúcares, debido al rol del fósforo en la síntesis de carbohidratos en plantas. Así, los resultados concuerdan con los reportados por Boucher et al. (1999), quienes encontraron mayores concentraciones de azúcar en plantas colonizadas por Glomus vermiforme. De forma similar, plantas de maíz bajo estrés por sequía, asociadas con Glomus intraradices, presentan mayores concentraciones de azúcar que las plantas no micorrizadas; esto puede ser el resultado de un incremento de la tasa fotosintética o de una reducción de la degradación de clorofila (Boucher et al., 1999).
A nivel bioquímico se analizaron las concentraciones de proteínas en diferentes tejidos de la planta. Los resultados muestran diferencias significativas según la Anova entre tratamientos, en la concentración de proteína foliar, pero no en la proteína radical. Los cambios en la concentración de proteínas en tejido estuvieron determinados por una combinación entre el fósforo disponible en el suelo y la inoculación con micorrizas de género Glomus, de la siguiente manera: plantas bajo condiciones de estrés por fósforo (1 mg·kg-1) presentan mayor concentración de proteína foliar, que plantas no estresadas (100 mg·kg-1); mientras que plantas de maíz micorrizadas incrementan la síntesis de proteínas con respecto a plantas no micorrizadas.
Estos resultados permiten suponer que la asociación simbiótica con Glomus spp. contribuye con la síntesis de proteínas de estrés, las cuales forman parte de la respuesta al déficit de fósforo en el suelo. De esta forma, el estrés por deficiencia de fósforo, conduce a la expresión diferencial de la información genética, produciendo cambios en los productos génicos, incluyendo mRNA y proteínas (Usuda y Shimogawara, 1995). Es así como aumenta la síntesis de nuevas proteínas en plantas estresadas y disminuye el nivel de centenares de proteínas existentes. Estas proteínas específicas de estrés, posiblemente dotan a las plantas con la capacidad de adaptarse al estrés medioambiental por medio de ajustes fisiológicos y bioquímicos (Usuda y Shimogawara, 1995). Según Boucher et al. (1999), altas concentraciones de proteínas en maíz han sido asociadas con un rol adaptativo de las micorrizas arbusculares en la reducción de la degradación proteica bajo condiciones de estrés y a la producción de proteínas llamadas micorrizinas, las cuales pueden ser inducidas por la asociación con Glomus spp., en respuesta a la infección con el hongo, pero su función específica aún se desconoce. La identificación de estas proteínas llamadas micorrizinas se inició con el uso de electroforesis bidimensional, donde es posible reconocer diferencias en los patrones electroforéticos entre plantas bajo estrés por deficiencia de fósforo y aquellas no estresadas, así como plantas micorrizadas con Glomus y aquellas no micorrizadas. Estas evidencias corroboran que la condición de estrés conlleva a la síntesis de proteínas de estrés, y como la asociación de maíz con Glomus spp. contribuye con la síntesis de nuevas proteínas como mecanismos de respuesta de la planta al estrés ambiental (Boucher et al., 1999)
Con relación a la concentración de nutrientes en tejido vegetal, se observa que los mayores contenidos de fósforo (P), nitrógeno (N), potasio (K) y magnesio (Mg) se presentan con los más altos niveles de fósforo disponible en el suelo (100 mg/kg), especialmente en presencia de Glomus spp., seguidos de la concentración media (40 mg·kg-1), mientras que las menores concentraciones se encuentra en el testigo (1 mg·kg-1) (tabla 3).
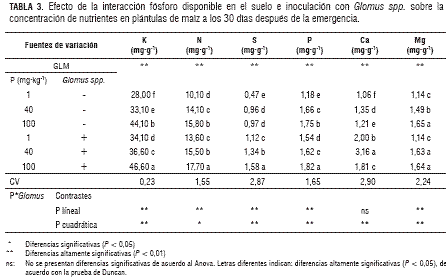
Es importante destacar, que existe un efecto aditivo sobre concentración de K, N, S, P y Mg en planta, debido a las aplicaciones de Glomus spp. para cada uno de los contenidos de fósforo en el suelo, de la siguiente manera: plantas con niveles altos de fósforo disponible (100 mg·kg-1), asociadas a MA muestran mayor concentración de la mayoría de los nutrientes, excepto calcio comparadas con plantas no micorrizadas con igual nivel de fósforo en el suelo. La mayor concentración de nutrientes en tejido vegetal (N, P, S, K y Mg) se presentan en plántulas de maíz que crecen bajo la mayor concentración de fósforo disponible en el suelo (100 mg·kg-1), seguidas del nivel medio (40 mg·kg-1) y estas a su vez fueron superiores al testigo, con solo 1 mg.kg-1 de fósforo disponible en el suelo. De forma similar, plantas asociadas con Glomus spp. presentan concentraciones mayores de nutrientes en tejido vegetal a los 30 dde, con relación a plantas de maíz no micorrizadas con Glomus spp. Con el propósito de analizar el efecto independiente de la disponibilidad de fósforo en el suelo y la inoculación con Glomus spp., se diseñaron dos diagramas radiales de la concentración de nutrientes en plántulas de maíz a los 20 y 30 dde, que se presentan en las figuras 1 y 2.
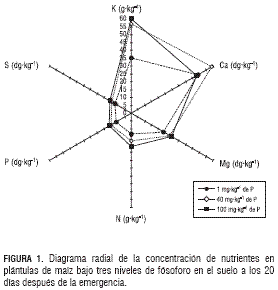
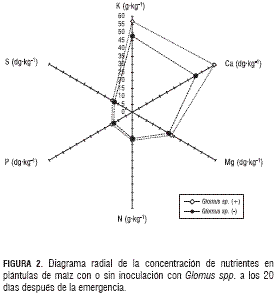
La figura 1 representa la concentración de nutrientes (N, P, K, Ca, Mg y S) en tejido vegetal para cada uno de los tratamientos en tres polígonos. De acuerdo con este diagrama existe una relación entre el tamaño del polígono y el nivel de P en el suelo, es así que a bajas dosis de P en el suelo la plántulas de maíz muestra menores concentraciones de nutrientes (N, P, K, Ca y Mg) en tejido vegetal; mientras que las dosis altas de P en el suelo (línea continua) se presentan mayores concentraciones de nutrientes en tejido vegetal (N, P, K y Mg), representadas en un polígono mayor, y la dosis media de P en el suelo se relaciona con un polígono de tamaño intermedio. De forma similar, la figura 2 es un diagrama radial que representa la concentración de nutrientes en tejido vegetal en plantas de maíz con y sin inoculación con Glomus spp., donde claramente se observa que el status nutricional de las plántulas inoculadas con Glomus spp. es mejor que aquellas sin inoculación. Estos resultados confirman el papel del fósforo en el suelo y de Glomus spp. en el estado nutricional de la plántulas de maíz a los 20 días después de la emergencia.
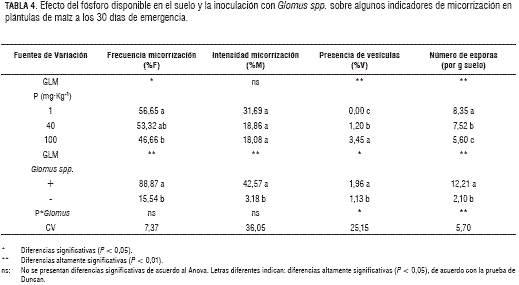
Finalmente se evaluó el efecto del fósforo disponible y de la inoculación con Glomus spp. sobre varios indicadores de micorrización en plántulas de maíz a los 30 dde, como se observa en la tabla 4. Los resultados del análisis estadístico muestran diferencias significativas debidas a la concentración de fósforo en el suelo, para las variables: frecuencia de micorrización (%F), presencia de vesículas y número de esporas por gramo de suelo, pero no en intensidad de micorrización (%M), según la Anova y las pruebas Duncan. Estos resultados indican que a menores concentraciones de fósforo disponible en el suelo existe un mayor número de plantas micorrizadas (%F), pero el porcentaje de colonización por raíz (%M) no cambió significativamente a los 30 dde. Mientras la presencia de vesículas se incrementa con la concentración de fósforo el número de esporas disminuye. Estos resultados pueden ser explicados, dado que la producción de vesículas en plantas micorrizadas ocurre como respuesta del simbionte a factores adversos, donde altas concentraciones de fósforo inhiben la asociación simbiótica; mientras que el número de esporas presentes en la muestra representan aquellas esporas que no germinaron y no las que son fruto de la esporulación, debido a que este proceso requiere de más tiempo una vez se ha colonizado el tejido radical. Para todas las variables relacionadas con micorrización se pudo establecer que la inoculación con Glomus spp. aumenta significativamente la frecuencia (%F) y la intensidad de micorrización (%M), la presencia e intensidad de vesículas (%V), así como el número de esporas por gramo de suelo, según la Anova y las pruebas Duncan. Los tratamientos sin inoculación con micorrizas se hicieron sobre suelo no estéril, razón por la cual presentan algunos niveles de micorrización proveniente de esporas nativas. Estos resultados confirman las diferencias entre tratamiento con o sin inoculación con Glomus spp.
Conclusiones
De acuerdo con los resultados experimentales, bajas concentraciones de fósforo inorgánico disponible en el suelo se relacionan con una disminución en el área foliar que afecta el crecimiento de plantas de maíz a los 20 y 30 dde. Situación que se refleja en la reducción de materia seca, tanto en hojas como en raíz, posiblemente debido a la disminución en la concentración de fósforo inorgánico en hojas. Como mecanismos de compensación a las deficiencias de fósforo en el suelo, las plántulas de maíz traslocan carbohidratos a la raíz en detrimento de las hojas, cambiando el balance de la planta en la distribución de materia seca, expresado en el índice raíz : parte aérea. Este mecanismo sólo se presenta en los primeros días después de que la planta es sometida a estrés por fósforo (< 10 días); posteriormente, el balance cambia nuevamente y la parte aérea de la planta presenta un rápido incremento en materia seca superior al de la raíz, mostrando menores índices raíz : parte aérea. Adicionalmente se observó que plantas de maíz asociadas a micorrizas arbusculares, del género Glomus, presentaron mayores índices de crecimiento, expresados en biomasa (materia seca y área foliar) debido al estímulo al crecimiento vegetal, como una consecuencia de una mejor nutrición mineral por parte del hospedero, especialmente el fósforo. Este mayor crecimiento de la planta de maíz micorrizada con respecto a no micorrizada está relacionado con incrementos en la concentración de azúcares en tejido, debido al rol del fósforo en la síntesis de carbohidratos en plantas.
Al comparar la concentración de proteínas en tejidos foliares y radicales, solo se observan diferencias significativas a nivel de las hojas. La concentración de proteínas aumenta en plantas micorrizadas y no micorrizadas bajo estrés por fósforo, debido a que la condición de estrés conlleva a una síntesis de proteínas de estrés, como mecanismos de respuesta de la planta al ambiente. Adicionalmente, se observa que en plantas micorrizadas aumenta la producción de proteínas foliares con respecto a que aquellas no micorrizadas bajo concentraciones bajas y medias de fósforo (1 y 40 mg·kg-1 de P). Estos resultados permiten suponer que la asociación simbiótica con Glomus spp. contribuye con la síntesis de proteínas de estrés, las cuales forman parte de la respuesta al déficit de fósforo en el suelo. De esta forma, el estrés por deficiencia de fósforo, conduce a la expresión diferencial de la información genética, produciendo cambios en los productos génicos, incluyendo mRNA y proteínas. Es así como aumenta la síntesis de nuevas proteínas en plantas estresadas. Estas proteínas específicas de estrés, llamadas micorrizinas, posiblemente dotan a las plantas con la capacidad de adaptarse al estrés medioambiental por medio de ajustes fisiológicos y bioquímicos. Según Boucher et al. (1999), las micorrizinas pueden ser inducidas por la asociación MA, en respuesta a la infección con el hongo, pero su función específica aún se desconoce.
Literatura citada
Atkinson, D. 1973. Some general effects of phosphorus deficiency on growth and development. Plant Physiol. 72, 101-111. [ Links ]
Boucher, A., Y. Dalpe y C. Charest. 1999. Effect of arbuscular mycorrhizal colonization of four species of Glomus on physiological responses of Maize. Plant Nutr. 2(4,5), 783-797. [ Links ]
Calderón, F y M. Pavlova. 2001. Metodologías de análisis foliar. Calderón Laboratorios Ltda., Bogotá. [ Links ]
Ferreris G. N. y L. A., Couretot. 2006. Inoculación con promotores de crecimiento y uso de diferentes dosis de fertilizante fosforado en maíz en ambientes con baja disponibilidad de fósforo en el suelo. Área de Desarrollo Rural INTA, EA. Pergamino, Buenos Aires. En: http://www.elsitioagricola.com/articulos/ferraris/ InoculacionconPromotoresdeCrecimientoenMaiz.pdf [ Links ]
Fredeen, A., IM. Rao, y N. Ferry. 1989. Influence of phosphorous nutrition in Glycine max. Plant Physiol. 89, 225-230. [ Links ]
Gianinazzi-Pearson, V. y C. Azcón Aguilar. 1991. Fisiología de las micorrizas vesículo-arbusculares. En: Olivares, J. y J .M. Barea (eds.). Fijación y movilización biológica de nutrientes. Vol. 2. Consejo Superior de Investigaciones Científicas, Madrid. pp. 175-202. [ Links ]
Jain A., M.J. Vasconcelos, K.G. Raghothama y S.V Sahi. 2007. Molecular mechanisms of plant adaptation to phosphate deficiency. Plant Breeding Rev. 29, 359-419. [ Links ]
Mollier, A. y S. Pellerin. 1999. Maize root system growth and development as influenced by phosphorus deficiency. J. Expl. Bot. 50(333), 487-497. [ Links ]
Peck, N. y G. MacDonald. 1989. Sweet corn plant responses to P and K in the soil and to band applied monoammonium phosphate, potassium sulphate and magnesium sulphate. J. Amer. Soc. Hort. Sci. 114, 269-272. [ Links ]
Peck, N., G. MacDonald y J. Barnard. 1988. Sweet corn seedling responses to band applied nitrogen, phosphorus and soil and potassium fertilizers. J.Amer.Soc.Hort.Sci. 113, 336-342. [ Links ]
Pellerin, S. y A. Mollier. 2001. How to include mineral nutrition in crop growth models? The example of phosphorus on maize: Plant nutrition food security and sustainability of agro-ecosystems. Kluwer Academic Publishers. pp. 110-111. [ Links ]
Prystupa P., F. H. Gutiérrez Boem y G. Cernik. 2005. Generación del rendimiento en un cultivo de maíz sujeto a deficiencias de fósforo. Informaciones Agronómicas No. 27. Facultad de Agronomía UBA, Buenos Aires. [ Links ]
Rao, I.M. y N. Ferry. 1989. Leaf phosphorus status, photosynthesis, and carbon partitioning in sugar beet. Plant Physiol. 90, 814-819. [ Links ]
Riccardi, F., P. Gazeau, D. Vienne y M. Zivy. 1998. Protein Changes in response to progressive water deficit in maize. Plant Physiol. 117, 1253-1263. [ Links ]
Russo, V.M. y A.J. Pappelis. 1995. Senescence in sweet corn as influenced by phosphorous nutrition. Plant Nutr. 18(4), 707-717. [ Links ]
Sanders, I.R., J.P. Clapp y A. Wiemken. 1996. The genetic diversity of arbuscular mycorrhizal fungi in natural ecosystems - a key to understanding the ecology and functioning of the mycorrizal symbiosis. New Phytologist 133(1), 123-134. [ Links ]
Silveira A. 1992. Micorrizas. En: Microbiologia do solo. Sociedad Brasileira de Ciencia do Solo, Campinas, pp. 257-282. [ Links ]
Taiz y E. Zeiger, 1998. Plant physiology. 2nd edition. Sinauer Associates, Sunderland, Massachusetts. pp. 725-756. [ Links ]
Trouvelot A., J. L. Kough y V. Gianinazzi-Pearson. 1986. Measure du taux de mycorrhization VA dun systeme radiculaire. Recherche de methodes destimation ayand une signification functionnelle. En: Mycorrhizae. Physiology and genetics. Primer Simposio Europeo de Micorrizas. INRA, París. pp. 626-630. [ Links ]
Usuda H. y K. Shimogawara. 1995. Phosphate deficiency in maiz. VI: Changes in the two-dimensional electrophoretic patterns of soluble proteins form second leaf blades associated with induced senescence. Plant Cell Physiol. 36(6), 1149-1155. [ Links ]














