Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.26 no.1 Bogotá Jan./June 2008
PROTECCIÓN DE CULTIVOS
Hibert Giovani García1, Mauricio Marín2, Sonia Jaramillo3 y José Miguel Cotes4
1 Ingeniero agrónomo, auxiliar de investigación, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. hggarcia@unalmed.edu.co
2 Profesor asistente, Facultad de Ciencias, Universidad Nacional de Colombia, Medellín. hggarcia@unalmed.edu.co
3 Profesora asociada, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. sjaramal@unalmed.edu.co
4 Profesor asistente, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. jmcotes@unalmed.edu.co
Fecha de recepción: septiembre 27 de 2007. Aceptado para publicación: abril 9 de 2008
RESUMEN
La gota de la papa causada por Phytophthora infestans es la enfermedad más limitante de este cultivo en Colombia, donde la mayor parte de regiones productoras presentan condiciones óptimas para su desarrollo epidémico. Esta situación conduce a los agricultores a la utilización excesiva de diferentes fungicidas, lo que además de representar cerca del 10% de los costos de producción, causa un grave deterioro ambiental y de salud pública. Esta investigación pretende apoyar los programas de M.I.E. a partir del monitoreo de los niveles de sensibilidad de 15 aislamientos de P. infestans obtenidos en Antioquia, Cundinamarca y Boyacá a los fungicidas Ridomil® Gold, Curzate® M-8, Previcur® N SL y Mildex® 711 WG, como una herramienta de análisis de riesgos que permita ofrecer a los agricultores de papa recomendaciones técnicas basadas en la generación de líneas de sensibilidad. Las evaluaciones se realizaron utilizando la metodología de inmersión de discos de hoja con siete dosis de producto comercial. Los resultados indican que la población estudiada presenta altos niveles de sensibilidad a los cuatro fungicidas. Para el caso del Curzate® M-8, se alcanzaron valores promedio de EC50 de 0,28 mg·L-1, mientras que la EC50 para Previcur® N SL fue de 0,71 mg·L-1. Para los fungicidas Ridomil® Gold y Mildex® 711 WG estos valores alcanzaron 0,62 y 0,54 mg·L-1, respectivamente. Por otra parte, la producción de esporangios se redujo de 41.181 esporangios/mL obtenidos como promedio de todos los aislamientos en el tratamiento control, a menos de 500 esporangios/mL cuando se evaluaron las dosis máximas de los cuatro fungicidas.
Palabras clave: Cymoxanil, EC50, Fenamidone, Metalaxyl, papa, Propamocarb.
ABSTRACT
Potato late blight caused by Phytophthora infestans is the most restrictive disease of this crop in Colombia, where environmental conditions are optimal conditions for its epidemic development. This situation leads to an excessive use of fungicides by farmers, which besides representing near 10% of production costs, causes a serious damage of environment and public health. This research pretends to support IPM programs by monitoring the sensitivity levels of 15 isolates of P. infestans obtained from crops in Antioquia, Cundinamarca and Boyacá, to fungicides Ridomil® Gold, Curzate® M-8, Previcur® N SL and Mildex® 711 WG as a tool of the risk analysis that permit to offer to the farmers the technical recommendations based on the generation of sensitivity lines. Evaluations of sensitivity were carried out using the immersion of leaf discs methodology with seven doses of each commercial product. Results show that the studied population presents high levels of sensitivity to these fungicides. In the case of Curzate® M-8, the average EC50 value was 0.28 mg·L-1, while the EC50 for Previcur® N SL reached 0.71 mg·L-1. In tests with fungicides Ridomil® Gold and Mildex® 711 WG, these values were 0.62 and 0.54 mg·L-1, respectively. Finally, sporangia production decreased from an average of 41,181 sporangia/mL in control treatment to less than 500 sporangia/mL when the maximum doses of four fungicides were evaluated.
Key words: Cymoxanil, EC50, Fenamidone, Metalaxyl, potato, Propamocarb.
Introducción
La enfermedad más limitante del cultivo de la papa (Solanum tuberosum L.) es la gota o tizón tardío, causada por el Oomycete Phytophthora infestans (Mont.) de Bary (Erwin y Ribeiro, 1996). Su efecto sobre la agricultura mundial se estima en 5.000 millones de dólares perdidos al año (Duncan, 1999). En Colombia es especialmente importante debido a la ubicación de los cultivos en regiones con condiciones climáticas favorables para el desarrollo del patógeno y a la siembra de materiales altamente susceptibles, como las variedades Diacol Capiro, Parda Pastusa, ICA Nevada y Tuquerreña. Así por ejemplo, bajo las condiciones del oriente antioqueño, los agricultores de papa realizan hasta 18 aspersiones de fungicidas protectantes y sistémicos para controlar la gota en cada ciclo de cultivo, lo cual representa un costo que oscila entre el 10% y el 30% del valor total de la producción de los cultivos de papa en el país (Jaramillo, 2004).
La resistencia genética varietal ha sido uno de los principales métodos empleados para el manejo de la gota. La generación de variedades con resistencia raza-específica obtenidas a partir de especies de solanáceas no cultivadas como S. demissum probó ser efectiva en algunos países. Sin embargo, la alta variabilidad del patógeno ha sobrepasado las barreras genéticas que presentaban dichas variedades, lo que ha llevado a la desaparición comercial de estos materiales. Esta situación condujo al desarrollo de materiales con resistencia general (poligénica), algunos de los cuales están disponibles en diferentes países del mundo (Erwin y Ribeiro, 1996). En Colombia, la variedad Monserrate, un cruce entre cultivares de S. tuberosum y S. andigena (Estrada y Guzmán, 1969), es uno de los casos más representativos del potencial que ofrece la resistencia poligénica como método de manejo del tizón tardío de la papa.
La utilización de fungicidas de síntesis química es el otro gran pilar sobre el cual ha recaído el control de P. infestans. Hasta 1970, los fungicidas más utilizados incluían el caldo bordelés y otros productos cúpricos, además de las ftalimidas y los ditiocarbamatos (Rich, 1983). Posteriormente, el control se basó en la utilización de fungicidas sistémicos, en especial del grupo fenilamidas, cianoacetamida-oximas, carbamatos e inhibidores de QoI; entre los cuales se destacan los i.a. Metalaxyl, Cymoxanil, Propamocarb y Fenamidone. El Metalaxyl es un fungicida sistémico con acción protectante, curativa y erradicante usado exclusivamente para el control de Oomycetes, ya que no presenta acción sobre hongos verdaderos (Erwin y Ribeiro, 1996). Inhibe la síntesis de ARN ribosomal a nivel de la incorporación de uridina por parte de la ARN polimerasa I (Davidse, 1995) y hace parte del grupo de las fenilaminas en conjunto con Oxadixyl, Benalaxyl y Ofurace (Gisi y Cohen, 1996).
Por su parte, el Cymoxanil es una molécula fungicida perteneciente a la familia química de las cianoacetamidaoximas. Su movimiento en la planta es translaminar, no tiene movimiento acropétalo, su persistencia en la planta está limitada a unos pocos días y posee un modo de acción multisitio que incluye la inhibición de la síntesis de ADN, ARN, aminoácidos y lípidos, además de afectar la respiración celular y la permeabilidad de la membrana celular (Leroux, 1993). Recientemente, se encontró que esta molécula también actúa como un inductor de las defensas naturales de las plantas, que reaccionan mediante respuestas de hipersensibilidad y aumento en el espesor de las paredes celulares deteniendo el crecimiento miceliar del Oomycete (Howard et al., 2000).
El Propamocarb pertenece al grupo de los carbamatos. Es un fungicida básicamente translaminar que actúa sobre el micelio joven, afectando la permeabilidad de la membrana celular, y poco efectivo cuando el micelio está completamente desarrollado (Papavizas et al., 1978). Adicionalmente a su acción foliar, puede ser absorbido por las raíces, razón por la cual es utilizado en aplicaciones tipo drench para el control de Oomycetes del suelo (EFSA, 2006).
El fungicida Fenamidone proviene de un nuevo grupo de moléculas derivadas de la química de la Imidazolinona. Su rango de acción incluye un gran número de patógenos de la clase Oomycetes, aunque también controla algunos hongos verdaderos pertenecientes a la clase Ascomycetes (por ejemplo Mycosphaerella spp.) y a los hongos mitospóricos (por ejemplo Alternaria spp.) (Mercer y Latorse, 2003). Esta molécula actúa inhibiendo la respiración mitocondrial, al bloquear el transporte de electrones a nivel de la ubihidroquinona en el complejo III (citocromo C oxidorreductasa), también llamado complejo bc1. Dicho modo de acción es similar al que presentan las Estrobilurinas y el Famoxadone, por lo que estos compuestos se han agrupado por parte de la Fungicide Resistance Action Committee (FRAC) dentro del grupo de resistencia cruzada QoI (Quinone outside Inhibitors) (FRAC, 2006).
La efectividad de algunos de estos productos en diversas regiones del mundo se ha venido reduciendo gradualmente como resultado de la aparición de resistencia en las poblaciones del patógeno, debido a la alta presión de selección ejercida por el uso continuo de dichas moléculas. Se ha demostrado que la presencia de mutaciones puntuales en los genes que codifican para las proteínas blanco de la acción fungicida y de ciertas secuencias de nucleótidos ubicadas en las regiones promotoras de dichos genes se encuentran asociadas con la ocurrencia de varios fitopatógenos con genotipos resistentes a diversas moléculas químicas. La frecuencia de aparición de dichos cambios genéticos está directamente asociada con la tasa de recombinación en los ciclos sexuales y parasexuales que presentan los hongos y Oomycetes (Damicone, 2004; FRAC, 2006).
Un hecho preocupante derivado de las investigaciones realizadas en Colombia sobre P. infestans son los bajos niveles de sensibilidad que han presentado algunos de los aislamientos al fungicida sistémico Metalaxyl, el más comúnmente empleado para su control. Así por ejemplo, en el año 2001 se determinó que cerca del 75% de los aislamientos colectados en el departamento de Antioquia resultó insensible al Metalaxyl (Jaramillo et al., 2002; Jaramillo, 2004), mientras que los resultados de sensibilidad al Cymoxanil han resultado variables (Jaramillo et al., 2002; Ochoa, 2004), por lo que es importante continuar con su evaluación. Esta situación ha conducido a la necesidad de emplear otros fungicidas sistémicos para controlar el patógeno en los cultivos de papa del país, siendo los fungicidas Propamocarb y Fenamidone alternativas disponibles en el mercado, que requieren evaluación y monitoreo constante.
Estas evaluaciones son especialmente críticas para mejorar la competitividad de la cadena productiva de la papa, por cuanto la utilización de pesticidas en este cultivo es especialmente alta, al representar cerca del 14% del total de los costos de producción. Adicionalmente, el proceso de toma de decisiones por parte de los agricultores para la utilización de estos productos carece en gran medida de criterios técnicos y se basa en recomendaciones tradicionales. De acuerdo con el MADR (2006), la sobredosificación de insumos químicos representa un problema grave en el cultivo de la papa en Colombia y cerca del 50% de los costos relativos al uso de estos productos. El objetivo de la presente investigación fue analizar el nivel de sensibilidad de 15 aislamientos de P. infestans a cuatro de los fungicidas sistémicos utilizados en Colombia para el control de P. infestans, con el fin de establecer acciones de monitoreo que apoyen la toma de decisiones relacionadas con el uso de fungicidas de síntesis química en el cultivo de la papa en Colombia.
Materiales y métodos
Esta investigación se desarrolló en los Laboratorios de Estudios Moleculares y de Biología Celular y Molecular de la Universidad Nacional de Colombia, sede Medellín. Las plantas empleadas para la obtención de los folíolos fueron sembradas en el Centro Experimental Paysandú (Medellín, bh-MB, 2.550 msnm, temperatura media 14 °C y precipitación promedio anual de 2.000 mm).
Aislamientos de Phytophthora infestans
Se utilizaron 15 aislamientos colectados durante los dos semestres del año 2006, en cultivos de papa de los departamentos de Antioquia, Cundinamarca y Boyacá (tabla 1). El proceso de aislamiento del patógeno consistió en la ubicación de los tejidos vegetales con síntomas de gota sobre rodajas de papa variedad Tuquerreña (sin genes mayores de resistencia a P. infestans) y en la siembra del micelio desarrollado sobre medio Agar centeno (18 g de harina de centeno, 18 g de agar, 18 g de azúcar, 1 L de agua destilada), purificándose por transferencia continua a nuevas cajas de Petri. Previamente a la realización de las evaluaciones, se activaron los aislamientos a partir de la inoculación de suspensiones de esporangios en tubérculos de papa variedad Tuquerreña, desinfectados por 15 min en hipoclorito de sodio al 2% y etanol al 96% por 1 min, y se incubaron en cámara húmeda durante 4-6 días.
Sensibilidad de Phytophthora infestans a cuatro fungicidas sistémicos
Los aislamientos fueron evaluados por su nivel de sensibilidad a los fungicidas Ridomil® Gold MZ 68 WP (Metalaxyl- M 4% y Mancozeb 64%), Curzate® M-8 (cymoxanil 8% y Mancozeb 64%), Previcur® N SL (hidrocloruro de propamocarb 700 g·L-1+) y Mildex® 711 WG (44,4 g·kg-1 de i.a. Fenamidone y 667 g·kg-1 de Fosetyl-Al) bajo condiciones in vitro, mediante la utilización de discos de hoja de 14 mm obtenidos a partir de plantas de papa variedad Diacol Capiro. Las dosis utilizadas de cada fungicida se calcularon siguiendo una escala exponencial y fueron seleccionadas con base en los trabajos previos de Sujkowsky et al. (1993), Power et al. (1995), Latorse y González-Hilt (2003), Argel et al. (2004) y Ochoa (2004), de la siguiente forma: Ridomil® Gold MZ 68 WP 0; 1; 2,5; 6,3; 16; 40 y 100 mg·L-1, Curzate® M-8: 0; 0,1; 0,3; 0,7; 1,8; 4,6 y 12 mg·L-1 , Previcur® N SL: 0; 0,1; 0,3; 0,7; 2,5 y 13 mg·L-1 y Mildex® 711 WG: 0; 0,1; 0,2; 0,5; 1,3; 3 y 7 mg·L-1.
La evaluación se realizó a partir de la inmersión de los discos de hoja en la respectiva solución durante 1 minuto. Los discos así tratados, se localizaron en cajas de Petri con medio de sobrevivencia (1,5% Agar + 2 mg·L-1 de Kinetina) y se incubaron por 24 h a 18 °C y 12 h de luz. Transcurrido el periodo de incubación, cada disco de hoja se inoculó por el envés con una gota de 10 uL de una suspensión de 10.000 esporangios/mL, previamente preparada a partir de conteos en un hematocitómetro. Las cajas de Petri fueron ubicadas durante cinco días bajo las condiciones antes descritas, tiempo después del cual se evaluó sobre cada disco el porcentaje de área foliar necrosada siguiendo una escala 0-5, en donde cero se refiere a la ausencia de síntomas y cinco a un porcentaje de área foliar afectada superior al 50%. Para cada dosis se utilizaron tres cajas de Petri con cuatro discos y el experimento completo se repitió dos veces en el tiempo. En la evaluación de la dosis 0 mg·L-1 (tratamiento control) se sumergieron los discos de hoja en agua destilada estéril y se inocularon con el patógeno en forma similar a los demás tratamientos.
Adicionalmente, se determinó la concentración promedio de esporangios generados bajo cada una de las dosis evaluadas del fungicida para cada aislamiento. Para esto, se depositaron los discos de hoja correspondientes a cada tratamiento en tubos con 10 mL de agua destilada, agitándose mediante vortéx para proceder a realizar los conteos respectivos. Para el análisis estadístico del experimento se procedió a transformar los valores discretos de la escala de severidad en una escala de porcentaje en donde 0-1 corresponde a valores de 0%-12,5%; 1-2, 12,5%-25%; 2-3, 25%-37,5%; 3-4,37,5%-50%; 4-5, 50%-100%. La información generada fue analizada mediante análisis Probit y de esta forma se calcularon los valores de EC50 para cada aislamiento, utilizando el programa SAS v. 9.1.3.
Resultados
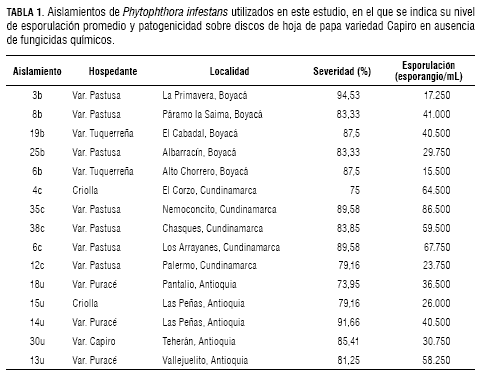
La virulencia sobre papa de los 15 aislamientos de P. infestans evaluados en este estudio quedó demostrada por los altos niveles de enfermedad que causaron sobre discos de hoja sin tratamiento químico, alcanzándose niveles de severidad entre un 70% y un 100% y en su capacidad de esporular, con un promedio de 41.181 esporangios/mL. En los experimentos se evidenció un nivel de variación entre las respuestas de los diferentes aislamientos evaluados, situación que era de esperarse debido a su procedencia heterogénea ( tabla 1).La acción fungicida de los cuatro productos evaluados fue evidente en los dos experimentos realizados, puesto que se redujeron los niveles de enfermedad y la producción de esporangios con el aumento de las dosis de cada uno de los aislamientos. El fungicida Ridomil® Gold causó una reducción promedio de los niveles de enfermedad de 49% con la primera dosis evaluada (1 mg·L-1), mientras que este efecto alcanzó el 74% y 98% de reducción de enfermedad cuando se utilizaron las dosis 6,3 mg·L-1 y 100 mg·L-1, respectivamente (figura 1A). La acción antiesporulante de este fungicida fue especialmente alta, al reducirse la producción promedio de esporangios en un 96% cuando se utilizó la dosis de 16 mg·L-1 y al inhibir completamente la esporulación en 14 de los 15 aislamientos bajo estudio, cuando se utilizó la dosis máxima de 100 mg·L-1 (figura 2A). Con respecto a los valores de EC50 calculados, se encontró que estos variaron desde niveles tan bajos como 0,045 mg·L-1 en el aislamiento 8b hasta 4,86 mg·L-1 en el aislamiento 38c, con un promedio de 0,62 mg·L-1 ± (0,59 - 0,66) (figura 3A).
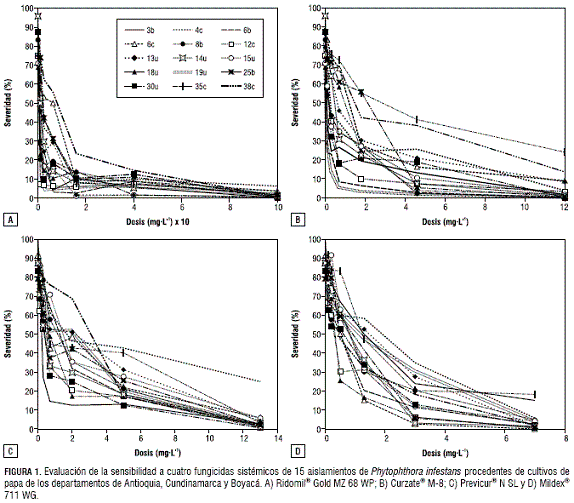
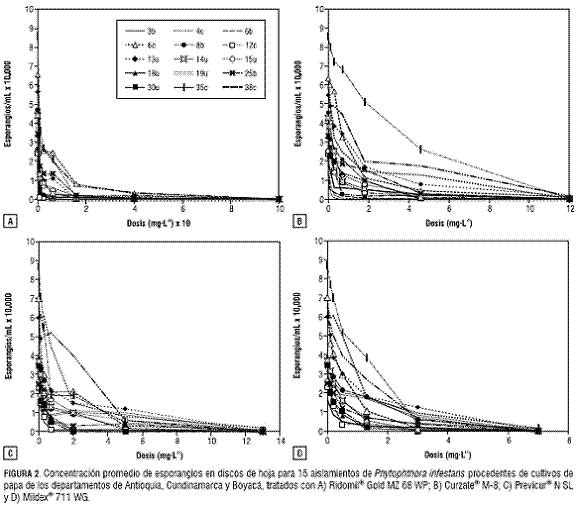
Con relación al fungicida Curzate® M-8, se destaca el hecho de que la primera dosis evaluada de 0,1 mg·L-1 causó una reducción promedio del 24,5% en la severidad de la enfermedad con respecto al control, y algunos aislamientos presentaron una alta sensibilidad a este producto, pues bajo dicha dosis tan solo causaron el 58% (aislamiento 30u) y 38% (aislamiento 3b) de severidad. Cuando se evaluó la dosis de 1,8 mg·L-1, los niveles de enfermedad presentaron un promedio de 27% de severidad, mientras que la dosis máxima evaluada (12 mg·L-1) generó una reducción promedio de enfermedad del 95%. Sin embargo, bajo esta dosis, los aislamientos 35c y 38c causaron enfermedad en niveles del 24% y 13% en la escala porcentual, respectivamente (figura 1B). La acción antiesporulante de este fungicida se evidenció por la reducción en la producción promedio de esporangios (54% con la dosis de 0,7 mg·L-1) y en la inhibición de la producción de esporangios en 11 de los 15 aislamientos con la dosis máxima evaluada. Los aislamientos 6c, 35c, 38c y 13u alcanzaron niveles de esporulación superiores a 1.000 esporangios/mL (figura 2B). Los valores de EC50 calculados correspondieron a valores inferiores a 1 mg·L-1 en trece de los aislamientos, algunos de los cuales presentaron valores tan bajos como 0,02 mg·L-1 (aislamiento 6b), mientras que los aislamientos 35c y 38c alcanzaron una EC50 de 2,3 y 1,3 mg·L-1, respectivamente. El promedio general de EC50 para este fungicida fue de 0,29 mg·L-1 ± (0,27 - 0,30) (figura 3B).
En la evaluación del fungicida Previcur® N SL se evidenció el alto nivel de sensibilidad de 14 de los 15 aislamientos estudiados a su único ingrediente activo Propamocarb, ya que con dosis tan bajas como 0,3 mg·L-1 se obtuvo una reducción promedio de severidad del 26%. La excepción correspondió al aislamiento 4c que prácticamente bajo esta dosis generó los mismos niveles de enfermedad que el tratamiento control. Este comportamiento fue consistente en las demás dosis evaluadas, al punto que, bajo la dosis máxima de 13 mg·L-1, los 14 aislamientos no causaron niveles de enfermedad superiores al 6%, mientras que el aislamiento 4c alcanzó un valor del 25% (figura 1C). La efectividad como antiesporulante del Previcur® N SL fue comprobada, al encontrarse que este producto inhibió completamente la generación de esporangios en 11 de los 15 aislamientos bajo la dosis máxima evaluada, mientras que los cuatro aislamientos restantes no generaron más de 2.000 esporangios/mL (figura 2C). El cálculo de los valores de EC50 arrojó un promedio general de 0,71 mg·L-1 ± (0,69 - 0,73) para todos los aislamientos, aunque se presentaron variaciones individuales con aislamientos extremadamente sensibles al Propamocarb como el 3b, 12c, 14u y 30u que tuvieron valores de EC50 inferiores a 0,4 mg·L-1 y otros con mayores niveles de tolerancia, como los aislamientos 4c (2,1 mg·L-1) y 38c (1,8 mg·L-1) (figura 3C).
El fungicida Mildex® 711 WG fue altamente efectivo, puesto que redujo los niveles de enfermedad en todos los aislamientos evaluados; alcanzó valores promedio de reducción de enfermedad del 58% cuando se evaluó la dosis de 1,3 mg·L-1. Algunos aislamientos fueron altamente sensibles, ya que, bajo la dosis de 0,5 mg·L-1, se redujeron sus niveles de enfermedad con respecto al control en valores superiores al 36%. Con excepción de los aislamientos 35c y 3b, que fueron los únicos que alcanzaron valores en la escala de severidad del 12,5%-25% cuando se sometieron a la dosis máxima evaluada de 7 mg·L-1, los demás aislamientos no superaron niveles del 6% (figura 1D). Al igual que los demás fungicidas evaluados, la acción antiesporulante del Mildex® 711 WG fue comprobada al reducirse en un 49% el número promedio de esporangios generados por los aislamientos bajo la dosis de 0,5 mg·L-1, niveles que llegaron al 100% de inhibición en diez de los aislamientos, cuando se sometieron a la dosis máxima evaluada de 7 mg·L-1 (figura 2D). Los cinco aislamientos restantes generaron niveles de esporulación inferiores a 1.500 esporangios/mL. Al calcular los valores de EC50, se encontró un promedio general de 0,54 mg·L-1 ± (0,53 - 0,55) (figura 3D).
Discusión
En este estudio se evaluó el nivel de sensibilidad de 15 aislamientos de P. infestans a cuatro fungicidas comerciales utilizados para el control de este patógeno en las regiones cultivadoras de papa de Colombia, y se encontró una alta eficiencia de todos ellos, tanto para reducir el nivel de enfermedad como para inhibir la producción de esporangios del patógeno. Es de resaltar que en el trabajo no se encontró ningún aislamiento que pudiera calificarse como resistente a alguna de las moléculas químicas involucradas en este estudio. La utilización de estos productos en su formulación comercial, que, con excepción del Previcur® N SL, incluyen una molécula principal con características sistémicas y un fungicida acompañante, puede conducir a un efecto de enmascaramiento que dificulta la lectura de la acción directa de los fungicidas sistémicos.
Sin embargo, el empleo del producto comercial en estos estudios ofrece la ventaja de permitir una mejor aproximación a las condiciones reales bajo las cuales estos se utilizan en el campo, en comparación con estudios en los que se emplea el i.a. en grado técnico. Para el análisis de los resultados de este trabajo, es importante tener en cuenta que técnicamente no es posible realizar comparaciones entre los efectos de dosis similares a partir de diferentes fungicidas, debido a que cada uno de ellos presenta diferentes modos de acción y a que su formulación varía en las concentraciones de i.a.
Así por ejemplo, mientras que el Ridomil® Gold incluye un 4% de i.a. Metalaxyl-M y 64% de Mancozeb, el Curzate® M-8 es formulado como una mezcla de Cymoxanil (8%) y Mancozeb (64%); el Metalaxyl-M actúa sobre la síntesis de ARN ribosomal y el Cymoxanil es un fungicida con acción multisitio (Gisi y Cohen, 1996; Gullino et al., 1997). Los valores de EC50 encontrados para el Ridomil® Gold fueron muy bajos, pues en promedio, para los 15 aislamientos evaluados, alcanzaron un nivel de 0,62 mg·L-1, lo cual dista mucho del límite de 100 mg·L-1 definido por Sujkowsky et al. (1993) y Gisi y Cohen (1996) para calificar una cepa como resistente a moléculas fungicidas del grupo químico de las fenilaminas. El máximo valor de EC50 encontrado en este trabajo correspondió a 4,86 mg·L-1 para el aislamiento 8b, ubicándose en el nivel intermedio de sensibilidad de la escala propuesta por Sujkowsky et al. (1993).
La diferencia es aún mayor cuando se comparan los resultados de esta investigación con los reportados en otros trabajos realizados con este patógeno en Colombia. Así por ejemplo, Jaramillo et al. (2002) determinaron que cerca del 75% de los aislamientos colectados en el departamento de Antioquia en el 2001 resultaron insensibles al i.a. Metalaxyl; mientras que Lagos (2002), al evaluar 63 aislamientos procedentes del departamento de Nariño, encontró que el 24% de estos presentaban reacciones de resistencia en sus diferentes niveles (baja, alta, total). Sin embargo, estas comparaciones deben ser analizadas con detalle, ya que las metodologías de evaluación utilizadas y la fuente de la molécula química empleada fueron diferentes a las utilizadas en la presente investigación, pues en dichos trabajos se usó i.a. de la mezcla racémica de Metalaxyl (enantiomeros R y S) y lectura de la inhibición del crecimiento del Oomycete en medio de cultivo, mientras que en este estudio la fuente correspondió a una formulación comercial que incluye sólo el isómero puro R, comercialmente denominado Metalaxyl M y, además, contiene el fungicida protectante Mancozeb.
Cuando se hace la comparación de los resultados obtenidos en esta investigación con relación a los niveles de sensibilidad de P. infestans al Metalaxyl con estudios desarrollados en otros países como Costa Rica (Páez et al., 2001), Inglaterra (Gisi et al., 2002) y Estados Unidos (Deahl et al., 1995) —donde los niveles de resistencia oscilan entre el 40% y el 60% de los aislamientos evaluados—, se encuentra una gran diferencia, que posiblemente está asociada a las variaciones en las poblaciones del patógeno presente en dichas zonas caracterizadas por la ocurrencia de ambos tipos de apareamiento (A1 y A2), lo cual constituye un alto factor de riesgo de distribución del gen dominante asociado a la resistencia a Fenilaminas en Oomycetes vía reproducción sexual (Shattock, 1988).
Los bajos niveles de sensibilidad al Ridomil® Gold encontrados en la población de P. infestans evaluada en este estudio conducen a redoblar los esfuerzos para mantener este fungicida como herramienta de apoyo en los programas de manejo integrado de la gota de la papa en Colombia y, muy especialmente, a implementar las estrategias antirresistencia recomendadas por FRAC (2006) para el manejo de estos fungicidas, resumidas por Damicone (2004) en los siguientes aspectos: a) reducir la presión de selección mediante la utilización de prácticas culturales de control; b) utilizar mezclas de tanque o mezclas comerciales que incluyan fungicidas del tipo fenilaminas con productos protectantes multisitio en proporciones superiores al 75%; c) limitar el uso de estos fungicidas a 2-4 aplicaciones por ciclo de cultivo e intervalos mínimos de catorce días; d) utilizar fungicidas protectantes entre aplicaciones de fenilamidas; e) evitar el uso curativo o erradicante de dichos fungicidas, y f) no usar aplicaciones al suelo de fenilamidas dirigidas a patógenos aéreos.
Con respecto a la evaluación del Curzate® M-8, se observó un alto nivel de sensibilidad de la mayoría de aislamientos evaluados a este fungicida, nivel que incluso fue observable en dosis tan bajas como 0,1 y 0,3 mg·L-1. Esto se reflejó en los bajos valores de EC50 calculados para toda la población (promedio de 0,29 mg·L-1). Sin embargo, dos de los aislamientos (35c y 38c) demostraron cierta tolerancia a este producto, produciendo 1.500 y 2.500 esporangios/mL y niveles de enfermedad del 24% y del 13%, respectivamente, aún bajo la dosis máxima evaluada de 12 mg·L-1.
Cuando se comparan estos resultados con otros estudios realizados en el país, se encuentra que es frecuente este comportamiento de alta sensibilidad en aislamientos de P. infestans al Cymoxanil. Así, Lagos (2002) encontró que de 64 aislamientos de P. infestans colectados en Nariño, el 83% resultó sensible al i.a. Cymoxanil y ninguno alcanzó el nivel de calificación de resistentes (EC50 ≥10 mg·L-1). De igual forma, Ochoa (2004), al evaluar la sensibilidad de 50 aislamientos de P. infestans obtenidos en diferentes regiones de Colombia, encontró que ninguno de ellos tuvo la capacidad de crecer en medios de cultivo cuando se adicionó a este una concentración de i.a. de Cymoxanil de 0,8 mg·L-1.
Al comparar la efectividad antiesporulante de este producto con reportes de la literatura de otros países, no es posible encontrar referencias relacionadas con P. infestans, aunque sí con el Oomycete Plasmopara viticola, para el cual Gullino et al. (1997) encontraron que una alta proporción de los aislamientos italianos evaluados presentaba MIC superiores a 100 mg·L-1 de i.a. y que algunas poblaciones conservaron su capacidad de esporulación, aun bajo concentraciones de 250 mg·L-1, con lo cual fueron calificadas como resistentes a esta molécula química. Este reporte alerta sobre la posibilidad real de ocurrencia de poblaciones resistentes de Oomycetes al i.a. Cymoxanil, a pesar de que dicha molécula es calificada por la FRAC (2006) con un nivel de riesgo bajo. El que dos aislamientos evaluados en este trabajo presenten valores de EC50 superiores hasta ocho veces con respecto a la media encontrada en el resto de la población es un indicativo de la necesidad de continuar con el monitoreo y especialmente de establecer medidas que eviten la aparición de aislamientos con resistencia a este producto, reduciendo la utilización del Curzate® M-8 como un producto erradicante y alternando su aplicación con otros fungicidas sistémicos que presentan diferentes modos de acción (Gullino et al., 1997).
El fungicida Previcur® N SL resultó altamente efectivo para reducir los niveles de enfermedad y esporulación de los aislamientos evaluados, calculándose una media de EC50 de 0,71 mg·L-1 y observándose la inhibición completa de la esporulación en el 73,3% de los aislamientos con la dosis máxima (13 mg·L-1). El Previcur® N SL es un fungicida comúnmente utilizado para el control de patógenos Oomycetes del suelo y para el tratamiento de semilla y de material de propagación vegetativo en diversos cultivos de campo abierto e invernadero. Su utilización para el control de P. infestans en papa y tomate se viene incrementando en diferentes regiones del mundo, debido a la reducción en la efectividad de los fungicidas sistémicos tradicionalmente utilizados.
En Colombia es frecuente que los agricultores de papa recurran a su uso sólo cuando se presentan altos niveles de enfermedad y como última alternativa para el control del patógeno, de manera que su utilización se realiza como curativo y erradicante, lo que a mediano plazo puede conducir a un alto riesgo de selección de variantes resistentes a su i.a. Propamocarb. Esta situación ya se ha reportado en varias especies del Oomycete Pythium (Moorman et al., 2004), donde se encontraron aislamientos que exhibían niveles de EC50 que superaban los 1.000 mg·L-1, en comparación con las líneas base de sensibilidad que presentaban rangos de 0,5 a 10 mg·L-1 (Papavizas et al., 1978; Moorman et al., 2004), por lo que es importante ajustar las recomendaciones y mantener el monitoreo constante de las poblaciones a este fungicida.
Con referencia a lo encontrado en la evaluación del fungicida Mildex® 711 WG, se confirmó el potencial que presenta este producto como una herramienta de apoyo a los programas de manejo integrado de la gota de la papa, pues los valores de EC50 encontrados promediaron 0,54 mg·L-1 para los 15 aislamientos, con un estrecho rango de variación de 0,26 a 1,3 mg·L-1. Este fungicida fue también efectivo como antiesporulante, al inhibir completamente la germinación de 10 de los aislamientos bajo la dosis máxima evaluada (7 mg·L-1). Al comparar los resultados aquí obtenidos con trabajos anteriores de nuestro grupo de investigación con aislamientos colectados de diferentes procedencias geográficas y años de colección, se encuentra una gran similitud en los niveles de EC50. Así, por ejemplo, Argel et al. (2004) establecieron una línea base de sensibilidad al Fenamidone utilizando 31 aislamientos de P. infestans de todo el país y encontraron valores de EC50 que oscilaron entre 0,14 y 3,51 mg·L-1, con una media de 1,83 mg·L-1; mientras que Escudero (2005), al evaluar cuatro aislamientos de P. infestans de tres municipios de Antioquia, encontraron que los rangos de EC50 oscilaron entre 0,13 y 2,03 mg·L-1 y de 0,07 a 2,9 mg·L-1 cuando se empleó el i.a. Fenamidone en grado técnico y en su formulación comercial, respectivamente.
Es importante destacar que los resultados de estos trabajos contrastan drásticamente con aquellos definidos para P. infestans en Europa, que en promedio alcanzan valores de 9 mg·L-1 en Holanda (Mercer y Latorse, 2003) a 15 mg·L-1 en Francia, Alemania y Reino Unido (Latorse y González- Hilt, 2003) y se ubican a una distancia apreciable de la dosis de Fenamidone establecida como el límite para calificar a los Oomycetes con resistencia a dicho fungicida (50 mg·L-1) (Sirven y Beffa, 2003). Sin embargo, también vale la pena mencionar que la utilización masiva de este fungicida para el control de P. infestans en Colombia debe ser cuidadosamente analizada, ya que el Fenamidone, al hacer parte del grupo de fungicidas QoI, es una de las moléculas definidas por FRAC (2006) como de alto riesgo a seleccionar poblaciones de hongos y Oomycetes resistentes, debido a su modo de acción único y a la ocurrencia del fenómeno de resistencia cruzada con las estrobilurinas (Gisi et al., 2002).
El efecto detrimental que ocasiona el fenómeno de resistencia a fungicidas en el ambiente, la salud pública y la economía de las regiones agrícolas trasciende el ámbito de las compañías productoras de agroquímicos y constituye un problema social con profundos efectos tanto sobre las poblaciones rurales más vulnerables como sobre los consumidores concentrados en los centros urbanos, por lo cual se requiere la cooperación de entidades de investigación y organismos de control del Estado para el diseño de estrategias que eviten la selección de poblaciones resistentes. Esta investigación es un aporte a la implementación de sistemas de monitoreo continuo de los niveles de sensibilidad de las poblaciones de P. infestans a los principales productos fungicidas utilizados para su control. La metodología empleada ha sido probada en diferentes patosistemas (FRAC, 2007) y, aunque sus resultados pueden diferir con la ocurrencia de la resistencia en campo, son un indicativo del comportamiento que presentan las poblaciones de hongos y Oomycetes ante un fungicida en particular, lo que puede servir de sistema de alarma para conducir evaluaciones más certeras que identifiquen en forma temprana la presencia de aislamientos de P. infestans con pérdida de sensibilidad a fungicidas.
Agradecimientos
Esta investigación se realizó gracias al apoyo económico de la Vicerrectoría de Investigaciones de la Universidad Nacional de Colombia, a través del proyecto Quipú 20101005571. Para las colecciones de aislamientos se contó con el apoyo del personal técnico de Fedepapa, en los departamentos de Antioquia, Boyacá y Cundinamarca.
Literatura citada
Argel, L.E., S. Jaramillo, J.G. Morales, B. Jacqmin y E. Guzmán. 2004. Línea base de sensibilidad de Phytophthora infestans al fenamidone en Colombia. En: Memorias XXI Congreso de la Asociación Latinoamericana de la Papa (ALAP). 7-12 marzo de 2004. Valdivia. [ Links ]
Damicone, J. 2004. Fungicide resistance management. En: http:// pearl.agcomm.okstate.edu plantdiseases/f-766.htm; consulta: junio de 2007. [ Links ]
Davidse, L.C. 1995. Phenylamide fungicides: biochemical action and resistance. pp. 347-354. En: Lyr, H. (ed). Modern selective fungicides. 2nd edition. Gustav Fischer Verlag, Jena. [ Links ]
Deahl K.L, S.P. Demuth, S.L. Sinden y A. Rivera-Peña. 1995. Identification of mating types and metalaxyl resistance in North American populations of Phytophthora infestans. Amer. Potato J. 72, 35-49. [ Links ]
Duncan, J.M. 1999. Phytophthora an abiding threat to our crops. Microbiol. Today 26, 114-116. [ Links ]
EFSA. 2006. Conclusion regarding the peer review of the pesticide risk assessment of the active substance propamocarb. En: http://ec.europa.eu/food/plant/protection/evaluation/existactive; consulta: julio de 2007. [ Links ]
Erwin D.C. y O.K. Ribeiro. 1996. Phytophthora diseases worldwide. APS Press, St. Paul, Minnesota. 562 p. [ Links ]
Escudero, M. 2005. Secuencia parcial del gen citocromo b de Phytophthora infestans y su relación con la resistencia al fenamidone. Trabajo de grado. Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. 27 p. [ Links ]
Estrada, N. y S. Guzman. 1969. Herencia de la resistencia de campo al "tizón" (Phytophthora infestans Mont. de Bary) en variedades cultivadas de papa (subespecies tuberosas y andigena). Revista ICA 4, 117-137. [ Links ]
FRAC. 2006. QoI working group. En: http://www.frac.info; consulta: junio de 2007. [ Links ]
FRAC. 2007. FRAC monitoring methods. En: www.frac.info/frac/; consulta: junio de 2007. [ Links ]
Gisi, U. y Y. Cohen. 1996. Resistance to phenylamide fungicides: A case of study with Phytophthora infestans involving mating type and race structure. Annu. Rev. Phytopathol. 34, 549-572. [ Links ]
Gisi, U., H. Sierotzki, A. Cook y A. McCaffery. 2002. Mechanisms influencing the evolution of resistance to Qo inhibitor fungicides. Pestic. Mgt. Sci. 58, 859-867. [ Links ]
Gullino, M. L., E. Mescalchin y M. Mezzalama. 1997. Sensitivity to cymoxanil in populations of Plasmopara viticola in northern Italy. Plant Pathol. 46, 729-736. [ Links ]
Howard, R.J., M. Ferrari, J.L. Genet y M. Stidham. 2000. Biology of Curzate® action against Plasmopara viticola infection on grape. AFPP-Sixième Conférence Internationale sur les maladies des plantes. 6-8 de diciembre, 2000. Tours, Francia. [ Links ]
Jaramillo, S. 2004. Monografía sobre Phytophthora infestans (Mont.) de Bary. Universidad Nacional de Colombia, Medellín. 137 p. [ Links ]
Jaramillo, S., L.A. Gutiérrez, E. Gilchrist, L. Afanador y J.G. Morales. 2002. Sensibilidad de aislamientos de Phytophthora infestans (Mont) de Bary procedentes de diferentes zonas paperas colombianas a fungicidas sistémicos. Mimeografiado. Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Medellín. [ Links ]
Lagos, L.E. 2002. Aislamiento y caracterización genética de las poblaciones de Phytophthora infestans (Mont.) de Bary en las zonas productoras de papa Solanum tuberosum L. en el departamento de Nariño. Tesis de maestría, Facultad de Ciencias, Universidad del Valle, Cali. 78 p. [ Links ]
Latorse, M. y H. González. 2003. Sensitivity base line and resistance monitoring on Plasmopara viticola and Phytophthora infestans. Pflanzenschutz Nachrichten Bayer 56, 511-522. [ Links ]
Leroux, P., K. Chabane y G. Bompeix. 1993. Selection and characterization of Phytophthora parasitica mutants with ultraviolet- induced resistance to dimethomorph or metalaxyl. Pestic. Sci. 39, 325-329. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2006. Observatorio agrocadenas Colombia. Documento de trabajo No. 100. En: http://www.agrocadenas.gov.co; consulta: junio de 2007. [ Links ]
Mercer, R.T. y M.P. Latorse. 2003. Fungicidal properties of the active ingredient fenamidone. Pflanzenschutz Nachrichten Bayer 56, 465-476. [ Links ]
Moorman, G., S. Kang, D. Geiser, y S. Kim. 2004. Identification and characterization of Pythium species associated with greenhouse f loral crops in Pennsylvania. Plant Dis. 86, 1227-1231. [ Links ]
Ochoa, D. 2004. Determinación de la sensibilidad en aislamientos colombianos de Phytophthora infestans hacia Cymoxanil, Dimetomorf y Clorotalonil. Trabajo de grado. Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá. [ Links ]
Páez, O., R. Valverde, L. Gómez y A. Brenes. 2001. Resistencia de aislamientos de Phytophthora infestans al metalaxyl en el cultivo de la papa en Costa Rica. Agronomía Costarricense 25, 33-44. [ Links ]
Papavizas, G.C., N.R. O' Neill y J.A. Lewis. 1978. Fungistatic activity of propyl-N-(alphadimethylaminopropyl) carbamate on Pythium spp. and its reversal by sterols. Phytopathol. 68, 1667-1671. [ Links ]
Power, R., R. Hamlen y A. Morehart. 1995. A variation in sensitivity of Phytophthora infestans field isolates to cymoxanil, chlorothalonil and metalaxyl. pp. 154-159. En: Dowley L.J., E. Annon, R.L. Cooke, T. Keane y E. O'Sullivan (eds). Phytophthora infestans 150. Boole Press, Dublin. [ Links ]
Rich, A.E. 1983. Potato diseases. Academic Press, Nueva York. 228 p. [ Links ]
Shattock, R.C. 1988. Studies on the inheritance of resistance to metalaxyl in Phytophthora infestans. Plant Pathol. 37, 4-11. [ Links ]
Sirven, C. y R. Beffa. 2003. Resistence to fenamidone: Monitoring by real-time quantitative PCR on Plasmopara viticola. Pflanzenschutz Nachrichten Bayer 56, 523-532. [ Links ]
Sujkowski, L.S., B.A. Fry, R.J. Power, S.B. Goodwin, T.L. Peever, C.D., D.I. Therrien, Ritch, L.S. Sujkowski, L.J. Spielman y W.E. Fry. 1993. Phytophthora infestans in Poland from 1987-1989; nuclear DNA content, mating type distribution and response to metalaxyl. J. Phytopathol. 139, 68-80. [ Links ]














