Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.26 no.1 Bogotá Jan./June 2008
Nancy Eunice Niño1, Germán Arbeláez2 y Rafael Navarro3
1 Programa de Maestría en Ciencias Agrarias con énfasis en Fitopatología, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. nancy.eunice@utadeo.edu.co
2 Profesor titular, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. garbelaezt@unal.edu.co
3 Docente asociado, Universidad Católica de Oriente, Río Negro, Antioquia. rnavarro@uco.edu.co
Fecha de recepción: noviembre 8 de 2007. Aceptado para publicación: abril 9 de 2008
RESUMEN
Este estudio se realizó en el Centro de Investigaciones y Asesorías Agroindustriales de la Universidad de Bogotá Jorge Tadeo Lozano, Chía (Cundinamarca), bajo condiciones de invernadero, durante diez meses de cultivo. Se evaluó el efecto de diferentes densidades poblacionales de Meloidogyne hapla (0, 50, 100, 200, 500 y 1.000 larvas J2/100 cc de suelo), sobre parámetros productivos de la uchuva: altura de las plantas, diámetro de tallo, peso fresco, peso seco y biomasa de follaje, peso fresco de raíces, índice de nodulación radicular y peso fresco de frutos. Se hizo análisis de varianza, pruebas de contrastes y prueba de Tukey (α=0,05), en un diseño completamente aleatorio, con seis tratamientos y cinco repeticiones, mediante el programa SAS v.8.0. El tratamiento de 500 larvas J2/100 cc suelo fue el que más afectó la altura de las plantas, el diámetro del tallo, la biomasa de follaje, el peso fresco de raíces y presentó el índice de nodulación radical más alto. No se encontraron diferencias significativas entre los tratamientos inoculados con M. hapla, para peso fresco, peso seco de follaje y peso fresco de frutos, ni para el número de larvas J2 en suelo y masas de huevos. Mediante la ecuación: Y = m + (1-m)ZP-T propuesta por Seinhorst (1965), se estableció un límite de tolerancia de 50 larvas J2 de M. hapla/100 cc suelo, para peso fresco de raíces y un límite de tolerancia de 450 larvas J2 de M. hapla/100 cc suelo, para biomasa de follaje.
Palabras clave: inoculación, ciclo de vida, límite de tolerancia, nematodo de nudo.
ABSTRACT
A trial was conducted at the Center of Investigations and Agroindustrial Accessory of the University Jorge Tadeo Lozano, Chía (Cundinamarca) under greenhouse condition during ten months of cultivation. The effect of different population densities of M. hapla (0, 50, 100, 200, 500 and 1,000 larvae J2/100 cc soil) on productive parameters of the cape gooseberry, such as plant height, stem diameter, fresh and dry weights of leaves, fresh weight of roots, root nodulation index and weight of fruits in four harvests were evaluated. A variance analysis, contrasts test and Tukey test, within a randomized design with six treatments, and five repetitions was done within SAS v.8.0 program. It was determined that a treatment 500 larvae J2/100 cc soil had the highest effect on the plant height, stem diameter, leaf biomass and fresh weight of roots, besides it showed the highest root nodulation index. There were no significant differences found among the treatments for fresh weight and dry weight of leaves and fruits weight. For J2 larvae’s number in soil and eggs mass, the differences among the treatments inoculated with M. hapla were not found. A tolerance limit of 50 larvas J2/l00 cc soil was derived from fitting the data of root fresh weight and a tolerance limit of 450 larvas J2/l00 cc soil from data of biomass using the equation Y=m+(1-m)ZP-T proposed by Seinhorst (1965).
Key words: inoculation, life cycle, tolerance limit, root knot nematode.
Introducción
La uchuva (Physalis peruviana L.) es una planta herbácea que ha sido considerada por mucho tiempo como maleza; sin embargo, en la actualidad es una especie frutícola exótica, apetecida en el mercado internacional, por sus propiedades nutricionales y medicinales. Esta planta pertenece al orden Tubiflorales, familia Solanaceae y es originaria de la zona andina. El nombre científico del género viene de la raíz griega physa, que significa vejiga o ampolla, y la especie es en honor al Perú, su país de origen. En Colombia, la palabra uchuva se deriva del vocablo indígena ucuva, que significa fruto. En inglés se le conoce como cape gooseberry, golden berry, andean cherry o ground cherry, y en Ecuador se le conoce como uvilla. La uchuva además se cultiva en menor escala en otros países como Australia, Nueva Zelanda, Kenia, Sudáfrica e Inglaterra (Angulo, 2003; Fischer, 2000).
En Colombia, a finales de la década del ochenta, se introdujeron al departamento de Boyacá dos ecotipos africanos, procedentes de Kenia y Sudáfrica, los cuales se diferencian del ecotipo Colombia por su tamaño, color y forma del cáliz (Fischer, 2000; Chaparro et al., 2005). Los estudios dedicados a la propagación de esta planta aún no son bien conocidos, por ello, no se ha logrado la unificación de conceptos y criterios técnicos para el mejoramiento genético del fruto que logre la aceptación nacional y la calidad para exportación (Almanza, 2000).
A partir de los años noventa, Colombia se convirtió en uno de los mayores productores de uchuva, con un incremento del área cultivada en los departamentos de Cundinamarca, Boyacá y Antioquia, principalmente. Además, este cultivo se ha convertido en una excelente alternativa agrícola y en una importante fuente de ingresos para los agricultores. Sin embargo, con el auge del cultivo y su explotación intensiva, se han incrementado los problemas fitosanitarios que disminuyen el rendimiento y la calidad del producto (Angulo, 2005). Según datos de Proexport (2007), en los últimos cuatro años las exportaciones de uchuva se han incrementado, hasta alcanzar en 2005 un total de ingresos por US$ 23.841.328, correspondientes a 6.421.664 t de fruta, con lo que se superó el total anual exportado en el año 2004. De acuerdo con las cifras de exportaciones totales anuales, Colombia es considerado uno de los países exportadores de uchuva más importantes en el mundo, por su exquisita calidad, por encima de Sudáfrica, Kenia, Zimbabwe y varios países americanos (Angulo, 2005).
La uchuva requiere de un manejo tecnificado para cumplir con las exigencias de los mercados internacionales; sin embargo, por ser relativamente reciente, aspectos como su fisiología, sus requerimientos nutricionales e hídricos y sus problemas fitosanitarios no han sido estudiados debidamente con fundamento científico. Debido a esto, el CIAA de la Universidad Jorge Tadeo Lozano (UJTL) ha venido desarrollando proyectos de investigación que llenen estos vacíos (Angulo, 2005). De acuerdo con los primeros resultados de este estudio en cultivos de uchuva de la Sabana de Bogotá y en Miraflores (Boyacá), entre los años 2001 y 2003, se encontró que los géneros Meloidogyne, Pratylenchus y Rotylenchus estaban asociados a este cultivo, siendo Meloidogyne el nematodo más importante. Así mismo, se encontró Meloidogyne formando asociaciones con otros patógenos de suelo y ocasionando síntomas más severos en los cultivos. Por ejemplo, plantas de uchuva afectadas por este parásito, que presentaban infección por hongos fitopatógenos como Fusarium oxysporum o por bacterias vasculares como Ralstonia solanacearum, debido a que la presencia de este parásito puede incrementar la susceptibilidad de las plantas a patógenos de suelo (Angulo, 2003 y 2005).
Según Castillo (2002), en el municipio de Silvania, Cundinamarca (zona de mayor producción de uchuva en el país), se dedujo que el nematodo del nudo radical afecta la producción en uchuva y, en particular, la especie M. hapla, sin ser el patógeno primordial, disminuye notablemente el número de frutos por planta y el tamaño de estos, aparte de incidir severamente en otras enfermedades. Así mismo, Góngora y Rojas (2006) reportan que en la mayoría de las zonas productoras de uchuva en Cundinamarca algunas enfermedades causadas por hongos, bacterias y nematodos del género Meloidogyne disminuyen la productividad del cultivo.
Teniendo en cuenta lo anterior y que además en Colombia existen pocos trabajos en lo referente al diagnóstico, monitoreo y control de ese parásito en este cultivo, la presente investigación tuvo como objetivo determinar el efecto de diferentes densidades poblacionales iniciales de M. hapla sobre parámetros productivos de la uchuva (altura de las plantas, diámetro de tallo, peso fresco, peso seco y biomasa de follaje; peso fresco de raíces, índice de nodulación radicular y peso fresco de frutos), así como establecer el límite de tolerancia de uchuva para este parásito, bajo condiciones controladas de invernadero en la Sabana de Bogotá.
Materiales y métodos
El trabajo se realizó en el cuarto número 3 del invernadero del área de control biológico del CIAA, el cual cuenta con un área aproximada de 10 m2 de piso en cemento y una temperatura promedio de 26 °C. Se utilizaron plantas de uchuva (P. peruviana, ecotipo Colombia), obtenidas a partir de semillas sexuales de plantas de producción, provenientes del CIAA, que se germinaron bajo condiciones controladas y se mantuvieron en semillero durante siete semanas, donde se seleccionaron plantas de tamaño uniforme de una altura promedio de 15 cm.
Para la inoculación se utilizaron estados J2 M. hapla, obtenidos a partir de raíces de plantas de uchuva infectadas previamente por esta especie y de las cuales se tomaron agallas, donde se seleccionaron masas de huevos en estado avanzado de desarrollo, para hacer su extracción por el método de incubación modificado de Shurtleff y Averre (2005).
Se empleó suelo proveniente del CIAA, el cual se esterilizó en autoclave a 15 libras de presión por 20 min; posteriormente, se mezcló con cascarilla de arroz en proporción de 3:1, con el fin de mejorar su estructura física. Se utilizaron bolsas plásticas calibre 4, de 55 cm de diámetro x 80 cm de alto y, en cada bolsa, se colocaron 25 kg de sustrato y se sembró una plántula de uchuva.
Los tratamientos a evaluar con los niveles de población inicial (J2) fueron los siguientes:
T0: 0 larvas (testigo)
T1: 50 larvas (J2) x 100 cc de suelo
T2: 100 larvas (J2 ) x 100 cc de suelo
T3: 200 larvas (J2) x 100 cc de suelo
T4: 500 larvas (J2) x 100 cc de suelo
T5: 1.000 larvas (J2) x 100 cc de suelo
Para calcular el número de larvas J2 a inocular por bolsa, se utilizó la siguiente fórmula:
donde: C1= concentración inicial de larvas J2; V1= suspensión de larvas J2 eclosionadas en laboratorio; C2= concentración planteada en los tratamientos; V2= volumen de suelo a inocular.
La inoculación de larvas J2 se hizo ocho días después del transplante y para aplicar el inóculo, se utilizó una pala, se sacó cada planta, luego se mezcló el suelo con el inóculo y finalmente, se volvió a sembrar la planta. Una vez inoculadas, las plantas se mantuvieron bajo condiciones de invernadero, a una temperatura máxima de 27 C y mínima de 11,6 C. Se colocaron sobre una base de listones de madera levantados con ladrillos, con el fin de que no hubiera contacto con el suelo, ni contaminación entre plantas. En el invernadero se colocó un termómetro de máximas y mínimas, para registrar la temperatura diaria durante el experimento.
El experimento tuvo una duración de 10 meses, durante los cuales se hicieron todas las labores de mantenimiento de las plantas, fertilización, podas y control de plagas de follaje, según Fischer (2000) y Angulo (2003 y 2005). Además se hicieron monitoreos semanales, para detectar la presencia de plagas y enfermedades de follaje y además hacer un manejo adecuado de la sanidad de las plantas durante el experimento.
Evaluación de parte aérea
• Evaluación de altura de las plantas. Se tomaron medidas de altura, cada 15 días, a todas las plantas, desde la base del tallo hasta el extremo superior de la última rama.
• Evaluación de diámetro de las plantas. Al final del experimento y con la ayuda de un calibrador se tomó la medida del diámetro de la base del tallo en cada una de las plantas.
• Evaluación de peso fresco y peso seco de follaje. Se pesó cada planta al final del experimento, en una balanza analítica marca Sartorius BL500, para obtener el peso fresco; luego, estas se colocaron en bandejas metálicas y se llevaron a un horno secador a una temperatura de 70 °C, por 72 h, para obtener finalmente su peso seco.
• Evaluación de frutos. Se evaluaron cuatro cosechas (al 4°, 6°, 8° y 10° mes), de las que se tomaron medidas de peso fresco y número de frutos en cada una de las plantas, para comparar la producción obtenida en cada tratamiento.
Evaluación de suelo y raíces
• Extracción de nematodos del suelo. Al final del experimento, se tomó un kilogramo de suelo por planta, para su posterior procesamiento en laboratorio, donde se procedió a hacer la extracción de nematodos empleando el método de Bearmann modificado (Volcy, 1998). Para cada muestra se realizaron tres réplicas.
• Evaluación de peso fresco de raíz. Al final del experimento, las raíces fueron lavadas, para eliminar los residuos de suelo, y luego secadas con toallas de papel absorbente, con el fin de eliminar el exceso de agua. Finalmente, cada una de las raíces fue pesada en una balanza digital Sartorios BL500, con una precisión de décimas de gramo.
• Evaluación de índice de nudosidad. Para determinar el grado de infección se utilizó la escala de Bridge y Page (1980), citado por Volcy (1998), la cual considera valores de 0 a 10: 0= raíces sanas, 1-4= agallas sobre raíces secundarias solamente, 5-10= agallas sobre raíces laterales (5, 50% de raíces con agallas y 10, máxima infección). Esta escala es recomendada por su fácil manejo en campo.
• Evaluación del número de nudos y masas de huevos. Para cada una de las plantas en todos los tratamientos se tomaron submuestras de un gramo de raíz, con tres repeticiones, en las que se contó el número promedio de nudos y de masas de huevos.
• Diseño experimental. Se estableció un diseño completamente aleatorio, con seis tratamientos y cinco repeticiones. Para evaluar el efecto de poblaciones iniciales de M. hapla sobre cada uno de los parámetros, se hizo análisis de varianza, pruebas de comparación de Tukey (α=0,05) y prueba de contrastes, mediante el programa SAS v. 8.0. Para relacionar el peso de fresco de raíces, biomasa, altura de las plantas y peso fresco de frutos tomados durante el experimento, con las densidades poblacionales iniciales M. hapla, se utilizó el programa Seinfit, Version Maquintosh (Viaene et al., 1997), el cual, mediante la ecuación de Seinhorst (1965), calcula el límite de tolerancia para cada parámetro. Esta ecuación es una de las mejores formas de relacionar el efecto de diferentes densidades iniciales de nematodos, con el crecimiento de las plantas.
Resultados
Evaluación de la parte aérea.
Efecto sobre la altura de las plantas
En el análisis de varianza para la variable altura de plantas, de acuerdo con la Diferencia Honesta Significativa (DHS) de Tukey (α= 0,05), a los 15 y 30 días después de la inoculación, la población de 100 larvas J2 de M. hapla presentó diferencias significativas con respecto al testigo, mientras que las demás poblaciones presentaron un comportamiento similar a los testigos no inoculados. Durante los 45 y 245 días después de inoculación, no se presentaron diferencias entre los tratamientos, para esta variable. A partir de los 270 días después de la inoculación, el testigo mostró diferencias significativas frente a los tratamientos de 500 y 1.000 larvas J2 de M. hapla/100 cc de suelo, al presentar los promedios de altura más bajos, mientras que los tratamientos de 50, 100 y 200 larvas J2 fueron similares entre sí y superados en el valor promedio por los testigos no inoculados.
De acuerdo con el análisis de regresión cuadrática simple, para la variable altura de plantas, los tratamientos de 100, 200, 500 y 1.000 larvas J2 de M. hapla/100 cc de suelo presentaron un comportamiento similar, con valores de altura más bajos que los testigos, mientras que el tratamiento de 50 larvas J2 de M. hapla/100 cc de suelo presentó valores de altura mayores (figura 1).
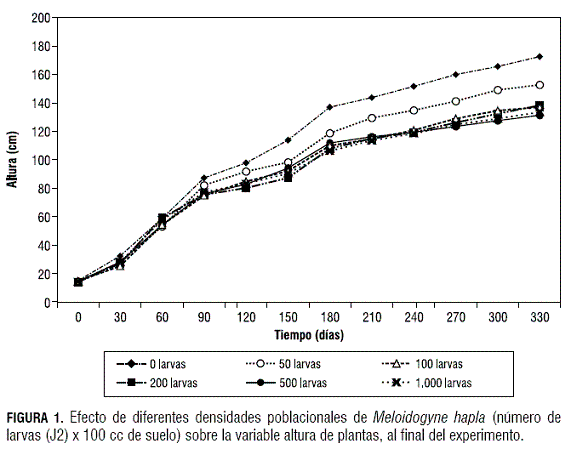
En el análisis de contrastes para el parámetro altura de plantas, el testigo (α= 0,05) y (P>F=<0,0001, F=20,17) presentó diferencias significativas con respecto a los demás tratamientos; así mismo, el tratamiento de 50 larvas J2 de M. hapla/100 cc de suelo (α= 0,05) y (P>F 0,0299, F=4,73) presentó diferencias significativas con respecto a los tratamientos de 100, 200, 500 y 1.000 larvas J2 de M. hapla/100 cc de suelo.
Entre los tratamientos de 100, 200, 500 y 1.000 larvas de M. hapla/100 cc de suelo no se presentaron diferencias significativas, ya que en la prueba de contrastes entre estos tratamientos se obtuvieron valores de probabilidad (P) mayores a 0,9 con α= 0,05.
Efecto sobre el diámetro de tallo
En cuanto al diámetro del tallo principal de las plantas, de acuerdo con la prueba de Tukey (α= 0,05), no se presentaron diferencias significativas entre el testigo y los tratamientos de 50, 100, 200 y 1.000 larvas J2 de M. hapla/100 cc de suelo. El tratamiento de 500 larvas J2 de M. hapla/100 cc de suelo presentó diferencias significativas con respecto al testigo, con un valor de diámetro de tallo de 1,624 cm, mientras que el valor del testigo fue de 2,068 cm (tabla 1).
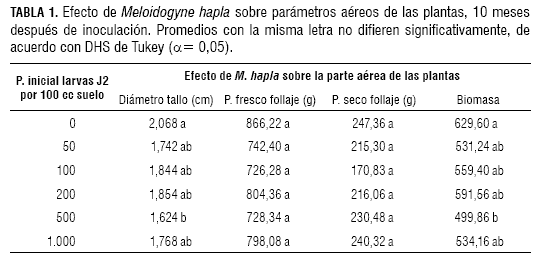
Efecto sobre el peso fresco de follaje
Para el parámetro peso fresco del follaje, de acuerdo con el análisis de varianza (α= 0,05; P>F= 0,056 y F= 2,54), no se presentaron diferencias significativas entre tratamientos.
Efecto sobre el peso seco de follaje
Según el análisis de varianza, para el peso seco de follaje, con un (α= 0,05) y (P>F 0,1314; F= 1,90), no se presentaron diferencias significativas entre tratamientos.
Evaluación de biomasa de follaje
En cuanto a biomasa de follaje, de acuerdo con la prueba de Tukey (α= 0,05), se presentaron diferencias significativas entre el tratamiento de 500 larvas J2 de M. hapla/100 cc suelo y los demás tratamientos, ya que este presentó el valor de biomasa más bajo (499,8 g). Así mismo, los tratamientos de 50, 100, 200 y 1.000 larvas J2 de M. hapla/100 cc no presentaron diferencias entre sí y fueron diferentes al testigo y al tratamiento de 500 larvas J2 de M. hapla/100 cc de suelo (tabla 1).
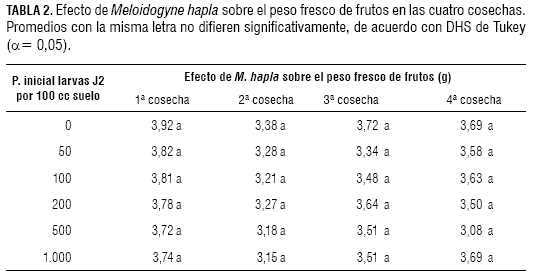
Evaluación de peso fresco de frutos en las cuatro cosechas
De acuerdo con la prueba de Tukey (α= 0,05), en las cuatro cosechas no se presentaron diferencias significativas en el peso fresco de frutos entre tratamientos (tabla 2).
Evaluación de número de frutos en tercera cosecha
Para el número de frutos en la tercera cosecha, según el análisis de varianza con (α= 0,05, P>F 0,4728; F= 0,94), no se encontraron diferencias significativas entre los tratamientos evaluados (tabla 3).
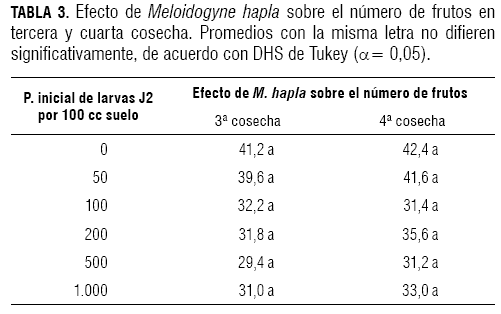
Evaluación de número de frutos en cuarta cosecha
Para el número de frutos en la cuarta cosecha, según la prueba de Tukey (α= 0,05, P>F 0,7083; F= 0,59), tampoco se presentaron diferencias significativas entre los tratamientos (tabla 3).
Evaluación de poblaciones de larvas J2 de M. hapla en suelo
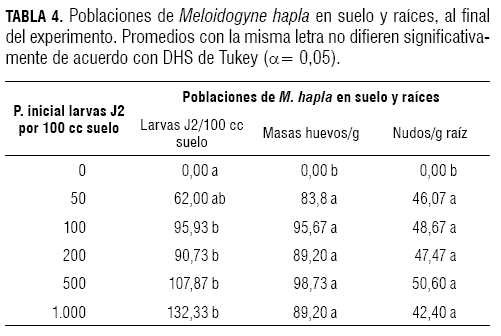
En cuanto a la población de larvas J2 de M. hapla en suelo, de acuerdo con la prueba de Tukey (α= 0,05), no se presentaron diferencias significativas entre el grupo de tratamientos de 100, 200, 500 y 1.000 larvas J2 y, a su vez, estos fueron diferentes del testigo y del tratamiento de 50 larvas J2 100 cc/suelo, el cual presentó el valor promedio más bajo (62 larvas J2) (tabla 4).
Evaluación del índice de nodusidad radical (INR)
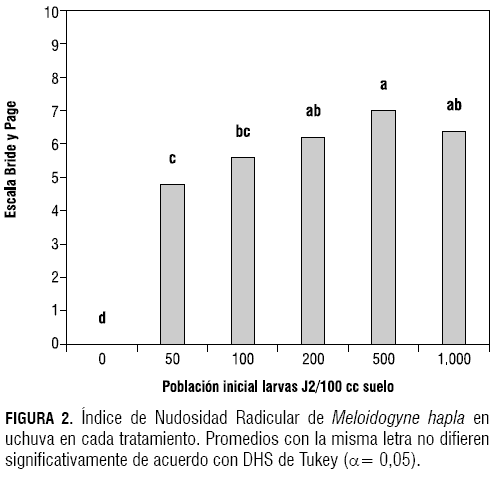
Según la prueba de Tukey (α= 0,05), el testigo presentó diferencias significativas respecto a los demás tratamientos. Los tratamientos de 100, 200 y 1.000 larvas J2 de M. hapla/100 cc no presentaron diferencias entre sí en el valor del índice de nudosidad radicular, pero estas sí fueron significativas entre los tratamientos de 50 y 500 larvas J2 de M. hapla. El índice de nudosidad radicular más alto lo presentó el tratamiento de 500 larvas J2, con un valor de 7 en la escala de Bridge y Page (1980), citado por Volcy (1998) (figura 2).
Evaluación de número de nudos en raíces
En el análisis de varianza, con (α= 0,05, P>F <0,0001; F= 65,73), en cuanto al número total de nudos/g de raíz, el testigo presentó diferencias significativas con los tratamientos de 50, 100, 200, 500 y 1.000 larvas J2 de M. hapla, los cuales presentaron valores similares entre sí para este parámetro (tabla 4).
Evaluación de número de masas de huevos de M. hapla en raíces
En cuanto al número de masas de huevos de M. hapla por gramo de raíces, el testigo presentó diferencias significativas con los tratamientos de 50, 100, 200, 500 y 1.000 larvas J2 de M. hapla, los cuales presentaron valores similares entre sí para este parámetro, de acuerdo al análisis de varianza (α= 0,05, P>F= <0,0001; F= 24,28) (tabla 4).
Evaluación de peso fresco de raíz
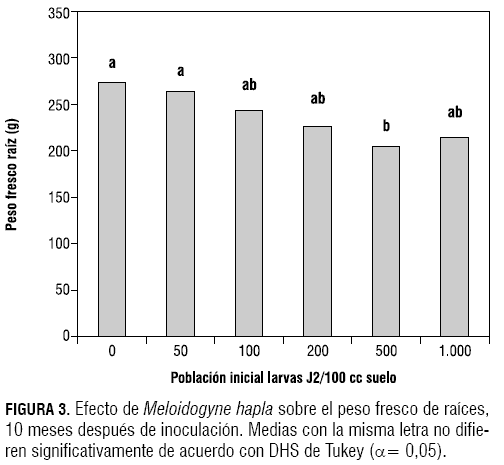
En cuanto al peso fresco de raíces, de acuerdo con la prueba de Tukey (α= 0,05), los tratamientos testigo y el inoculado con 50 larvas J2 de M. hapla/100 cc de suelo no presentaron diferencias significativas entre sí y fueron diferentes de los demás. Los tratamientos de 100, 200 y 1.000 larvas J2 presentaron valores similares para este parámetro. Finalmente, el tratamiento inoculado con 500 larvas J2 presentó el valor promedio más bajo de todos los tratamientos (204,94 g) (figura 3).
Relación entre las poblaciones iniciales de M. hapla y altura de las plantas
Empleando el programa Seinfit (Viaene et al., 1997), se hizo el mismo análisis anterior, con los datos de altura tomados cada mes y con los datos de peso fresco de frutos en las cuatro cosechas, pero en todos los casos se obtuvo un límite de tolerancia igual a cero (0), es decir, que las diferentes densidades de M. hapla inoculadas en plantas de uchuva, durante los diez meses de evaluación, no presentaron efectos notables sobre estos parámetros.
Relación entre las poblaciones iniciales de M. hapla y el peso fresco de raíces
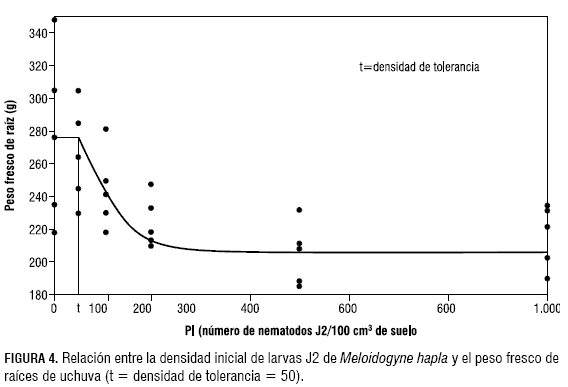
Con base en los datos de peso fresco de raíces tomados al final del experimento y empleando el programa Seinfit (Viaene et al., 1997), se logró determinar la ecuación de Seinhorst, donde se relacionan las densidades poblacionales iniciales de M. hapla con el desarrollo de las plantas.
Partiendo de la ecuación de Seinhorst, donde Y= m + (1 - m)ZP-T, y con los datos de peso fresco de raíces se obtuvo la siguiente ecuación:
Y = 206.299 + 69.666 + 0,985844^(x-50) para x > 50 donde:
X < 50 = Ym = 275.967
z = 0,985844
m = 0,7475
t = 50
r2= 0,86
De acuerdo con esta ecuación, se obtuvo un rendimiento en peso de raíz de 0,7475 y un límite de tolerancia de 50 larvas J2 de M. hapla, con un coeficiente de correlación del 86%, es decir que la presencia de poblaciones menores o iguales a este valor no tienen un efecto notable en el peso fresco de raíces y, por ende, en el desarrollo de las plantas (figura 4).
Relación entre las poblaciones iniciales de M. hapla y biomasa de follaje
Para biomasa de follaje, según el análisis estadístico, se presentaron diferencias significativas (α=0,05, P>F= 0,0466; F= 2,67) entre la población inicial de 500 larvas J2 de M. hapla/100 cc y los testigos. A partir de la ecuación de Seinhorst, se obtuvo la siguiente:
Y= 0 + 3,323 x 0,999 (x-450) para x >450 donde:
Ym = 3,32308 (rendimiento)
z = 0,999
m = 0
t = 450
r2 = 0,63
De acuerdo con esta ecuación, se obtuvo un rendimiento en peso de raíz de 3,323 y un límite de tolerancia de 450 larvas J2 de M. hapla/100 cc suelo, con un coeficiente de correlación del 0,63%, es decir que, a partir de esta población, se comienza a ver efecto en la biomasa de follaje (figura 5).
Discusión
En la evaluación del efecto de altura de plantas, en los primeros meses no se observaron diferencias significativas entre los tratamientos. Gaviria (1999) atribuye este efecto a que fisiológicamente las plantas absorben mayor cantidad de agua y aumentan su elongación, como respuesta inicial al ataque de nematodos. Después de siete meses de inoculación, se observó un efecto negativo sobre la altura de las plantas en los tratamientos de 100, 200, 500 y 1.000 larvas J2 de M. hapla/100 cc de suelo. Al final del experimento, el tratamiento 500 (500 larvas J2/100 cc de suelo) fue el que más afectó la altura de las plantas; lo anterior se puede explicar, dado que la infección de Meloidogyne en raíces tiene efectos importantes en la fisiología de la planta y afecta principalmente la tasa fotosintética, así como la toma de nutrientes y, por tanto, su normal crecimiento y desarrollo (Volcy, 1998). Esto además coincide con los reportes de Silva (1994), donde, después de 90 días de inoculación con 5.000 huevos de M. hapla, en 20 variedades de pompón, se encontró un efecto estadísticamente significativo sobre altura de las plantas, en variedades susceptibles y medianamente susceptibles.
En cuanto a peso fresco y peso seco del follaje, a pesar de que estos tendieron a disminuir a medida que se aumentaban las poblaciones iniciales de M. hapla, con respecto alos testigos, estadísticamente no se encontraron diferencias significativas entre los tratamientos evaluados. Así mismo, en una investigación similar llevada a cabo por Chan y López (1992), donde se inocularon diferentes densidades poblacionales de M. incognita en tomate, no se encontraron diferencias significativas entre tratamientos para el peso fresco del follaje, lo cual puede indicar que este parámetro no es determinante en la evaluación del efecto de nematodos en plantas de uchuva.
Para biomasa de follaje la población inicial de 500 larvas J2/100 cc suelo presentó diferencias significativas con el testigo, lo cual además se pudo calcular mediante la ecuación de Seinhorst, donde se obtuvo un límite de tolerancia aproximado de 450 larvas J2/100 cc suelo, con un coeficiente de correlación del 62%, por tanto, se puede concluir que, a partir de esta población, el parámetro de biomasa comienza a verse afectado.
Al final del experimento, para la población final de larvas J2 de M. hapla en suelo, estadísticamente no se encontraron diferencias significativas entre los tratamientos 100, 200, 500 y 1.000, debido en parte a que los huevos de Meloidogyne no eclosionan simultáneamente y porque, al tener hábito endoparásito, pasa la mayor parte de su ciclo dentro de raíces, esto según lo reportado por Taylor y Sasser (1983), Eisenback (1985); Eisenback y Triantaphyllou (1990).
En cuanto al peso de frutos, en las cuatro cosechas evaluadas, no se presentaron diferencias significativas entre tratamientos, así mismo, para el número de frutos en la tercera y cuarta cosecha, aunque se observó una tendencia a disminuir su número, a medida que aumentaban las poblaciones iniciales de M. hapla, estadísticamente no presentaron diferencias significativas. En forma similar, estudios realizados en cultivos de kiwi (Actinidia deliciosa) por Magunacelaya y Monsalves (1994) no encontraron relación entre las producciones de frutos de las plantas estudiadas, con diferentes niveles poblacionales de M. hapla, ya que con un adecuado manejo agronómico de las plantaciones, sin la aplicación de nematicidas, para su control, se obtenía buenos rendimientos en cosecha.
Es importante anotar, que debido a la gran variación en tamaño y en forma de los frutos de uchuva dentro de una misma planta, de acuerdo con Fischer (2000), dado que aún presenta características silvestres, por tanto, no se logró evaluar con precisión el efecto del nematodo sobre este parámetro.
El peso fresco de raíces presentó una tendencia a disminuir a medida que se aumentaba la población inicial de larvas J2 de M. hapla, sin embargo, el tratamiento 500 (500 larvas J2/100 cc de suelo) fue el que más afectó el peso fresco de raíces. Esto coincide con los resultados obtenidos por Chan y López (1992), donde plantas de tomate inoculadas con M. incognita afectaron en forma significativa el peso de raíces en poblaciones iniciales de 100, 200, 400, 1.200 y 1.900 huevos/100 cc de suelo, además el tratamiento inoculado con 400 huevos/100 cc de suelo fue el que presentó el menor peso de raíz. Lo observado en esta investigación además es soportado con los resultados de Silva (1994), donde el peso de raíces de pompón también resultó ser el mejor indicativo del efecto de M. hapla en la susceptibilidad de las plantas, ya que cuando aumentaban las poblaciones se disminuía el peso de raíces, con una correlación altamente negativa, en variedades susceptibles.
Según la ecuación de Seinhorst, para el peso fresco de raíces de uchuva, se determinó un límite de tolerancia de 50 larvas J2 de Meloidogyne hapla y un rendimiento en el peso de raíz de 0,7475; en un estudio similar realizado por Chan y López (1992), obtuvo un rendimiento de 0,75 y un límite de tolerancia de 200 larvas J2 de M. incognita en cultivo de tomate, donde además estos autores citan reportes de Olthof y Potter (1977) y Chiodo y Khan (1988), quienes mencionan la necesidad de aplicar algún método de control con poblaciones iniciales de 100 y 200 J2/100 cc de suelo de M. incognita y M. hapla, respectivamente, ya que a partir de estas poblaciones la producción disminuía notoriamente.
El tratamiento de mayor densidad poblacional, inoculado con 1.000 larvas J2/100 cc de suelo, no tuvo el mayor efecto negativo de las plantas, ya que presentó un comportamiento similar a los tratamientos de 100, 200 y 500 larvas J2 de M. hapla/100 cc suelo, como se esperaba, lo cual se puede atribuir a que en poblaciones muy altas, por competencia en la invasión y por sitios de alimentación, puede ocurrir mortalidad de individuos y, de esta forma, haya reducción en su multiplicación; esto de acuerdo a estudios de nematodos sedentarios realizados por Jones y Perry, citado por Trudgill y Phillips (1997).
Con base en los resultados y teniendo en cuenta lo anterior, se podría plantear una estrategia de manejo de M. hapla en cultivos de uchuva; aunque lo ideal es un manejo preventivo, donde no se tuvieran estados infectivos antes de la siembra; si se parte de poblaciones iniciales menores de 50 larvas J2/100 cc de suelo, según lo sugerido por Oostenbrink (1971) y Gaviria (1999), por debajo del límite de tolerancia, se puede hacer algún tipo de control biológico -con hongos nematófagos o extractos vegetales- con el cual se puedan controlar poblaciones bajas; si se parte de poblaciones mayores a esta densidad de M. hapla en suelo, se deben tomar medidas de control químico, ya que en estas poblaciones se comienza a ver mayor efecto en la parte aérea, como se pudo demostrar en los resultados obtenidos, donde se vieron afectados principalmente los parámetros peso fresco de raíces, altura de las plantas, diámetro de tallo y biomasa.
En los resultados de este trabajo se pudo determinar que un adecuado manejo de la fertilización logra contrarrestar en parte el daño de este parásito cuando está presente, ya que no hubo un efecto significativo en algunos parámetros de follaje; lo cual coincide con lo reportado por Magunacelaya y Monsalves (1994), para cultivos de kiwi establecidos en los que, a pesar de tener M. hapla en diferentes densidades poblacionales, se lograron buenos rendimientos, con un adecuado manejo de la fertilización; sin embargo, es importante tener en cuenta que los daños mecánicos causados por M. hapla en raíces, de acuerdo con Taylor y Sasser (1983) y Agrios (2005), predisponen las plantas a infección por otros patógenos de suelo como Pythium, F. oxysporum, Ralstonia solancearum, etc., los cuales son los que finalmente pueden causar la pérdida de las plantas.
Literatura citada
Agrios, G.N. 2005. Plant Pathology. 5th Edition. Elvesier Academic Press, Londres, UK. 992 p. [ Links ]
Almanza, P.J. 2000. Propagación. pp. 27-40. En: Flórez, V.J., G. Fischer y A.D. Sora (eds.). 2000. Producción, poscosecha y exportación de la uchuva (Physalis peruviana L.). Unibiblos, Universidad Nacional de Colombia, Bogotá. 175 p. [ Links ]
Angulo, R. 2003. Frutales exóticos de clima frío. Edición Bayer CropScience S.A., Bogotá. pp. 27-48. [ Links ]
Angulo, R. (ed.). 2005. Uchuva el cultivo. Centro de Investigaciones y Asesoría Agroindustriales, Universidad de Bogotá Jorge Tadeo Lozano - Colciencias, Bogotá. 78 p. [ Links ]
Barker, K.R., P.B. Shoemaker y L.A. Nelson.1976. Relationships of initial population densities of Meloidogyne incognita and Meloidogyne hapla to yield of tomato. J. Nematology 3, 232- 239. [ Links ]
Blanco, J.O. 2000. Manejo de enfermedades. pp. 57-65. En: Florez, V.J., G. Fischer y A.D. Sora (eds.). Producción, poscosecha y exportación de la Uchuva (Physalis peruviana L.). Unibiblos, Universidad Nacional de Colombia, Bogotá. [ Links ]
Castillo, J.D. 2002. Identificación de Meloidogyne spp. en plantas de uchuva (Physalis peruviana L.) en el municipio de Silvania. Trabajo no publicado, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. [ Links ]
Chan, S. y R. López. 1992. Efecto de diferentes densidades poblacionales de Meloidogyne incognita sobre el crecimiento del tomate. Agron. Costarricense 16(2), 165-169. [ Links ]
Chaparro, M.C., A.S. Peñuela, J.M. Rojas y G.M. Vidal. 2005. Evaluación experimental y comercial del tratamiento cuarentenario con frío en la calidad de la uchuva (Physalis peruviana L.). Federación Nacional de Cafeteros, Cenicafé, Chinchiná, Caldas. pp. 7-14. [ Links ]
Convenio MAG-IICA. 2001. La uvilla (Physalys peruviana L., Physalys edulis). Subprograma de Cooperación Técnica, Ecuador. En: http://www.sica.gov.ec/agronegocios/Biblioteca/ Convenio%20MAG%20IICA/productos/uvilla_mag.pdf; consulta: julio de 2007. [ Links ]
Eisenback, J.D. 1985. Diagnostic characters useful in the identification of the four most common species of root-knot nematodes (Meloidogyne spp.). pp. 95-112. En: Sasser, J.N. y C.C. Carter (eds.). An advanced treatise on Meloidogyne. Vol. 1: Biology and control. North Carolina State University, Raleigh. [ Links ]
Eisenback, J.D. y H. Triantaphyllou.1990. Root knot nematodes: Meloidogyne species and races. En: Rickle, W. (ed.). Manual of agricultural nematology. Marcel Dekker Ink., Florida. [ Links ]
Fischer, G. 2000. Crecimiento y desarrollo. pp. 9-26. En: Flórez, V.J., G. Fischer y A.D. Sora (eds.). Producción, poscosecha y exportación de la Uchuva (Physalis peruviana L.). Unibiblos, Universidad Nacional de Colombia, Bogotá. [ Links ]
Gaviria, B.M.1999. Estrategias para el manejo de nematodos fitoparásitos en el cultivo de crisantemo (Dendranthema grandiflora) en el Oriente Antioqueño. Tesis de doctorado. Universidad Católica de Oriente, Ríonegro, Antioquia. [ Links ]
Góngora, A. y P. Rojas. 2006. Incidencia de las enfermedades en uchuva (Physalis periviana L), en dos zonas de Cundinamarca. Trabajo de grado. Facultad de Ciencias Biológicas, Pontificia Universidad Javeriana, Bogotá. [ Links ]
Magunacelaya, J.C. y P. Monsalves. 1994. Meloidogyne hapla en kiwi en Chile: juveniles infectivos en suelo, agallamiento en raíces y producción de frutos. Facultad de Ciencias Agrarias y Forestales, Universidad de Chile, Santiago. [ Links ]
Navarro, R. y B. Gaviria. 2005. Comunicación personal. Ríonegro, Antioquia. [ Links ]
Niño, N. 1998. Nematodos fitoparásitos y otras plagas de suelo en floricultura. Seminario Perspectivas sobre Nematodos Fitopatógenos y Entomopatógenos en Colombia. Socolen, Universidad Nacional Colombia, Bogotá. [ Links ]
Oostenbrink, M. 1971. Quantitative aspects of plant-nematode relationships. Indian J. Nematology 1, 68-74. [ Links ]
Seinhorst, J.W. 1995. The reduction of the growth and weight of plants by a second and later generations of nematodes. Nematologica 41, 592-602. [ Links ]
Shurtleff, M.C. y C.W. Averre. 2005. Diagnosis plant diseases caused by nematodos. APS Press, The American Phytopathological Society. St. Paul, Minnesota. 187 p. [ Links ]
Silva, J. 1994. Efecto de Meloidogyne hapla en 20 variedades de pompón. Tesis de maestría. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. 94 p. [ Links ]
Sirca, S., G. Ureck y G. Karssen. 2004. The incidence of the rootknot nematode Meloidogyne incognita and Meloidogyne hapla in Slovenia. Acta Agriculturae Slovenica 838(1), 15-22. [ Links ]
Stanelis, A. 2004. Gall nematode Meloidogyne hapla Chitwood, race A in Lithuania. Ecologica 4, 40-42. [ Links ]
Taylor, L. y J.N. Sasser. 1983. Biología, identificación y control de los nematodos de nódulo de la raíz. Proyecto Internacional de Meloidogyne, Universidad del Estado de Carolina del Norte y AID, Carolina del Norte. 111 p. [ Links ]
Triantaphyllou, A.C. 1993. Meloidogyne hapla. J. Nematology 25, 15-26. [ Links ]
Trudgill, D.L. y M.S. Phillips. 1997. Nematode population dynamics, threshold levels and estimation of crop losses. En: http://fao.org/ docrep/v9978e/v9978e07.htm; consulta: noviembre de 2005. [ Links ]
Viaene, N.M. y G.S. Abawi. 1996. Damage threshold of Meloidogyne hapla to lettuce in organic soil. J. Nematology 28(4), 537- 545. [ Links ]
Viaene, N.M., P. Simoens y G.S. Abawi. 1997. SeinFit, a computer program for the estimation of the Seinhorst equation. J. Nematology 29(4), 474-477. [ Links ]
Vergel, D.M. 1999. Metodología para la evaluación de la resistencia a nematodos del nudo radical (Meloidogyne spp.) en Coffea spp. y evaluación de germoplasma en café. Tesis de maestría. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. [ Links ]
Volcy, Ch. 1998. Diversidad y parasitismo en plantas: Tomo 2. Primera edición. Universidad Nacional de Colombia, Medellín. 182 p. [ Links ]
Wallace, H.R. 1983. Interactions between nematodes and other factor on plants. J. Nematology 15, 221-227. [ Links ]
Zadocks, K.C. 1985. On the conceptual basis of crop loss assessment threshold theory. Annu. Rev. Phytopathol. 23, 445-473. [ Links ]
Zapata, J. L., A. Saldarriaga, M. Londoño y C. Díaz. 2002. Manejo del cultivo de la uchuva en Colombia, Boletín Técnico 14, Centro de Investigación La Selva, Corpoica Ríonegro, Antioquia. [ Links ]
Zuckerman, B., W. Mai y L. Krusberg. 1990. Plant nematology laboratory manual. Agricultural Experimental Station. University of Massachusetts. [ Links ]














