Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.26 no.2 Bogotá July/Dec. 2008
Liliana Bernal1, Lucy Pesca1, Daniel Rodríguez2, Fernando Cantor2 y José R. Cure2
1 Biólogas, Facultad de Ciencias, Universidad Militar Nueva Granada, Bogotá (Colombia). ecologia@umng.edu.co
2 Docentes, Facultad de Ciencias, Universidad Militar Nueva Granada, Bogotá (Colombia). ecologia@umng.edu.co
Fecha de recepción: febrero 2 de 2008. Aceptado para publicación: julio 10 de 2008
RESUMEN
Los daños ocasionados por Trialeurodes vaporariorum generan pérdidas económicas que disminuyen la producción y pueden contribuir en el alza de los precios del tomate. Para su control se acude a aplicaciones continuas de insecticidas, sin obtener resultados satisfactorios. Como alternativa de control se realizan liberaciones del parasitoide Encarsia formosa. Sin embargo, el éxito de este sistema implica estimar la densidad de la plaga a través de un método de muestreo adecuado. Por ello, se estandarizó un plan de muestreo directo, económicamente viable, para ninfas de mosca blanca en un cultivo comercial de tomate bajo invernadero. Se determinó la incidencia de prácticas de manejo y de la fenología en la distribución espacial de ninfas. En términos generales, el muestreo se dividió en tres etapas: 1) muestreo totalmente aleatorio, entre las 5 y 7 semanas después de la siembra (sds), para plantas no divididas en tercios; 2) muestreo aleatorio, entre las 8 y 16 sds, los conteos se realizaron en hojas del tercio inferior; 3) muestreo bietápico: planta y hoja, entre las 17 y 24 sds, los conteos se efectuaron sobre hojas de los tercios medio y superior. Se encontró que prácticas culturales como el despunte influyeron en la distribución espacial de las ninfas. La implementación del muestreo directo generó un incremento en la producción del 0,06% y permitió estimar la densidad de ninfas de T. vaporariorum en el cultivo (con precisiones de 5%, 10% y 25%) como criterio para liberar E. formosa.
Palabras clave: mosca blanca, tamaño de muestra, dinámica de población, tomate.
ABSTRACT
The damages produced by Trialeurodes vaporariorum generate economic losses that decrease yield and can cause an increase in the price of tomato. The control of this pest is carried out by continues applications of insecticides without obtaining satisfactory results. One alternative control is carried out releasing wasps of the parasitoid Encarsia formosa. Nevertheless, the success of this system implies to reckon the pest density through a method of adequate sampling. An economic and viable direct sampling plan by the previous arguments was standardized for nymphs of whitefly in a commercial tomato crop under greenhouse. The incidence of the management practices and phenology was determined in the spatial distribution of nymphs. In general terms, the sampling was divided in three stages: 1) sampling completely random that was carried out between 5th and 7th weeks after sowing (WAS) for plants no divided in thirds, 2) sampling random between 8th and 16th WAS, counts were carried out in leaves from the lower third, 3) sampling in two stages: plant and leaf, counts were carried out between 17th and 24th WAS on leaves from the middle and upper third. It was found that cultural practices as the blunt influenced the spatial distribution of nymphs. The implementation of direct sampling generated an increment in yield equal to 0.06% and reckoned nymph density of T. vaporariorum in tomato crops (with precisions 5%, 10% and 25%) as a criterion to carry out releasing the parasitoid E. formosa.
Key words: whitefly, sample size, population dynamics, tomato.
Introducción
El tomate es una planta de importancia socioeconómica por su alta demanda como hortaliza de consumo. No obstante, requiere de un alto costo en mano de obra, que puede llegar a 160 jornales por ciclo de producción (Jaramillo et al., 2006), siendo un producto susceptible a fluctuaciones climáticas, enfermedades y plagas, como la mosca blanca de los invernaderos Trialeurodes vaporariorum (Westwood) (Hemiptera: Aleyrodidae) (Vallejo, 1999).Cardona (1995) anota que T. vaporariorum hizo su aparición en Colombia en 1984, en la zona Andina. Desde entonces el control de esta plaga se ha convertido en un serio problema. Esto se debe a que el insecto exhibe altos niveles de resistencia a los insecticidas (Madrigal, 1992, 2001), plasticidad genética para desarrollar biotipos (Van Lenteren, 2000), alta capacidad de proliferación, amplio rango de plantas hospederas y hábito de mantenerse protegida en el envés de las hojas (Madrigal, 1992, 2001; Rodríguez et al., 1996; Van Lenteren, 2000).
Por ser una especie de hábitos chupadores (Perea et al., 2003), T. vaporariorum ocasiona daños directos e indirectos en la planta: a) al perforar las células del follaje; b) al succionar la savia de las plantas, causando clorosis y debilitando su crecimiento; c) al excretar miel de rocío, induciendo el desarrollo de Cladosporium sp. (fumagina) (Noldus et al.,1986; Corredor, 1992; Gerling, 1992; Malais y Ravensberg, 1992; Baker, 1996; Perea et al., 2003) y d) al transmitir enfermedades virosas de una planta a otra, como el virus del amarillamiento del tomate (ToCV) (Wisler et al., 1998b) y el virus infeccioso del amarillamiento del tomate (TICV) (Difuss et al., 1996).
A nivel mundial se realizan estudios orientados al control biológico de la mosca blanca con el endoparasitoide Encarsia formosa (Hymenoptera: Aphelinidae), como alternativa de manejo de T. vaporariorum (Gould et al., 1975; Van Lenteren y Van Roermund, 1999). Sin embargo, fue sólo hasta 1997 que un programa de investigación empezó a evaluar y adaptar en Colombia sistemas de control biológico de esta plaga con la avispa parasitoide (De Vis, 2001), demostrando que, en el caso de cultivos bajo invernadero, el uso de sistemas de control biológico resulta económicamente más rentable que el control químico (Bolckmans, 1999; Van Lenteren y Martin, 1999).
El desarrollo de un programa de control biológico involucra el conocimiento del ciclo de vida, la dispersión de la población y la densidad de la plaga, como criterios al momento de tomar decisiones oportunas sobre actividades de manejo (Legg y Moon, 1994).
El ciclo de vida de la mosca blanca tiene una duración aproximada de 28 días, a temperaturas entre 22-25 °C (Castresana, 1986) y consiste en seis estados de desarrollo: huevo, cuatro estadios ninfales y adulto (Malais y Ravensberg, 1992). Los estados de desarrollo de T. vaporariorum presentan distribución agregada durante casi todo el ciclo de cultivo (Xu Ru-Mei, 1985; Bueno et al., 2005).
Los adultos se caracterizan por estar agregados en el envés de las hojas del tercio superior de la planta, donde se realiza la síntesis de proteínas y por lo tanto, se encuentran niveles más altos de nitrógeno; esto se debe al apareamiento y a la selección de sitios de oviposición y alimento cercanos a las venas principales (Xu Ru-Mei, 1985). Las ninfas se encuentran en mayor número en el tercio medio de la planta (Suárez y López, 1992) y, conforme ésta crece, se presenta una diferenciación de edades de ninfas dentro de los tercios de ella (Xu Ru-Mei, 1985; Noldus et al., 1986).
Van Lenteren y Woets (1988) afirman que la densidad de T. vaporariorum puede estar determinada por la edad en que se encuentre el cultivo, ya que las plantas son más susceptibles al ataque de la plaga en determinadas etapas.
El conocimiento de la dispersión de una población permite: a) entender el comportamiento básico de la especie (Ives y Moon, 1987; Buntin, 1994; Davis, 1994), b) transformar datos para el análisis estadístico (Ives y Moon, 1987), c) seleccionar un patrón óptimo de muestreo (Duque, 1986; Ives y Moon, 1987; Andrews y Quezada, 1989), d) determinar un tamaño óptimo de muestra (Buntin, 1994; Davis, 1994) y e) desarrollar un programa de muestreo (Buntin, 1994; Davis, 1994).
Una herramienta útil en programas de manejo integrado de plagas es el muestreo directo, que permite estimar la densidad de la plaga en un cultivo y establecer si la población se encuentra por encima o por debajo del umbral de acción. Esto posibilita la toma de decisiones al momento de implementar estrategias de control (Buntin, 1994; Ramos, 1991).
En Colombia no se conoce un sistema de muestreo directo en tomate que sea a su vez confiable y económico para cuantificar las poblaciones de mosca blanca en cultivos de tomate. Los métodos de muestreo directo que se manejan en la actualidad son aplicaciones de técnicas empleadas en el sector floricultor, con especificaciones diferentes a las características propias del cultivo de tomate (Sánchez, 1997). Sin embargo, varios acercamientos se han logrado con los estudios realizados en tomate por Rodríguez et al. (1996) y en habichuela y fríjol por Bueno et al. (2005).
Con el fin de implementar estrategias de manejo para el control de mosca blanca en tomate bajo invernadero, se desarrolló un plan de muestreo directo para la mosca blanca de los invernaderos T. vaporariorum, como criterio de manejo para realizar liberaciones del parasitoide E. formosa y contribuir así al establecimiento de un sistema de control biológico confiable y económicamente viable.
Materiales y métodos
Caracterización del área de estudio
El estudio se realizó en un cultivo comercial de tomate bajo invernadero, entre marzo y julio de 2006, durante un ciclo de cultivo en un invernadero con un área de 4.500 m2, localizado a 2.095 msnm, en la empresa Hortifresh S.A., vereda el Pedregal, municipio de Sutamarchán (Boyacá). La temperatura máxima bajo invernadero fue 25 °C y la mínima, 10 °C, con una humedad relativa de 70% y fotoperíodo de 12:12. El invernadero estaba cubierto por plástico de invernadero calibre 8 y la entrada de aire se hizo a través de cortinas y cumbreras.
Se trabajó con tres variedades: Bravona, Durinta y Romana, transplantadas a las 4 semanas de edad en sustrato de cascarilla de arroz cruda y cáscara de coco, con distancias de siembra de 0,23 m entre plantas y 1,03 m entre camas. Las prácticas culturales fueron representativas de las realizadas por agricultores de la zona. En cuanto al control químico, se empleó un total de 20 pesticidas, la mitad de ellos insecticidas.
Definición del plan de muestreo
Con el fin de determinar el número de muestras que deben tomarse para la ejecución de un plan de muestreo, se realizó un estudio preliminar considerando el costo en términos de tiempo (en segundos) y el esfuerzo (representado por un jornal).
Se definió la hoja como unidad de muestreo y se realizó un muestreo trietápico, estableciendo como unidades de la etapa primaria a cuadros, de la etapa secundaria a plantas y de la etapa terciaria a hojas.
En cada evento de muestreo y antes del inicio de los conteos, se aleatorizaron cuadros y plantas. La unidad cuadro tenía un área de 29,60 m2, cada cuadro contenía 5 camas y estaba definido por la intersección entre las naves y las divisiones del invernadero. Cada planta se dividió en tercio superior, medio e inferior, que variaron dependiendo de la altura de la planta. En cada planta se tomaron datos de: altura, número de nudos, número de hojas, inflorescencias, racimos y números de ninfas y adultos presentes por hoja.
Además, con el fin de determinar si ninfas y adultos se distribuían homogéneamente o se agrupaban sobre determinados foliolos de la hoja, se diseñó una numeración para cada foliolo. El conteo de los individuos se inició en el foliolo del extremo de la hoja (opuesto al pecíolo) y posteriormente de derecha a izquierda en zig-zag a lo largo de la hoja.
Para determinar el número de unidades de muestreo, se tuvo en cuenta la fenología de la planta, la densidad de ninfas y adultos de mosca blanca y el tiempo de un jornal. El muestreo empezó a las 5 sds; inicialmente se tomaron 24 cuadros, 4 plantas por cuadro y 6 hojas por planta. Cuando las plantas alcanzaron 8 semanas de edad, el conteo de los individuos se realizó en 9 hojas por planta (3 hojas por tercio).
El registro de las variables se realizó semanalmente, desde las 5 hasta las 24 semanas de edad de las plantas. Así mismo, se registraron cada semana los datos de temperaturas máxima y mínima y cada 20 días el pH (con pHmetro) y la conductividad eléctrica del suelo (con conductivímetro).
Análisis estadístico
Para el análisis estadístico se utilizó el software R versión 2.2.1 (http://www.r-project.org). Se realizó una regresión múltiple para determinar si se presentó efecto de las prácticas de manejo y/o condiciones agroclimáticas sobre la densidad de ninfas y adultos. Se realizaron análisis de varianza con el fin de determinar: a) cómo se relacionan las etapas con la variabilidad en la densidad de ninfas en el cultivo y b) si los tercios de la planta y la disposición de los foliolos tienen efecto sobre la densidad de las ninfas. Adicional a esto, se hizo una prueba de comparación múltiple para conocer la proporción de ninfas y adultos en cada tercio de la planta y foliolo de la hoja.
Con el fin de comparar el promedio de ninfas de tercer estadio por hoja entre los tres tercios de la planta, se realizó un análisis de varianza completamente al azar, tomando 3 hojas por tercio como repeticiones. Se aplicó la transformación Box-Cox (Gómez, 1999) a los conteos de ninfas por hojas para aproximar los datos a una distribución normal. Posteriormente, se compararon los promedios para cada uno de los tercios mediante la prueba de Tukey (Zar, 1974). El patrón de distribución espacial de ninfas de T. vaporariorum en el universo de muestreo se estimó a través de la relación varianza/promedio de la densidad de ninfas por hoja y el parámetro b de la ley de poder de Taylor (LPT). En términos descriptivos, la LPT presenta altos coeficientes de correlación y proporciona un mejor ajuste de los datos, especialmente a un bajo rango de densidades medias (Buntin, 1994; Davis 1994).
El tamaño óptimo de muestra se estimó con precisiones de 5%, 10% y 25%. Para un muestreo trietápico se utilizaron las fórmulas citadas por Gómez (1999):
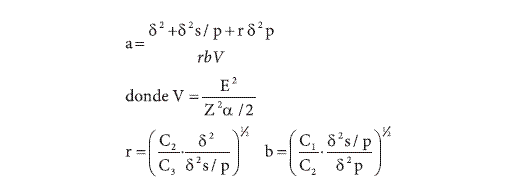
en donde, V es igual a la varianza media; E, la precisión deseada; Z, el valor de z; a, unidades de la etapa primaria; b, unidades de la etapa secundaria; r, unidades de la etapa terciaria; σ2, varianza de las unidades de la etapa terciaria dentro de la secundaria; σ2 S/P, varianza de las unidades de la etapa secundaria dentro de la primaria y σ2 P, varianza dentro de las unidades de la etapa primaria.
Sin embargo, en caso de que las etapas no resultaran relevantes, se consideraron las fórmulas planteada por Finch et al. (1975) para un muestreo totalmente aleatorio y sin etapas, que consideran parámetros de regresión de la LPT con un valor fijo de precisión:
en donde, n es el número de muestras; a (el intercepto) y b (la pendiente), parámetros de regresión del promedio de individuos por unidad secundaria y la varianza de la etapa secundaria (Se 2); Do, un valor de precisión fijo y m, la densidad de individuos por unidad secundaria.
Estimación de la densidad de ninfas de T. vaporariorum por planta
Con el propósito de determinar la densidad promedio de ninfas por planta como herramienta al momento de realizar liberaciones de E. formosa en cultivos de tomate mantenidos bajo invernadero, se elaboró un software de aplicación que facilita al agricultor realizar esta tarea en forma rápida y precisa.
El software de aplicación se elaboró a partir del resultado de la separación de medias de los tercios de la planta, agrupadas conforme al tercio en el que se presentó la mayor concentración de individuos por hoja. Este software permite proyectar el promedio de ninfas por hoja para cualquier tercio, a partir del número total de hojas por tercio y del promedio de ninfas por hoja para el tercio en donde se concentró la mayor proporción de individuos.
Las proporciones de ninfas por tercio demandan errores que son aplicables en cualquier evento de muestreo; por lo tanto, se calculó el error estándar para cada una de estas proporciones.
El costo del muestreo se estimó a partir del tamaño de muestra, el tiempo empleado y el costo de un jornal.
Resultados y discusión
Fluctuación de ninfas y adultos de T. vaporariorum a nivel de planta
La densidad de ninfas y adultos de T. vaporariorum en un cultivo de tomate bajo invernadero puede presentar variaciones, como resultado de la influencia de labores culturales, el control químico y las condiciones ambientales.
Aunque prácticas como el deshoje, la poda, la eliminación de chupones y el despunte son labores que tienen por objeto la remoción de material vegetal, se encontró que el deshoje repercute significativamente sobre la densidad de ninfas (P=0,00220) y adultos (P=0,00607) de T. vaporariorum. En la figura 1 se observa que el efecto del deshoje realizado a las 20 sds (semanas después de la siembra), pico de densidad para ninfas y adultos, produjo una disminución de 87% en el número de ninfas por planta, con respecto a las 21 sds. Al efectuar el segundo deshoje (a las 21 sds) se encontró una disminución de 62% y 47% en la población de ninfas y adultos, respectivamente, en relación con las 23 sds. Entre las 23 y 24 sds, cuando no se realizó esta labor, la población de ninfas disminuyó 15% y la de adultos aumentó 15% (figura 1).
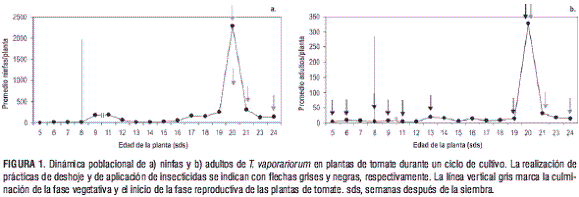
Además del deshoje, la aplicación de insecticidas tuvo efecto sobre la densidad de adultos (P = 0,13270, con significancia al 15%). La primera aplicación se realizó a las 5 sds (semana en la que se iniciaron los conteos), cuando era evidente la presencia de adultos de mosca blanca. Hacia las 8 sds ó inicio de la fase reproductiva (figuras 1 y 2c), se observó que la población de ninfas se duplicó, con respecto a la primera semana del muestreo, mientras que la de adultos se mantuvo.
La disminución en las aplicaciones de insecticidas en las dos semanas consecutivas al inicio de los conteos, permitió un aumento en la población de adultos de 50% a las 8 sds (con respecto a las 9 sds) y de 96% entre las 19 y 20 sds, como lo muestra la figura 1b. Sin embargo, es importante resaltar que las aplicaciones no estuvieron sujetas al estudio sino a políticas de empresa.
El deshoje sumado a la aplicación de insecticidas ocasionó una disminución de 96% en el número de adultos entre las 20 y 21 sds. Esto confirma estudios anteriores realizados por De Vis (2001), en los que se afirma que el número de ninfas por hoja es notablemente mayor al de adultos, debido a que aquéllas son menos susceptibles por permanecer en el envés de las hojas y estar protegidas con una cubierta cerosa contra insecticidas y altas temperaturas (figura 1).
En los resultados obtenidos por De Vis (2001), se encontró que el mayor número de adultos por planta (a temperatura promedio de 15,5 °C bajo invernadero) se mantuvo entre las 16 y las 19 sds, lo que variaba según el año de muestreo. Por otra parte, Sánchez et al. (2005) registraron que a temperatura promedio de 32,5 °C la densidad máxima de ninfas y de adultos en un cultivo de tomate a media sombra se presentó a las 20 y 22 sds, respectivamente, y en cultivo al aire libre, a las 19 sds para ambos estadios.
Al comparar los resultados del presente estudio con los obtenidos por De Vis (2001) y Sánchez et al. (2005), se encontró que la planta fue más susceptible al ataque por parte de ninfas y adultos entre las 19 y 20 sds, lo que puede explicarse por el hecho que las plantas registran la mayor cantidad de hojas en todo el ciclo de cultivo y por lo tanto, alcanzan su máxima oferta en el suministro alimenticio (figura 2b).
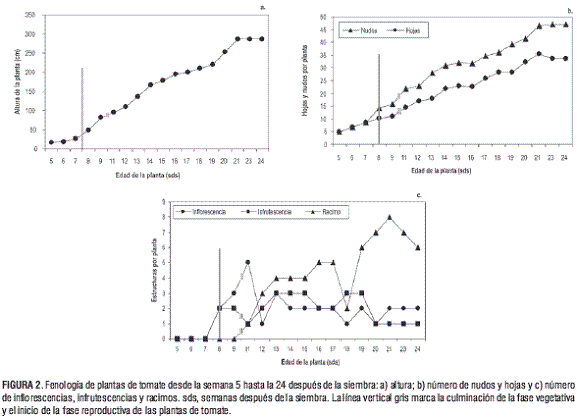
Efecto de la fenología sobre la fluctuación de T. vaporariorum En las figuras 1 y 2 se observa que la fase vegetativa culmina a las 8 sds (línea gris) con la aparición de la primera infl orescencia, dando paso a la fase reproductiva, tal como lo reporta Jaramillo et al. (2006). La fase reproductiva tiene una duración de 17 semanas, es decir, desde las 8 sds hasta las 24 sds. Dentro de la fase reproductiva, la etapa de fructificación se inició a partir de la 11 semana de edad (figura 2c), coincidiendo también con lo anotado por Jaramillo et al. (2006).
En la figura 2a se observa que la altura de las plantas de tomate se asemeja a una curva sigmoidea. A las 21 sds la planta alcanzó su máxima altura, así como la mayor cantidad de nudos, hojas y racimos (figuras 2b y 2c). Si se tiene en cuenta que a las 20 sds se obtuvo el pico máximo de densidad de ninfas y adultos, es factible explicar este aumento por el incremento en el número de hojas y por lo tanto, por la máxima oferta de suministro alimenticio (figura 2b).
Durante el muestreo se observó que el número de nudos superó al de hojas a partir de las 8 sds, cuando se inició la fase reproductiva (figura 2b). Hacia la 21 sds, el número de hojas disminuyó debido al deshoje realizado a las 20 semanas de edad (figura 1) y a la aparición de hojas senescentes. El aumento en el número de racimos (figura 2c), la altura y el número de hojas entre las 9 y 11 sds (figura 2a y 2b) coincide con el incremento de la población de ninfas entre las 8 y las 11 sds (figura 1a). Si se tiene en cuenta que la etapa vegetativa culminó a las 8 sds y que la formación del primer racimo ocurrió a las 11 sds, se asume que entre las 9 y 11 sds la planta contaba con una gran cantidad de asimilados en sus hojas (para el llenado de frutos) que suministraron una fuente rica en nutrientes y contribuyeron en parte al aumento de la población de ninfas.
En la figura 1 se observa que entre las 11 y 13 sds la población de adultos aumentó, debido a que a las 12 sds no se realizó aplicación de insecticidas, y la de ninfas disminuyó. Sin embargo, si se considera que entre las 12 y 13 sds el número de racimos aumentó (figura 2c) y el de hojas se mantuvo estable (figura 2b), es posible que el descenso en la población de ninfas se debiera al efecto de la competencia por alimento y espacio.
Fluctuación en la proporción de ninfas de T. vaporariorum a nivel de tercio
En la figura 3 se observa que la proporción de ninfas por tercio de la planta se encuentra a partir de la 8 sds. Los conteos comprendidos entre las 5 y 7 sds se realizaron sobre 6 hojas, debido a que las plantas no superaban las 8 hojas ni los 50 cm de altura.
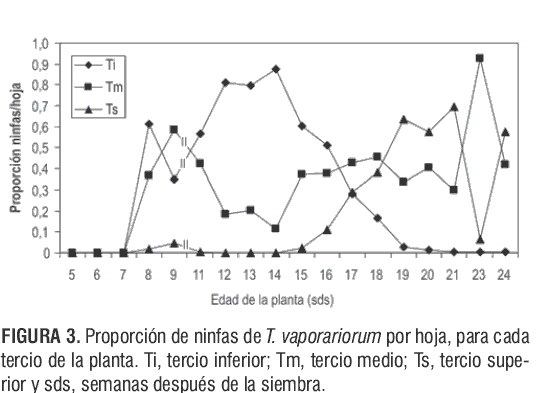
Entre las 8 y 16 sds se encontraron diferencias altamente significativas en el número promedio de ninfas según el tercio de la planta (P<0,01); así mismo, la prueba de Tukey mostró diferencias significativas entre los tres tercios, con P<0,01 para las tres comparaciones.
Los análisis de varianza entre las 17 y 24 sds revelaron diferencias altamente significativas entre los tercios de la planta (P<0,01); posteriormente, la prueba de Tukey señaló diferencias entre los tercios medio e inferior (P>0,05). Adicional a esto, se comparó el tercio superior con los otros dos tercios, encontrándose diferencias altamente significativas (P<0,01), con el promedio mayor para los tercios medio e inferior.
El paso de la etapa vegetativa a la reproductiva (8 sds) y el crecimiento en términos de altura marcó el inicio de una diferenciación de ninfas en edades sobre los tercios de la planta (figura 3).
Entre las 8 y 16 sds se registró una mayor proporción de ninfas de mosca blanca en el tercio inferior (Ti) de la planta. Entre las 17 y 18 sds se encontró una mayor proporción en el tercio medio de la planta y a partir de las 19 sds y hasta las 21 sds fue evidente un aumento en el número de ninfas en el tercio superior, debido a la preferencia de la mosca blanca por alimentarse de hojas jóvenes y de ovipositar cerca de las venas principales, lo que posteriormente da surgimiento a nuevas generaciones de ninfas como consecuencia de oviposiciones previas. A las 23 y 24 sds las ninfas se encontraron en mayor proporción en el tercio medio y superior, respectivamente, como consecuencia de la superposición de generaciones de ninfas y del crecimiento de la planta.
La proporción de ninfas en los tercios de la planta determina el surgimiento de cuatro momentos de la población: el primero, para plantas no divididas en tercios (Tp); el segundo, para ninfas concentradas en el tercio inferior (Ti); el tercero, para ninfas concentradas en el tercio medio (Tm) y el cuarto, para ninfas concentradas en el tercio superior (Ts).
Distribución de ninfas y adultos de T. vaporariorum a nivel de foliolos
En el caso de las ninfas, se encontró que de los 18 eventos de muestreo sólo 8 resultaron significativos para diferencia de número promedio de individuos por foliolo. En estas fechas se encontró una mayor incidencia de ninfas en los foliolos 7 y 8 localizados hacia el interior de la planta. La mayor incidencia puede explicarse por el hecho que los foliolos 7 y 8 eran ramificaciones jóvenes de la hoja, seleccionados por el adulto como sitios de oviposición. Sin embargo, por la alta variabilidad de las ninfas en los foliolos se recomienda realizar los conteos de ninfas sobre toda la hoja.
Distribución espacial de ninfas de T. vaporariorum
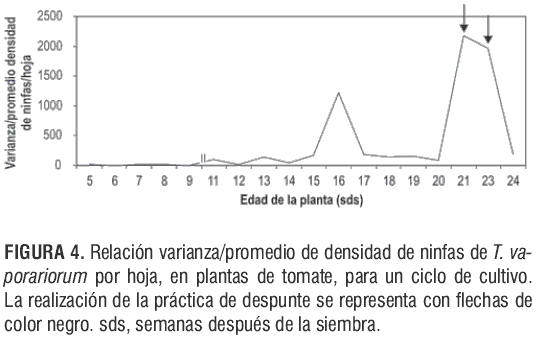
En los resultados obtenidos con la relación varianza/promedio de densidad de ninfas por hoja (figura 4), se observó que la varianza es mayor que el promedio en todas las semanas de muestreo, es decir, que la distribución de ninfas es agregada durante todo el ciclo de cultivo. Sin embargo, se encontró que prácticas culturales como el despunte infl uyen significativamente (P=4,29·10-7) en que la distribución de ninfas de T. vaporariorum sea agregada.
En la semana 16 después de la siembra, la población de ninfas se encontraba muy agregada (figura 4), posiblemente por haber sido esta semana una etapa transitoria en la distribución de ninfas entre el tercio inferior y medio de la planta (figura 3).
Entre las 21 y 23 sds la población de ninfas presentó la mayor agregación en todo del ciclo de cultivo (figura 4). Lo anterior, tal vez como consecuencia del despunte o la eliminación del meristemo apical de la planta, que evita la formación de hojas nuevas (sitios de oviposición) y ocasiona una aglomeración de los huevos y después, el surgimiento de ninfas en las hojas más jóvenes de la planta cercanas al meristemo apical, localizadas entre el Tm y el Ts (figura 3).
Definición del tamaño de muestra
Al realizar el Anova para el muestreo trietápico, se encontró que la variabilidad de la etapa cuadro es muy baja, generando en ocasiones estimativos negativos. Por esta razón, el muestreo se redujo a dos etapas: planta y hoja. Cuando se estimó el tamaño de muestra para el muestreo bietápico, se encontró que éste variaba considerablemente en cada evento de muestreo. Por esta razón se utilizó la ley de poder de Taylor (LPT).
Los parámetros de la LPT se estimaron para cada uno de los cuatro momentos descritos previamente (Tp, Ti, Tm y Ts) y para cada unidad de muestreo (planta y hoja); sin embargo, se encontró una pendiente mayor a 2 (b>2). Por esta razón, se analizaron: a) las proporciones de varianza de planta y hoja para cada una de las fechas de muestreo y b) los resultados de la proporción de T. vaporariorum entre tercios (figura 3).
En el análisis de los resultados se identifi caron tres momentos diferentes, desde el punto de vista de la distribución de la plaga:
1. Tp (plantas no divididas en tercios), en el que en la etapa planta no resultó ser un componente importante, por lo cual se tuvo en cuenta sólo hoja (muestreo aleatorio).
2. Ti (ninfas concentradas en el tercio inferior de la planta), en el que la proporción de varianza de planta no fue significativa, por lo cual se redujo a hoja (muestreo aleatorio).
3. Tm-s (ninfas concentradas en el tercio medio y superior de la planta), en el que las etapas planta y hoja son importantes (bietápico). Sin embargo, cuando se realizaron las regresiones por separado para cada tercio, ninguna resultó significativa. Lo anterior llevó a unir los dos tercios y a hacer una regresión conjunta para ambos, de modo que el tamaño de muestra obtenido pueda usarse para Tm y Ts.
El surgimiento de los tres momentos determina que la densidad y la distribución de la plaga varíen con la edad de la planta. De esta manera, con sólo realizar conteos en el tercio en donde se concentra la mayor proporción de ninfas y contar el número total de hojas por tercio, es posible estimar un número promedio de individuos por hoja en los tercios restantes.
Cuando la proporción de ninfas es mayor en el tercio inferior, se realizan conteos de ninfas en hojas ubicadas en el tercio inferior y luego el promedio de ninfas por hoja se extrapola a los tercios medio y superior a través de las siguientes proporciones: 0,51 para el tercio medio y 0,04 para el tercio superior.
Para el tercer momento del muestreo (Tm-s), se encontró una proporción mayor en el tercio medio. La proyección del número promedio de ninfas por hoja sobre los tercios inferior y superior se calcula con las siguientes proporciones: 0,15 para el tercio inferior y 0,98 para el tercio superior.
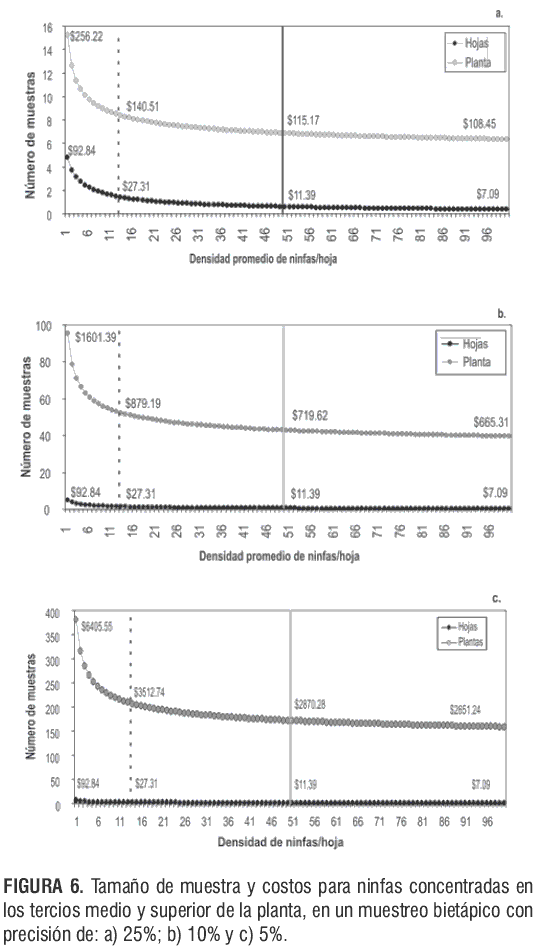
Estas proporciones, que hacen parte del software de aplicación, permiten proyectar la densidad de ninfas por planta, que sirve como criterio de manejo al momento de realizar liberaciones del parasitoide E. formosa. En la figuras 5 y 6 se observa que el tamaño de muestra varía conforme a la densidad promedio de ninfas por hoja, la precisión y el costo. Es decir, que el número de muestras disminuye cuando: a) la densidad de ninfas por hoja aumenta y/o b) la precisión disminuye; lo que genera una reducción en el costo.
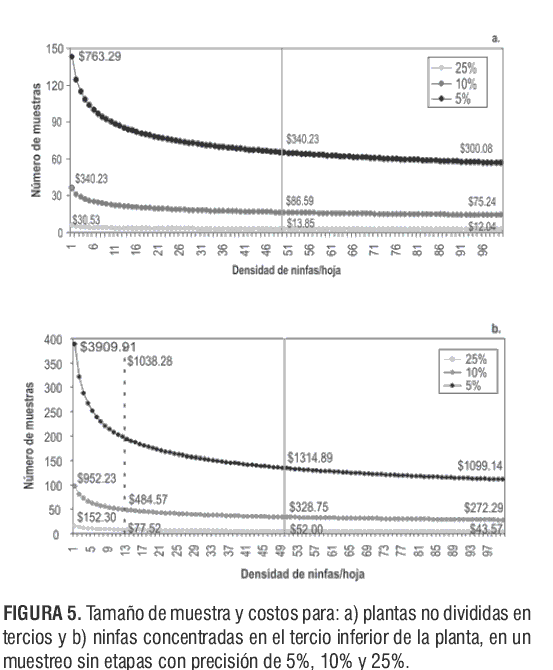
En la figura 5a se estima el tamaño de muestra para un muestreo aleatorio (entre las 5 y 7 sds, cuando las plantas no se dividen en tercios), en función de la densidad de ninfas por hoja. Es decir, si el promedio de ninfas por hoja para esta etapa no supera la unidad, se deben muestrear 143; 36 ó 6 hojas (1 hoja por planta), asumiendo un costo de: $763,29 pesos, con una precisión del 5%; $190,82 pesos al 10% ó $30,53 pesos al 25%. Esto dependerá del balance que el agricultor realice entre precisión y costo al momento de realizar liberaciones con la avispa parasitoide.
En las figuras 5b y 6a-c se estimaron tres tamaños de muestra. La línea punteada indica la densidad promedio de ninfas de T. vaporariorum que se obtuvo para las etapas Ti, Tm y Ts, respectivamente.
Entre las 8 y las 16 sds, cuando las ninfas se concentraron en el Ti de las plantas de tomate (figura 5b), se alcanzó una densidad mínima de 1 y máxima de 12 ninfas por hoja (línea punteada). El número de hojas que se debe muestrear para estimar la densidad mínima encontrada en el muestreo es de 388; 97 ó 16 hojas (1 hoja por planta), asumiendo un costo aproximado de $3800, $950 y $150 pesos, con una precisión de 5%, 10% ó 25%, respectivamente. Para estimar la densidad máxima como la obtenida en el muestreo, se deben muestrear 198; 49 u 8 hojas, asumiendo un costo aproximado de $1.940, $485 ó $78 pesos, con una precisión de 5%, 10% ó 25%, respectivamente.
En las figuras 6a-c se observa que para estimar una densidad de 13 ninfas por planta (línea punteada) se recomienda muestrear una hoja que se localice entre el tercio medio y el superior (17-24 sds), asumiendo un costo aproximado de $3.510, $580 ó $140 pesos, con una precisión de 5%, 10% ó 25%, respectivamente.
Plan de muestreo directo
El plan de muestreo para la determinación de la densidad de ninfas de T. vaporariorum en cultivos de tomate mantenidos bajo invernadero contempla los siguientes pasos (figura 7):
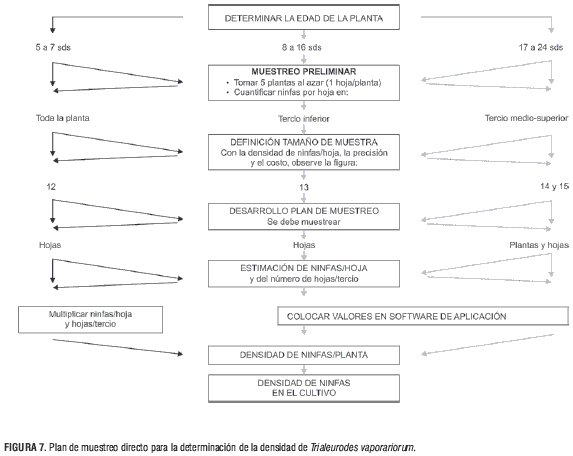
1. Ejecución del muestreo piloto, que consiste te en tomar 5 hojas por planta, dependiendo de la edad en la que se encuentre el cultivo.
2. Definición del tamaño de muestra con base en costo y precisión con que se quiere proceder. 3. Ejecución del plan de muestreo.
4. Estimación de la densidad de ninfas de T. vaporariorum por hoja.
5. Estimación de la densidad de ninfas de T. vaporariorum por planta.
6. de T. vaporariorum en el cultivo.
Costo total del muestreo
El costo total (en pesos) de los 18 eventos de muestreo fluctúa entre $2.357,92 y $327,69, con una precisión de 25%; entre $13.274,84 y $1.989,84, con una precisión de 10% y entre $52.263,83 y $7.719,86, con una precisión de 5%. Jaramillo et al. (2006) afirman que por ciclo de producción en tomate se requieren 160 jornales; es decir, si se asume que el costo máximo del muestreo directo equivale a $52.263,83 (con una precisión de 5%), se concluye que el muestreo directo representa un 6% de sobrecosto en mano de obra y un 0,06% de sobrecosto en la producción de una hectárea de tomate bajo invernadero, asumiendo como costo total de la producción de una hectárea de tomate bajo invernadero a $155.579.400.
Conclusiones
Se desarrolló un plan de muestreo directo confiable y económico para la determinación de niveles de población de ninfas de T. vaporariorum, como criterio para la liberación de E. formosa. Este método contempla diferentes esquemas de muestreo, conforme varía la distribución de la plaga en función de la edad de la planta.En términos generales el plan de muestreo cambia en tres etapas del cultivo: en la primera, las plantas tienen entre 5 y 7 semanas de edad y se realiza un muestreo aleatorio y conteos en toda la planta. En la segunda, las plantas tienen entre 8 y 16 semanas de edad y se realiza un muestreo aleatorio y conteos de ninfas por hoja en el tercio inferior. En la tercera, las plantas están entre las 17 y 24 sds y se realiza un muestreo bietápico (planta y hoja) y conteos de ninfas por hoja en los tercios medio-superior.
Prácticas culturales como el despunte influyen en la distribución espacial de ninfas de T. vaporariorum en un cultivo comercial de tomate bajo invernadero.
Agradecimientos
A la Universidad Militar Nueva Granada por el apoyo financiero de este proyecto (CIAS-2004-007) y a la Empresa Hortifresh por el apoyo logístico durante su desarrollo.
Literatura citada
Andrews, K. y J. Quezada. 1989. Manejo integrado de plagas inséctiles en la agricultura, estado actual y futuro. Escuela Agrícola Panamericana, El Zamorano (Honduras). 623 p. [ Links ]
Baker, J.R. 1996. Insectos y otras plagas de las flores y plantas del follaje. Hortitecnia, Bogotá. 105 p. [ Links ]
Bolcksmans, K.J.F. 1999. Commercial aspects of biological pests control. pp. 310-318. En: Albajes, R., M.L. Gullino, J.C. Van Lenteren y Y. Elad (eds.). Integrated pest and disease management in greenhouse crops. Kluwer Publishers, Dordrecht (Holanda). [ Links ]
Bueno, J.M., C. Cardona y P. Chacón. 2005. Fenología, distribución espacial y desarrollo de métodos de muestreo para Trialeurodes vaporariorum (Westwood) (Hemiptera:Aleyrodidae) en habichuela y fríjol (Phaseolus vulgaris L.). Revista Colombiana de Entomología 31(2), 161-170. [ Links ]
Buntin, D. 1994. Developing a primary sampling program. pp. 99- 115. En: Pedigo, L.P. y G.D. Buntin. Handbook of sampling methods for arthropods in agriculture. CRC Press, Boca Raton, FL. 714 p. [ Links ]
Castresana, L. 1986. Encarsia tricolor Foerster (Hymenoptera, Aphelinidae) en la lucha biológica contra la mosca blanca de los invernaderos (Trialeurodes vaporariorum Westwood). Tesis doctoral. Escuela Técnica Superior de Ingenieros Agrónomos de Madrid (ETSI), Universidad Politécnica de Madrid, Madrid. [ Links ]
Cardona, C. 1995. Manejo de Trialeurodes vaporariorum (Westwood) en fríjol en la zona Andina: aspectos técnicos, actitudes del agricultor y transferencia de tecnología. Revista CEIBA 36(1), 53-65. [ Links ]
Corredor, D. 1992. Algunos aspectos sobre el control de la mosca blanca de los invernaderos Trialeurodes vaporariorum en la Sabana de Bogotá. Universidad Nacional de Colombia, Bogotá. 10 p. [ Links ]
Davis, P. 1994. Statistics for describing population. pp. 33-54. En: Pedigo, L.P. y G.D. Buntin. Handbook of sampling methods for arthropods in agriculture. CRC Press, Boca Raton, FL. 714 p. [ Links ]
De Vis, R.M.J. 2001. Biological control of whitefly on greenhouse in Colombia: Encarsia formosa or Amitus fuscipensis? Wageningen University, Amsterdam. 166 p. [ Links ]
Duffus, J.E., H. Liu y G.C. Wisler. 1996. Tomato infectious chlorosis virus. A new clostero-likevirus transmitted by Trialeurodes vaporariorum. Eur. J. Plant Pathol. 102, 219-226. [ Links ]
Duque, M.C. 1986. Patrones de distribución espacial de artrópodos y su importancia en la definición de un plan de muestreo. Seminario-taller. Miscelánea. Sociedad Colombiana de Entomología, Bogotá. pp. 1-29. [ Links ]
Finch, S., G. Skinner y G.H. Freeman. 1975. The distribution and analysis of cabbage root fly egg populations. Ann. Appl. Biol. 79, 1-18. [ Links ]
Gerling, D. 1992. Approaches to the biological control of whiteflies. Florida Entomologist 75 (4), 446-456. [ Links ]
Gómez, H. 1999. Algunos métodos estadísticos para el estudio para el estudio de poblaciones de organismos. Universidad Nacional de Colombia, Medellín. 216 p. [ Links ]
Gould, H.J., W.J. Parr, H.C. Woodville y S.P. Simmonds. 1975. Biological control of glasshouse whitefly (Trialeurodes vaporariorum) on cucumbers. Entomophaga 20(3), 285-292. [ Links ]
Ives, P.M. y R.D. Moon,. 1987. Sampling theory and protocol for insects. pp. 49-75. En: Teng, P.S. (ed.). Crop loss assessment and pest management. American Phytopathological Society Press, USA. 270 p. [ Links ]
Jaramillo, J., V.P. Rodríguez, M. Guzmán y M. Zapata. 2006. El cultivo de tomate bajo invernadero. Corpoica, Centro de Investigación La Selva, Rionegro (Antioquia, Colombia). 48 p. [ Links ]
Legg, D.E. y R.D.Moon. 1994. Bias and variability in statistical estimates. pp. 55-69. En: Pedigo, L.P. y G.D. Buntin. Handbook of sampling methods for arthropods in agriculture. CRC Press, Boca Raton, FL. 714 p. [ Links ]
Madrigal, A. 1992. Nuevos aportes al manejo integrado de la mosca blanca de los invernaderos. Universidad Nacional de Colombia, Medellín. 93 p. [ Links ]
Madrigal, A. 2001. Fundamentos de control biológico de plagas. Universidad Nacional de Colombia, Medellín. 397 p. [ Links ]
Malais, M. y W.J. Ravensberg. 1992. Knowing and recognizing. The biology of glasshouse pests and their natural enemies. Koppert Biological Systems, Holanda. 110 p. [ Links ]
Noldus, L.P.J.J., X. Rumei y J.C. Van Lenteren. 1986. The parasitehost relationship between Encarsia formosa Gahan (Hymenoptera, Aphelinidae) and Trialeurodes vaporariorum (Westwood) (Homoptera, Aleyrodidae). XIX. Feeding- site selection by the greenhouse whitefly. J. Appl. Ent. 101, 492- 507. [ Links ]
Perea, E.I., E. Rojas y A. Villalobos. 2003. Diagnostico de Trialeurodes vaporariorum (Homoptera: Aleyrodidae) en tabaco y fríjol de García Rovira (Santander). Revista Colombiana de Entomología 29(1), 7-10. [ Links ]
Ramos, H.A. 1991. Bases para el establecimiento de un sistema de muestreo de trips (Thysanoptera: Tripidae), con trampas blancas en un cultivo comercial de clavel, en la Sabana de Bogotá. Trabajo de grado. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. 65 p. [ Links ]
Rodríguez, A., M. Hiller y E. Williams. 1996. Umbrales de acción para la mosca blanca de los invernaderos, Trialeurodes vaporariorum (Westwood) (Homoptera:Aleyrodidae), en tomate. Revista Colombiana de Entomología 22(1), 87-92. [ Links ]
Sánchez, M.L. 1997. Evaluación de las fluctuaciones poblacionales de la mosca blanca Trialeurodes vaporariorum (Westwood) al introducir el parásito Encarsia formosa (Gahan) como alternativa de manejo de la plaga, en cultivo de rosa para exportación en la Sabana de Bogotá. Trabajo de grado. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. 119 p. [ Links ]
Sánchez, D., R. Scotta y C. Arregui. 2005. Población de mosca blanca en tomate cultivado a campo con pantallas de sombreamiento. Pesq. Agropec. Bras. 40 (2), 183-185. [ Links ]
Suárez, M. y A. López. 1992. Estudio para la cría masiva de Encarsia formosa Gahan bajo condiciones de invernadero en la Sabana de Bogotá. Trabajo de grado. Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. 96 p. [ Links ]
Vallejo, F.A. 1999. Mejoramiento genético y producción de tomate en Colombia. Editorial Feriva, Cali (Colombia). 216 p. [ Links ]
Van Lenteren, J.C. y J. Woets. 1988. Biological and integrated pest control in greenhouses. Annu. Rev. Entomol. 33, 239-269. [ Links ]
Van Lenteren, J.C. y N.A. Martin. 1999. Biological control of whitefly. pp. 202-216. En: Albajes, R., M.L. Gullino, J.C. Van Lenteren y Y. Elad (eds.). Integrated pest and disease management in greenhouse crops. Kluwer Publishers, Dordrecht (Holanda). [ Links ]
Van Lenteren, J.C. y H.J.W Van Roermund. 1999. Why is the parasitoid Encarsia formosa so successful in controlling whitefly? pp. 116-130. En: Hawkins, B.A. y H.V. Cornell (eds.). Theoretical approaches to biological control. Cambridge University Press, Cambridge (Reino Unido). [ Links ]
Van Lenteren, J.C. 2000. A greenhouse without pesticides: fact or fantasy? Crop Protection 19, 375-384. [ Links ]
Wisler, G.C., LI, R.H., Liu, H.-Y., Lowry, D.S. y J.E. Duffus. 1998. Tomato chlorosis virus: a new whitefly-transmitted, phloemlimited, bipartite closterovirus of tomato. Phytopathology 88, 402-409. [ Links ]
Xu Ru-Mei. 1985. Dynamics of within-leaf spatial distribution patterns of greenhouse whiteflies and the biological interpretations. J. Appl. Ecology 22, 63-72. [ Links ]
Zar, J. 1974. Biostatistical analysis. Prentice-Hall, Englewood Cliffs, NJ. 620 p. [ Links ]