Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.26 no.3 Bogotá Sep./Dec. 2008
Fánor Casierra-Posada1 y Nancy E. Gómez G.2
1 Profesor asociado, Grupo de Investigación Ecofisiología Vegetal, Facultad de Ciencias Agropecuarias, Universidad Pedagógica y Tecnológica de Colombia, Tunja. fanor.casierra@uptc.edu.co
2 Ingeniera agrónoma, Universidad Pedagógica y Tecnológica de Colombia, Tunja. nancyegomez19@yahoo.es
Fecha de recepción: 21 de noviembre de 2007. Aceptado para publicación: 5 de noviembre de 2008
RESUMEN
En regiones tropicales y subtropicales se producen pérdidas en las plantas cultivadas como consecuencia de lluvias estacionales prolongadas. El exceso de agua produce condiciones de anoxia en el suelo en pocas horas. Las raíces sufren hipoxia o anoxia, lo cual tiene como resultado una crisis energética que afecta el crecimiento de la planta. El presente estudio se orientó hacia la determinación de crecimiento foliar y radical en dos especies de fique (Furcraea castilla y F. macrophylla) cultivadas en encharcamiento en campo abierto en Tunja, Colombia. Las plantas se desarrollaron a partir de bulbilos, en bolsas plásticas con 3 kg de suelo. Las plantas control se regaron cada 4 días. Las bolsas de las plantas encharcadas se cubrieron con una bolsa plástica adicional para limitar el drenaje y se regaron hasta mantener el agua 1 cm por encima de la superficie del suelo. En ambas especies la materia seca total de la planta, el peso específico de las hojas y el área foliar se redujeron con el encharcamiento, mientras que la longitud total radical se incrementó. La relación raíz:vástago se redujo en F. macrophylla pero se incrementó en F. castilla. A pesar de que ambas especies fueron fuertemente afectadas por el encharcamiento, F. macrophylla mostró mejor adaptación a este factor de estrés que F. castilla.
Palabras clave: área foliar, distribución de materia seca, relación raíz:vástago, longitud radical.
ABSTRACT
In tropical and subtropical regions severe crop losses are caused by prolonged seasonal rainfall. Excess water produces anoxic soil conditions within a few hours. Plant roots, consequently, suffer hypoxia or anoxia, which results in an energy crisis affecting the plant growth. The present study aims to determine the leaf and root growth of two sisal species (Furcraea castilla and F. macrophylla) growing under flooding stress in open field in Tunja, Colombia. Plants grew from bulblets in plastic bags filled with 3 kg of soil. Control plants were watered every 4 days. The bags of the flooded plants were covered with an additional plastic bag limiting drainage, and were watered until the water surface remained 1 cm above soil. In both species, the dry total matter per plant, the specific leaf weight and leaf area were depressed by flooding, while the total root length was increased. The root to shoot ratio was reduced by flooding in F. macrophylla but in F. castilla it increased. Although both species were strongly affected by flooding, F. macrophylla showed better adaptation to this stress factor than F. castilla.
Key words: leaf area, dry matter partitioning, root:shoot ratio, root length.
Introducción
El género Furcraea, miembro de la familia Agavaceae, es endémico de América tropical, específicamente de la región andina de Colombia y Venezuela; se encuentra distribuido tanto en localidades continentales como insulares, desde México hasta Bolivia, incluyendo todas las islas del Caribe (Ministerio de Agricultura y Desarrollo Rural, 2005a; García-Mendoza, 1998).
En Colombia el cultivo de fique participó con 0,07% en el monto total de la producción agrícola en 2004. El área cultivada osciló entre 15.388 y 23.094 ha entre 1994 y 2006. Para 2004 abarcó 16.333 ha, de las cuales, 38,3% se cultivaron en Cauca, 29,0% en Nariño y 26,3% en Santander (Ministerio de Agricultura y Desarrollo Rural, 2005b). A pesar de la relevancia de este cultivo, su cadena productiva obtuvo solo 0,6% de la inversión en ciencia y tecnología entre 2002 y 2006 (Ministerio de Agricultura y Desarrollo Rural, 2007), lo que es un indice de la falta de investigacion en este cultivo en Colombia.
En relacion con el genero Furcraea (Agavaceae) se han realizado investigaciones de gran relevancia orientadas al desarrollo de claves para su identificacion, descripcion, sinonimia, distribucion, habitat y fenologia (Garcia- Mendoza, 1998); se ha estudiado su filogenia con base en analisis de DNA (Bogler y Simpson, 1995; Bogler y Simpson, 1996); se ha desarrollado un protocolo para su micropropagacion in vitro (Martinez y Pacheco, 2006); se ha caracterizado su sistema de produccion y sus aplicaciones agroindustriales (Ministerio de Agricultura y Desarrollo Rural, 2005a; Simmons-Boyce et al., 2004; Itabashi et al., 1999; Perez, 1974); se reporta como una especie de metabolismo CAM (cassulacean acid metabolism) (Casierra-Posada y Gonzalez, 2008); se ha estudiado su comportamiento bajo condiciones de estres salino por NaCl (Casierra-Posada et al., 2006), a pesar de lo cual es todavia poco lo que se conoce sobre su fisiologia.
Las condiciones naturales en que se desarrollan los vegetales, como inundaciones, exceso de precipitacion, compactacion del suelo y actividad de los microorganismos, pueden tener como consecuencia una disminucion en la disponibilidad de oxigeno. Durante la imbibicion y germinacion de las semillas, la produccion de microsporas o el desarrollo de la fruta, la disponibilidad de oxigeno para la produccion energetica puede ser limitada. Esta condicion puede deberse tambien a la restriccion en la difusion de oxigeno en los tejidos internos o a los altos indices de metabolismo celular, como en celulas meristematicas en division (Larcher, 2001; Bailey-Serres y Chang, 2005).
Las celulas de los organismos aerobios han desarrollado respuestas adaptativas tendientes a compensar la crisis energetica generada por la privacion del oxigeno. Las respuestas a nivel celular en plantas completas varian e incluyen alteraciones en el metabolismo y desarrollo, que en algunos casos confieren tolerancia a largo plazo. Se han conseguido avances en la comprension del papel de la activacion o de factores que reducen la represion, transcripcion y alteraciones en la expresion genetica regulada por el oxigeno en algunos procariotes y eucariotes modelo. Los procesos que determinan estas respuestas incluyen sensores multiples directos o indirectos y rutas de transduccion de los mensajeros que actuan de manera independiente o reciproca. Los mecanismos de deteccion directa pueden implicar proteinas o compuestos que se unen o reaccionan con el oxigeno. Perturbaciones en la homeostasis celular, por ejemplo niveles de energia alterados, estados redox o niveles de calcio, pueden ser la base para deteccion de mecanismos indirectos (Blokhina, 2000; Bailey-Serres y Chang, 2005).
Entre las adaptaciones estructurales frente al fenomeno de baja disponibilidad de oxigeno en el suelo, se encuentra la formacion de aerenquima en tallos y raices de plantas acuaticas y en aquellas tolerantes a situaciones de encharcamiento, lo que permite la oxigenacion a larga distancia de los tejidos sometidos a hipoxia. La formacion de tejido interconectado, lleno de gases, tiene lugar mediante dos rutas. En el primer caso sucede la separacion de las celulas durante el desarrollo y muerte programada de las celulas, lo cual sucede frecuentemente, incluso en plantas que crecen en condiciones normales (Drew, 1997). En el segundo caso esta implicada la participacion del etileno (Jackson, 1985), el cual, en bajas concentraciones en el aire (0,1-1,0 µL·L-1), promueve la muerte normal de las celulas, pero en raices de plantas expuestas a hipoxia se han encontrado concentraciones altas tanto de la hormona como de su precursor (He et al., 1994). Por tanto, el objetivo de este trabajo fue la evaluacion del comportamiento de dos especies de fique en relacion con su crecimiento bajo condiciones de suelo inundado.
Materiales y metodos
El material vegetal objeto de estudio se obtuvo a partir de bulbilos de Furcraea macrophylla y F. castilla, los cuales crecieron en bolsas (3 kg de tierra negra), a campo abierto (13,8 °C de temperatura promedio y humedad relativa de 78,4%), en la granja Las Flores de la Universidad Pedagogica y Tecnologica de Colombia (UPTC) en Tunja, ubicada a 5° 33’ latitud norte, 73° 24’ longitud oeste. Al momento de la brotacion se aplicaron por planta 3 g de fertilizante comercial 15-15-15.
De cada especie se tomaron 60 plantas; 30 se mantuvieron a capacidad de campo. A las 30 plantas restantes, por variedad, se les realizo saturacion hidrica: cada matera se cubrio con una bolsa plastica y se adiciono agua que saturara el suelo hasta la superficie. El ensayo tuvo una duracion de siete meses, de los cuales las plantas de tratamiento correspondiente estuvieron encharcadas los dos ultimos meses. Las plantas se mantuvieron hasta que empezaron a presentar los sintomas de estres.
Como variables dependientes se tomaron: el peso seco de los tejidos, por secado de las muestras en una estufa a 105 oC, hasta peso constante; el peso especifico de las hojas como el cociente entre el peso seco y el area foliar; la longitud total radical como la suma de la longitud de todas las raíces; la relación raíz:vástago como la razón entre el peso seco de la raíz y los órganos aéreos; el área foliar se determinó con un analizador LI-COR® 3000A (LI-COR, Nebraska).
El experimento consistió en un ensayo bifactorial, con dos especies (Furcraea macrophylla y F. castilla) y dos condiciones de humedad en el suelo (normal y encharcado), diseño completamente al azar, 30 replicas, tomando una planta como unidad experimental. La información se analizó mediante una tabla Anava y la prueba de separación de promedios de Tukey (P<0,01) con la aplicación SPSS (Statistical Product and Service Solutions) versión 11.5.1.
Resultados y discusión
Como consecuencia del encharcamiento se encontró un incremento en los valores de pH del suelo. Los valores de pH del suelo en plantas regadas normalmente fue de 5,0 en promedio, pero en el suelo de plantas sometidas a encharcamiento se registraron valores de pH de 6,4 en promedio. Resultados similares en cuanto a la modificación del valor del pH en suelos encharcados habían sido reportados por León y Arregocés (1985) y Casierra-Posada y Vargas (2007), quienes justifican el incremento en el pH en suelos encharcados como una consecuencia de la reducción de óxidos mangánicos e hidróxidos férricos que permite la liberación de iones OH-. Por otro lado, el potencial redox en suelos encharcados se reduce drásticamente, lo que provoca el incremento de la población de microorganismos anaeróbicos, los cuales utilizan la materia orgánica del suelo como fuente de energía, pero requieren iones que puedan ser reducidos, como aceptores de electrones. Estos receptores de electrones pueden ser los nitratos o los sulfatos. De manera similar, el hierro trivalente o el manganeso tetravalente se pueden reducir a iones bivalentes (León y Arregocés, 1985; Schulze et al., 2002). Además, el CO2 también puede usarse como aceptor de electrones, lo que resulta en la producción de metano. Tales reacciones consumen protones, dando como resultado un incremento en el pH del suelo (Schulze et al., 2002).
El encharcamiento provocó una reducción en la producción total de materia seca de las plantas evaluadas, con diferencias altamente significativas (P<0,01). En F. macrophylla el encharcamiento redujo 38,9% la producción total de materia seca, mientras que en F. castilla la reducción estuvo en el orden de 48,0% (figura 1).
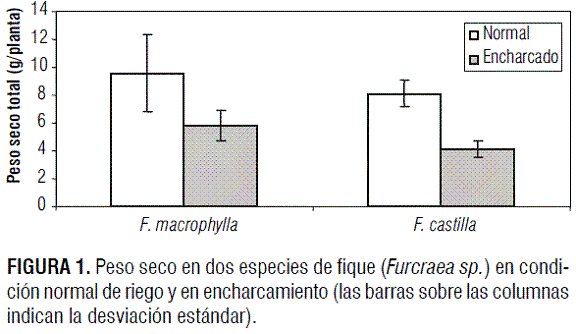
La disminución en la producción de materia seca puede ser una resultante del hecho de que la capacidad fotosintética resulta fuertemente inhibida bajo condiciones de encharcamiento, en plantas poco tolerantes a este factor causante de estrés. Lo cual sucede dado que la apertura estomática dirige el CER (CO2 exchange rate) en plantas encharcadas (Regehr et al., 1975; Phung y Knipling, 1976) y se reporta que la reducción en la conductancia estomática coincide con la reducción del CER y baja concentración interna de CO2 (Davies y Flore, 1986a, 1986b). Esta disminución en la toma de CO2 reduce las posibilidades de involucrar el compuesto al ciclo de Calvin, disminuyendo la carboxilación y por tanto la producción de materia seca. Los valores tan elevados de disminución de materia seca bajo condiciones de encharcamiento, fueron un índice del bajo nivel de tolerancia de las dos especies a este factor causante de estrés. Por otro lado, las raíces de plantas expuestas a baja disponibilidad de oxígeno en el sustrato deben cambiar su proceso respiratorio de aeróbico (con disponibilidad de O2 suficiente) a anaeróbico (bajo hipoxia). Mientras que en el primer caso se producirían 38 moléculas de ATP, durante la fermentación, inducida por la hipoxia, se producirían solo 2-3 moléculas de ATP, con el consecuente déficit de energía para los procesos metabólicos relacionados con el crecimiento (Brändle, 1996).
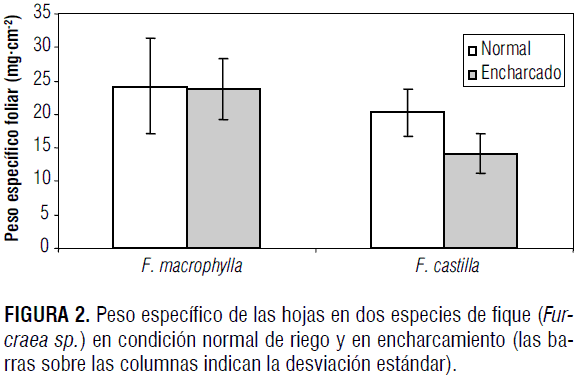
En cuanto a los resultados de la variable peso específico de las hojas (figura 2), el encharcamiento provocó disminución en sus valores. Se presentó diferencia altamente significativa (P<0,01) para el factor especie y para la interacción especie * condición; sin embargo, no hubo diferencia significativa para el factor condición. En F. macrophylla el encharcamiento redujo 2,0% el peso específico de las hojas, mientras que en F. castilla la reducción estuvo alrededor de 30,0%. Los resultados obtenidos en cuanto al comportamiento del peso específico de las hojas pueden articularse a la reducción en la tasa fotosintética que tiene lugar en plantas expuestas a encharcamiento. Adicionalmente, muchos estudios han mostrado la acumulación de aminoácidos en los tejidos vegetales en condiciones de baja disponibilidad de oxígeno en el suelo (Roberts et al., 1992; Good y Muench, 1993). Sousa y Sodek (2003) encontraron los máximos valores en la concentración de alanina entre 48 y 72 h luego de la exposición de plantas de Glycine max a la hipoxia. Además, el incremento en los niveles de proteínas implica que el metabolismo y producción de aminoácidos en condiciones de hipoxia es muy activo cuando las plantas se exponen a baja disponibilidad de oxígeno. Esta apreciación debe tomarse en consideración cuando la producción del fique se orienta hacia la obtención de sapogeninas (hecogeninas y tigogeninas) para utilizarlas en farmacéutica (Ministerio de Ambiente, Vivienda y Desarrollo Territorial, 2006).
La longitud radicular (figura 3) se vio favorecida por el encharcamiento con diferencias altamente significativas (P<0,01) en cuanto al factor condición, pero sin diferencia estadísticamente significativa para el factor especie ni para la interacción especie * condición. En F. macrophylla el encharcamiento incrementó 94,2% la longitud radical, y en F. castilla el incremento fue de 74,7%.
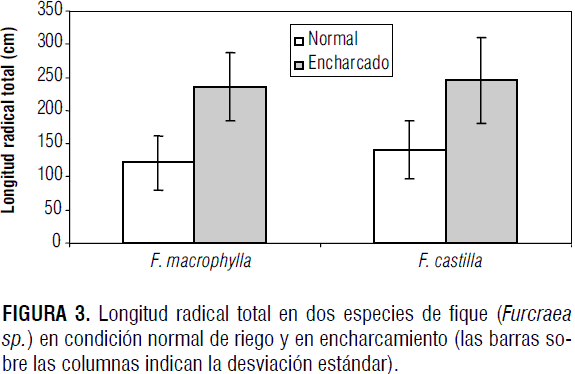
En raíces de Arabidopsis algunos análisis de mutantes revelaron que las especies reactivas de oxígeno (Reactive oxygen species - ROS) producidas por la NAD(P)H-oxidasa activan los canales de calcio, facilitando el flujo del elemento, el cual es necesario para el crecimiento de las raíces (Foreman et al., 2003; Mori y Schroeder, 2004). Además, la ROP (Response to Oxygen Deprivation) en Arabidopsis es responsable del gradiente de calcio intracelular en los pelos radicales (Jones et al., 2002). Estas observaciones permiten especular que la ROP puede promover un incremento en el calcio citosólico, bajo condiciones de hipoxia, lo cual podría ser mediado por la NAD(P)H-oxidasa, localizada posiblemente en la membrana plasmática (Bailey-Serres y Chang, 2005), lo cual daría como resultado el crecimiento de la raíz en vegetales expuestos a hipoxia.
El incremento en la longitud total de raíces encontrado se debió a la producción de raíces adventicias inducida por el encharcamiento (figura 4), mediante las cuales la planta tiene la posibilidad de tomar el oxígeno disuelto en la parte superior del perfil del suelo.
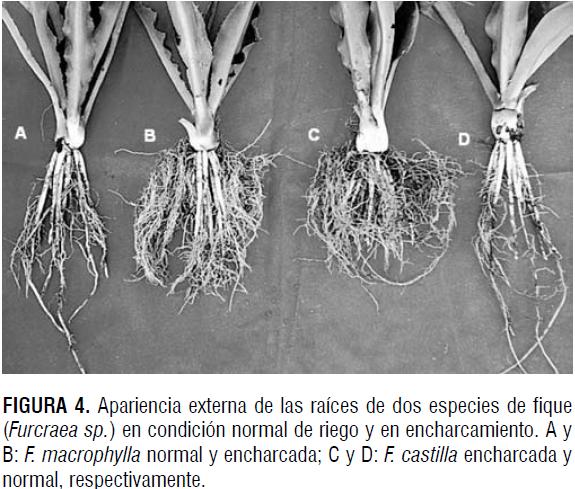
Un componente adicional en la respuesta de las plantas a la hipoxia es el etileno, el cual necesita oxígeno molecular para su síntesis. Este regulador del crecimiento se requiere para la muerte programada de células que determina tanto la formación de aerénquima como la formación de raíces adventicias en condiciones de baja difusión de oxígeno (Drew et al., 2000; Mergemann y Sauter, 2000; Gunawardena et al., 2001). Por tanto, la producción de raíces adventicias mediada por el etileno es un mecanismo importante en la adaptación de los vegetales a las condiciones de hipoxia, y es así como F. macrophylla tiene una mejor adaptación a estas condiciones que F. castilla, mediante esta modificación anatómica que le permitiría sobrevivir por un periodo más prolongado en encharcamiento.
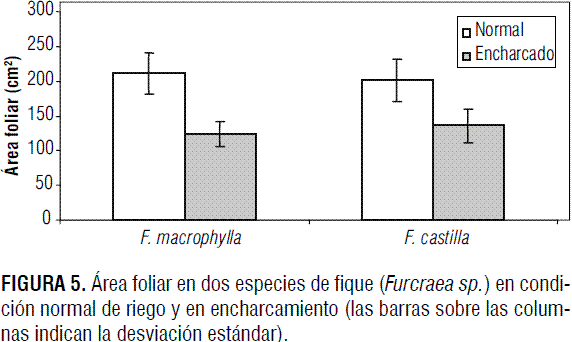
El encharcamiento redujo el área foliar en las plantas evaluadas de ambas especies, con diferencias altamente significativas (P<0,01) para el factor condición y significativas (P<0,05) para la interacción condición * especie. No hubo diferencia significativa para el factor especie. En F. macrophylla el encharcamiento redujo 41,5% la producción total de materia seca, mientras que en F. castilla la reducción estuvo en el orden de 32,7%.
Se han reportado resultados similares en cuanto a la reducción del área foliar (figura 5) en plantas expuestas a encharcamiento. En Persea americana el encharcamiento redujo 34,5% el área foliar (Besoain et al., 2005). Esta condición de estrés vegetal no solo redujo el área foliar sino que indujo entre 20 y 60% de necrosis en las láminas foliares de Oryza sativa como consecuencia de la producción y acumulación de etanol en los tejidos (Boamfa et al., 2003); lo mismo sucedió en plantas de Fragaria sp., en las cuales la hipoxia disminuyó entre 47,1 y 74,4%, con respecto a las plantas control, y además se produjo entre 30,1 y 41,2% de área foliar necrótica (Casierra-Posada y Vargas, 2007). Por tanto el encharcamiento afecta negativamente el crecimiento de la parte aérea en muchas especies vegetales, mediante la inhibición de la formación de nuevas hojas así como de la expansión foliar y del crecimiento de internodos. También causa senescencia prematura y abscisión de las hojas (Kozlowski, 1984; Kozlowski et al., 1991; Kozlowski y Pallardy, 1996). La expansión de las hojas se inhibe debido a la reducción de la extensibilidad de las paredes celulares, la cual es un factor determinante para el crecimiento (Smit et al., 1989).
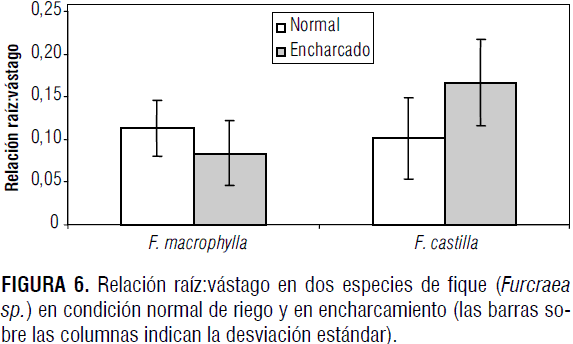
El encharcamiento indujo una respuesta diferencial en cuanto a la relación raíz:vástago (figura 6), en las dos especies evaluadas. Mientras que en F. macrophylla el valor de la relación se redujo 38,9% con el encharcamiento, en F. macrophylla este valor se incrementó 60,0%. Para el factor condición no se presentó diferencia significativa; sin embargo, sí hubo diferencia altamente significativa (P<0,01) para el factor especie y para la interacción especie * condición. Se ha encontrado que la fermentación es un proceso esencial en la tolerancia de las raíces a la hipoxia, lo cual no sucede en los vástagos de Arabidopsis. Es más, los tratamientos con ABA promueven la tolerancia a la falta de oxígeno solamente en las raíces de la misma especie (Ellis et al., 1999). Estas observaciones y las diferencias en la señalización manejada por el calcio en órganos específicos (Sedbrook et al., 1996) son indicadores de que las raíces y el vástago difieren ampliamente en los mecanismos de sensibilidad y respuesta a la falta de oxígeno (Bailey-Serres y Chang, 2005).
Dadas las alteraciones metabólicas, anatómicas y morfológicas inducidas por el encharcamiento, el patrón de asignación de materia seca en los diferentes órganos de las plantas se modificó (figura 7). El factor más determinante para esta modificación fue la acumulación de materia seca en las raíces.
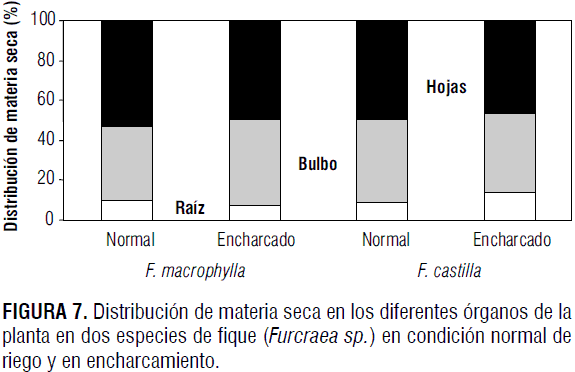
Mientras que en F. macrophylla la acumulación de materia seca en las raíces se redujo 24,7% con el encharcamiento, a pesar de que la longitud total de las raíces se había incrementado 94,2% con respecto a las plantas control, en F. castilla el peso seco de las raíces se incrementó 51,1%, con un aumento de 74,7% en la longitud de las raíces, lo que implica que las raíces de F. macrophylla fueron menos densas que las de F. castilla. Este resultado sugiere una mayor formación de aerénquima en F. macrophylla que en F. castilla, con una mayor posibilidad de movilización de O2 como sustrato respiratorio hacia los tejidos sometidos a hipoxia. La formación de aerénquima es una respuesta adaptativa de plantas que tienen la posibilidad de tolerar las condiciones de baja disponibilidad de oxígeno en el sustrato (Schulze et al., 2002).
A pesar de que ambas especies estudiadas mostraron baja adaptabilidad a las condiciones de estrés por hipoxia, según los factores del crecimiento estudiados, F. macrophylla mostró mejor adaptación a este factor que F. castilla; por consiguiente, se debe ser cuidadoso al seleccionar la especie a cultivar en regiones con suelos pesados y precipitación alta, pues estas condiciones limitan la difusión de oxígeno en el suelo, lo que haría que el crecimiento y, por tanto, la producción se vean seriamente comprometidos.
Agradecimientos
Este estudio se desarrolló con el apoyo de la Dirección de Investigaciones (DIN) de la Universidad Pedagógica y Tecnológica de Colombia, Tunja, en el marco del plan de trabajo del Grupo de Investigación Ecofisiología Vegetal, adscrito al programa de Ingeniería Agronómica de la Facultad de Ciencias Agropecuarias.
Literatura citada
Bailey-Serres, J. y R. Chang. 2005. Sensing and signalling in response to oxygen deprivation in plants and other organisms. Ann. Bot. 96, 507-518. [ Links ]
Besoain, X., C. Arenas, E. Salgado y B.A. Latorre. 2005. Effect of soil flooding period on the development of avocado (Persea americana) root rot caused by Phytophthora cinnamomi. Cien. Inv. Agr. 32(2), 79-84. [ Links ]
Blokhina, O. 2000. Anoxia and oxidative stress: lipid peroxidation, antioxidant status and mitochondrial functions in plants. Ph. D. thesis. The Faculty of Science, University of Helsinki. 79 p. [ Links ]
Boamfa, E.I., P.C. Ram, M.B. Jackson, J. Reuss y F.J.M. Harren. 2003. Dynamic aspects of alcoholic fermentation of rice seedlings in response to anaerobiosis and to complete submergence: relationship to submergence tolerance. Ann. Bot. 91, 279-290. [ Links ]
Bogler, D.J. y B.B. Simpson. 1995. A chloroplast DNA study of the Agavaceae. Syst. Bot. 20(2), 191-205. [ Links ]
Bogler, D.J. y B.B. Simpson. 1996. Phylogeny of Agavaceae based on its rDNA sequence variation. Amer. J. Bot. 83(9), 1225-1235. [ Links ]
Brändle, R. 1996. Überflutung und Sauerstoffmangel. pp. 123-148. En: Brunold, C., A. Rüegsegger y R. Brändle (eds.). Stress bei Pflanzen. Haupt-Verlag, Berh. [ Links ]
Casierra-Posada, F. y D.M. González. 2008. Cambio circadiano en los valores de pH y acidez titulable en la savia de dos especies de fique. Revista Orinoquia (en prensa). [ Links ]
Casierra-Posada, F., W.A. Pérez y F. Portilla. 2006. Relaciones hídricas y distribución de materia seca en especies de fique (Furcreaa sp. Vent.) cultivadas bajo estrés por NaCl. Agron. Colomb. 24(2), 280-289. [ Links ]
Casierra-Posada, F. y Y.A. Vargas. 2007. Crecimiento y producción de fruta en cultivares de fresa (Fragaria sp.) afectados por encharcamiento. Rev. Colomb. Cienc. Hort. 1(1), 21-32. [ Links ]
Davies, F.S. y J.A. Flore. 1986a. Short-term flooding effects on gas exchange and quantum yield of rabbiteye blueberry (Vaccinium ashei Reade). Plant Physiol. 81, 289-292. [ Links ]
Davies, F.S. y J.A. Flore. 1986b. Gas exchange and flooding stress of highbush and rabbiteye blueberries. J. Amer. Soc. Hort. Sci. 111, 565-571. [ Links ]
Drew, M.C. 1997. Oxygen deficiency and root metabolism: injury and acclimation under hypoxia and anoxia. Annu. Rev. Plant Physiol. Plant Mol. Biol. 48, 223- 250. [ Links ]
Drew, M.C., C.-J. He y P.W. Morgan. 2000. Programmed cell death and aerenchyma formation in roots. Trends Plant Sci. 5(3), 123-127. [ Links ]
Ellis, M.H., E.S. Dennis y W.J. Peacock. 1999. Arabidopsis roots and shoots have different mechanisms for hypoxic stress tolerance. Plant Physiol. 119, 57-64. [ Links ]
Foreman, J., V. Demidchik, J.H. Bothwell, P. Mylona, H. Miedema y M.A. Torres. 2003. Reactive oxygen species produced by NADPH oxidase regulate plant cell growth. Nature 422, 442-446. [ Links ]
García-Mendoza, A.J. 1998. Revisión taxonómica del género Furcraea (Agavaceae) en México y Guatemala. UNAM, Instituto de Biología. Informe final resultado de proyecto Conabio. México. 67 p. [ Links ]
Good, A.G. y D.G. Muench. 1993. Long-term anaerobic metabolism in root tissue. Plant Physiol. 101, 1163-1168. [ Links ]
Gunawardena, A.H., D.M. Pearce, M.B. Jackson, C.R. Hawes y D.E. Evans. 2001. Characterization of programmed cell death during aerenchyma formation induced by ethylene or hypoxia in roots of maize (Zea mays L.). Planta 212, 205-214. [ Links ]
He, Ch.-J., M.C. Drew y P.W. Morgan. 1994. Plant induction of enzymes associated with lysigenous aerenchyma formation in roots of Zea mays during hypoxia and nitrogen starvation. Plant Physiol. 105, 861-865. [ Links ]
Itabashi, M., K. Segawa, Y. Ikeda, S. Kondo, H. Naganawa, T. Koyano y K. Umezawa. 1999. A new bioactive steroidal saponin, furcreastatin, from the plant Furcraea foetida. Carbohydr. Res. 323(1-4), 57-62. [ Links ]
Jackson, M.B. 1985. Ethylene and responses of plants to soil waterlogging and submergence. Annu. Rev. Plant Physiol. 36, 145-174. [ Links ]
Jones, M., J.J. Shen, Y. Fu, H. Li, Z. Yang y C.S. Grierson. 2002. The Arabidopsis ROP2 GTPase is a positive regulator of both root hair initiation and tip growth. Plant Cell 14, 763-776. [ Links ]
Kozlowski, T.T. 1984. Responses of woody plants to flooding. pp. 129-163. En: Kozlowski, T.T. (ed.). Flooding and plant growth. Academic Press, Orlando, FL. [ Links ]
Kozlowski, T.T., P.J. Kramer y S.G. Pallardy. 1991. The physiological ecology of woody plants. Academic Press, San Diego, CA. 657 p. [ Links ]
Kozlowski, T.T. y S.G. Pallardy. 1996. Growth control in woody plants. Academic Press, San Diego, CA. 641 p. [ Links ]
Larcher, W. 2001. Ökophysiologie der Pflanzen. 6th ed. Eugen Ulmer, Stuttgart. pp. 324-328. [ Links ]
León, L.A. y O. Arregocés. 1985. Química de los suelos inundados. pp. 287-305. En: Tascón, E.E. y D. García (eds.). Arroz: investigación y producción. Guía de estudio. CIAT, Cali. [ Links ]
Martínez, M.A. y J.C. Pacheco. 2006. Protocolo para la micropropagación de Furcraea macrophylla Baker. Agron. Colomb. 24(2), 207-213. [ Links ]
Mergemann, H. y M. Sauter. 2000. Ethylene induces epidermal cell death at the site of adventitious root emergence in rice. Plant Physiol. 124, 609-614. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2005a. Acuerdo para el fomento de la producción y la competitividad del subsector del fique. Corpoica, IICA, Bogotá. 46 p. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2005b. Anuario estadístico. Información tomada de URPA-Boyacá en medio magnético. Bogotá. [ Links ]
Ministerio de Agricultura y Desarrollo Rural. 2007. Estadísticas sector agropecuario. En: www.minagricultura.gov.co/archivos/ carpeta_ministro_3_septiembre_2007def.pdf; consulta: 28 de septiembre de 2007. [ Links ]
Ministerio de Ambiente, Vivienda y Desarrollo Territorial. 2006. Guía ambiental del subsector fiquero. Cadena productiva nacional del fique (Cadefique). Segunda edición. En: www. corpoica.org.co/Archivos/Publicaciones/Guia_Ambiental_ Fiquera_2006_.pdf; consulta: 5 de septiembre de 2007. [ Links ]
Mori, I.C. y J.I. Schroeder. 2004. Reactive oxygen species activation of plant Ca2+ channels. A signaling mechanism in polar growth, hormone transduction, stress signaling, and hypothetically mechanotransduction. Plant Physiol. 135, 702-708. [ Links ]
Pérez M., J.A. 1974. El fique. Su taxonomía, cultivo y tecnología. Segunda edición. Compañía de Empaque, Editorial Colina. 115 p. [ Links ]
Phung, H.T. y E.B. Knipling. 1976. Photosynthesis and transpiration of Citrus seedlings under flooded conditions. HortScience 11, 131-133. [ Links ]
Regehr, D.L., F.A. Bazzaz y W.R. Boggess. 1975. Photosynthesis, transpiration and leaf conductance of Populus deltoides in relation to flooding and drought. Photosynthetica 9, 52-61. [ Links ]
Roberts, J.K.M., M.A. Hooks, A.P. Miaullis, S. Edwards y C. Webster. 1992. Contribution of malate and amino acid metabolism to cytoplasmic pH regulation in hypoxic maize root tips studied using nuclear magnetic resonance spectroscopy. Plant Physiol. 9, 480-487. [ Links ]
Schulze, E.D., E. Beck y K. Müller-Hohenstein. 2002. Oxigen de- ficiency (anaerobiosis and hypoxia). pp. 99-116. En: Schulze, E.D., E. Beck y K. Müller-Hohenstein (eds.). Plant ecology. Springer Verlag, Berlín. [ Links ]
Sedbrook, J.C., P.J. Kronebusch, G.G. Borisy, A.J. Trewavas y P.H. Masson. 1996. Transgenic Aequorin reveals organ specific cytosolic Ca2+ responses to anoxia in Arabidopisis thaliana seedlings. Plant Physiol. 111, 243-257. [ Links ]
Smit, B., M. Stachowiak y E. van Volkenburgh. 1989. Cellular processes limiting leaf growth in plants under hypoxic root stress. J. Exp. Bot. 40, 89-94. [ Links ]
Simmons-Boyce, J.L., W.F. Tinto, S. McLean y W.F. Reynolds. 2004. Saponins from Furcraea selloa var. Marginata. Fitoterapia 75(7-8), 634-638. [ Links ]
Sousa, C.A.F. y L. Sodek. 2003. Alanine metabolism and alanine aminotransferase activity in soybean (Glycine max) during hypoxia of the root system and subsequent return to normoxia. Environ. Exp. Bot. 50, 1-8. [ Links ]














