Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.26 no.3 Bogotá Sep./Dec. 2008
Liliana Hoyos-Carvajal1, Paola Chaparro2, Miriam Abramsky3, Ilan Chet3 y Sergio Orduz4
1 Profesora auxiliar, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. limhoyosca@unal.edu.co
2 Investigadora, Research Associate Microbiology Department, San Antonio, Texas (USA). pao48@hotmail.com
3 Investigadores, Facultad de Agricultura, Universidad Hebrea de Jerusalén, Jerusalén (Israel). chet@agri.huji.ac.il
4 Profesor asociado, Facultad de Ciencias, Universidad Nacional de Colombia, Medellín; Corporación para Investigaciones Biológicas (CIB), Medellín (Colombia). sorduzp@unalmed.edu.co
Fecha de recepción: 11 de marzo de 2008. Aceptado para publicación: 5 de noviembre de 2008
RESUMEN
Se evaluó la eficacia biológica de ocho aislamientos de Trichoderma spp. provenientes de suelos de Colombia para el control de los agentes causales de volcamiento, Sclerotium rolfsii y Rhizoctonia solani, bajo condiciones in vitro y de invernadero. Los análisis in vitro mostraron la capacidad antagónica de todos los aislamientos evaluados. En condiciones de invernadero, cuatro aislamientos fueron altamente eficaces contra S. rolfsii en plantas de fríjol en semillero (>90% de reducción de la enfermedad) y dos aislamientos fueron eficaces contra R. solani en plantas de algodón en semillero (58 y 61% de reducción de la enfermedad). El análisis UP-PCR y DS-PCR permitió determinar tres grupos de aislamientos; dentro de estas asociaciones formadas no se encontró ninguna relación evidente entre la posición en el dendrograma y la actividad antagónica, pero sí permitió separar las especies de Trichoderma por grupos, e incluso encontrar diferencias dentro de aislamientos de una misma especie. Los resultados muestran que el comportamiento micoparasítico de los aislamientos de Trichoderma spp. varía según el hongo fitopatógeno, evidenciando una amplia especificidad del antagonista por su sustrato, es decir por el hongo atacado; por lo tanto es necesario realizar cuidadosas selecciones del aislamiento de Trichoderma que se utilice en programas de control de fitopatógenos.
Palabras clave: eficacia biológica, control biológico, hongo fitopatógeno, UP-PCR, DS-PCR
ABSTRACT
The biological effectiveness of eight isolates of Trichoderma spp. coming from Colombian soils was evaluated under in vitro and greenhouse conditions for the controlled causal agents of damping-off, Sclerotium rolfsii and Rhizoctonia solani. In vitro analysis showed the antagonistic capacity of all evaluated isolates. Under greenhouse conditions, four isolates were highly effective against S. rolfsii in bean nursery plants (>90% of disease reduction) and two isolates were effective against R. solani in cotton nursery plants (58 and 61% of disease reduction). The analysis UP-PCR and DS-PCR permitted the determination of three groups of isolates. Within these associations no clear link between the position in the dendrogram and antagonistic activity was found, but it allowed separation of species of Trichoderma by groups and even within isolates of the same species. The results indicate that the mycoparasitic capacity of Trichoderma spp. varies according to the phytopathogen fungi, showing a broad specificity of the antagonist for its substrate that is attacked by the fungus. Therefore it is necessary to make careful selections of the isolates of Trichoderma to be used in pathogens control programs.
Key words: biological effectiveness, biological control, phytopathogen fungi, UP-PCR, DS-PCR.
Introducción
Los fitopatógenos Rhizoctonia solani Kühn y Sclerotium rolfsii Sacc. causan enfermedades en los tallos y las raíces de una gran variedad de cultivos y son responsables del volcamiento de plántulas de semillero y pudriciones en etapas de pre y posemergencia (Adams, 1990; Goldman et al., 1994). Estas dos especies de fitopatógenos ocupan nichos ecológicos similares y su rango de hospederos es semejante; sus estructuras de resistencia están constituidas por esclerocios que pueden permanecer viables en el suelo hasta 10 años y pueden escapar con facilidad de la acción de los fungicidas de origen sintético (Adams, 1990). El control con fungicidas de origen sintético se hace difícil debido a que se han de atacar los esclerocios remanentes en el suelo y se debe mantener la acción tóxica en el tiempo.
Por esta razón, las dos especies de hongos fitopatógenos son un buen objetivo para seleccionar un agente de control biológico que pueda reducir los nuevos propágulos generados por los fitopatógenos y además que se multiplique y colonice el suelo donde se hallan las estructuras infectivas de los patógenos; estas características las ofrecen hongos antagonistas como Trichoderma spp. (Mathivanan et al., 2000). Tanto R. solani como S. rolfsii son susceptibles al ataque de algunos aislamientos de Trichoderma spp. Se ha encontrado actividad micoparasítica contra Rhizoctonia spp. en aislamientos de T. hamatum, T. harzianum, T. longibrachiatum, T. koningii, T. pseudokoningii, T. viride, T. virens y Trichoderma sp. (Howell et al., 2000; Jakhar et al., 1998; Jeffries y Young, 1994; Lewis et al., 1996). También Sclerotium spp. es parasitado por aislamientos de T. longibrachiatum, T. viride, T. hamatum y T. harzianum (Inbar et al., 1996; Lewis y Fravel, 1996), y algunas de estas cepas presentan actividad antagónica sobre ambos fitopatógenos. En condiciones controladas y de campo se ha demostrado la eficacia de Trichoderma para controlar enfermedades causadas por R. solani en plantas de algodón, lechuga, berenjena, ocra y girasol, logrando reducciones significativas del patógeno en estos cultivos (Chun y Choi, 1990; Mathivanan et al., 2000).
La selectividad de aislamientos particulares de Trichoderma sobre los fitopatógenos se debe a factores de reconocimiento que determinan en forma inicial la acción de antagonismo de un hongo sobre otro y que, posteriormente, desencadenan respuestas típicas de micoparasitismo, como producción de enzimas líticas. En estudios respecto al mecanismo de acción de Trichoderma sobre Rhizoctonia spp. y Sclerotium spp. se ha encontrado que la interacción inicial entre antagonista y fitopatógeno obedece a la acción de lectinas durante el proceso de reconocimiento y posteriormente se inicia la liberación al medio de diversas enzimas con actividad quitinolítica, glucanolítica, celulolítica y proteolítica (Carsolio et al., 1999; El-Katatny et al., 2001; Inbar et al., 1996) que tienen como finalidad degradar las estructuras del hongo fitopatógeno y después nutrirse de los productos resultantes de la actividad enzimática (Goldman et al., 1994). También se ha demostrado que en la interacción Trichoderma-planta-patógeno hay mediación directa del antagonista sobre la planta para que el patógeno no la ataque; una revisión reciente del fenómeno la realizó Howell (2006), y en ella se exponen algunos mecanismos mediante los cuales la planta de algodón puede escapar del ataque de patógenos; Trichoderma modula o estimula algunas respuestas en la planta. T. virens elicita la producción de terpenoides sobre la planta de algodón, haciendo que esta se proteja contra la infección por R. solani (Hanson y Howell, 2004).
Con el fin de conocer qué rango de especies o tipos de aislamientos de Trichoderma son antagónicos sobre un organismo en particular y garantizar la calidad en posteriores formulaciones es necesario llevar a cabo pruebas para la identificación del hongo de interés. Con tal finalidad se han utilizado marcadores multisitio que ofrecen información de la especie y permiten hacer un monitoreo a nivel infragenérico (o infraespecífico); tales marcadores incluyen DS-PCR (reacción en cadena de la polimerasa, PCR, de doble estringencia) (Lubeck et al., 1999) y UP-PCR (PCR con iniciadores universales) (Matioli y Brito, 1995). Estos últimos se han utilizado en la identificación de cepas de Trichoderma con alta actividad micoparasítica. Tanto los marcadores UP-PCR como los DS-PCR son similares a los RAPD (amplificación al azar de fragmentos polimórficos) ya que sin previo conocimiento de la secuencia a amplificar se generan múltiples bandas. No obstante, la UP-PCR y la DS-PCR utilizan temperaturas de alineamiento relativamente altas (>53 °C), características que les confieren alta reproducibilidad en los patrones de bandas generados.
Con estos antecedentes se planteó como objetivo de este estudio evaluar la capacidad de ocho aislamientos de Trichoderma spp., de Colombia, para reducir las enfermedades causadas por R. solani y S. rolfsii en condiciones de laboratorio y de invernadero y utilizar marcadores moleculares UP-PCR y DS-PCR como criterio para la identificación de las especies de los aislamientos de Trichoderma y para un posible establecimiento de relaciones entre la actividad micoparasítica de Trichoderma sobre los fitopatógenos empleados en el presente estudio.
Materiales y métodos
Material biológico
Se estudiaron 7 aislamientos de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg (T-21, T-25, T-26, T-71, T-86, T-109 y T-110) y 1 de Trichoderma longibrachiatum Rifai (T-29), para un total de 8 aislamientos, procedentes de la colección de microorganismos de la Unidad de Biotecnología y Control Biológico de la Corporación para Investigaciones Biológicas (CIB), obtenidos en suelos de la sabana Cundiboyacense e identificados mediante caracteres moleculares, morfológicos y metabólicos (Hoyos-Carvajal et al., 2009). Para el análisis molecular, además de los aislamientos de Trichoderma se incluyeron una cepa de Gliocladium spp. G-56 y una de Fusarium spp. Los aislamientos de patógenos de algodón y fríjol para los estudios in vitro se colectaron en Colombia y se identificaron mediante caracteres morfológicos (Barnett, 1960). El experimento de invernadero se ejecutó en la Facultad de Agricultura de la Universidad Hebrea de Jerusalen. Todos los hongos se mantuvieron en PDA y se subcultivaron segun lo requerido a 25 °C.
Analisis de antagonismo in vitro
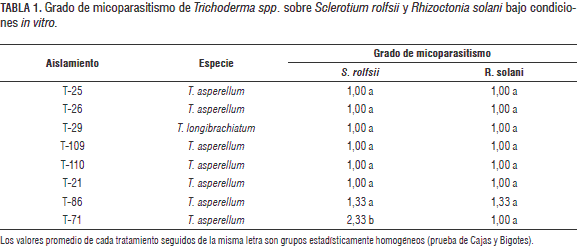
Los aislamientos de Trichoderma spp. se evaluaron contra Rhizoctonia solani Kuhn y Sclerotioum rolfsii Sacc. y se determino su capacidad antagonica de acuerdo con el sistema de rangos descrito por Royse y Ries (1978). Para tal fin, en cajas de Petri de 9 cm de diametro con PDA se colocaron discos de 4 mm de diametro del antagonista y del fitopatogeno a una distancia de 3 cm; la distancia de los microorganismos con respecto al borde de la caja de Petri fue de 3 cm. Cada tratamiento se realizo por triplicado y se mantuvo a 20 °C en fotoperiodo 12:12 (luz:oscuridad) durante 4 dias. El grado de antagonismo se evaluo segun una escala en proporciones crecientes, donde un valor de 1 representa un cubrimiento del 100% de Trichoderma sobre el fitopatogeno y 5 la ausencia de desarrollo del antagonista y crecimiento de un 100% del fitopatogeno.
Un aislamiento de Trichoderma se considero antagonista contra el patogeno si el promedio de los grados para una comparacion determinada (3 cajas de Petri) era < 2, y no antagonista si el promedio era > 3. A los aislamientos con un grado entre 2 y 3 no se les asigno clasificacion (Roise y Ries, 1978). El analisis estadistico de los experimentos in vitro se realizo mediante la prueba de Kruskall-Wallis, con el programa Statistica version 5.1 - 1998 (StatSoft, Inc.) y la separacion de grupos estadisticamente homogeneos se llevo a cabo por medio de la prueba de grafico de cajas y bigotes (box and wisker plots).
Experimentos en invernadero
Los experimentos se realizaron en semilleros de algodon (Gossypium barbardense L.) y de frijol (Phaseolus vulgaris L.) con potes de 0,5 kg de tierra (arcillo-arenosa, pH 7,4). Se inocularon simultaneamente en los potes las conidias de Trichoderma (1 x 106 conidias/g de tierra) y los hongos patogenos. R. solani (2 g micelio/kg de tierra) para inducir sintomas de mal del tallo en algodon y S. rolfsii (80 mg micelio/ kg de tierra) para inducir sintomas de moho blanco en el frijol. Se dejo un tratamiento denominado control absoluto en el cual no se inocularon hongos, y otro denominado testigo enfermo el cual fue inoculado solamente con el fitopatogeno. Las condiciones de crecimiento de las plantas se controlaron en un invernadero a 25-27 °C de temperatura y a 70-80% de humedad relativa. Cada experimento constaba de 10 replicas y se realizo en tres epocas diferentes.
Los sintomas de la enfermedad se registraron 7 dias despues del tratamiento. La incidencia se definio como porcentaje de plantas enfermas y la reduccion de la enfermedad se determino como 100*(X-Y/X), donde X es el numero de plantas enfermas en el testigo enfermo y Y las plantas enfermas en cada tratamiento. Para el analisis estadistico de los experimentos de invernadero se realizo un Anova y comparaciones de Tukey, en un diseno totalmente al azar con el programa Statistica version 5.1 - 1998 (StatSoft, Inc.).
Extraccion de ADN
Se efectuo de acuerdo con el metodo modificado descrito por Castle et al. (1998). Los aislamientos de los hongos se cultivaron en medio liquido (extracto de levadura 2,5%, glucosa 2,5%, NaNO3 0,2%) durante ocho dias a 28 °C y 125 rpm. Posteriormente se recupero el micelio por filtracion y se liofilizo. Un gramo del micelio liofilizado se macero en nitrogeno liquido, se le agregaron 7,5 mL de buffer de extraccion (50 mM Tris-HCl pH 7,2; 50 mM EDTA; 3% SDS; 1 M NaCl; 1% Mercaptoetanol) y se incubo a 60 ¨¬C por una hora, mezclando cada 10 min. Despues se adiciono un volumen de cloroformo:isoamil alcohol (24:1) y se mezclo por inversion hasta formar una emulsion.
Luego se centrifugo a 4 °C, 6.000 g por 15 min y se paso el sobrenadante a un tubo nuevo. El tratamiento con cloroformo:isoamil alcohol se realizo dos veces mas. Posteriormente se anadieron 0,54 volumenes de Isopropanol, se centrifugo a 4 °C, 3.500 g por 5 min, el pellet se seco al vacio y se resuspendio en 300 μL de buffer Tris EDTA. A continuacion se realizo una digestion con ARNasa A en concentracion final de 10 μg·mL-1 y se incubo a 37 °C por 30 min. Despues se adiciono acetato de sodio pH 5,2 a una concentracion final de 0,3 M y 2 volumenes de etanol absoluto y luego se centrifugo a 4 °C, 3.000 g durante 10 min. El sobrenadante se descarto y el precipitado se lavo con 500 μL de etanol al 70% y se volvio a centrifugar a 4 °C, 3.000 g por 10 min. Posteriormente el precipitado se seco al vacio y se resuspendio en 300 μL de buffer Tris EDTA.
Por ultimo las muestras se centrifugaron a 4 °C, 1.350 g durante 10 min y se transfirio el sobrenadante a nuevos tubos. La integridad de ADN se determino mediante electroforesis en gel de agarosa al 0,8% tenido con bromuro de etidio y se midio la concentracion por densitometria usando el software Quantive One 4.0.3 (Biorad), comparando la intensidad de las bandas de interes con el marcador de peso molecular low DNA mass ladder (Gibco BRL).
DS-PCR
Se usaron los primers para microsatélites A137 (5' GGCTCGAAGTGGACTAGCAC 3') y B175 (5'TATA CCTTTCGTTCGGCCTG 3') y los primers RAPD OPM02 (5'-ACAACGCCTC-3'), OPM07 (5'-CCGTGACTCA-3') y OPM-08 (5'-TCTGTTCCCC-3'); en las combinaciones, A137-OPM02, B175-OPM08 y 58A-OPM07. La reacción de amplificación contenía buffer PCR 1X, MgCl2 3 mM, dNTPs 0,2 mM, primer microsatélite 0,8 µM, primer RAPD 1,6 µM, Taq polimerasa 1 U (Gibco BRL), 25 ng de ADN y agua destilada estéril hasta completar un volumen de 25 µL. El programa de amplificación se realizó en dos fases: la primera consistió en 15 ciclos de 94 °C por 20 s 53 °C por 1 min y 72 °C por 20 s. En la segunda fase se realizaron 25 ciclos de 94 °C por 30 s, 35 °C por 30 s y 72 °C por 1 min. El programa de amplificación incluyó una denaturación inicial de 94 °C por 2 min y una elongación final de 72 °C por 1 min (Matioli y Brito, 1995).
UP-PCR
La técnica UP-PCR contempla el uso de un único primer de aproximadamente 16-21 nucleótidos en longitud y un máximo de 30 ciclos en cada reacción de amplificación. En este trabajo se utilizaron los primers L-45 5'-GTAAAACGACGGCCCAGT- 3' y L-15/AS19 5'-GAGGGTGGCGGCTAG- 3' (Lubeck et al., 1999). Las concentraciones de los reactivos fueron las mismas utilizadas para DS-PCR; el programa de amplificación incluyó una denaturación inicial a 94 °C por 2,5 min, seguida por 30 ciclos de 92 °C por 50 s, 53 °C por 90 s y 72 °C por 30 s, finalizando con una fase de extensión de 72 °C por 3 min.
Análisis
Todas las reacciones de amplificación se realizaron al menos dos veces y la separación de los productos amplificados por DS-PCR y UP-PCR se efectuó en geles de poliacrilamida al 12% y se revelaron con AgNO3 (Sambrook et al., 1989). Los resultados obtenidos con los marcadores moleculares se analizaron con el algoritmo de grupos de medias aritméticas (Upgma) y el coeficiente de similitud de Jackard que permitió la construcción de un dendrograma construido con el software Statistica (StatSoft, Inc.), versión 5.1, que muestra las relaciones entre los aislamientos analizados.
Resultados y discusión
Antagonismo in vitro y en invernadero de Trichoderma sobre S. rolfsii y R. solani
Los aislamientos de Trichoderma spp. evaluados contra S. rolfsii mostraron 100% de actividad antagónica. De acuerdo con resultados preliminares de los ensayos de antagonismo in vitro, sobre el aislamiento evaluado de R. solani es necesario el establecimiento inicial de Trichoderma spp. en las cajas de Petri de 12 a 24 h antes, ya que el crecimiento del antagonista es menor en comparación con el del fitopatógeno durante los 3 a 5 días iniciales, pero al cabo del noveno día Trichoderma spp. logra establecerse sobre R. solani y parasitar totalmente su micelio. Todos los aislamientos, excepto T-71 (T. asperellum), mostraron un 100% de actividad antagónica para R. solani (tabla 1). De acuerdo con los resultados de los ensayos de antagonismo in vitro, todos los aislamientos utilizados en este estudio poseen actividad antagónica sobre los aislamientos empleados de S. rolfsii y R. solani; no obstante, en pruebas in vitro con este último, tal como se mencionó anteriormente, es necesario el establecimiento inicial de los aislamientos de Trichoderma en las cajas de Petri.
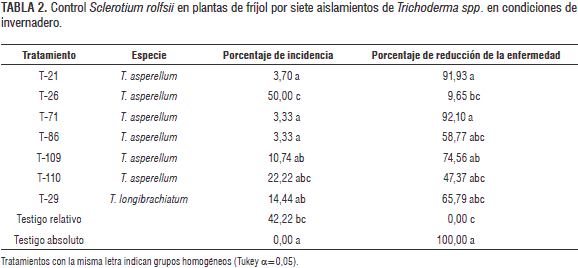
En condiciones de invernadero los aislamientos T. asperellum T-21 y T-71 fueron efectivos controlando la infección causada por S. rolfsii. En tratamientos con estos antagonistas la enfermedad tuvo una incidencia entre 3,3 y 3,7% en semilleros de plantas de fríjol, logrando una reducción superior al 90% (tabla 2). T-86, T-109 y T-110 (T. asperellum) y T-29 (T. longibrachiatum) presentaron una actividad antagónica media en condiciones de invernadero, con porcentajes de reducción de la enfermedad entre 47 y 74%.
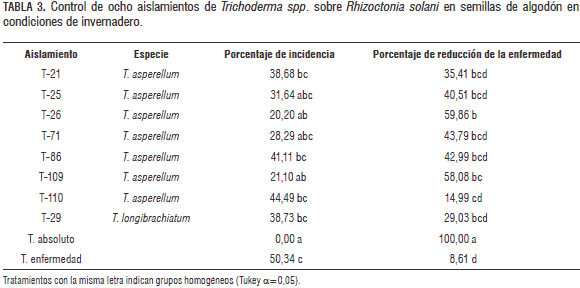
El aislamiento T-26 de T. asperellum no mostró actividad controladora y presentó valores de incidencia de la enfermedad similares a los de las plantas inoculadas con el fitopatógeno (únicamente 50%). La disminución de la incidencia de la enfermedad causada por R. solani observada en semilleros de plantas de algodón fue menor que en el caso anterior (tabla 3). Los aislamientos T-26 y T-109 de T. asperellum presentaron una reducción de la enfermedad cercana a un 60% con respecto a las plantas inoculadas únicamente con R. solani en las cuales la incidencia del "mal de tallo" fue de un 50%. Tratamientos de T. asperellum T-21, T-25, T-71 y T-86 y T. longibrachiatum T-29 presentan valores intermedios de control de la enfermedad con porcentajes de reducción de incidencia entre 29 y 43%. La actividad más baja en control de R. solani se presentó en el tratamiento con el aislamiento T-110 de T. asperellum, con 15% en reducción de la enfermedad.
Usualmente se infiere que la actividad antagónica in vitro de los aislamientos de Trichoderma constituye un indicativo inicial de su promisoria actividad biológica contra hongos fitopatógenos. Regularmente se seleccionan los mejores y luego se lleva a ensayos de invernadero y posteriormente a campo, donde se descarta un considerable número de aislamientos como agentes de regulación biológica de hongos fitopatógenos por la inconsistencia de actividad entre el medio in vitro y en invernadero (Carsolio et al., 1999; Howell, 1998). En el presente trabajo algunos aislamientos eficientes en las pruebas in vitro mostraron una disminución o incluso ausencia en su actividad micoparasítica en invernadero y viceversa, es decir no existe un indicativo claro de actividad entre los ensayos de laboratorio y los realizados in vivo, en contraste con investigaciones similares de Durman et al. (1999) quienes encontraron una buena correlación entre los métodos in vitro y los ensayos en invernadero.
Lo anterior puede explicarse por las diferencias en las condiciones ambientales y nutricionales que se presentan en los ensayos in vitro y en ensayos en los cuales se utiliza suelo como sustrato o se exponen los hongos a condiciones medioambientales "no artificiales", ya que en tales casos varían sustancialmente elementos como complejos de aire, disponibilidad de nutrientes y minerales, pH, distribución de agua, temperatura y luz (Carlile y Watkinson, 1996). El efecto de estos elementos esenciales logra incidir en la capacidad antagónica de los aislamientos, pudiendo existir pequeñas diferencias en los micrositios del sustrato que determinen la acción antagónica de Trichoderma spp., lo cual no ocurre en una caja de Petri donde las condiciones son homogéneas. Lo anterior es confirmado por Askew y Laing (1994) quienes sostienen que el microclima en suelo en viveros se caracteriza por alto contenido de humedad y variaciones de la temperatura; tales cambios pueden alterar el estado fisiológico del hongo y este a su vez la capacidad micoparasítica de Trichoderma, la cual es una respuesta a la necesidad de fuentes de nutrición (Vasseur et al., 1995), como lo demuestran los estudios de expresión de las enzimas de los genes ech42 y prb1 implicados en micoparasitismo, sugiriendo que ambos genes parecen ser regulados por la disponibilidad de nutrientes y por el estado fisiológico del hongo antagonista (Carsolio et al., 1999). Adicionalmente, en las pruebas in vitro no se tiene en cuenta la interacción con la planta, la cual es determinante para el funcionamiento del antagonista como tal (Howell et al., 2000).
Un análisis comparativo del control de S. rolfsii y R. solani muestra que no todos los aislamientos de una misma especie de Trichoderma actúan de la misma manera e intensidad contra ambos patógenos; por el contrario, su actividad es altamente específica. Este es el caso de T-109 (T. asperellum) el cual tiene niveles intermedios en la reducción de la enfermedad causada por S. rolfsii, pero en el control de R. solani es uno de los más eficaces. T-26 (T. asperellum) no controla S. rolfsii, incluso se alcanza a observar niveles de incidencia de la enfermedad similares al control sin tratamiento con antagonistas, pero para el caso de control de R. solani posee altos niveles de reducción de la enfermedad. Una razón de estos fenómenos de especificidad pueden ser las interacciones bioquímicas entre hongos. En estudios de Elad et al., (1983) acerca de este fenómeno, se aisló una lectina de las hifas y del filtrado del cultivo en medio líquido de R. solani, a su vez las paredes de la célula de Trichoderma spp. contienen galactosa, que previene la aglutinación de esta lectina (Goldman et al., 1994). De ambos estudios se concluye que la lectina presente en las hifas de R. solani se une a los residuos de galactosa en las paredes de la célula de Trichoderma spp. y da inicio a la acción micoparasítica sobre el fitopatógeno.
Los extractos y filtrados de cultivos de S. rolfsii también exhibieron actividad aglutinante (Barak et al., 1985); sin embargo, la especificidad del azúcar, la actividad de aglutinación y la estabilidad de la aglutinina son absolutamente diferentes de la de R. solani.
De igual forma los resultados obtenidos en este estudio ponen de manifiesto la especificidad micoparasítica sobre fitopatógenos que existe entre aislamientos de una misma especie de Trichoderma y advierten respecto a la necesidad de realizar búsqueda y estudio de aislamientos con alta actividad antagónica sobre diversos patógenos, sin generalizar o extrapolar su eficacia a un amplio rango de hongos.
Análisis UP-PCR y DS-PCR
Los datos obtenidos por los análisis de los marcadores moleculares (figura 1) permitieron una separación intergenérica, estableciéndose tres grupos (figura 2): uno donde se ubican los aislamientos de T. asperellum y T. longibrachiatum, un segundo grupo de T. asperellum -y el más cercano a este género- fue el conformado por el aislamiento G-56 de Gliocladium sp. y un tercero constituido por el aislamiento de Fusarium sp. Dentro de los aislamientos de Trichoderma, los marcadores empleados originaron dos subgrupos, uno compuesto por aislamientos de la especie T. asperellum y otro constituido por el aislamiento de T. longibrachiatum T-29, el cual presentó en todas las reacciones de amplificación un patrón de bandas diferentes al resto de ejemplares utilizados en el ensayo. Adicionalmente, dentro de los ejemplares analizados de la especie T. asperellum, los marcadores detectaron diferencias, estableciendo tres subgrupos en interior de este taxa no correlacionados con actividad biológica antagonista pero sí con diferencias biogeográficas y metabólicas (Hoyos et al., 2009).
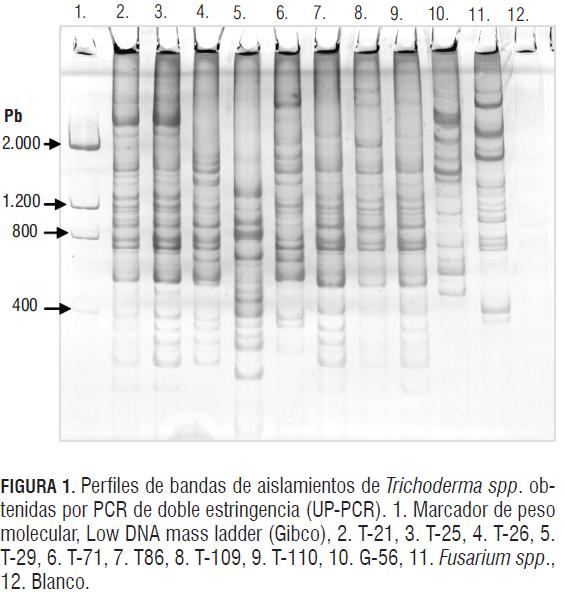
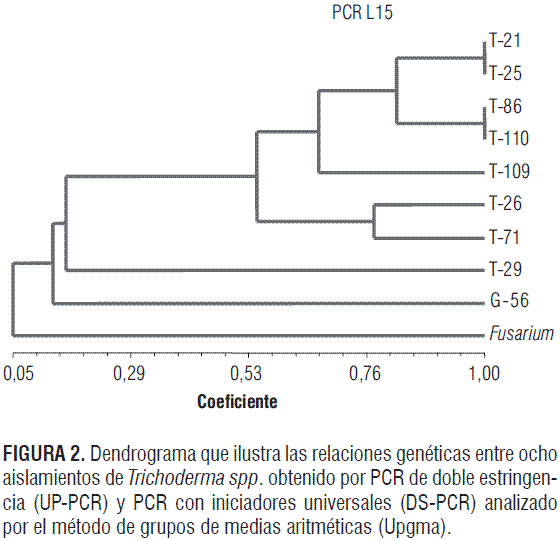
Los marcadores moleculares empleados, UP-PCR y DSPCR, indican que T. longibrachiatum T-29 mostró ser el más divergente de los aislamientos (16% de similitud) con respecto a los demás aislamientos de la especie T. asperellum que comparten un 55% de similitud (figura 2), pero incluso se demuestra que dentro de los ejemplares de T. asperellum existen diferencias. Sin embargo, no se encontró correlación entre la actividad antagonista y las agrupaciones establecidas en los dendrogramas, lo cual puede deberse a que muchos genes contribuyen al micoparasitismo, y diferentes especies pueden tener involucradas diversas rutas metabólicas o estrategias biológicas para desarrollar su potencial como agentes de control biológico efectivos, por lo tanto es usual que los análisis filogenéticos no generen grupos consistentes con agrupaciones generadas por características de micoparasitismo (Hoyos et al., 2009).
Conclusiones
En las pruebas in vitro los aislamientos de Trichoderma spp. evaluados contra S. rolfsii mostraron 100% de actividad antagónica, y para R. solani, todos los aislamientos, excepto T-71 (T. asperellum). No obstante las pruebas in vitro, usualmente empleadas como método de selección preliminar de agentes de control biológico, en las condiciones experimentales de este trabajo no fueron un buen indicativo de la actividad antagónica en suelo; un ejemplo de ello lo constituye el aislamiento T. asperellum T-71 que muestra un comportamiento deficiente en pruebas de laboratorio contra S. rolfsii, pero en condiciones de invernadero controla la enfermedad totalmente. Caso contrario sucede con algunos otros aislamientos de esta especie, como T-26, T-86 y T-110, eficientes en condiciones de laboratorio pero no en invernadero.
En este trabajo se evidencia una alta especificidad de los aislamientos de Trichoderma por su sustrato (hongo fitopatógeno); se demuestra a lo largo de los experimentos que este hongo antagonista es altamente selectivo en su ataque, difiriendo inclusive en su efectividad biocontroladora de aislamientos de una misma especie, para el caso T. asperellum T-71 específico para S. rolfsii, pero no para R. solani, y T. asperellum T-109 muy efectivo contra R. solani. Por lo anterior se puede concluir que no es posible extrapolar actividad antagónica de aislamientos de Trichoderma en condiciones de invernadero basándose en experimentos in vitro y tampoco por taxones particulares como usualmente se realiza.
Los marcadores moleculares empleados no permitieron realizar una separación consistente de grupos de aislamientos dentro de una misma especie por su actividad antagónica.
Agradecimientos
Esta investigación recibió la ayuda financiera de Colciencias, CIB, SENA y la Universidad Hebrea de Jerusalén. Un reconocimiento especial al Dr. Vladimir Gouli por proporcionar algunos de los aislamientos de Trichoderma utilizados en este estudio y al Dr. John Bissett por la identificación de los mismos.
Literatura citada
Adams, P.B. 1990. The potential of mycoparasites for biological control of plant diseases. Annu. Rev. Phytopathol. 28, 59-72. [ Links ]
Askew, D.J. y M.D. Laing. 1994. The In Vitro screening of 118 Trichoderma isolates for antagonism to Rhizoctonia solani an evaluation of different environmental sites on Trichoderma as sources of aggressive strains. Plant Soil 159, 277-281. [ Links ]
Barnett, H.L. 1960. Illustrated genera of imperfect fungi. Burgess Publishing Co, Minneapolis. 215 p. [ Links ]
Barak, R., Y. Elad, D. Mirelman, e I. Chet. 1985. Lectins: a possible basis for specific recognition in the interaction between Trichoderma and Sclerotium rolfsii. Phytopathol. 75, 458-462. [ Links ]
Bell, D.K., H.D. Wells y C.R. Markham. 1982. In vitro antagonism of Trichoderma species against six fungal pathogens. Phytopathol. 72, 396-400. [ Links ]
Carlile, M.J. y S.C. Watkinson. 1996. The fungi. 3rd ed. Academic Press, San Diego. 482 p. [ Links ]
Carsolio, C., N. Benhamou, S. Haran, C. Cortez, A. Gutierrez y A. Herrera-Estrella. 1999. Role of the Trichoderma harzianum endochitinase gene, ech42, in mycoparasitism. Appl. Environ. Microbiol. 65, 929-935. [ Links ]
Castle, A., D. Speranzini, N. Rghei, G. Alm, D. Rinker y J. Bissett. 1998. Morphological and molecular identification of Trichoderma isolates on North American mushroom farms. Appl. Environ. Microbiol. 64, 133-137. [ Links ]
Durman, S., A. Menéndez, A. Godeas. 1999. Evaluation of Trichoderma spp. as antagonistic of Rhizoctonia solani in vitro and as biocontrol in greenhouse tomato plants. Revista Argentina de Microbiología 31, 13-18. [ Links ]
El-Katatny, M.H., M. Gudelj, K.H. Robra, M.A. Elnaghy y G.M. Gübitz. 2001. Characterization of a chitinase and an endobeta- 1,3-glucanase from Trichoderma harzianum Rifai T24 involved in control of the phytopathogen Sclerotium rolfsii. Appl. Microbiol. Biotechnol. 56, 137-43. [ Links ]
Elad, Y. I. Chet, P. Boyle y Y. Henis. 1983. Parasitism of Trichoderma spp. on Rhizoctonia solani and Sclerotium rolfsii scanning electron microscopy and fluorescence microscopy. Phytopathol. 73, 85-88. [ Links ]
Esposito, E. y M. da Silva. 1998. Systematics and environmental application of the genus Trichoderma. Crit. Rev. Microbiol. 24, 89-98. [ Links ]
Gómez, I., I. Chet y A. Herrera-Estrella. 1997. Genetic diversity and vegetative compatibility among Trichoderma harzianum isolates. Mol. Gen. Genet. MGG 256, 127-135. [ Links ]
Goldman, G.H., C. Hayes y G.E. Harman. 1994. Molecular and cellular biology of biocontrol by Trichoderma spp. Trends Biotechnol. 12, 478-482. [ Links ]
Grondona, I., R. Hermosa, M. Tejada, M.D. Gomis, P.F. Mateos, P. D. Bridge, E. Monte e I. García-Acha. 1997. Physiological and biochemical characterization of Trichoderma harzianum, a biological control agent against soilborne fungal plant pathogens. Appl. Environment. Microbiol. 63, 3189-3198. [ Links ]
Hanson, L.E. y C.R. Howell. 2004. Elicitors of plant defense responses from biocontrol strains of Trichoderma virens. Phytopathol. 94, 171-176. [ Links ]
Hoyos-Carvajal, L.M., S. Orduz y J. Bissett. 2009. Genetic and metabolic biodiversity of Trichoderma from Colombia and adjacent neotropic regions. Fungal Genet. Biol. (en prensa). [ Links ]
Howell, C.R. 2006. Understanding the mechanisms employed by Trichoderma virens to effect biological control of cotton diseases. Phytopathol. 96, 178-180. [ Links ]
Howell, C.R., L.E. Hanson, R.D. Stipanovic y L.S. Puckhaber. 2000. Induction of terpenoid synthesis in cotton roots and control of Rhizoctonia solani by seed treatment with Trichoderma virens. Phytopathol. 90, 248-252. [ Links ]
Inbar, J., A. Menendez e I. Chet. 1996. Hyphal interactions between Trichoderma harzianum and Sclerotinia sclerotiorum and its role in biological control. Soil Biol. Biochem. 28, 757-763. [ Links ]
Jakhar, S.S., M.S. Chauhan y J.C. Duhan. 1998. Management of root rot of cotton (Gossypium species) caused by Rhizoctonia species. Plant Dis. Res. 13, 115-118. [ Links ]
Jeffries, P. y T.W.K. Young. 1994. Biocontrol of Plant Pathogens. Interfungal Parasitic Relationships. CAB International, Wallingford. pp. 181-221. [ Links ]
Lewis, J.A. y G.C. Papavizas. 1991. Biocontrol of damping-off caused by Rhizoctonia solani in the field with formulations of Trichoderma spp. and Gliocladium virens. Crop Protection 10, 396-402. [ Links ]
Lubeck, M., I. Alekhina, S. Lubeck, D. Jensen y S. Bulat. 1999. Delineation of Trichoderma two different genotypic groups by a highly robust fingerprinting method, UP-PCR, and UP-PCR product cross-hybridization. Mycol. Res. 103, 289-298. [ Links ]
Matioli, S. y R. Brito. 1995. Obtaining genetic markers by using double - stringency PCR with microsatellites and arbitrary primers. BioTechniques 19, 752-758. [ Links ]
Mathivanan, N., K. Srinivasan y S. Chelliah. 2000. Biological control of soil-borne diseases of cotton, eggplant, okra and sunflower by Trichoderma viride. Z. Pflanzenk. Pflanzen. 107, 235-244. [ Links ]
Papavizas, G.C. y J.A. Lewis. 1989. Effect of Gliocladium and Trichoderma on damping-off and blight of snapbean caused by Sclerotium rolfsii. Plant Pathol. 38, 227-86. [ Links ]
Pervaiz, A., S. Miller, T. Meulia, H.A. Hoitink y J. Kim. 1999. Precise detection and tracing of Trichoderma harzianum 382 in compost-amended potting mixes by using molecular markers. Appl. Environ. Microbiol. 65, 5421-5426. [ Links ]
Raeder, U. y P. Broda. 1985. Rapid preparation of ADN from filamentous fungi. Lett. Appl. Microbiol. 1, 17-20. [ Links ]
Royse, D.J. y S.M. Ries. 1978. The influence of fungi isolated from peach twigs on the pathogenecity of Cytospora cincta. Phytopathol. 68, 603-607 [ Links ]
Sambrook, J., E.F. Fritzch y T. Maniatis. 1989. Molecular cloning. A laboratory manual. Cold Spring Harbor Laboratory Press, Woodbury, NY. [ Links ]
Vasseur, V., M. Van Montagu y G. Goldman. 1995. Trichoderma harzianum genes induced during growth on Rhizoctonia solani cell walls. Microbiol. 147, 767-774. [ Links ]














