Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.26 no.3 Bogotá Sep./Dec. 2008
Viviana Gutiérrez R.1, Ángela Pinzón E.2, Jaime Casas3 y María Mercedes Martínez4
1 Estudiante, Laboratorio de Microbiología Ambiental y de Suelos, Departamento de Microbiología, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá. gutierreze@javeriana.edu.co
2 Estudiante, Laboratorio de Química Microbiológica, Departamento de Química, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá. angela-pinzon@javeriana.edu.co
3 Profesor, Departamento de Química, Facultad de Ciencia y Tecnología, Universidad Pedagógica Nacional, Bogotá. jcasas@pedagogica.edu.co
4 Profesor, Laboratorio de Microbiología Ambiental y de Suelos, Departamento de Microbiología, Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá. mmmartin@javeriana.edu.co
Fecha de recepción: 28 de agosto de 2007. Aceptado para publicación: 5 de noviembre de 2008
RESUMEN
En el presente estudio se determinó la actividad celulolítica en suelo mediante el uso de una técnica fluorogénica que utiliza 4-metilumbeliferil B-glucosa (MUF) como sustrato, y se comparó con la técnica de Somogyi Nelson (SN). Se manejó sedimento como control positivo del método MUF, ya que esta técnica se estandarizó previamente en esta matriz, y suelo como matriz a evaluar. El muestreo de suelo se realizó en Puerto López, Meta, en cultivos de Stevia rebaudiana Bertoni mediante un muestreo aleatorio simple. El sedimento se recolectó en el humedal La Conejera, localidad de Suba, Bogotá. Se realizaron tres tratamientos para ambas matrices: T1: matriz (control); T2: matriz+extracto crudo enzimático (2,34 UC); T3: matriz+Streptomyces sp. (59x103 conidios/mL). Para la obtención del extracto crudo enzimático utilizado en el T2 se realizó el aislamiento del microorganismo celulolítico con mayor actividad en agar CMC 1% m/v a partir de muestras de suelo, para su posterior fermentación y obtención de extracto enzimático. La incubación de las matrices en los tres tratamientos se realizó a temperatura ambiente, humedad mantenida a 4,6% durante 60 días, con muestreos periódicos cada 15 días para determinar actividad enzimática por métodos planteados (MUF y SN). No se evidenciaron efectos diferenciales en la actividad enzimática con ninguno de los tratamientos planteados, como tampoco se obtuvo correlación estadística entre los métodos (<16%). Es así que se propone la técnica fluorogénica como una metodología viable y fiable de la actividad celulolítica, en virtud de su alta especificidad, mayor rapidez en el montaje, así como por su facilidad de ejecución y apreciable precisión en términos de repetibilidad; sin embargo la técnica de SN no se descarta para futuros estudios.
Palabras clave: B-glucosidasa, celulasas, 4-metilumbeliferil B-glucosa, Somogyi Nelson, calidad de suelo.
ABSTRACT
In this study celullolytic activity was determined in soil using a fluorogenic technique, which utilizes 4-methylumbelliferil B-glucose (MUF) as substrate, and was compared with the quantitative technique of Somogyi Nelson (SN). Sediment control was handled as a positive method of MUF, as this technique was standardized previously in this matrix. Soil sampling was done in Puerto López, Meta, in Stevia rebaudiana Bertoni crops using a simple random sampling. Sediments were collected in La Conejera wetland located in Suba, Bogotá. Three treatments were done to both matrixes: T1: Matrix (control); T2: Matrix + crude enzymatic extract (2.34 UC); T3: Matrix + Streptomyces sp (59x103 spores/mL). To obtain the crude enzymatic extract used in T2 an isolation of the celulloytic microogranisms was done with greater activity in carboximethylcellulose (CMC 1%) from soil samples for its subsequent fermentation and extraction of enzyme extract. Incubation of the matrix in three treatments was done at room temperature during 60 days where tests were performed every 15 days in order to analyze enzymatic activity by the established methods (MUF and SN). Humidity was maintained at 4.6%. No evidence of differential effects in the enzymatic activity with any of the treatments was found. Also, there was no statistical correlation between the methods (<16%). Thus, we propose the fluorogenic technique as a viable and reliable methodology to determinate cellulolytic activity because of its high specificity, faster assembly as well as its easy manipulation, precision and repeatability. Nevertheless the SN technique has not been ruled out for future studies.
Key words: B-glucosidase, celullases, 4-methylumbelliferil B-glucose, Somogyi Nelson, soil quality.
Introducción
Karlen y colaboradores (2001) definen la calidad de un suelo como la capacidad de un tipo específico de suelo para funcionar, en ecosistemas naturales o controlados, de tal manera que sustente la productividad animal y vegetal, mantenga o mejore la calidad del agua o del aire y soporte la presencia humana saludable. Está dada tanto por el componente fisicoquímico como por el biológico, que incluye organismos de la micro y mesofauna, por ejemplo bacterias fosfatosolubilizadoras y fijadoras de nitrogeno, y tambien por lombrices y actividad enzimatica. Los estudios de fertilidad se han basado durante muchos anos en el analisis de la microflora presente en el suelo y dejan de lado la participacion de las enzimas extracelulares producidas por esta microflora en la degradacion de la materia organica y en el flujo continuo de los elementos en el suelo (Cerón y Melgarejo, 2005).
Las celulasas, como base de este estudio, desempenan un papel importante en el ciclo del carbono en el suelo, degradando desechos vegetales que estan compuestos en su mayoria de celulosa (Nielsen y Winding, 2002). Esta actividad cobra gran importancia en agroindustrias debido a que la degradacion de este polimero se relaciona directamente con la fertilidad y calidad del suelo (Cerón y Melgarejo, 2005).
En el caso de cultivos de Stevia rebaudiana Bertoni se observa que el aporte de materia organica (MO) es minimo debido a que se realiza la recoleccion de hojas y es el tallo lo unico que ingresa al ciclo del carbono edafico, que es de dificil y lenta degradacion. Por tanto se espera que el porcentaje de MO presente en los suelos a evaluar sea bajo y de esta manera se pueda evaluar si los metodos utilizados para la determinacion de actividad celulolitica (MUF y SN) son suficientemente sensibles para detectar niveles enzimaticos tan bajos.
Actualmente la deteccion de enzimas extracelulares en suelos tiene mayor relevancia dentro de los parametros biologicos para la determinacion de calidad. Los metodos enzimaticos tradicionales emplean la cuantificacion del sustrato con tecnicas colorimetricas como Somogyi Nelson, Bradford, DNS, glucosa oxidasa, antrona, azul de prusia o yodo-yoduro, que son dispendiosas, costosas y demoradas. No obstante, existen metodos en que la utilizacion de fluorogenos como el 4-metilubeliferona, 7-amino-4-metilcumarina, naranja de acridina y acido sulfonico 8-anilino-1-naftaleno, entre otros, permite desarrollar tecnicas altamente especificas, pues consisten en sustratos analogos ligados que son limitados para un grupo de enzimas restringido, superando las limitaciones de las tecnicas tradicionales, ya que permiten mayor sensibilidad y precision y la interpretacion de resultados es sencilla y en menor tiempo (Turner et al., 2002; Debosz et al., 1999; Boshker y Cappenberg, 1994; Chernoglazov et al., 1988). Sin embargo, aunque se utilizan indistintamente, no se sabe el grado de correlacion entre los metodos tradicionales y los implementados en la actualidad para la determinacion de la actividad enzimatica en suelo. Por tanto su evaluacion es de gran utilidad para la seleccion del metodo mas apropiado y asi obtener resultados con mayor confiabilidad.
Este trabajo establece la correlacion existente entre la tecnica de deteccion de B-glucosidasas en suelo de un cultivo de Stevia mediante el uso de 4-metilumbeliferil B-glucosa, y el metodo colorimetrico tradicional de Somogyi Nelson, y de esta manera obtener un indicador biologico importante en la calidad del suelo analizado.
Materiales y metodos
Muestreo
El area de estudio se localizo en cultivos de Stevia rebaudiana Bertoni ubicados en el municipio de Puerto Lopez, Meta, con temperatura media de 27 °C, contenido de materia organica en suelo de 1,77% y pH de 5,4 (Barrera y Brito, 1997). El area de muestreo fue de 126 m2, donde se realizo un muestreo aleatorio simple con base en una division del terreno en cuadrantes de 25 cm2, a partir de los cuales se tomaron 58 muestras de 500 g cada una, a una profundidad aproximada de 20 cm.
Las muestras de sedimento utilizadas como control positivo (Boschker y Cappenberg, 1994) se recolectaron en el humedal La Conejera, ubicado en la localidad de Suba, Bogota, teniendo en cuenta unicamente zonas sin tratamiento de recuperacion. El contenido de materia organica promedio es de 6,14% y pH de 6,9. La toma de muestras de sedimento se realizo a una profundidad de 1 metro bajo el nivel del agua.
Procesamiento de muestras
Las muestras se tamizaron con tamices 12 y se dispusieron en microcosmos con 250 gramos de suelo cada una, en condiciones controladas con temperatura media de 18 °C y humedad constante de 4,6%, para realizar muestreos cada 0, 15, 30, 45 y 60 dias, a partir de los cuales se determino la actividad celulolitica tanto cualitativa como cuantitativamente (Turner et al., 2002).
Por su parte, en las muestras de sedimento se removieron las particulas grandes de materia organica y se mezclaron con el agua propia del sitio de muestreo hasta anegamiento, despues de homogenizarlas mecanicamente y formar una muestra compuesta (Ayala et al., 2001).
Aislamiento y seleccion de la cepa con mayor actividad celulolitica a partir de suelo Para la obtención del extracto crudo enzimático utilizado en el T2 y del inóculo microbiano utilizado en el T3 se realizó un screening de microorganismos celulolíticos en la matriz suelo. El aislamiento primario se realizó en medio carboximetilcelulosa (CMC) 1% m/v siguiendo el procedimiento descrito por Quintero y colaboradores (2004). Posteriormente las colonias que presentaron algún tipo de actividad celulolítica se resembraron en agar CMC por punción en el centro de la caja. Los halos de hidrólisis revelados con el colorante rojo congo y solución salina se midieron en cm para cada cepa y se analizaron estadísticamente para establecer diferencias significativas. Las cepas celulolíticas aisladas se conservaron a -20 °C en glicerol al 25% v/v bajo el procedimiento descrito por Poutou et al., 1994.
Diseño experimental
Las variables independientes manejadas en el estudio incluyen la adición de extracto crudo enzimático al suelo (variable de naturaleza nominal), la adición de microorganismo celulolítico al suelo (variable de naturaleza nominal), el tiempo de incubación de las muestras de suelo (variable de naturaleza ordinal, expresada en días) y finalmente la naturaleza de la matriz empleada (variable de naturaleza nominal). La variable independiente hace referencia a la actividad enzimática (variable de naturaleza continua, expresada en UC/g de suelo).
El sedimento se utilizó como control positivo de la técnica MUF con el fin de verificar que las condiciones bajo las cuales se desarrolló el análisis fluorogénico fueran óptimas para la obtención de resultados satisfactorios (Boschker y Cappenberg, 1994). Como control negativo se utilizó suelo artificial con una composición de 70% arena, 20% arcilla y 10% turba (Porta et al., 2003).
Durante el estudio se realizaron tres tratamientos (tabla 1), evaluando las diferencias de la actividad enzimática durante los 60 días de estudio con análisis periódicos cada 15 días, mediante las dos técnicas utilizadas.
El extracto crudo enzimatico se obtuvo a partir del microorganismo con mayor actividad celulolitica (identificadocomo Streptomyces sp.) aislado de las muestras de suelo, al igual que la produccion del inoculante utilizado en el T3.

La determinacion de la actividad del extracto crudo enzimatico se produjo por el procedimiento descrito por Granados y colaboradores (2003). La actividad celulolitica se determino mediante las tecnicas de Somogyi Nelson (SN) y la fluorogenica (MUF), utilizando en esta ultima la fraccion B-glucosa en una concentracion de 2 mM (Boschker y Cappenberg, 1994). Cada ensayo se realizo por triplicado.
Determinacion de actividad celulolitica mediante la tecnica de Somogyi Nelson
Para la extraccion de azucares de las muestras de suelo y del extracto crudo enzimatico utilizado en el T2 se tomaron 5 g o mL de la muestra y se adicionaron 0,5 mL de tolueno y 20 mL de buffer acetato pH 5,5, dejando reposar 20 min a 30 °C. Una vez cumplido este tiempo se centrifugaron las muestras a 8.000 rpm, 20 min a 4 °C (Deng y Tabatabai, 1994).
Del sobrenadante obtenido a partir de la centrifugacion se tomaron 200 uL y se mezclaron con 200 uL del reactivo de Somogyi I y 50 uL del reactivo Somogyi II. La mezcla se homogenizo durante 1 min con el uso de un agitador vortex, para posteriormente someterla a 90 °C en bano maria durante 20 min. El enfriamiento se realizo mediante la inmersion de los tubos en agua fria durante 5 min. Finalmente se adicionaron 250 uL del reactivo de Nelson y 700 uL de agua desionizada. La lectura de absorbancia se realizo a 595 nm 24 h despues de terminado el procedimiento (Rodriguez, 2000).
Determinacion de actividad celulolitica mediante la tecnica fluorogenica
Para la deteccion de la actividad enzimatica extracelular las muestras de suelo se mezclaron en una relacion 5:1 con agua desionizada. La tecnica se realizo mediante el procedimiento descrito por Boscker y Cappenberg (1994), con una concentracion de 4-metilumbeliferil B-glucosa de 2 mM.
La fluorescencia generada se midio en un fluorometro Perkin-Elmer Coleman 139 UV-VIS, a una longitud de onda de excitacion de 360 nm y una longitud de onda de emision de 455 nm.
La conversion a sustrato hidrolizado se realizo mediante la comparacion con la curva patron, utilizando el fluorogeno 4-metilumbeliferona base (MUF). La actividad de B-glucosidasas se define como umol MUF liberado por g de suelo y hora.
Para el analisis de los resultados se utilizo el programa estadistico JMPin version 4.0 para Windows; mediante el test Kruskal Wallis se determinaron diferencias significativas entre los tratamientos evaluados a traves del tiempo y, finalmente, se aplico un indice de correlacion de Pearson para establecer la similitud entre los metodos MUF y SN.
Resultados y discusion
En el aislamiento de cepas con actividad celulolitica realizado a partir de muestras de suelo con el fin de obtener el extracto crudo enzimatico para el tratamiento 2 de matriz suelo y matriz sedimento, se logro obtener 16 cepas bacterianas filamentosas cuya actividad celulolitica se evaluo y confirmo en agar CMC al 1% m/v. La actividad se evaluo semicuantitativamente con base en el diametro de los halos de hidrolisis revelados con rojo congo, resultados que pueden observarse en la tabla 2.
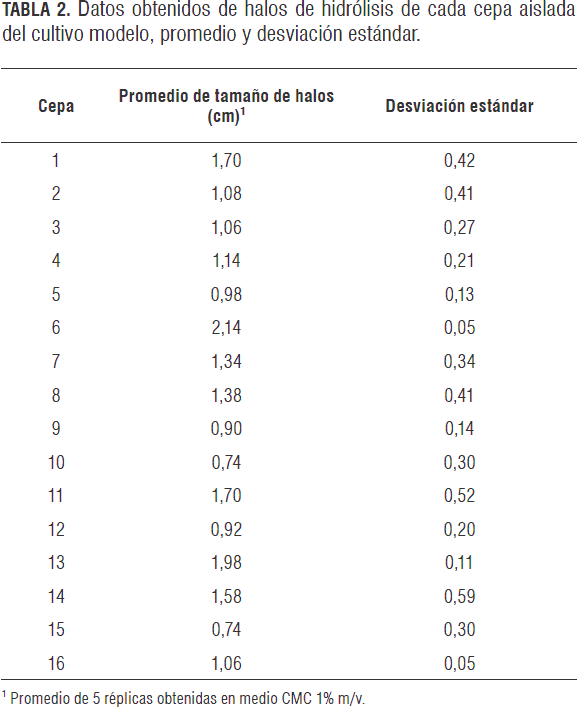
Los valores máximos de actividad de observaron en las cepas sombreadas en la tabla 2 (cepas 1, 6, 11, 12 y 14), pero mediante el análisis de varianza Anova se estableció que la cepa 6, identificada posteriormente como Streptomyces sp., presentó un mayor tamaño de halo de hidrólisis (2,14 cm) con relación a las demás cepas aisladas, por lo que fue utilizada para la producción del extracto crudo.
Por otro lado, respecto a la cuantificación de glucosa residual mediante la técnica de SN, se comprobó en estudios anteriores que la presencia de metales en la muestra puede llegar a interferir en el desarrollo de color por cambios en la fuerza iónica de la solución que se analiza (Deng y Tabatabai, 1994). Sin embargo, al ser sometida la muestra de suelo a un proceso de decationización, y comparar estadísticamente los datos arrojados con la muestra sin decationizar, no se evidenciaron diferencias significativas en los resultados mediante la técnica, por lo que se hizo innecesaria la aplicación de este paso durante el desarrollo del estudio.
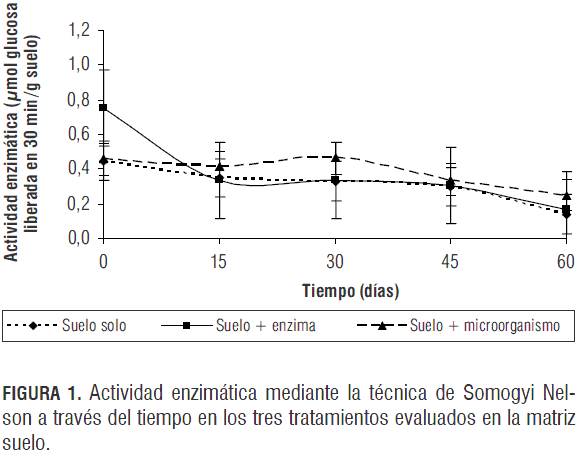
Por otra parte, en la determinación de la actividad celulolítica mediante la técnica de SN en suelo con los tres tratamientos realizados, es evidente una mayor actividad en el tratamiento con adición de microorganismo (figura 1) debido a la deficiencia de materia orgánica presente en la matriz analizada (1,77%). No se obtuvo actividad celulolítica con el control negativo (suelo artificial). En las condiciones de este estudio se esperaría que la actividad enzimática aumentara de manera significativa hasta que el microorganismo iniciara la fase de latencia y/o la materia orgánica fuera un factor limitante, momento en el que la producción de enzimas se detendría.
El tratamiento con adición de enzima presenta un comportamiento muy similar al suelo sin tratamiento (figura 1). La disminución drástica de actividad enzimática en el transcurso de los primeros 15 días de incubación se presenta por la composición del suelo (26% arcilla) ya que las enzimas extracelulares, en este caso celulasas, al ser adicionadas libremente en una muestra determinada, se asocian rápidamente al material particulado, como arcillas, materia orgánica y sustancias húmicas, lo que puede disminuir o inhibir completamente su actividad (Acosta et al., 2007). Este comportamiento responde a varios factores, incluyendo el cambio en la estructura cuaternaria, la capacidad de mantener la integridad del sitio activo, proporción proteína:arcilla de la asociación y los cambios en la disponibilidad de sustrato. En el caso de mantenerse en estado libre pueden ser fácilmente degradadas por proteasas extracelulares presentes en el suelo (Debosz et al., 1999; Tate, 1987).
Igualmente, la producción de ácidos orgánicos a partir del metabolismo microbiano logró disminuir el pH del suelo durante los 60 días de estudio hasta llegar a valores cercanos a 4, condiciones bajo las que se dificulta o se reduce la velocidad de degradación de la celulosa, debido a la inestabilidad de la proteína y al número limitado de microorganismos degradadores de celulosa presentes en la matriz. Por esta razón se presenta el descenso de la actividad celulolítica a los 60 días de iniciado el proceso de incubación (Hu-Hu et al., 2004).
La actividad celulolítica se mantiene relativamente estable a partir del día 15 de incubación con una leve disminución a través del tiempo en los tres tratamientos. No obstante, mediante el análisis estadístico (Kruskal Wallis) se evidencian diferencias significativas (P=0,0001) en la actividad enzimática durante los 60 días de estudio mediante la técnica de Somogyi Nelson en suelo. Sin embargo, entre tratamientos no se evidenciaron dichas diferencias (P=0,3536).
Por su parte, la actividad celulolítica en las muestras de sedimento del humedal muestra un comportamiento similar en los tres tratamientos evaluados (figura 2); se observa que al final del tiempo de incubación los valores de actividad tienden a bajar al mismo nivel (0,228 UC).
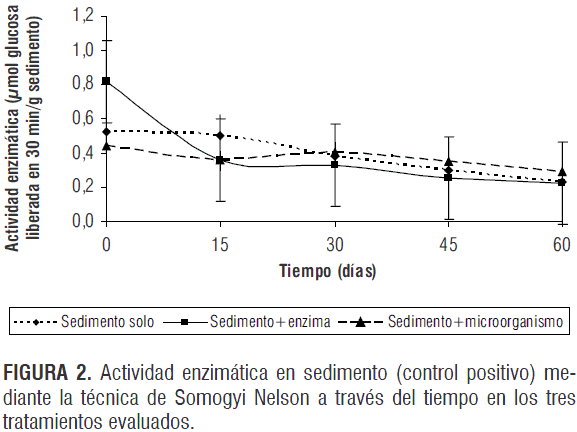
En el tiempo 0 del proceso las enzimas celulolíticas muestran la mayor actividad (0,816 UC), la cual disminuye a 0,228 UC a medida que la celulosa sufre el proceso de degradación y es aprovechada por la microflora nativa. Al final del proceso de descomposición la actividad de las enzimas comienza a reflejarse de manera más lenta debido a que los materiales recalcitrantes de las matrices, como la lignina, son la única fuente de carbono disponible (Kourtev et al., 2002).
De otro lado, la tendencia de la actividad enzimática observada en los tratamientos con la adición del microorganismo y el control, es similar a la obtenida en suelo, aunque los valores registrados son mayores, debido posiblemente a que la cantidad de carbono orgánico presente en el sedimento (6,15%) es mayor que en el suelo, pues los restos vegetales constituyen gran proporción de los desechos generados en un humedal, aumentando el potencial celulolítico de la matriz.
Así mismo, en la matriz sedimento el tratamiento con adición de enzima produjo resultados similares a los obtenidos en suelo en el tratamiento 3 (matriz + adición de microorganismo), con la diferencia de que la materia orgánica presente no es un factor limitante. Por el contrario, las condiciones intrínsecas de la matriz, como pH, concentración de oxígeno, humedad, entre otras, probablemente eliminaron por completo su población, debido a que el microorganismo se encontraba adaptado a suelos de mayor oxigenación, menor humedad, mayor temperatura y menor pH.
De esta forma se rechaza la hipótesis nula (P=0,0001) ya que se demuestra que los cambios en la actividad enzimática a través del tiempo en sedimento (control positivo) presentan diferencias significativas. No obstante, al igual que en el suelo, se acepta la hipótesis nula de homogeneidad (P=0,5782) y se concluye que entre los tratamientos tampoco existen diferencias significativas.
De otra manera, y como parte importante del estudio, la sensibilidad en la determinación de la actividad celulolítica mediante la técnica fluorogénica se evidenció en las dos matrices evaluadas (suelo y sedimento) (figura 3) ya que la obtención de valores tan bajos mediante esta técnica de difícil detección comparados con otras técnicas empleadas para el mismo fin. Debosz et al. (1999) indican que la reactividad de los fluorógenos hace que el método sea tanto específico como sensible, ya que depende de la afinidad sustrato-enzima. Igualmente, Vassalo y colaboradores (2006) afirman que los sustratos fluorogenicos se usan para detectar especificamente enzimas en muestras de origen biologico con actividad baja y con mayor confiabilidad frente a otras tecnicas fotometricas y de potenciometria (Boshker y Cappenberg, 1994). Todo esto sustenta la excelente alternativa que se vuelven los sustratos fluorogenicos para la determinacion de la actividad enzimatica en matrices con insuficiencia de materia organica.
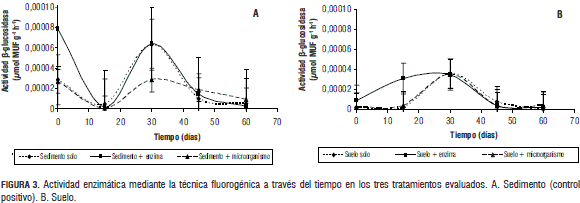
Los valores de actividad enzimatica tan bajos presentados en suelo (figura 3B) se deben a varios factores: i) la actividad de B-glucosidasas se ve disminuida en suelos destinados a la agricultura, comparados con bosques y pastizales, debido a las perdidas graduales de materia organica; ii) la cantidad de microorganismos, principal fuente de enzimas en suelo, se ve disminuida generalmente en suelos de clima calido y regiones aridas, comparados con los de clima frio, debido a la poca disponibilidad de agua por baja retencion y alta evaporacion; iii) la degradacion de materia organica excede la tasa de sintesis de humus en suelos de regiones calidas, lo que afecta seriamente a la actividad celulolitica. Igualmente, los suelos agricolas son terrenos desnudos donde las condiciones ambientales afectan con mayor agresividad a las poblaciones microbianas nativas y su metabolismo, a diferencia de suelos con abundante vegetacion como los pastizales, donde hay mayor proteccion de la fraccion biologica por el recubrimiento vegetal (Acosta et al., 2007; Tate, 1987), todas las caracteristicas en mencion, propias del terreno en estudio.
Asi mismo, las B-glucosidasas son las mas abundantes y faciles de detectar de los tres grupos de enzimas que intervienen en la degradacion de celulosa en suelo. Su actividad es de particular importancia por su rol central en el ciclaje de materia organica, la cual se considera como un componente valioso y fundamental de la calidad del suelo (Turner et al., 2002).
Es importante anotar que las actividades enzimaticas tan bajas reflejadas en el sedimento con los tratamientos evaluados pudieron verse disminuidas por la presencia del bioinoculante, que genero competencia con la flora autoctona del sedimento durante los primeros 15 dias del estudio. Por esta razon la actividad B-glucosidasa observada a partir del tiempo 30 es menor que la del sedimento sin tratamiento alguno, indicando posiblemente que el microorganismo inoculado fue eliminado por completo, asi los valores conseguidos corresponderan posiblemente a la microflora nativa de la matriz (Debosz et al., 1999).
El tratamiento con adicion de enzima, a diferencia de los otros tratamientos, mostro un aumento de la actividad B-glucosidasa debido a que la enzima adicionada pudo asociarse a particulas del suelo sin sufrir disminucion funcional importante durante los primeros periodos de incubacion. Por esta razon permanecieron activas desde el momento de la inoculacion, liberando glucosa mediante la intervencion de las B-glucosidasas y de algunas B-1,4-glucanasas, a partir de la materia organica presente en el suelo y consecuentemente estimulando el crecimiento microbiano (Acosta et al., 2007).
A su vez la microflora, al aumentar su biomasa, aumenta la produccion de estas proteinas, cuya actividad se suma a la cantidad de enzima adicionada con anterioridad. Finalmente, su actividad decrece por agotamiento de materia organica al igual que en los demas tratamientos.
Aunque la adicion de enzima genero un aumento en la actividad enzimatica, los valores obtenidos no son muy altos, comparados con los descritos por Debosz et al. (1999), debido a que las B-glucosidasas extracelulares inmovilizadas tienen una actividad despreciable, y la degradacion de celobiosa en suelos se debe a enzimas liberadas de organismos en crecimiento mas que a la fraccion de enzimas acumulada (Turner et al., 2002).
La actividad enzimatica obtenida a traves del tiempo en sedimento de humedal (figura 3A), demostro que las condiciones bajo las cuales se desarrollo la tecnica con el uso de 4-metilumbeliferil B-glucosa fueron las indicadas para permitir el desarrollo del maximo porcentaje de fluorescencia de las muestras, pues esta matriz se utilizo como control positivo de la tecnica (Boshker y Cappenberg, 1994).
Esto indica que el pH, la temperatura y otras variables del procedimiento pueden aplicarse igualmente tanto al suelo como al sedimento.
Finalmente, de acuerdo con el analisis de correlacion se expone de manera clara que los metodos comparados no presentan un ajuste lineal (r2 = 0,15) por lo que no pueden ser utilizados indistintamente para la determinacion de actividad celulolitica en suelo, debido a que Somogyi Nelson se basa en la cuantificacion de producto final liberado (azucares reductores), mientras que la tecnica fluorogenica cuantifica la enzima especifica involucrada en la hidrolisis del sustrato. Por tanto, para la cuantificacion enzimatica la tecnica colorimetrica, al ser indirecta, presenta menor especificidad que la tecnica fluorogenica, considerada directa (Weder y Kaiser, 1995).
Conclusiones
El uso de tecnicas con baja sensibilidad en estudios de enzimas de suelo aumenta la complejidad y disminuye la confiabilidad de los resultados, debido a que se requeriria mayores tiempos de incubacion por la imposibilidad de detectar bajas concentraciones del producto de reaccion.
Esto hace que la muestra tenga una mayor exposicion a condiciones ambientales adversas, evitando que la actividad enzimatica presente un desarrollo normal, ya que factores como la humedad, pH, temperatura y oxigenacion pueden limitar la cinetica enzimatica.
Por su parte, los sustratos fluorogenicos poseen varias ventajas frente a las tecnicas colorimetricas tradicionales, debido a que requieren menor tiempo de incubacion, procedimientos mas cortos, menores riesgos en la manipulacion, mayor sensibilidad y especificidad. Ademas los resultados obtenidos en este estudio demuestran que son una buena opcion para la determinacion de actividad enzimatica en suelos agricolas con bajo contenido de materia organica, baja humedad y altas temperaturas, ya que los valores tienden a ser muy bajos por las condiciones adversas.
Si se pretende utilizar los datos de actividad celulolitica como un parametro indicador en la calidad de un determinado suelo, la tecnica fluorogenica con el uso de 4-metilumbeliferil B-glucosa es la mas indicada, debido a que las B-glucosidasas son ampliamente utilizadas para el monitoreo de la calidad del suelo ya que cumplen un papel importante en el ciclaje de la materia organica del suelo, pues es el paso limitante en la degradacion de celulosa, y son las mas abundantes. Ademas, su deteccion es relativamente simple mediante esta tecnica, y se pueden detectar cambios minimos en la actividad celulolitica a traves del tiempo, debido a la alta sensibilidad de la tecnica (Turner et al, 2002; Ceron y Melgarejo, 2005).
Por el contrario, si los datos de actividad celulolitica no van a ser utilizados para este fin, o no se requiere la actividad celulolitica en estricto sentido, no se descarta la posibilidad de utilizar la tecnica de Somogyi Nelson, pues la seleccion del metodo dependera del objetivo y del presupuesto del estudio. Los valores obtenidos brindaran al investigador una vision global de las actividades enzimaticas presentes, incluyendo celulasas, xilanasas y amilasas. No obstante, el costo de la tecnica aumentara dependiendo de la presencia de metales en la matriz, pues son interferentes en el desarrollo de color en el metodo, por tanto se requerira el uso de resina de intercambio cationico para su remocion y evitar asi la obtencion de resultados erroneos (Deng y Tabatabai, 1994).
Adicionalmente, a pesar de la especificidad de la tecnica fluorogenica, la actividad de B-glucosidasas tiene una correlacion estadisticamente significativa con el carbono y el nitrogeno organico, lo que tambien puede brindar una vision global de la materia organica disponible y por tanto el potencial de las actividades enzimaticas (Debosz et al., 1999; McLaughlin et al., 2000).
Es importante tener en cuenta que, aunque la tecnica fluorogenica con sustratos derivados de la 4-metilumbeliferona (MUF) es aplicable a gran variedad de matrices y enzimas, debido a la diversidad de sustratos disponibles en el mercado para la deteccion de diferentes enzimas, la concentracion maxima de MUF estara dada por la cantidad de materia organica disponible. Por esto, la implementacion de esta tecnica en sustratos como vermicompuesto o compost requerira mayores concentraciones de fluorogeno que las utilizadas en este estudio.
Agradecimientos
Al proyecto CCI-FIUC-PUJ en formación de técnicos para el aprovechamiento de materia orgánica en suelos de países en vías de desarrollo.
Literatura citada
Acosta, V., L. Cruz, D. Sotomayor y L. Pérez. 2007. Enzyme activities as affected by soil properties and land use in a tropical watershed. Appl. Soil Ecol. 35, 35-45. [ Links ]
Ayala, A., K. Santamaría y M. Martínez. 2001. Evaluación de la remoción de benceno por bacterias aisladas del rizoplano del Limnobium laevigatum presente en el humedal de la Conejera. Microbiología industrial. Pontificia Universidad Javeriana, Bogotá. pp. 25-26. [ Links ]
Barrera, E. y E. Brito. 1997. Control del saltamontes Rhammatocerus sclustocercoides en estado de ninfa: Puerto López, Meta, Colombia. Trabajo de grado. Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá. p. 17. [ Links ]
Boschker, H. y T. Cappenberg. 1994. A sensitive method using 4-methylumbelliferyl-B-cellobiose as a substrate to measure (1,4)- B-glucanase activity in sediments. Appl. Environ. Microbiol. 60, 3592-3596. [ Links ]
Cerón, L. y L. Melgarejo. 2005. Enzimas del suelo: indicadores de salud y calidad. Acta Biológica Colombiana 10, 5-15. [ Links ]
Chernoglazov, V., A. Jafarova y A. Klyosov. 1988. Continuous photometric determination of endo-C1,4-B-D-glucanases (cellulase) activity using 4-methylumbelliferyl- B-D-cellobioside as a substrate. Analytical Biochem. 179, 186-189. [ Links ]
Debosz, K., P. Rasmussen y A. Pedersen. 1999. Temporal variations in microbial biomass C and cellulolytic enzyme activity in arable soils: effects of organic matter input. Appl. Soil Ecol. 13, 209-218. [ Links ]
Deng, S.P. y M.A. Tabatabai. 1994. Colorimetric determination of reducing sugars in soils. Soil Biol. Biochem. 26, 473-477. [ Links ]
Granados, L., J. Valderrama y M. Franco. 2003. Evaluación de la actividad proteolítica y amilolítica de actinomycetes termofílicos aislados a partir de pilas de compost. Microbiología industrial. Pontificia Universidad Javeriana, Bogotá. p. 27. [ Links ]
Hu-Hu, Z., G. Wang y H. Yu. 2004. Anaerobic degradation of cellulose by rumen microorganisms at various pH values. Biochem. Eng. J. 21, 59-62. [ Links ]
Karlen, D., S. Sndrews y J. Doran. 2001. Soil quality: current concepts and applications. Adv. Agron. 74, 1-22. [ Links ]
Kourtev, P., J. Ehrenfeld y W. Huang. 2002. Enzyme activities during litter descomposition of two exotic and two native plant species in hardwood forest of New Jersey. Soil Biol. Biochem. 34, 1207-1218. [ Links ]
McLaughlin, J., M. Gale, M. Jurgensen y C. Trettin. 2000. Soil organic matter and nitrogen cycling in response to harvesting, mechanical site preparation, and fertilization in a wetland with a mineral substrate. Forest Ecol. Mgt. 129, 7- 23. [ Links ]
Nielsen, M.N. y A. Winding. 2002. Microorganisms as indicators of soil health. National Environmental Research Institute, Denmark. Technical report No. 388. pp. 13-15, 22, 47-48. [ Links ]
Porta, J., M. López y C. Roquero. 2003. Edafología: para la agricultura y el medio ambiente. Tercera edición. Ediciones Mundi- Prensa, Madrid. 322 p. [ Links ]
Poutou, R., E. Amador y M. Candelario. 1994. Banco de células primario: caracterización y papel en la producción de proteínas recombinantes. Centro de Ingeniería Genética y Biotecnología Aplicada. Sociedad Iberoamericana de Biotecnología 11, 55-59. [ Links ]
Quintero, M., A. Pedroza y A. Matiz. 2004. Evaluación de un preformulado sólido como acelerador de compostaje de residuos orgánicos en el municipio de El Cocuy. Trabajo de grado. Facultad de Ciencias, Pontificia Universidad Javeriana, Bogotá. pp. 52-75. [ Links ]
Rodríguez, M. 2000. Towards identifying biochemical markers for post harvest physiological deterioration in Cassava. Ph.D. thesis. University of Bath, U.K. [ Links ]
Tate, R. 1987. Soil organic matter: biological and ecological effects. John Wiley and Sons, Nueva York. pp. 70-77. [ Links ]
Turner, B., D. Hopkins, P. Haygarth y N. Ostle. 2002. B-Glycosidase activity in pasture soils. Appl. Soil Ecol. 20, 157-162. [ Links ]
Vassalo, A., E. Rogana, C. Fátima y D. Ferreira. 1999. The correction of reaction rates in continuous fluorometric assays of enzymes. Journal of Biochemistry and Biofisiology Methods. doi: 10.1016/j.jbbm; consulta: 11 de julio de 2007. [ Links ]
Wader, J. y K. Kaiser. 1995. Fluorogenic substrates for hydrolase detection following electrophoresis. J. Chromatography 698, 181-201. [ Links ]














