Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Agronomía Colombiana
versión impresa ISSN 0120-9965
Agron. colomb. v.28 n.2 Bogotá mayo/ago. 2010
Presencia de cuatro virus en algunas accesiones de la Colección Central Colombiana de papa mantenida en campo
Presence of four viruses in some field accessions of the Colombian Potato Central Collection
Mónica Guzmán1, 3, Verónica Román1, Liliana Franco2 y Patricia Rodríguez1
1 Laboratorio de Virus Vegetales, Instituto de Biotecnología (IBUN), Universidad Nacional de Colombia, Bogota (Colombia).
2 Facultad de Ciencias, Universidad Militar Nueva Granada, Bogotá (Colombia).
3 Autor de correspondencia. mmguzmanb@unal.edu.co
RESUMEN
La Colección Central Colombiana (CCC) de papa en campo puede ser blanco de fitopatógenos. En el año 2008 se estableció la prevalencia de los virus Potato virus X (PVX), Potato virus Y (PVY), Potato leafroll virus (PLRV), y Potato virus S (PVS) en muestras de un grupo de 581 accesiones de papa (Solanum L. sect. Petota Dumort) mantenidas por la Corporación Colombiana Agropecuaria (Corpoica). Folíolos de dos plantas por accesión se expusieron a anticuerpos comerciales específicos (Agdia) haciendo uso de las técnicas ELISA-DAS o DASI. El 98,8% de todas las muestras analizadas arrojó resultados positivos para al menos uno de los cuatro virus, en diferentes porcentajes para cada uno de ellos. PVS se detectó en el 85% de las accesiones, seguido de PLRV (77,4%), PVY (58,6%) y PVX (13,9%). En el 44% de las muestras de los Grupos Chaucha y Phureja se detectaron sólo dos de los virus evaluados; en el 40% de las accesiones de los Grupos Tuberosum y Andígena se encontraron tres virus; y en el 21% de las muestras del Grupo Tuberosum se observaron cuatro de ellos. Se encontró una alta prevalencia de infección viral simple y mixta en las accesiones analizadas (aproximadamente 50% de la Colección estudiada). Esta incidencia infecciosa puede ir deteriorando la calidad y cantidad de estos tubérculos. Pocas accesiones (1,2%) arrojaron resultados negativos para los cuatro virus. Sin embargo, cabe señalar que no se analizaron todas las plantas disponibles para una misma accesión, lo cual impide afirmar que los resultados son concluyentes. A pesar de ello, estos son importantes para las instituciones y programas interesados en la conservación de recursos genéticos y el mantenimiento de la diversidad de Solanum L. sect. Petota Dumort en Colombia.
Palabras clave: banco de germoplasma, técnica ELISA, virus de papa, diagnóstico.
ABSTRACT
The Colombian Central Potato Collection (CCC) is exposed to the attack of phytopathogens in the field. In 2008, the present research established the prevalence of the following potato viruses: Potato virus X (PVX), Potato virus Y (PVY), Potato leafroll virus (PLRV), y Potato virus S (PVS) in samples of 581 potato (Solanum L. sect. Petota Dumort) accessions maintained by Corpoica (Corporación Colombiana Agropecuaria). Leaflets of two plants per accession were exposed to commercial specific antibodies (Agdia) by DAS-ELISA or DASI techniques. Of the studied samples, 98.8% tested positive for at least one of the four viruses, in different percentages. PVS was found in 85% of the samples, followed by PLRV (77.4%), PVY (58.6%) and PVX (13.9%). In 44% of the samples of Groups Chaucha and Phureja the screening detected only two of the studied viruses. Forty percent of the samples of Groups Tuberosum and Andigena had three of the viruses; and 21% of the Group Tuberosum materials were infected by four of the pathogens. A strong prevalence (50% of the accessions) of simple and mixed infections was observed, a condition that may deteriorate the quality and quantity of these tubers. Only a few accessions (1.2%) tested negative for the four viruses. As only two samples per accession were studied, the results cannot be said to be conclusive. Yet, they are important for institutions and programs devoted to the conservation of genetic resources and to the maintenance of the diversity of Solanum L. sect. Petota Dumort in Colombia.
Key words: germplasm bank, ELISA technique, diagnostic, potato virus.
Introducción
El cultivo de papa es el cuarto en producción mundial, con 300 millones de toneladas sembradas en aproximadamente 18 millones de hectáreas (Faostat, 2009). En Colombia, el cultivo ocupa el quinto lugar en la producción agrícola, con dos millones de toneladas sembradas en 140.050 ha ubicadas principalmente en los departamentos de Cundinamarca, Boyacá, Nariño y Antioquia. En otros departamentos la papa es un cultivo secundario, y el consumo per capita es de 43 kg año-1 (Díaz, 2004; Faostat, 2009). La mayor diversidad de papa se encuentra en los países andinos como Perú, Bolivia, Colombia, Ecuador y Venezuela. Solo Perú informa 3.800 variedades (CIP, 2009). Rodríguez (2009) hace una revisión para compilar las diferentes propuestas existentes para la clasificación de la papa cultivada y sus parientes silvestres, Solanum L. sect. Petota Dumort, indicando que la taxonomía continúa siendo compleja y no hay consenso acerca de la clasificación de la papa, basado en trabajos de Huaman y Spooner (2002), entre otros, quienes reclasifican las papas más cultivadas en tres Grupos como Solanum tuberosum, Grupos Phureja, Chaucha y Andígena, manteniendo a S. tuberosum ssp. tuberosum (estos son los grupos de interés para el presente trabajo). Las diferencias principales entre los grupos son el tamaño, la calidad y el periodo de dormancia de los tubérculos, la ploidía (Phureja-diploide, Chaucha-triploide; Andígena-tetraploide y tuberosum-dipoloide), características de las hojas y flores, tiempo y calidad de luz (días largos o cortos) para la floración y el desarrollo de tubérculos (Estrada, 1999; Vreugdenhil, 2007).
La Colección Central Colombiana (CCC) de papa mantenida por Corpoica procura la preservación de los bancos de germoplasma de papa. La colección de campo de 915 accesiones en tubérculo-semilla se regenera cada año y se utiliza como activa y de base. Consta de plantas vivas que se propagan vegetativamente en el campo mediante tubérculos semilla. Está conformada por los grupos: subespecie andígena, 664 accesiones, subespecie tuberosum, 84 accesiones, especie phureja, 52 accesiones, chaucha, 48 accesiones; variedades comerciales, 32 y 4 accesiones provenientes de colectas provenientes del departamento de Boyacá, en 1999, y 31 accesiones de especies cultivadas y silvestres: jungadifolium, flahaultii, stoloniferum, estradae, colombianum (Moreno y Valbuena, 2006).
Los tubérculos mantienen las características diversas de cada material, pero pueden servir de reservorios de fitopatógenos como virus, los cuales se perpetúan por infección vertical (Razdan y Mattoo, 2005; Guzmán, 2008). Se reportan aproximadamente 40 virus que infectan la papa (Vreugdenhil, 2007), de los cuales 25 se encuentran en la región andina (Salazar, 1981). Los efectos de la expresión viral (clorosis, necrosis, mosaicos en las hojas, etc.) pueden causar alteraciones de la forma o el número de tubérculo afectando la calidad de las accesiones (Salazar, 1981) y, eventualmente, la supervivencia de estas. Los virus de plantas de mayor incidencia se caracterizan por ser RNA monocatenario, de sentido positivo. Las características principales de algunos virus que infectan la papa se sintetizan en la Tab. 1.
Estimar las pérdidas por infecciones virales es complicado, pues depende de factores como los variantes virales, variedad, edad de las plantas, factores climáticos, presencia de otros virus, entre otros (Salazar, 1995; Guzmán, 2008). Algunas razas de PVX provocan necrosis que pueden causar pérdidas de la producción entre el 15 y el 50%, y el PLRV, patógeno de la papa más distribuido en el mundo, puede llegar a producir pérdidas hasta del 80% (Marshall et al., 1988). El PVS se caracteriza por presentar síntomas suaves, pero puede disminuir el rendimiento de manera significativa (Wetter, 1971). El PVY puede causar pérdidas hasta del 80%, dependiendo del aislado y del cultivar; además causa infecciones severas en tomate, tabaco y pimentón (Beemster y de Bokx, 1987). El PVX expresa síntomas variables y puede causar pérdidas entre el 10 y el 50% (Beemster y de Bokx, 1987). En muchos casos, la presencia conjunta de dos virus en la misma planta exacerba la expresión de los síntomas aumentando las pérdidas; por ejemplo, las mezclas de PVX + PVY y PVY + PLRV pueden disminuir la producción de las cosechas hasta en un 80% (Salazar, 1981, 1990; Savenkov y Valkonen, 2001; Zapata, 2004; Agrios, 2005).
La prevalencia de algunos virus importantes para el cultivo de la papa se ha estudiado especialmente en campo o en diferentes colecciones de germoplasma del mundo; por ejemplo en Chile, Contreras y Banse (1982) reportaron la presencia de PVS (54,4%), PVX (33,1%), PVY (19%) y PLRV (16,5%), como los virus más comunes. En Perú, Baker (2007) informa de una prevalencia de PVS de 8,7%, seguido de PVY (6,5%), PLRV (4,3%) y PVX (2,2%). En general, estos cuatro virus son los más estudiados en los diferentes países cultivadores de papa por su alta prevalencia y sus efectos en la producción (Bertschinger et al., 1990; Rodríguez et al., 1997; Fankhauser, et al., 1999; Devaux, et al., 2000; Guzmán, et al., 2002; Lozoya, et al., 2002; Clausen et al., 2005; Vásquez et al., 2006).
La técnica serológica cuantitativa de ELISA (Enzyme Linked Inmmunosorbent Assay) para la detección de virus vegetales, adaptada por Clark y Adams (1977), se utiliza ampliamente en la detección de virus vegetales y en la medición del título viral, por su sensibilidad y facilidad de interpretación. Actualmente se utilizan las variantes ELISA-DAS y DASI (Enzyme Linked Inmmunosorbent Assay - Double Antibody Sandwich/-Indirect), respectivamente, en las que se utilizan anticuerpos específicos para la detección viral (cubrimiento y secundario) y anticuerpos conjugados a la fosfatasa alcalina, que por reacción con el sustrato de esta enzima, permiten la estimación del título viral por medio de la medición de la absorbancia a 405 nm. Los valores de densidad óptica (DO) son relativos al título viral en la muestra, y la estimación de la concentración de virus en la muestra se hace mediante comparación con una curva de calibración de concentración conocida (Clark y Adams, 1977; Guzmán et al., 2002; Agrios, 2005; Guzmán, 2008).
Los estudios sobre la incidencia de virus en colecciones y bancos de germoplasma no solo tienen como objeto conocer el estado fitosanitario de las accesiones para tomar decisiones oportunas de control y manejo, sino que sirven para evitar el degeneramiento de las variedades y buscar materiales mejorados o silvestres que sean portadores de genes de resistencia a virus o a sus vectores, y que eventualmente puedan emplearse en cruces de programas de mejoramiento. El objetivo del presente trabajo fue determinar mediante técnicas serológicas la prevalencia simple de los virus PVX, PLRV, PVY, PVS y de sus posibles combinaciones (mixta) en un grupo de accesiones derivadas de la CCC de papa mantenida por Corpoica-Tibaitatá en condiciones de campo y conocer la posible dependencia de los virus con relación al hospedero.
Metodología
Material vegetal y aislados virales
Se recolectaron 581 accesiones de la CCC de papa de campo ubicada en el Centro Experimental de Corpoica-Tibaitatá, Mosquera (Cundinamarca). Del total de accesiones, el 73% correspondía a S. tuberosum grupo Andígena, 12% a S. tuberosum spp. tuberosum, 10% al grupo Phureja y 6% al grupo Chaucha. Para cada accesión se recolectaron muestras foliares de dos plantas solamente (A y B) y se almacenaron a -20°C. Los aislados virales se obtuvieron macerando en nitrógeno líquido las muestras foliares de las 1.170 plantas, seguido de resuspensión en buffer de extracción de ELISA pH 7,4 en relación 1:10 (instrucciones Agdia).
Detección de los virus PVX, PLRV, PVS y PVY por ELISA
La técnica de ELISA-DAS fue utilizada para la detección de PVX, PLRV, PVS, y la ELISA-DASI para la detección del virus PVY. Para este último se usaron los anticuerpos primario y secundario Anti-PVY y el conjugado RAM (Rabbit anti-mouse) marcado con la fosfatasa alcalina. Se siguieron los protocolos propuestos para cada virus por la casa comercial Agdia (Elkhart, IN). Cada una de las 1.170 muestras (581 A y 581 B) se analizó adicionalmente por duplicado en pozos independientes de la placa de ELISA. La densidad óptica (DO) de cada planta se estableció como el promedio de las DO de los duplicados. Los resultados se compararon con controles positivos y negativos (Agdia®) para cada virus o utilizando el CTV (Citrus tristeza virus) como control negativo. Las placas se leyeron a los 90 min en un lector de ELISA Biorad® (Bio-Rad Laboratories, Inc., Hercules, CA) con un filtro de 405 nm. Una muestra se consideró positiva (infectada) para un virus, cuando la DO fue mayor al doble del promedio de las DO de los controles negativos de cada placa de ELISA, siguiendo la metodología estandarizada utilizada en el Laboratorio de Virus Vegetales del Instituto de Biotecnología de la Universidad Nacional de Colombia.
Análisis estadístico
La prevalencia se calculó como el porcentaje de infección (número de muestras positivas sobre muestras infectadas), a partir de los promedios de DO de cada muestra, para lo cual se utilizó el programa Excel® (Microsoft Corporation, Washington, DF) para los análisis de porcentajes y gráficas. Los rangos de infección se establecieron arbitrariamente con relación al promedio de DO del control negativo (CN), así: 2CN ≤ DO baja < 3CN; 3CN ≤ DO media < 5CN 2CN ≤ DO baja < 4CN; 4CN ≤ DO media < 8CN y 8CN ≤ DO alta. Para conocer la posible dependencia (o independencia) de los virus con relación al hospedero, se realizó la prueba de tablas cruzadas con chi2 (X2) con el programa Minitab® (Minitab Inc., State College, PA).
Resultados y discusión
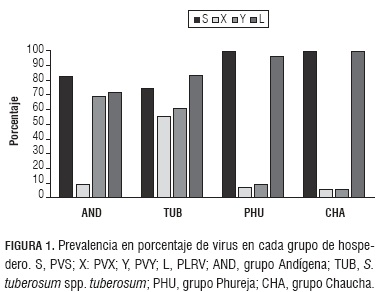
De las 581 accesiones analizadas de la CCC de papa, el 1,2%, fueron negativas para los virus evaluados y 11,3% fueron positivas para un virus; es decir, se detectaron infecciones mixtas en la mayoría de las accesiones (87,5%). La prevalencia general de los virus fue la siguiente: PVS (84,7%), PLRV (77,2%), PVY (58,6%) y PVX (13,9%), predominando los virus transmitidos por áfidos. La Fig. 1 resume la prevalencia de cada virus por hospedero. En Phureja y Chaucha, el virus PVS se detectó en 100% de las muestras y PLRV en el 96,4 y 100%, respectivamente. En los grupos Andígena y Tuberosum tuberosum, PVS se detectó en 83 y 74,6% y PLRV en 71% y 83% de las accesiones, respectivamente. PVX se detectó en bajo porcentaje (entre 5,9 y 8,9%) en los hospederos. Un ejemplo de los resultados de las placas de ELISA para la detección de cada uno de los virus PVX, PLRV, PVS y PVY en un mismo grupo de accesiones de papa se muestra en la Fig. 2. Separando las accesiones estudiadas por grupos de Solanum tuberosum, se encontró en general que la infección mixta de dos virus se presenta en una frecuencia mayor al 80% en las muestras de accesiones de los grupos Chaucha y Phureja, mientras que infecciones de tres virus se detectaron en 40% de las accesiones de S. tuberosum spp. tuberosum y en el grupo Andígena. Cuatro virus se detectaron en 4,7% de las accesiones, con mayor prevalencia en S. tuberosum spp. tuberosum. La Tab. 2 resume los porcentajes de prevalencia de cada virus por grupo de accesiones y los diferentes tipos de combinaciones virales encontradas versus los hospederos. Como se desprende de esta tabla, en el grupo Andígena la infección simple más frecuente fue de PVS (6,22%) y la combinación viral más frecuente fue entre los virus PVS+PVY+PLRV (40,67%). En los grupos Phureja y Chaucha, la combinación más frecuente fue de los virus PVS+PLRV en más del 80% de las muestras. En S. tuberosum spp. tuberosum, se detectaron diferentes combinaciones entre tres y cuatro virus con porcentajes similares (16,4; 19,4 y 20%).
Es importante resaltar que PVS se detectó en todos los grupos de accesiones y en todas las combinaciones, ya sea entre dos, tres o cuatro virus. PVS es un virus ampliamente distribuido en cultivos del mundo, y causa, en general, síntomas suaves que pueden pasar desapercibidos, pero reduce significativamente los rendimientos. La infección usualmente es latente, y algunos cultivares sensibles pueden mostrar mosaico o bandas de colores tenues en las nervaduras. La alta prevalencia del virus PVS en todas las accesiones podría explicarse porque se transmite tanto mecánicamente como por vectores áfidos, ampliando las posibilidades de contaminación de las plantas. No es claro todavía si podría potenciar la expresión de otros virus estableciendo relaciones sinérgicas que puedan causar pérdidas importantes para el cultivo y pérdidas de las accesiones del banco de germoplasma que lo contengan. De otra parte, en PVX es llamativa la baja prevalencia encontrada en este estudio como infección simple. Este virus se halló principalmente en combinaciones mixtas de tres virus, entre PVY, PLRV o PVS ( Tab. 2). En otros trabajos se ha reportado que PVX y PVY actúan sinérgicamente y pueden reducir el número de tubérculos y la producción hasta en 60% (Hooker, 1981; Pruss et al., 1997). Por su parte, PLRV se encontró en combinaciones diferentes, ya sea con PVS o de otra parte, combinado con PYS y PVY (Tab. 2). PLRV es considerado uno de los virus con mayor efecto en el rendimiento de papa. En los diferentes países andinos la infección simple ha reducido la producción hasta en un 50%.
En Perú, Scheidegger et al. (1995) informaron una reducción del rendimiento del 49% causada por la infección de PLRV en combinación con APMV. Con frecuencia, se subestima el efecto de combinaciones virales, y la degeneración de los cultivares de papa puede incrementarse por la infección viral de varios virus a la vez. De otra parte, Salazar (1990) y Bertschinger et al. (1995) plantearon que los virus PLRV y PVY transmitidos por los áfidos reducen hasta en 50% el rendimiento de una población originada en tubérculos-semilla sanos, en tanto que los virus transmitidos por contacto y combinaciones virales entre ellos ocasionaron una reducción significativa del rendimiento en el caso de cultivos de baja densidad de siembra.
Los altos porcentajes de infecciones mixtas entre dos o tres virus (especialmente de las asociaciones PVS+PLRV y PVS+PVY+PLRV) puede deberse a que los tubérculos de algunas accesiones colectadas en campo, en diferentes localidades del país, se introdujeron en la CCC de papa ya infectadas por uno o varios virus. Por tanto, es preciso indexar el material antes de ser introducido en la CCC de papa. De otra parte, los virus pudieron ser adquiridos durante el mantenimiento de las accesiones en el campo, ya sea por transmisión con vectores tipo áfidos, moscas o mecánicamente, por roce entre plantas o por herramientas infectadas (Rodríguez et al., 1997; Guzmán, 2008). Para evitar los efectos deletéreos de los virus en las colecciones de germoplasma, un procedimiento común es el análisis de los materiales por ELISA, por diagnóstico molecular o por microscopía electrónica o por cultivo in vitro de meristemos, que permitan eliminar plantas infectadas de la colección antes de que se dispersen los virus, rutinas que se implementan en el Centro Internacional de la Papa (CIP). De cualquier forma, el riesgo de perder accesiones y diversidad genética de la papa en Colombia debido a la infección viral podría ser alta a corto o mediano tiempo, si no se apoyan los programas de manejo de patógenos utilizando cultivo in vitro o de criopreservación y métodos de detección rutinaria de patógenos y selección fitosanitaria en campo.
De otra parte, utilizando la prueba de tablas cruzadas con chi2 (X2) con el programa Minitab® (2007), se estableció una cierta dependencia de los virus con relación a un grupo de papa, correlación en que probablemente tenga que ver la ploidía (Tab. 3), lo que concuerda con diferentes autores (Mollov y Thill, 2004; Bertschinger et al., 1990). De los cuatro virus estudiados, el que menos aporta en la dependencia es PVS porque se encuentra en altas proporciones en los cuatro huéspedes, mientras que PVY está más asociado con el grupo Andígena al contribuir más a la fórmula de X2; igual ocurre con el virus PVX y S. tuberosum spp. tuberosum. Es probable que otras características, como el fotoperiodo y el periodo de dormancia influyan (Estrada, 1999), o en el caso de PVX (transmitido mecánicamente), por el manejo que el banco le da a los tubérculos (Salazar, 1995).
La Fig. 3 ilustra los porcentajes de accesiones por cada grupo (Phureja, Chaucha, Andigena, S. tuberosum spp. tuberosum) teniendo en cuenta los rangos de las DO encontrados para cada virus. Más del 50% de las muestras de los grupos Phureja y Chaucha están infectadas con los virus PVS y PLRV con alto título viral (DO entre 1,7 hasta 2,8) (Fig. 3a y b). El 55% de accesiones de la subespecie tuberosum que contienen el virus PVX concuerda con los resultados cruzados de dependencia P = 0,00 X2 = 44,7 (Tab. 3). Además, la DO del virus PVX en esta subespecie presentó los valores más altos (DO: 2,0-3,1), lo que podría indicar que es un huésped más susceptible (Fig. 3d). En el grupo Andígena, los rangos de DO (bajo, medio, alto) fueron similares para todos los virus (Fig. 3c), sugiriendo que es un hospedero muy susceptible. Se podría sospechar diferentes tiempos de infección en el desarrollo de las accesiones en campo, lo que conlleva a un título viral diferente puesto que fueron sembradas en la misma época.
Los altos títulos virales se relacionan con la prevalencia de los virus en cada especie, pero nada se puede concluir sobre la resistencia de la subespecie tuberosum o del grupo Andígena a los virus PVS, PLRV y PVY. Los virus PVY y PVX presentaron bajo título viral en el grupo Phureja o ausencia en el grupo Chaucha (Fig. 3a y b), y es probable que puedan ser hospederos más tolerantes o resistentes. Esta es una observación preliminar interesante que justificaría estudios en búsqueda de genes de tolerancia o resistencia a estos virus en estos grupos de genotipos. Según Zapata (2004), la mayoría de los virus están especializados para infectar sólo algunos géneros o especies de plantas. Dependiendo del número de especies que el virus pueda infectar, se dice que el rango de hospederos es estrecho, moderado o amplio. Para el mismo virus, las especies pueden reaccionar con diferentes síntomas; por ejemplo, el PLRV infecta Solanum tuberosum spp. tuberosum e induce síntomas diferentes a los inducidos en S. tuberosum ssp. andigena.
Para las combinaciones PVY+PVX o PVY+PLRV ya se ha informado el efecto sinergístico en lo relativo a la reducción de la producción.
En síntesis, en el presente trabajo se encontró una alta prevalencia de todos los virus analizados, (85%) de PVS, seguido de PLRV (77,4%), PVY (58,6%) y PVX (13,9%), casi el doble de lo informado por Contreras y Banse (1982) para Chile, donde PVS se detectó en 54,4%, PVX en 33,1%, PVY en 19% y PLRV en 16,5%, y alrededor de cuatro veces mayor que la prevalencia informada por Baker (2007) para Perú, donde PVS se detectó en 8,7% de muestras, seguido de PVY (6,5%), PLRV (4,3%) y PVX (2,2%). Las diferencias pueden deberse a varios factores como clima, altitud, variedades, incidencia de vectores, etc.; por tanto, los estudios no son completamente comparables entre sí. Sin embargo, es llamativo que PVS fue el virus de mayor prevalencia en los diferentes estudios, incluyendo el presente, al tener en cuenta que este virus se transmite mecánicamente y también por áfidos, lo que incrementaría la posibilidad de infección planta a planta. Es de anotar que el presente estudio determinó también la prevalencia de virus tanto en forma simple (únicos) como en mezclas entre ellos.
Finalmente es necesario reiterar que en el presente estudio se evaluó aproximadamente un 50% de la CCC de papa (581/915), con dos plantas por cada accesión tomadas al azar, y no se tiene certeza sobre si la condición de virosis se mantiene igual en las otras plantas que conformen una determinada accesión. Tampoco se realizó un análisis de la expresión de síntomas en las accesiones en condición de infección viral simple o mixta, por lo que no se pueden confirmar los fenómenos de resistencia, tolerancia o susceptibilidad. Queda en duda si el 1,2% de las accesiones negativas a los cuatro virus se debe a que podrían ser resistentes a los cuatro virus, cosa muy poco probable, o es una situación exclusiva de las dos plantas analizadas o que el material sea más propenso a la oxidación, y eso altere el resultado de ELISA. De los resultados obtenidos es posible predecir que en algunos hospederos se puedan desarrollar sinergismos entre combinaciones de virus diferentes. También es posible suponer que las accesiones afectadas por virosis se puedan deteriorar y aun perder como acervo genético.
Conclusiones
Este estudio pone de manifiesto los altos porcentajes de prevalencia de PVX, PVY, PVS y PLRV que afectan las accesiones de papa de la CCC de papa, ya sea en infecciones simples o mixtas entre dos virus (PLRV+PVS), (PVS+PVY) o más virus (PLRV+PVY+PVS). También se intentó relacionar la presencia de un virus determinado o grupo de ellos con un hospedero específico, y se halló cierta relación, pero no es concluyente. Los resultados indicaron que la subespecie tuberosum y el grupo Andígena son los más susceptibles a los virus PVX y PVY, respectivamente, mientras los grupos Phureja y Chaucha pueden ser infectados por cualquiera de los cuatro virus con títulos virales bajos o medios.
La prevalencia de PVS fue alta como infección simple, al igual que en reportes de otros países, y en combinaciones virales sobre las cuales hay pocos estudios, razón por la cual se desconoce si existen sinergismos entre estos virus.
Teniendo en cuenta que las infecciones virales simples o mixtas, transmitidas por vectores naturales, vegetativa o mecánicamente, pueden dar como resultado la reducción de la producción del número de tubérculos y de la calidad de los mismos, potencialmente ampliando la erosión de la variabilidad genética de la papa, y que en la CCC de papa se encuentra "la mayor riqueza de variabilidad genética para el mejoramiento del cultivo de papa" (Moreno y Valbuena, 2006), los resultados de este trabajo, basados en un conjunto parcial de muestras y de accesiones, deberían ser de importancia para las proyecciones de las instituciones y de los programas que propenden por la conservación de recursos genéticos y el mantenimiento de la diversidad de Solanum L. sect. Petota Dumort en Colombia.
De otra parte, sería interesante realizar un estudio sobre las posibles sinergias de estos virus y de sus posibles efectos en la producción. Además, analizar si la expresión de las infecciones virales puede variar entre los genotipos de las plantas, pues poco se conoce acerca de los factores que llevan a la expresión diferencial de los virus. Esto permitiría profundizar el conocimiento actual de las relaciones entre las plantas y virus, con el fin de conocer el origen molecular de los síntomas.
Agradecimientos
A Corpoica-Tibaitatá, Colección Central Colombiana de papa (Dílmer Moreno, curador), a Colciencias por su financiación (Convocatoria 405-2007), al Laboratorio de Virus Vegetales del Instituto de Biotecnología de la Universidad Nacional de Colombia, a Karen Cubillos, a María Teresa Martínez y a Camilo Soto por la colaboración técnica.
Literatura citada
Agrios, G. 2005. Plant pathology. 5th ed. Elsevier, Academic Press, New York, NY. [ Links ]
Beemster, A.B.R. y A. de Bokx. 1987. Survey of properties and symptoms. pp. 84-113. En: De Bokx, J.A. y J.P.H. van der Want (eds.). Viruses of potatoes and seed potato production. Wageningen University, Wageningen, The Netherlands. [ Links ]
Bertschinger, L., U. Scheidegger, K. Luther, O. Pinillos y A. Hidalgo. 1990. La incidencia de virus de papa en cultivares nativos y mejorados en La Sierra Peruana. Rev. Latinoam. Papa 3(1), 62-79. [ Links ]
Bertschinger, L., U.C. Scheidegger, J. Muñoz y A. Hidalgo. 1995. Efecto de diferentes virus sobre el rendimiento potencial de la papa y su interacción con el estado de brotamiento de tubérculos-semilla en la costa del Perú. Rev. Latinoam. Papa 7(8), 36-54. [ Links ]
CIP. 2009. Potato. En: Centro Internacional de la Papa, http://www.cipotato.org/potato; consulta: agosto de 2010. [ Links ]
Clark, M.F. y A.N. Adams. 1977. Characteristics of the microplate method of enzyme-linked immunosorbent assay for the detection of plant viruses. J. Gen. Virol. 34, 475-483. [ Links ]
Clausen, A., M. Colavita, I. Butzonitch y A.V. Carranza. 2005. A potato collecting expedition in the province of Jujuy, Argentina and disease indexing of virus and fungus pathogens in Andean cultivars. Genet. Resour. Crop. Evol. 52, 1099-1109. [ Links ]
Contreras, M.A. y J. Banse H. 1982. Determinación de virus en el Germoplasma chileno de papas Solanum sp. Agro Sur 10(2), 84-89. [ Links ]
Díaz, A., A. 2004. Guía ambiental para el cultivo de papa. Fedepapa; Ministerio de Ambiente, Vivienda y Desarrollo Social, Bogotá. [ Links ]
Devaux A., S. Gonzales, C. Bejarano, R. Casso, V. Suárez y T. Walker. 2000. Comparative performance and on-farm profitability of certified potato seed in the highlands of Bolivia. Program Report 1999-2000. Centro Internacional de Papa (CIP), Lima. [ Links ]
Estrada R., N. 1999. La biodiversidad en el mejoramiento genético de la papa. Proinpa; CIP; CID, La Paz. [ Links ]
Fankhauser, C., F. Merino, F. Yumisaca, J. Pucha y C. Gessler. 1999. Main diseases affecting seed degeneration in Ecuador, new perspectives for seed production in the Andes. En: 14th Triennial Conference European Association for Potato Research (EAPR). Sorrento, Italia. [ Links ]
Faostat. 2009. Producción mundial de papa, 1991-2007. En: FAO, http://faostat.fao.org/site/567/default.aspx#ancor; consulta: julio de 2010. [ Links ]
Guzmán, M., M. Caro e Y. García. 2002. Técnica de inmunoimpresión en membranas de nitrocelulosa: una detección rápida para estimar la incidencia de los virus PVX, PVY, PVS y PLRV que infectan a la papa (Solanum spp.). Rev. Colomb. Biotecnol. 4(2), 45-51. [ Links ]
Guzmán, M. 2008. Manual de protocolos para la detección de algunos virus que infectan la papa. Cevipapa; Ministerio de Agricultura y Desarrollo Social; IBUN-Universidad Nacional de Colombia; Unibiblos, Bogotá. [ Links ]
Hooker, W.J. 1981. Compendium of potato diseases. American Phytopathological Society; Centro Internacional de Papa (CIP), Lima. [ Links ]
Huaman, Z. y M. Spooner. 2002. Reclassification of landrace populations of cultivated potatoes (Solanum sect. petota). Amer. J. Bot. 89(6), 947-965. [ Links ]
ICTVdB Management. 2006. 00.057. Potyviridae. En: Büchen-Osmond, C. (ed.). ICTVdB - The Universal Virus Database, version 3. Columbia University, New York, NY. [ Links ]
ICTVdB Management. 2006. 00.039. Luteoviridae. En: Büchen-Osmond, C. (ed.). ICTVdB - The Universal Virus Database, version 3. Columbia University, New York, NY. [ Links ]
ICTVdB Management. 2006. 00.056. Flexiviridae. Potato virus X. En: Büchen-Osmond, C. (ed.). ICTVdB - The Universal Virus Database, version 3. Columbia University, New York, NY. [ Links ]
Lozoya, H., V. Sánchez, R. Román y A. Hernández. 2002. Virosis en clones internacionales de papa (Solanum tuberosum L.) en el Valle de Toluca, México. Agrociencia 36(1), 93-102. [ Links ]
Luque, C., P. Corzo y O. Pérez. 1991. Incidencia de virus en papa y su efecto sobre rendimiento en tres zonas agroecológicas de Colombia. Rev. Latinoam. Papa 4, 36-51. [ Links ]
Marshall, B., H. Barker y S.R. Verrall. 1988. Effect of Potato leafroll virus on the crop process leading to potato yield in potato tubers which differ in tolerance to infection. Ann. Appl. Biol. 113, 297-305. [ Links ]
Mollov, D. y C. Thill. 2004. Evidence of Potato virus Y asymptomatic clones in diploid and tetraploid potato breeding populations. Amer. J. Pot. Res. 81(5), 317-326. [ Links ]
Moreno, J.D. e I. Valbuena. 2006. Colección central colombiana de papa: riqueza de variabilidad genética para el mejoramiento del cultivo. Rev. Corpoica Cienc. Tecnol. Agropec. 4(4), 1-9. [ Links ]
Pruss G., X. Ge, X.M. Shi, J.C. Carrington y V.B. Vance. 1997. Plant viral synergism: the potyviral genome encodes a broad-range pathogenicity enhancer that transactivates replication of heterologous viruses. Plant Cell 9(6), 859-868. [ Links ]
Razdan, M.K. y A.K. Mattoo. 2005. Genetic improvement of solanaceous crops.Vol. 1 Potato. Science Publ., Inc. Enfield, NH. [ Links ]
Rodríguez, Y., E. Ortega C. y G. Trujillo. 1997. Diseminación de cuatro virus de papa en las zonas de Mucuchíes, Estado Mérida y el Páramo de Cubiro, Estado Lara, Venezuela. Rev. Latinoam. Papa 9(10), 60-76. [ Links ]
Rodríguez, L.E. 2009. Teorías sobre la clasificación taxonómica de las papas cultivadas (Solanum L. sect. Petota Dumort.). Una revisión. Agron. Colomb. 27(3), 305-312. [ Links ]
Salazar, L.F. 1981. Detection of PSTV by gel electrophoresis. Slide Set and Guide Book. International Potato Center (CIP), Lima. [ Links ]
Salazar, L.F. 1990. Main virus diseases of potato. Control of virus and virus-like diseases of potato and sweet potato. pp. 9-12. En: Report of 3rd Planning Conference. Centro Internacional de la Papa (CIP), Lima. [ Links ]
Salazar, L.F. 1995. Los virus de la papa y su control. Centro Internacional de la Papa (CIP), Lima. [ Links ]
Savenkov, E.I. y J.P.T. Valkonen. 2001. Potyviral helper-component proteinase expressed in transgenic plants enhances titers of Potato Leaf Roll Virus but does not alleviate its phloem limitation. Virol. 283, 285-293. [ Links ]
Vásquez, V., M. Montero-Astúa y C. Rivera. 2006. Incidencia y distribución altitudinal de 13 virus en cultivos de Solanum tuberosum (Solanaceae) en Costa Rica. Rev. Biol. Trop. 54(4), 1135-1141. [ Links ]
Vreugdenhil, D. 2007. Potato biology and biotechnology advances and perspectives. Elsevier, Amsterdam. [ Links ]
Wetter, C. 1971. Potato virus S. p. 3. En: Descriptions of plant viruses No 60. Common Wealth Mycological Institute; Association of Applied Biologists, Kew, UK. [ Links ]
Zapata, J.L. 2004. Algunos aspectos sobre los virus de la papa en Colombia. p. 24. En: Memorias I Taller Nacional sobre Patógenos del Suelo, Virus e Insectos Plaga Diferentes a Tecia solanivora. Cevipapa, Bogotá. [ Links ]