Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicas UIS
Print version ISSN 0121-0319
Medicas UIS vol.26 no.1 Bicaramanga Jan./Apr. 2013
Factores, causas y perspectivas de la obesidad
infantil en México
Mario E. Acosta-Hernández*
Eloy Gasca-Pérez*
Fernando R. Ramos-Morales**
Rosa V. García -Rodríguez**
Francisco Solís-Páez***
Gabriela Evaristo-Portilla****
Abraham H. Soto-Cid *****
*Maestro en Ciencias. Unidad de Servicios de Apoyo en Resolución Analítica de la Universidad Veracruzana. Calle Luis Castelazo Ayala S/N, Col. Industrial Animas, 91020, Xalapa. Veracruz. México.
**Doctor en Ciencias. Unidad de Servicios de Apoyo en Resolución Analítica de la Universidad Veracruzana. Calle Luis Castelazo Ayala S/N, Col. Industrial Animas, 91020, Xalapa. Veracruz. México.
***Licenciado en Quimica Clinica. Facultad de Bioanálisis Campus Xalapa. Universidad Veracruzana. Médicos y Odontólogos s/n Unidad del Bosque, 91010, Xalapa. Veracruz. México.
****Estudiante de Licenciatura en Química Clínica. Facultad de Bioanálisis Campus Xalapa. Universidad Veracruzana. Médicos y Odontólogos s/n Unidad del Bosque, 91010, Xalapa. Veracruz. México.
*****Doctor en Ciencias. Facultad de Química Farmacéutica Biológica. Universidad Veracruzana. Zona Universitaria, 91190, Xalapa. Veracruz. México.
Correspondencia: Dr. Fernando R. Ramos Morales.Unidad de Servicios de Apoyo en Resolución Analítica de la Universidad Veracruzana. Calle Luis Castelazo Ayala S/N, Col. Industrial Animas, 91020, Xalapa. Veracruz México. Correo electrónico: framos@uv.mx.
Artículo recibido 18 de enero de 2013 y aceptado para publicación el 1 de marzo de 2013
RESUMEN
Este escrito comprende una revisión bibliográfica sobre la obesidad infantil en México desde el año 2000 a 2012. La obesidad constituye un problema de salud pública la cual recientemente ha alcanzado proporciones de epidemia en algunos países. Esta patología constituye el principal problema de malnutrición en el adulto y es una enfermedad que ha aumentado notoriamente en la población infantil, ya que se calcula que más de 40 millones de niños padecen sobrepeso u obesidad. Es un trastorno multifactorial en cuya etiopatogenia están implicados factores genéticos, metabólicos, psicosociales y ambientales, por lo que es difícil distinguir en cada caso en particular la importancia relativa de estos factores. La obesidad infantil es uno de los factores de riesgo vinculados al aumento de enfermedad cardiovascular en el adulto, junto con la hipertensión, hipercolesterolemia y diabetes tipo II; se ha identificado que un factor importante en el desarrollo de la obesidad infantil es la influencia de los medios electrónicos que promueven un estilo de vida básicamente sedentario. (MÉD.UIS. 2013;26(1)59:68).
Palabras Clave: Obesidad. Pediatría. Sobrepeso. Diabetes Mellitus.
Factors, causes and perspective of childhood obesity in Mexico
ABSTRACT
This work is a review of the information about childhood obesity in Mexico from 2000 to 2012. Obesity is a public health problem, which has recently reached epidemic proportions in some countries. This pathology is the main problem of adult malnutrition and has dramatically increased in children, since it is estimated that over 40 million children have overweight or obesity. It involves several factors such as genetic, metabolic, psychosocial and environmental ones. As a result, it is difficult to distinguish their influence in different cases. However, a well-recognized factor in the development of childhood obesity is the media, which promotes a sedentary lifestyle. Childhood obesity is a risk factor associated with cardiovascular disease in adults, hypertension, hypercholesterolemia and diabetes Type II. (MÉD. UIS. 2013;26(1)59:68).
Keywords: Obesity. Pediatrics. Overweight. Diabetes Mellitus.
INTRODUCCIÓN
En la actualidad los términos de sobrepeso y obesidad se emplean como sinónimos, sin embargo, el sobrepeso se refiere a un exceso de peso corporal comparado con la talla, mientras que la obesidad se refiere a un exceso de grasa corporal. La obesidad puede definirse como aquella condición caracterizada por la acumulación excesiva de grasa corporal, como consecuencia de un ingreso calórico superior al gasto energético diario del individuo1,2. Actualmente es la pandemia no transmisible mayormente distribuida del mundo3.
Sin embargo, se ha definido a la obesidad como una enfermedad crónica, compleja y multifactorial que suele iniciarse en la infancia ó la adolescencia teniendo su origen en una interacción genética y ambiental, siendo más importante la parte ambiental o conductual, que se establece por un desequilibrio entre la ingesta y el gasto energético diario. Esta enfermedad se caracteriza por una excesiva acumulación de grasa y se manifiesta por un exceso de peso y volúmen corporal4.
De acuerdo con la OMS el Indice de Masa Corporal (IMC) definido como el peso en kilogramos de un sujeto, dividido por el cuadrado de la altura en metros (Kg/m2), es empleado para evaluar el sobre peso y la obesidad de un individuo, si un IMC está por arriba de 25 Kg/m2 es interpretado como sobrepeso y por encima de 30 Kg/m2 se cataloga como obesidad2,4-8. El objetivo de esta revisión es mostrar un panorama de la obesidad infantil en México, haciendo una revisión bibliográfica desde el año 2000 a 2012, considerando datos epidemiológicos de niños menores de 5 años y en edad escolar, de 5 a 11 años.
EPIDEMIOLOGÍA
De acuerdo con la OMS, actualmente existen en el mundo más de 1000 millones de adultos con problemas de sobrepeso y al menos 300 millones son clínicamente obesos. Estos índices no son propios sólo de países desarrollados, como inicialmente se llegó a pensar, sino que también afecta a países con menor desarrollo socioeconómico4. La obesidad y el sobrepeso suponen el mayor riesgo para las enfermedades crónicas, como: diabetes tipo II, enfermedades cardiovasculares, hipertensión y ciertas formas de cáncer9. De acuerdo a las estadísticas, cada año mueren alrededor de 2,6 millones de personas a causa de enfermedades relacionadas directamente con la obesidad. El 65% de la población mundial vive en países donde el sobrepeso y la obesidad causan más muertes que la desnutrición. Así mismo causa el 44% de los casos mundiales de diabetes, el 23% de cardiopatías y el 7% de algunos cánceres son atribuidos al exceso de peso9.
En México, la evolución histórica de este fenómeno ha estado relacionada con el mal estado nutricional de la población. En 1946 se publicó un artículo en el que se reconoce que al conjunto de síndromes que originan la obesidad se le denomina malnutrición4. La Encuesta Nacional de Salud y Nutrición 2012 indica que este padecimiento va en aumento, ya que en el país, 26 millones de adultos mexicanos presentaban sobrepeso y 22 millones, obesidad.En constraste, a nivel mundial en 2008, 1400 millones de adultos de más de 20 años tenían sobrepeso, de los cuales, más de 200 millones de hombres y cerca de 300 millones de mujeres eran obesos, mientras que en 2010, alrededor de 40 millones de niños menores de cinco años tenían sobrepeso10.
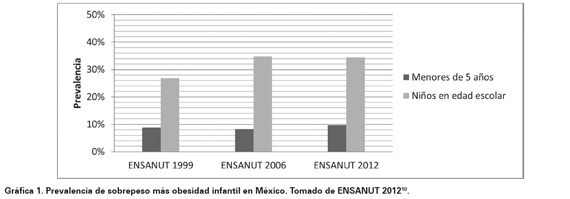
Particularmente en México, la Encuesta Nacional de Salud y Nutrición menciona una prevalencia de sobrepeso más obesidad en niños menores de cinco años del 9,7 % en 2012, 1,4 puntos porcentuales más con respecto a la encuesta anterior realizada en el año 2006, donde el valor alcanzaba 8,3 %. Por otra parte, en el grupo de infantes en edad escolar, que comprende de 5 a 11 años, se observa que la prevalencia combinada de sobrepeso y obesidad fue de 34,4 % en ambos sexos, 1,1 % menos que en 20063. Estos datos al ser comparados con el resto del mundo, se encuentra entre las más elevadas del orbe4,11. En constraste, a nivel mundial en 2010, alrededor de 40 millones de niños menores de 5 años tenían sobrepeso, lo que se traduce como un problema de gran importancia en Salud Pública12; que se asocia con diversas enfermedades, problemas físicos y consecuencias psicológicas13,14.
En Estados Unidos, desde 1980 se ha duplicado el número de niños con sobrepeso, mientras que el número de adolescentes con esta entidad se triplicó. Actualmente, este problema se ha convertido en una pandemia, México se encuentra entre los países con más alta prevalencia de sobrepeso en niños1. Se estima que en el país entre un 10 y 20% de estos padecimientos se dan en la infancia, de 30 a 40% en la adolescencia y hasta de un 60 a 70% en los adultos. Las estadísticas han indicado que en los últimos diez años una tercera parte de la población entre 5 y 11 años de edad en el país presenta exceso de peso corporal (sobrepeso más obesidad) y esto persiste como un gran reto de salud; niños varones presentan una prevalencia de obesidad del 36,9%, mientras que en las niñas se muestra en un 32%15 (Ver Gráfica 1.) Gráfica 1. Prevalencia de sobrepeso más obesidad infantil en Méxic
Una tendencia importante de la biología del ser humano es el incremento del tamaño, conforme los niños van creciendo de igual manera van ganando peso16,17. A los cuatro meses de edad se tiene gran cantidad de grasa, que disminuye de forma constante entre los 2 y 6 años. Sin embargo, si un niño es obeso entre los seis meses y siete años de edad, la probabilidad de que siga siendo obeso en la edad adulta es del 40%. Si un niño es obeso entre los 10 y 13 años, las probabilidades aumentan a un 70%. Esto se explica porque los adipocitos, se multiplican en esta etapa de la vida, por lo cual aumenta la posibilidad del niño de ser obeso cuando sea adulto18-20. Según consenso, la etiología de la obesidad se relaciona con la occidentalización en los hábitos alimentarios y el sedentarismo21,22. La obesidad infantil es epidémica en países como Grecia, Estados Unidos, México, Italia y Nueva Zelanda y está en aumento en otros; se estima que globalmente, 22 millones de niños menores de cinco años presentan sobrepeso. La prevalencia de obesidad infantil está aumentando de manera alarmante tanto en países desarrollados como en aquellos en vías de desarrollo9,23.
ETIOLOGÍA DE LA OBESIDAD INFATIL
Como se mencionó anteriormente el sobrepeso y la obesidad no tienen una causa única, son dependientes de diversos factores que promuevan la sobre ingesta de alimento a nivel de sistema nervioso central pero también el almacenaje excesivo de ciertos componentes como el tejido adiposo, que son relacionados con anomalías periféricas asociadas tanto a variaciones en receptores específicos hasta la secreción de sustancias por dicho tejido24-26.
Uno de los factores adquiridos que tienen mayor importancia son el lugar de nacimiento y residencia de la población, ya que es conocido que la prevalencia de esta enfermedad es mayor en países occidentales, y esto está íntimamente ligado a los hábitos alimenticios propios de cada país. Estudios comparativos en mexicoamericanos mencionan que aquellos nacidos en EEUU tienen hasta un 65% de riesgo de desarrollar obesidad en comparación con los nacidos en México27. Aunado a esto, existen factores ambientales que varían de país a país, dependiendo el nivel de industrialización e incluso dentro de un mismo país, el ambiente urbanizado tiende a tener mayores implicaciones en el desarrollo de este padecimiento en comparación con el medio rural, debido a mayores niveles de estrés28,29.
Por otra parte, las dietas actuales son ricas en alto contenido de grasas, carbohidratos y bajas en fibra, esto asociado con el alto nivel de sedentarismo, que predispone a la población a desarrollar dicha patología30,31. El crecimiento económico, la modernización, la urbanización y la globalización de los mercados alimentarios son algunas de las fuerzas que subyacen en esta epidemia mundial8,19. Actualmente los niños y adolescentes sustituyen actividades físicas por pautas como ver la televisión, jugar videojuegos, visitar redes sociales en medios electrónicos, por dar algunos ejemplos32,33. La alta ingesta de calorías en comparación con la energía gastada en niños y adolescentes con conducta sedentaria, explica porque estos factores antes mencionados no son mutuamente excluyentes34.
Además de los factores ambientales, se encuentran los factores hereditarios, hormonales, metabólicos y psicosociales7,35. Los factores genéticos rigen la capacidad o facilidad de acumular energía en forma de grasa tisular y menor facilidad para liberarla en forma de calor, lo que se denomina como elevada eficiencia energética del obeso. Se produce porque a largo plazo el gasto energético que presenta el individuo es inferior que la energía que ingiere, es decir, existe un balance energético positivo. La influencia genética se va a asociar a condiciones externas como los hábitos dietéticos y estilos de vida, relacionado esto con la disponibilidad de alimentos, la estructura sociológica y cultural que intervienen en el mecanismo de regulación del gasto y almacenamiento de la energía que es lo que define la estructura física35,36.
Dentro de las teorías relacionadas con el desarrollo de la enfermedad se encuentran las siguientes:
Hipótesis del gen ahorrador
Una de las hipótesis que existen es la propuesta por Neel, en la cual un "gen ahorrador" modifica la liberación de insulina y el almacenamiento de glucosa37. El autor de dicha hipótesis pretendía explicar la epidemiología de la diabetes mediante la exposición de casos clínicos de niños y adultos, relacionándola con la historia de la evolución, llegando a la conclusión de que este gen permitía una utilización eficiente de los alimentos, lo que proveía una ventaja de supervivencia, generando un almacenaje eficiente del exceso de energía y sobrevivir a períodos de escasez de alimentos38. Como se ha venido mencionando, dada la occidentalización del modo de vida, los alimentos consumidos actualmente son abundantes en carbohidratos, ocasionando que personas con dicho gen sean propensas a padecer diabetes y obesidad39.
Genes asociados a la leptina
La leptina es una hormona secretada por los adipocitos, esta es transportada por la circulación hasta el sistema nervioso central, donde se une a los receptoresde leptina en el núcleo arqueado del hipotálamo, estimulando la producción de proopiomelanocortina (POMC). Los dos subproductos de la POMC son la hormona a-melanocito estimulante y adrenocorticotropina. La hormona a-melanocito estimulante se une a receptores de 4-melanocortina en el núcleo paraventricular del hipotálamo causando una disminución en la ingesta de alimentos. Anteriormente se pensaba que la deficiencia de leptina era causa de obesidad, pero ahora sabemos que la obesidad suele tener altos niveles de leptina y que la resistencia a la leptina es la causa más probable de obesidad. Se ha observado que un individuo genéticamente delgado puede ganar entre 7 y 8 kilogramos antes de que los niveles de leptina aumenten lo suficiente para detener el aumento de peso. Al parecer las personas que ganan más peso pudieran no responder a la hormona, ya sea por una deficiencia en la síntesis o por alguno mutación en alguno de los muchos mecanismos de acción de la leptina40. Las mutaciones de este sistema leptina, receptor de leptina, POMC, o el receptor de la hormona estimuladora de los alfa melanocitos pudieran estar involucrados en el desarrollo de la obesidad41-44.
Gen del receptor ß-3-adrenérgico
Este se expresa en tejido adiposo, está relacionado con el metabolismo de lípidos y la termogénesis. Una mutación en el Trp64Arg se ha asociado con la obesidad45-8. La interacción de este receptor con otros receptores pudiera afectar la capacidad de éste para acoplarse con sus mediadores como por ejemplo con las proteínas G.
Gen receptor proliferador de peroxisomas activado gama (PPAR -γ)
La importancia de este receptor en la obesidad es apoyada por la eficacia de las tiazolidinedionas en el tratamiento de la obesidad49. Estas se unen al receptor PPAR-γ generando una mejor respuesta a la insulina y generando cambios importantes en el metabolismo de las grasas incluyendo una reducción de los ácidos grasos libres50. PPAR-γ es un receptor que es importante en la termogénesis y la señalización de la insulina. La mutación de Pro12Ala es común y resulta en la disminución de la respuesta de los genes PPAR-γ, esto trae como consecuencia que los individuos con esta mutación posean predisposición a la obesidad51.
Gen de adiponectina
Este péptido posee muchas acciones regulatorias en la homeostasis energética, metabolismo de glucosa y de los lípidos. De manera general, altos niveles de adiponectina conllevan a la pérdida de peso. Polimorfismos a nivel de este gen se han asociado con la obesidad52.
Asimismo, se han identificado otros factores asociados no solo al desarrollo de obesidad, sino también con la diabetes; estos son el ambiente fetal y neonatal, diversos estudios señalan que si el medio ambiente intrauterino se ve perturbado es decir, una nutrición pobre o enriquecida compromete la salud del recién nacido incrementando el riesgo de intolerancia a la insulina o intolerancia a la glucosa53,54.
Clásicamente está establecido que si ambos padres son obesos, el riesgo para la descendencia será de 69 a 80%; cuando solo uno de los padres es obeso será 41 a 50% y si ninguno de los dos es obeso el riesgo para la descendencia será solo del 9%. Varios investigadores señalan la existencia de otros factores ambientales predisponentes a la obesidad como el destete temprano del lactante, insuficiente uso de la lactancia materna y la ablactación antes del tercer mes de vida. También se mencionan la formación de malos hábitos en la alimentación como la ausencia de desayuno, ingestión de grandes cantidades de alimentos en las últimas horas del día, comer muy rápido, ingestión de alimentos con exceso de grasas o azúcares simples35,55-57. Es por ello que en los últimos 20 años el incremento de la prevalencia de la obesidad solo puede ser explicado por los factores ambientales al existir una epidemia de inactividad8. Kaiser Family Foundation reporta que existe una relación entre la exposición a los medios de comunicación y el desarrollo de la obesidad infantil, ya que, entre más tiempo se le dedique a los medios electrónicos, más notorias son las posibilidades de desarrollar la enfermedad y que esta permanezca hasta la adultez58.
Existen ciertos factores adquiridos que pudieran originar sobrepeso en el paciente pero en raras ocasiones llegan a una obesidad. Una de estas patologías es el Síndrome de Cushing, que es un desorden hormonal caracterizado por altos niveles de cortisol en sangre. En este tipo de síndrome la obesidad es troncal o visceral, y es de suma importancia diferenciarlo de una obesidad simple para tratarlo de manera correcta59. En el caso del hipotiroidismo, afección donde existe baja o nula producción de la hormona tiroidea, el peso ganado por el paciente puede deberse a la retención de agua, que se perderá al seguir el tratamiento hormonal correspondiente60.
Enzimas del eje intestino-cerebro como sistema regulador del peso corporal
Existen mecanismos homeostáticos para regular el apetito y el consumo energético que son regulados por vías de señalización entre el tejido adiposo y el intestino con el cerebro61. El llamado eje intestinocerebro es el encargado de regular la ingesta de alimento mediante una serie de hormonas liberadas por distintas porciones del sistema gastrointestinal. Uno de ellos, el péptido Y-Y (por la abreviación del aminoácido tirosina, PYY) que está conformado por 36 aminoácidos y es producido principalmente por células del tracto gastrointestinal distal, llamadas células L62. Este péptido tiene dos isoformas, PYY1-36 y PYY3-36, de las cuales la segunda es la mayormente presente en sangre en los estados de ayuno y alimentación, además ha sido relacionado con el consumo de energía, la regulación del peso corporal a largo plazo, y sensación de saciedad dependiente de la carga calórica63-65. Estudios realizados en personas obesas demuestran que necesitan mayor ingesta calórica para que los niveles sanguíneos de PYY3-36 alcancen los niveles necesarios para generar la sensación de saciedad en comparación con personas sanas66.
Otro producto derivado de la secreción del tracto gastrointestinal es el polipéptido pancreático (PP), formado por 36 aminoácidos y que es secretado en su mayoría por células F, localizadas en la periferia de los islotes de Langerhans en el páncreas y en menor medida por el colon67. El estímulo primario para la liberación de esta sustancia es la ingesta de nutrientes, aunque otros factores como la estimulación adrenérgica o el ejercicio en conjunto con colecistoquinina pudieran afectar la liberación de PP. El PP tiene funciones fisiológicas como la inhibición del vaciado gástrico, movilidad de la vesícula y secreción exocrina pancreática68. Estudios de administración por distintas vías del PP realizados tanto en roedores como en humanos demuestran que en individuos sanos se presenta una disminución de la ingesta de nutrientes, y que esta inhibición se conserva en roedores y humanos mórbidamente obesos69-71.
La amilina es un neuropeptido más, compuesto por 37 aminoácidos que es secretado de manera simultánea con la insulina desde las células beta del páncreas en respuesta a la ingestión de nutrientes, incremento hormonal y estímulo neuronal y está relacionado a la regulación de glucosa, inhibición de la secreción de glucagón postprandial y retraso en el vaciado gástrico. Se ha demostrado que la administración de amilina en roedores por distintas vías reduce la porción de comida ingerida así como alimentos altos en grasas y azúcares. Esta enzima tiende a agregarse lo que limita su acción anorexígena, sin embargo, existe un análogo sintético que difiere en 3 aminoácidos llamado pramlintide (AC137) que funciona como agente anti-agregación, lo que mantiene la actividad de la amilina72,73. Investigaciones en sujetos con diabetes tipo 2 y obesos no diabéticos demostró que una inyección subcutánea de pramlintide 1 hora antes de un buffet reduce la ingesta de alimento73. La colecistoquinina (CCK) es otra enzima de tipo anorexígena secretada por el intestino delgado y que tiene receptores a nivel de páncreas, vesícula y fibras aferentes del nervio vago, además de encontrarse receptores también en el núcleo del tracto solitario, en el área postrema e hipotálamo dorsomedial74,75. Esta enzima es secretada en respuesta al consumo de grasas saturadas, largas cadenas de ácidos grasos, así como, aminoácidos y pequeños péptidos. Está involucrada a la estimulación de la secreción de PYY y la inhibición de la grelina, lo que desencadena la conducta de saciedad en animales de laboratorio. Sin embargo, esta enzima está restringida en el tratamiento de sobrepeso y obesidad debido a las náuseas y tolerancia que produce su consumo a largo plazo76-78.
La Oxintomodulina (OXM), es una enzima que se eleva pospandrialmente, y esta elevación es directamente proporcional al consumo calórico. Estudios en roedores sugieren que la OXM está relacionada a la reducción de la ingesta de comida de manera aguda y en pruebas a largo plazo, los roedores sometidos a tratamiento con dicha enzima presentaron pérdida de peso significativa con respecto a los controles79,80. En humanos obesos, los estudios realizados demuestran que la administración de OXM reduce tanto la ingesta de alimento como el peso corporal81,82. Por último, existe una enzima que al contrario de las presentadas anteriormente se le atribuye una función orexígena, es decir, que al secretarse eleva el consumo de alimento generando ganancia de peso corporal, denominada grelina. En sujetos sanos, se han detectado altos niveles de grelina en estados de vigilia, sin embargo, en personas con anorexia nerviosa, reducción de la dieta o cirugía bariátrica también se presenta elevación de esta enzima83,84. La grelina está relacionada con la obesidad ya que funciona como regulador de otras enzimas orexígenas como el neuropéptido Y, lo que sugiere que una descompensación en la producción de grelina o en los receptores ubicados en el núcleo arcuato del hipotálamo podría predisponer una ganancia de peso85-88.
Todas las enzimas descritas, tienen como fin común la homeostasis del eje intestino cerebro, regulando la ingesta de alimento de manera directa y de manera indirecta, la reducción o ganancia del peso corporal, el gasto energético y la digestión de las distintas macromoléculas provenientes de los alimentos, lo que sugiere que cambios en la síntesis de estas enzimas y la expresión de sus respectivos receptores a nivel de sistema nervioso central predisponen a los individuos a padecer sobrepeso u obesidad89.
Consecuencias de la obesidad infantil
La obesidad está asociada con significativos problemas de salud en la infancia, es un importante y temprano factor de riesgo en gran parte de la morbilidad y mortalidad del adulto. Los problemas médicos comunes en niños y adolescentes obesos pueden afectar la salud cardiovascular produciendo hipercolesterolemia, diabetes tipo, dislipidemia e hipertensión, provocando además a nivel psicológico depresión y baja autoestima90-2.
DIAGNÓSTICO
El método diagnóstico utilizado se basa en estándares internacionales de IMC para edad, calculado como peso (Kg) dividido por la talla al cuadrado (m2)93,94. Estos estándares se han desarrollado para niños y adolescentes y corresponden con la clasificación de sobrepeso y obesidad para adultos de la OMS donde el punto de corte para sobrepeso es de 25 de IMC y el de obesidad es de 30. Con esta premisa un subgrupo de expertos de la OMS desarrolló estándares de IMC para la población pediátrica basados en los mismos puntos de corte. Posteriormente, éstos se trasladaron a su equivalente para cada edad, con el beneficio adicional de ser utilizables a nivel mundial19,93. De acuerdo con el Centro de Control y Prevención de Enfermedades (CDC, por sus siglas en inglés) en el caso específico de infantes, el médico debe calcular el IMC y posteriormente compararlo con las tablas estandarizadas de crecimiento, permitiendo un cálculo del percentil, es decir, cómo se compara un niño con otros de la misma edad y sexo. Así, por ejemplo, es posible que le digan que dicho niño está en el percentil 80. Esto significa que en comparación con otros niños de la misma edad y sexo, el 80% tienen un IMC más bajo. Así pues, los puntos de corte establecidos por la OMS y el CDC son: IMC para la edad entre los percentiles 85 y 94 corresponden a sobrepeso, mientras que un IMC para la edad correspondiente en el percentil 95 o superior es considerado obesidad95.
TRATAMIENTO
La terapia nutricional juega un papel importante en la prevención y el tratamiento de la enfermedad96. Es una terapia ciertamente compleja en la cual deben intervenir pediatras, nutricionistas, dietistas, psicólogos, comunicadores sociales y profesionales que trabajen para modifi car los factores de alimentación y estilos de vida u otros factores causales93,97. Cabe mencionar que en el tratamiento nutricional se deben satisfacer las necesidades de nutrientes para garantizar el correcto crecimiento y desarrollo del niño, por lo cual no se deben usar dietas restrictivas93,98. Además de la dieta es necesario un plan de ejercicios que permitan al niño la pérdida de grasa y mantener un adecuado seguimiento médico19.
A nivel farmacológico, el rimonabant y la sibutramina fueron ampliamente empleados en el tratamiento de la obesidad, sin embargo, han sido retirados del mercado por sus efectos adversos. Actualmente el orlistat es el único medicamento recomendado para el tratamiento a largo plazo. Si bien no es tan efi caz para la reducción del peso corporal, es seguro en los eventos cardiovasculares y sus efectos positivos en el control de la diabetes99. Sin embargo, el orlistat solo es utilizado en adolescentes mayores de 12 años, debido a que en edades inferiores un régimen alimentario apropiado, así como un una rutina de actividad física es considerada sufi ciente para prevenir o tratar la obesidad infantil. Aunado a esto, se sabe que el orlistat produce efectos adversos de tipo gastrointestinal como sudoración oleosa, aumento en la defecación, defecación oleosa, heces blandas e incontinencia fecal. Dichos efectos están directamente relacionados con el consumo de grasas en la dieta, es decir, que a menor consumo de grasas en la dieta, la sintomatología disminuirá considerablemente (Ver Figura 1)100.
A nivel conductual ha demostrado que los niños en edad preescolar son infl uenciados principalmente por el medio ambiente y las experiencias, lo cual se ve refl ejado en los hábitos y sus preferencias alimentarias. Algunos estudios sugieren la restricción moderada de los alimentos no sanos en lugar de que el niño sea presionado para consumir ciertos alimentos, de igual manera se puede recompensar las buenas acciones de los niños con alimentos saludables incrementándose la ración, especialmente en las horas de comida, lo cual favorecería la respuesta de los niños a una buena práctica en su alimentación101,102.
Cuando los métodos tradicionales como la dieta y el ejercicio fallan, la siguiente opción es la cirugía bariátrica, la cual se ha convertido en el método más empleado para el tratamiento de la obesidad en adolescentes mayores de 12 años y adultos, cuyo IMC es superior a 35 Kg/m2 dado que ha sido la única manera de perder peso de forma permanente103-105. En pacientes menores de 12 años, de la misma forma que en el tratamiento farmacológico, se sabe que un régimen adecuado de alimentación y actividad física son sufi cientes para reducir de manera considerable el IMC en condiciones de sobrepeso u obesidad. En pacientes que se han sometido a este procedimiento, y que además son diabéticos tipo II, alrededor del 87% han mostrado mejoría en la enfermedad, debido a que la cirugía puede reducir el número de calorías absorbidas105. Sin embargo, este procedimiento posee algunas desventajas, los pacientes requieren supervisión médica constante durante un periodo indeterminado además de estudios de laboratorio en este tiempo, los médicos tratantes deben estar familiarizados con los cuidados postoperatorios, porque podría derivar en una defi ciencia de nutrientes105, además en algunas ocasiones es necesario la readmisión de los pacientes corriendo el riesgo de realizar intervenciones secundarias103,106.
CONCLUSIONES
La obesidad es más que una cuestión estética, es una enfermedad que puede llegar a complicarse, siendo el factor principal para desarrollar diabetes tipo II en el país. Se debe hacer una mejor difusión de la necesidad de una dieta sana y una conciencia social sobre la conducta sedentaria y estimular tanto en los niños y adolescentes, así como, en los padres la cultura del deporte.
La occidentalización del estilo de vida, es decir, las dietas ricas en grasas saturadas y carbohidratos, aunado a la influencia de los medios electrónicos es la principal causa de una vida sedentaria. Conocer el problema es el primer paso para resolverlo, sin embargo, la información existente sobre obesidad infantil no es tan amplia comparada con la que se presenta en la enfermedad adulta, por lo que es necesario que los profesionales de la salud desarrollen estrategias encaminadas a prevenir la enfermedad en las primeras etapas de vida.
Las enzimas producidas por el sistema gastrointestinal en respuesta a los estados de vigilia y saciedad permiten entender que la obesidad no solo involucra los factores adquiridos como el sedentarismo y la malnutrición, pues también se ve reflejado en los mecanismos compensatorios endógenos, como es la síntesis y señalización de las hormonas anorexígenas y la grelina, en su calidad de orexígeno. Sin embargo, estas vías de señalización de la saciedad abren un panorama amplio para el diseño de moléculas que pudieran actuar sobre los receptores de dichas hormonas que permitan tratar a la obesidad de una manera menos agresiva que con los tratamientos utilizados a la fecha.
Si bien, se han empleado diversos medicamentos para combatir la obesidad con relativa efectividad, también se ha demostrado que su consumo a largo plazo generan efectos adversos, por lo cual, ante esta problemática en nuestro grupo de investigación, dedicado al diseño, síntesis, y evaluación de los posibles efectos biológicos de compuestos orgánicos, se está proyectando el desarrollo de moléculas que pudieran emplearse en un futuro como complemento en el tratamiento de la obesidad. Sin embargo, es de vital importancia considerar que el entorno familiar y las costumbres propias de la población fomentan el alto consumo de alimentos ricos en grasas saturadas, por lo que el sector salud ha hecho grandes esfuerzos por lanzar campañas donde se concientice tanto a los padres como a los infantes sobre la importancia de un estilo de vida sano, que incluye una dieta balanceada y un régimen de actividad física que involucre a todo el núcleo familiar, fomentando también la convivencia.
REFERENCIAS BIBLIOGRÁFICAS
1. Sánchez-Castillo CP, Pichardo E, López P. Epidemiología de la obesidad. Gaceta Médica México. 2004;140,Suppl;2:3-20. [ Links ]
2. World Health Organization [sede Web]: Obesity and overweight. [Actualizado 2012; acceso 24 de febrero 2012].Disponible en:http://www.who.int/mediacentre/factsheets/fs311/en/ [ Links ]
3. Eyzaguirre F, Silva R, Román R, Palacio A, Cosentino M, Vega V, et al. Prevalencia de síndrome metabólico en niños y adolescentes que consultan por obesidad. RevMedChil. 2011;139(6):732-8. [ Links ]
4. García E, De la Llata M, Kaufer M, Tusié MT, Calzada R, Vázquez V, et al. La obesidad y el síndrome metabólico como problema de salud pública: Una reflexión. Salud Pública de México. 2008;50(6). [ Links ]
5. Monteverde M, Novak B. Obesidad y esperanza de vida en México. Población y Salud en Mesoamérica. 2008;6(1):1-13. [ Links ]
6. Pajuelo J, Rocca J, Gamarra M. Obesidad infantil: sus características antropométricas y bioquímicas. Anales de la Facultad de Medicina. 2003;64(1): 21-6. [ Links ]
7. World Health Organization [sede Web]: Obesity: preventing and managing the global epidemic. [Actualizado 2012; acceso 24 de febrero 2012]. Disponible en http://www.who.int/nutrition/ publications/obesity/WHO_TRS_894/en/. [ Links ]
8. Reilly JJ, Dorosty AR, Emmet PM. Prevalence of overweight and obesity in British children: cohort study. BMJ. 1999;16;319(7216):1039. [ Links ]
9. World Health Organization [sede Web]: Sedentary lifestyle: a global public health problem. [Actualizado 2012; acceso 24 de febrero 2012]. Disponible en: http://www.vidyya.com/2pdfs/sedentary.pdf [ Links ]
10. Gutierrez JP, Rivera-Dommarco J, Shamah-Levy T, Villalpando- Hernandez S, Franco A, Cuevas-Nasu L,Romero-Martinez M, Hernandez-Avila M. Encuesta Nacional de Salud y Nutricion 2012. Resultados Nacionales.Cuernavaca, Mexico: Instituto Nacional de Salud Pública (MX), 2012. [ Links ]
11. Guerra JF, Valdez RM, Alderete MG, López MC. Antecedentes históricos sociales de la obesidad en México. Investigación en Salud. 2006;8(2):91-4. [ Links ]
12. World Health Organization [sede Web]: Mover forhealth [Actualizado 2012; acceso 24 de febrero 2012]. Disponible en:http://www.who.int/world-health-day/previous/2002/en/ [ Links ]
13. Barlow S, Dietz WH. Managing of child and adolescent obesity: summary and recommendations based on reports from pediatricians, pediatric nurse practitioners and registered dietitians. Pediatrics. 2002;110(1 Pt 2):236-8. [ Links ]
14. Dietz WH. Health consequences of obesity in youth: childhood predictors of adult disease. Pediatrics. 1998;101(3 Pt 2):518-25. [ Links ]
15. Secretaria de Salud. Boletín de práctica médica efectiva: Obesidad infantil. México; 2006. [ Links ]
16. Bonvecchio A, Safdie M, Monterrubio EA, Gust T, Villalpando S, Rivera JA.Overweigth and obesity trends in Mexican children 2 to 18 years of age from 1988 to 2006.Salud Publica Mex. 2009;51Suppl 4:586-94. [ Links ]
17. Gardner DS, Hoking J, Metcalf BS, Jeffery AN, Voss LD, Wilkin TJ. Contribution or early weight gain to childhood overweight and metabolic health: a longitudinal study (EarlyBird 36). Pediatrics 2009;123(1):e67-e73. [ Links ]
18. Anderson M. Understanding the childhood obesity epidemic. Colorado State University Extension, Nutrition Resources. [Consultado Marzo 2012]. Disponible en : http://www.ext.colostate.edu/pubs/foodnut/09317.html [ Links ]
19. Krebs NF, Jacobson MS. American Academy of Pediatrics Committee on Nutrition. Prevention of Pediatric Overweight and Obesity. Pediatrics. 2003;112; 424-30. [ Links ]
20. Serdula MK, Ivery D, Coates RJ, Freedman DS, Williamson DF, Bryers T. Do obese children become obese aldults?. A review of theliterature. Prev Med. 1993;22(2):167-77. [ Links ]
21. Instituto Nacional de Salud Pública. Obesidad Infantil. Boletín de Práctica Médica Efectiva PME 2006:1-6. [ Links ]
22. Deckelbaum RJ, Williams CL. Childhood Obesity: The Health Issue. Obes Res. 2001;9Suppl 4:239S-243S. [ Links ]
23. OECD. Obesityupdate 2012. [Consultado Mayo de 2013]. Disponible en: http://www.oecd.org/health/49716427.pdf [ Links ]
24. Ikramuddin S, Kellogg TA. Energy metabolism and Biochemistry of Obesity. Bariatric Times. 2005;(3)5:37-9 [ Links ]
25. Kershaw EE, Flier JS. Adipose tissue as an endocrine organ. J ClinEndocrinol Metab. 2004;89(6):2548-56. [ Links ]
26. Björntorp P. Metabolic implications of body fat distribution. Diabetes Care. 1991;14(12):1132-43. [ Links ]
27. Barcenas C, Wilkinson A, Strom S, Cao Y, Saunders K, Mahabir S, et al. Birthplace, years of residence in the United States, and Obesity among Mexican-American Adults. Obesity (Silver Spring). 2007;15(4):1043-52 [ Links ]
28. Jackson JE, Doescher MP, Jerant AF, Hart LG. A national study of obesity prevalence and trends by type of rural county. The Journal of Rural Health. 2005;21(2):140-8. [ Links ]
29. Kaplan MS, Huguet N, Newsom JT, McFarland BH. The association between length of residence and obesity among Hispanic Immigrants. American Journal of Preventive Medicine. 2004;27(4):323-26. [ Links ]
30. Brewis A. Biocultural Aspects of Obesity in Young Mexican Schoolchildren. Am J Hum Biol. 2003;15(3):446-60. [ Links ]
31. Popkin B. The nutrition transition and obesity in the developing world. J Nutr. 2001;131(3):871S-873S. [ Links ]
32. Wong SL, Leatherdale ST. Association between sedentary behavior, physical activity, and obesity: Inactivity among active kids. Prev Chronic Dis. 2009;6(1):A26. [ Links ]
33. Rey JP, Rodríguez G, Biosca M, Moreno LA. Sedentary behavior and obesity development in children and adolescents. Nutr Metab Cardiovasc Dis. 2008;18(3):242-51. [ Links ]
34. Ludwing DS, Peterson KE, Gortmaker SL. Relation between consumption of sugar-sweetened drinks and childhood obesity: a prospective, observational analysis. Lancet. 2001;357(9255):505-8 [ Links ]
35. Reilly J, Jackson D, Montgomery C, Kelly L, Slater C, Grant S, Paton J. Total energy expenditure and physical activity in young Scottish children: mixed longitudinal study. Lancet. 2004;17;363(9404):211-2. [ Links ]
36. Rodríguez Rossi R. La obesidad infantil y los efectos de los medios electrónicos de comunicación. Investigación en Salud.2006;8(2):95-98. [ Links ]
37. Chakravarthy MV, Booth FW. Eating, exercise, and "thrifty" genotypes: connecting the dots to-ward an evolutionary understanding of modern chronic diseases. J Appl Physiol. 2004;96(1):3-10. [ Links ]
38. Joffe B, Zimmet P. The thrifty genotype in type 2 diabetes: an unfinished symphony moving to its finale?. Endocrine. 1998;9(2):139-41. [ Links ]
39. Xiao Li, Xiubin Sun, Li Jin, Fuzhong. Worldwide spatial genetic structure of angiotensinconverting enzyme gene: a new evolutionary ecological evidence for the thrifty genotype hypothesis. European Journal of Human Genetics. 2011;19:1002-1008. [ Links ]
40. Proietto J, Baur LA. 10: Management of obesity. Med J Aust. 2004;3;180(9):474-80. [ Links ]
41. Branson R, Potoczna N, Kral JG, Lentes KU, Hoehe MR, Horber FF. Binge eating as a major phenotype of melanocortin 4 receptor gene mutations. N Engl J Med. 2003;20;348(12):1096-103. [ Links ]
42. Clement K, Vaisse C, Lahlou N, Cabrol S, Pelloux V, Cassuto D, et al. A mutation in the human leptin receptor gene causes obesity and pituitary dysfunction. Nature. 1998;26;392(6674):398-401. [ Links ]
43. Krude H, Biebermann H, Luck W, Horn R, Brabant G, Gruters A. Severe early-onset obesity, adrenal insufficiency and red hair pigmentation caused by POMC mutations in humans. Nat Genet. 1998;19:155-7. [ Links ]
44. Montague CT, Farooqi IS, Whitehead JP, Soos MA, Rau H, Wareham NJ, et. al. Congenital leptin deficiency is associated with severe early-onset obesity in humans. Nature. 1997;387:903- 8. [ Links ]
45. Kurokawa N, Nakai K, Kameo S, Liu ZM, Satoh H. Association of BMI with the beta3-adrenergic receptor gene polymorphism in Japanese: meta-analysis. Obes Res. 2001;9:741-5. [ Links ]
46. Clement K, Vaisse C, Manning BS, Basdevant A, Guy-Grand B, Ruiz J, et al. Genetic variation in the beta 3-adrenergic receptor and an increased capacity to gain weight in patients with morbid obesity. N Engl J Med 1995;333 : 352-4. [ Links ]
47. Walston J, Silver K, Bogardus C, Knowler WC, Celi FS, Austin S, et al. Time of onset of non-insulin-dependent diabetes mellitus and genetic variation in the beta 3-adrenergic-receptor gene. N Engl J Med. 1995;10; 333(6):343-7. [ Links ]
48. Widen E, Lehto M, Kanninen T, Walston J, Shuldiner AR, Groop LC. Association of a polymorphism in the beta 3-adrenergicreceptor gene with features of the insulin resistance syndrome in Finns. N Engl J Med. 1995;10;333(6):348-51. [ Links ]
49. Gurnell M, Savage DB, Chatterjee VK, O'Rahilly S. The metabolic syndrome: Peroxisome proliferator-activated receptor gamma and its therapeutic modulation. J Clin Endocrinol Metab. 2003;88(6):2412-21. [ Links ]
50. Oakes ND, Kennedy CJ, Jenkins AB, Laybutt DR, Chisholm DJ, Kraegen EW. A new antidiabetic agent, BRL 49653, reduces lipid availability and improves insulin action and glucoregulation in the rat. Diabetes. 1994;43:1203-10. [ Links ]
51. Ek J, Urhammer SA, Sorensen TI, Andersen T, Auwerx J, Pedersen O. Homozygosity of the Pro12Ala variant of the peroxisome proliferation-activated receptor-gamma2 (PPAR-gamma2): divergent modulating effects on body mass index in obese and lean Caucasian men. Diabetologia. 1999;42(7):892-5. [ Links ]
52. Stumvoll M, Tschritter O, Fritsche A, Staiger H, Renn W, Weisser M, et al. Association of the T-G polymorphism in adiponectin (exon 2) with obesity and insulin sensitivity: interaction with family history of type 2 diabetes. Diabetes. 2002;51(1):37-41 [ Links ]
53. Gonzalez A, Ovilo C. Genetic Basis, Nutritional Challenges and Adaptative Response in the Prenatal Origin of Obesity and Type-2 Diabetes. Curr Diabetes Rev. 2012; 8(2):144-54. [ Links ]
54. Reusens B, Ozanne SE, Remacle C. Fetal determinats of type 2 diabetes. CurrDrug Targets. 2007;8(8):935-41. [ Links ]
55. Hirschler VD, González C, Cemente G, Talgham S, Petticnichio H, Jadzinsky M. ¿Cómo perciben las madres de niños de jardín de infantes a sus hijos con sobrepeso? Archivo Argentina de Pediatría. 2006;104(3):221-26. [ Links ]
56. Durá T, Sánchez F. Obesidad Infantil: ¿un problema de educación individual, familiar o social? Acta Pediatr Esp. 2005;63: 204-7. [ Links ]
57. Field AE, Cook NR, Gillman MW. Weight Status in Childhood as a Predictor of Becoming Overweight or Hypertensive in Earlt Adulthood.TheNort American AssociationfortheStudy of Obesity. 2005;13:163-69. [ Links ]
58. Rodríguez-Rossi R. La obesidad infantil y los efectos de los medios electrónicos de comunicación. Artemisa en línea. 2006;8(2). Disponible en http://www.medigraphic.com/pdfs/invsal/isg-2006/isg062g.pdf. [ Links ]
59. Kumar V, Fausto N, Abbas A. Robbins and Cotran Pathologic Basis of Disease, 7th ed. (NY) Elsevier-Saunders 2010. [ Links ]
60. Sikaris KA. The Clinical Biochemistry of Obesity. Clin Biochem Rev. 2004 August; 25(3): 165-181. [ Links ]
61. Wynne K, Stanley S, Bloom S. The gut and regulation of body weight. J Clin Endocrinol Metab. 2004;89(6):2576-82. [ Links ]
62. Tatemoto K, Mutt V. Isolation of two novel candidates hormones using a chemical method for finding naturally occurring polypeptides. Nature.1980;5;285(5764):417-8. [ Links ]
63. Broom DR, Batterham RL, King JA, Stensel DJ. Influence of resistance and aerobic exercise on hunger, circulating levels of acylated ghrelin, and peptide YY in healthy males. Am J Physiol RegulIntegr Comp Physiol. 2008;296(1):29-35. [ Links ]
64. Korner J, Inabnet W, Conwell I, Taveras C, Daud A, Olivero L, et al. Differential effects of gastric bypass and banding on circulating gut hormone and leptin levels. Obesity. 2006;14(9):1553-61. [ Links ]
65. Grandt D, Schimiczek M, Beglinger C, Layer P, Goebell H, Eysselein V, et al. Two molecular forms of peptide YY (PYY) are abundant in human blood: characterization of a radioimmunoassay recognizing PYY 1-36 and PYY 3-36. RegulPept. 1994;51(2):151-59. [ Links ]
66. Batterham R, Ffytche D, Rosenthal J, Zelaya F, Barker G, Withers D, et al. PYY modulation of cortical and hypothalamic brain areas predicts feeding behaviour in humans. 2007. Nature. 2007;1;450(7166):106-9. [ Links ]
67. Ekblad E, Sundler F. Distribution of pancreatic polypeptide and peptide YY. Peptides. 2002;23(2):251-61. [ Links ]
68. Kojima S, Ueno N, Asakawa A, Sagiyama K, Naruo T, Mizuno S, et al. A role for pancreatic polypeptide in feeding and body weight regulation. Peptides. 2007;28(2):459-63. [ Links ]
69. Liu Y, Semjonous NM, Murphy KG, Ghatei MA, Bloom SR. The effects of pancreatic polypeptide on locomotor activity and food intake in mice. Int J Obes (Lond). 2008;32:1712-15. [ Links ]
70. Neary NM, McGowan BM, Monteiro MP, Jesudason DR, Ghatei MA, Bloom SR. No evidence of an additive inhibitory feeding effect following PP and PYY 3-36 administration. Int J Obes (Lond). 2008;32:1438-40. [ Links ]
71. Wortley KE, Garcia K, Okamoto H, Thabet K, Anderson KD, Shen V, et al. Peptide YY regulates bone turnover in rodents. Gastroenterology. 2007;133(5):1534-43. [ Links ]
72. Mack C, Wilson J, Athanacio J, Reynolds J, Laugero K, Guss S, et. al. Pharmacological actions of the peptide hormone amylin in the long-term regulation of food intake, food preference, and body weight. Am J Physiol RegulIntegr Comp Physiol. 2007;293(5):R1855-63. [ Links ]
73. Chapman I, Parker B, Doran S, Feinle-Bisset C, Wishart J, Strobel S, et al. Effect of pramlintide on satiety and food intake in obese subjects and subjects with type 2 diabetes. Diabetologia. 2005;48(5):838-48. [ Links ]
74. Murphy KG, Bloom SR. Gut hormones and the regulation of energy homeostasis. Nature. 2006;444:854-859. [ Links ]
75. Moran TH, Kinzig KP. Gastrointestinal satiety signals II. Cholecystokinin. Am J Physiol Gastrointest Liver Physiol. 2004;286:G183-G188. [ Links ]
76. Degen L, Drewe J, Piccoli F, Gräni K, Oesch S, Bunea R, et al. Effect of CCK-1 receptor blockade on ghrelin and PYY secretion in men. Am J Physiol RegulIntegr Comp Physiol. 2007;292(4):R1391-9. [ Links ]
77. Rehfeld JF, Bungaard JR, Friis-Hansen L, Goetze JP.On the tissuespecific processing of procholecystokinin in the brain and gutea short review. J Physiol Pharmacol. 2003;54Suppl 4:73-9. [ Links ]
78. Covasa M, Marcuson JK, Ritter RC. Diminished satiation in rats exposed to elevated levels of endogenous or exogenous cholecystokinin. Am J Physiol RegulIntegr Comp Physiol. 2001;280(2):R331-7. [ Links ]
79. Sam AH, Troke RC, Tan TM, Bewick GA. The role of the gut/brain axis in modulating food intake. Neuropharmacology. 2012;63(1):46-56. [ Links ]
80. Dakin CL, Small CJ, Batterham RL, Neary NM, Cohen MA, Patterson M, et al. Peripheral oxyntomodulin reduces food intake and body weight gain in rats. Endocrinology. 2004;145(6):2687-95. [ Links ]
81. Wynne K, Park AJ, Small CJ, Patterson M, Ellis SM, Murphy K, et al. Subcutaneous oxyntomodulin reduces body weight in overweight and obese subjects: a doubleblind, randomized, controlled trial. Diabetes. 2005;54(8):2390-5. [ Links ]
82. Cohen MA, Ellis SM, Le Roux CW, Batterham RL, Park A, Patterson M, et al. Oxyntomodulin suppresses appetite and reduces food intake in humans. J ClinEndocrinol Metab. 2003;88(10):4696-701. [ Links ]
83. Cummings DE, Weigle DS, Frayo RS, Breen PA, Ma MK, Dellinger EP, et al. Plasma ghrelin levels after diet-induced weight loss or gastric bypass surgery. N Engl J Med. 2002;23;346(21):1623-30. [ Links ]
84. Tschöp M, Wawarta R, Riepl RL, Friedrich S, Bidlingmaier M, Landgraf R, et al. Post-prandial decrease of circulating human ghrelin levels. J Endocrinol Invest. 2001;24(6):RC19-21. [ Links ]
85. Chuang JC, Perello M, Sakata I, Osborne S, Savitt JM, Lutter M, et al. Ghrelin mediates stress-induced food-reward behavior in mice. J Clin Invest. 2011;121:2684-92. [ Links ]
86. Sam AH, Troke RC, Tan TM, Bewick GA. The role of the gut/brain axis in modulating food intake. Neuropharmacology. 2012;63(1):46-56. [ Links ]
87. Bewick GA, Kent A, Campbell D, Patterson M, Ghatei MA, Bloom SR, et al. Mice with hyperghrelinemia are hyperphagic and glucose intolerant and have reduced leptin sensitivity. Diabetes. 2009;58:840-846. [ Links ]
88. Hewson A, Dickson S. Systemic administration of ghrelin induces Fos and Egr-1 proteins in the hypothalamic arcuate nucleus of fasted and fed rats. J. Neuroendocrinol. 2000;12(11):1047-49. [ Links ]
89. Karra E, Batterham, RL. The role of gut hormones in the regulation of body weight and energy Homeostasis. Molecular and Cellular Endocrinology. 2010;316;120-128 [ Links ]
90. Engeland A, Bjørge T, Tverdal A, Søgaard AJ. Obesity in adolescence and adulthood and the risk of adult mortality. Epidemiology. 2004;15(1):79-85. [ Links ]
91. Must A, Strauss RS. Risks and consequences of childhood and adolescent obesity.Int J Obes Relat Metab Disord. 1999;23Suppl 2:2-11. [ Links ]
92. Berenson GS, Srinivasan SR, Bao W, Newman WP 3rd, Tracy RE, Wattigney WA. Association between multiple cardiovascular risk factors and atherosclerosis in children and young adults. The Bogalusa Heart Study. N Engl J Med. 1998;4;338(23):1650-6. [ Links ]
93. Epstein LH, Myers MD, Raynor HA, Saelens BE. Treatment of pediatric obesity. Pediatrics. 1998;101(3 Pt 2):554-70. [ Links ]
94. Swinburn BA, Caterson I, Seidell JC, James WPT. Diet, nutrition and the prevention of excess weight gain and obesity.Public Health Nutr.2004;7(1A):123-46. [ Links ]
95. Kuczmarski RJ, Ogden CL, Guo SS, et al. 2000 CDC growth charts for the United States: Methods and development. National Center for Health Statistics.Vital Health Stat 11(246). 2002 [ Links ]
96. Velázquez L, Rico JM, Torres M, Medina P, Toca LE, Escobedo J. The impact of nutritional education on metabolic disorders in obese children and adolescets. Endocrinol Nutr. 2009;56(10):441-6. [ Links ]
97. Barja YS, Núñez NE, Velandia AS, Urrejola NP, Hodgson BMJ. Adherencia y efectividad a mediano plazo del tratamiento de la obesidad infantil. Rev ChilPediatr. 2005;76 (2); 151-158. [ Links ]
98. Campbell MW, Williams J, Hampton A, Wake M. Maternal concern and perceptions of overweight in Australian preschoolaged children. Med J Aust. 2006;20; 184(6):274-7. [ Links ]
99. Derosa, G, Maffioli, P. Anti-obesity drugs: a review about their effects and their safety. Expert Opin Drug Saf. 2012;11(3):459-71. [ Links ]
100. ADA Evidence Analysis Library. Use of Orlistat in the Treatment of Childhood Obesity [Consultado en Mayo de 2013]. Disponible en:http://andevidencelibrary.com/evidence.cfm?format_tables=0&evidence_summary_id=250452&auth=1 [ Links ]
101. Gibson EL, Kreichauf S, Wildgruber A, Vögele C, Summerbell CD, Nixon C, et al.A narrative review of psychological and educational strategies applied to young children's eating behaviours aimed at reducing obesity risk. Obes Rev. 2012;13Suppl 1:85-95. [ Links ]
102. Pufal MA, Moulin CC, Casagrande DS, Padoin AV, Suessenbach SP, Barhouch AS, et al.Prevalence of Overweight in Children of Obese Patients: a Dietary Overview. Obes Surg. 2012;22(8):1220-4. [ Links ]
103. Verdam FJ, Liedorp PR, Geubbels N, Janssen IM, Koek GH, Greve JW. EndoBarrier for counteracting obesity and metabolic syndrome (Article in Dutch). Ned Tijdschr Geneeskd. 2012;156(13):A3844. [ Links ]
104. Nalepa P, Piechnik A, Kiersztan A. Influence of bariatric surgery on remission of type 2 diabetes. (Article in Polish).PostepyHig Med Dosw (Online). 2011;65:804-18. [ Links ]
105. Koch TR, Finelli FC.Postoperative metabolic and nutritional complications of bariatric surgery.GastroenterolClin North Am. 2010;39(1):109-24. [ Links ]
106. Dorman RB, Miller CJ, Leslie DB, Serrot FJ, Slusarek B, Buchwald H, et al. Riskfor Hospital readmissionfollowing BariatricSurgery. PLOS ONE. 2012;7(3):e32506. [ Links ]