Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicas UIS
Print version ISSN 0121-0319
Medicas UIS vol.26 no.2 Bicaramanga May/Aug. 2013
Expresión de Her2/neu en carcinoma gástrico
en el área metropolitana de Bucaramanga en el
periodo 2006 a 2009
Carlos Alberto García Ramírez*
Claudia Janeth Uribe Pérez**
Paula Marina Niño Vargas***
Daniel Sebastián Salazar Radi***
Luis Enrique Vásquez Pinto***
*MD Patólogo. Docente asociado. Facultad de Ciencias de la Salud. Universidad Autónoma de Bucaramanga. Bucaramanga. Santander. Colombia.
** MD Patóloga. Coordinadora Registro Poblacional de Cáncer del Área Metropolitana de Bucaramanga. Bucaramanga. Santander. Colombia.
***Estudiante de medicina de VI año. Universidad Autónoma de Bucaramanga. Bucaramanga. Santander. Colombia.
Correspondencia: Dr. Carlos Alberto García Ramírez. Centro de Investigaciones Biomédicas. Facultad de Ciencias de la Salud. Universidad Autónoma de Bucaramanga.
Campus El Bosque. Calle 157 No. 19-55. Cañaveral Parque. Floridablanca. Santander. Colombia. Teléfono: 6571800-3102647587. Correo electrónico: cgarcia6@unab.edu.co.
Artículo recibido el 1 de mayo de 2013 y aceptado para publicación el 29 de julio de 2013.
RESUMEN
Introducción: el cáncer gástrico se ha convertido en un problema de salud pública en el mundo y en Colombia ocupando los primeros lugares en mortalidad. La oncoproteina Her2/neu ha demostrado ser un factor de mal pronóstico independiente, con una expresión variable de 8 a 91% y se asocia a una enfermedad más agresiva y menor respuesta al tratamiento. Objetivo: determinar la frecuencia de expresión de HER- 2/neu en carcinoma gástrico y su correlación histopatológica en pacientes del Área Metropolitana de Bucaramanga en el periodo de 2006 a 2009. Materiales y métodos: se realizó un estudio observacional de tipo corte transversal, con una población de 409 casos tomados del Registro Poblacional de Cáncer del Área Metropolitana de Bucaramanga. La información se recolectó de las historias clínicas y los bloques de parafina. Se realizó inmunohistoquímica por el método manual de HERCEPTEST. Los grados 0 y 1 fueron interpretados como negativos, los grados 2 como equívocos y los grados 3 como positivos. A los equívocos se les realizó hibridación inmunofluorecente in situ. Resultados: hubo predominio en hombres con 243 casos, el subtipo histopatológico que prevaleció fue el intestinal con 230 casos, la expresión de HER2/neu fue positiva en 46 casos y no se encontró asociación estadísticamente significativa con el subtipo histopatológico y género. Conclusiones: la expresión de HER2/neu fue positiva en 11,2% de los carcinomas gástricos de los pacientes del Área Metropolitana de Bucaramanga, lo cual es acorde con lo reportado en otros estudios y no hubo asociación estadísticamente significativa con el subtipo histológico y género. (MÉD.UIS.2013;26(2):21-8).
Palabras Clave: Neoplasias Gástricas. Receptor erbB-2. Inmunohistoquímica. Prevalencia. Colombia.
Her-2/neu expression in gastric cancer in Bucaramanga metropolitan
area between 2006 and 2009
ABSTRACT
Introduction: gastric cancer has become a public health problem in the world and in Colombia is one of the leading causes of mortality. The oncoprotein Her/2 neu has shown to be an independent bad prognostic factor with a variable expression ranging from 8 - 91% and has been associated with an aggressive disease and a lesser response to treatment. Aim: to determinate the frequency of Her/2 neu and its expression in gastric carcinoma, also its histopathologic correlation in patients from the Bucaramanga Metropolitan Area during 2006 to 2009. Materials and methods: we conducted an observational cross-sectional study with a population of 409 cases from the Population based Cancer Registry from Bucaramanga Metropolitan Area. The information was collected from clinical history and paraffin blocks. The immunochemistry was made with manual HERCEPTEST method. Scores 0 and 1 were interpretated as negative, score 2 as equivocal and score 3 as positive. The samples that were equivocal underwent fluorescence immunohistochemistry in situ. Results: males predominated with 243 cases, the intestinal type was the more prevalent with 230 cases, Her/2 neu expression was positive in 46 cases and there was no significant statistical association with histopathological subtype or gender. Conclusions: expression of Her/2 neu was positive in 11.2% of gastric carcinomas of patients from Bucaramanga Metropolitan Area, this finding is consistent with other reports, and neither there was any statistical significance association with subtype and gender. (MÉD.UIS.2013;26(2):21-8).
Keywords: Stomach Neoplasms. Receptor, erbB-2. Immunohistochemistry. Prevalence. Colombia.
INTRODUCCIÓN
El cáncer gástrico es la cuarta neoplasia maligna más frecuente en el mundo y la segunda causa de muerte por cáncer, es por esto que en los últimos años se ha convertido en un problema de salud pública, según el último informe de GLOBOCAM para el 20081. La incidencia en el mundo es muy variada encontrándose diferencias importantes en ciertos países como Japón, Chile, Costa Rica y Colombia, en donde la incidencia es superior hasta 20 veces más que en Estados Unidos2,3. En Colombia las cifras de incidencia y de mortalidad por cáncer gástrico para hombres son de 3959 casos, con 3008 muertes, ocupando el segundo lugar en frecuencia, después del cáncer de próstata y es la primera causa de muerte por cáncer en el género masculino3. En mujeres la incidencia y la mortalidad es de 2679 casos, con 2065 muertes, ocupando el tercer lugar en incidencia y mortalidad, luego del cáncer de glándula mamaria y el cáncer cuello uterino3. En el Área Metropolitana de Bucaramanga (AMB) según el último informe del Registro Poblacional de Cáncer para el periodo de 2003 a 2007, el cáncer gástrico ocupó el segundo lugar en incidencia en hombres después del cáncer de próstata con una tasa estandarizada por edad de 22,4 casos por 100 000 habitantes hombres, en mujeres el cuarto lugar después del cáncer de mama, cuello uterino, colon y recto con una tasa estandarizada por edad de 10,3 casos por 100 000 habitantes mujeres. Como causa de muerte por cáncer en la población general para el AMB, el cáncer de estómago causó el 15,2% de todas las muertes, siendo la primera causa en hombres y la segunda causa en mujeres después del cáncer de mama4.
El adenocarcinoma gástrico es la neoplasia maligna más frecuente del tracto gastro intestinal y corresponde al 95% de todos los tumores malignos primarios originados en este órgano5. Como la mayoría de las neoplasias malignas se presenta en personas mayores con un rango de edad amplia que va de los 40 a 70 años, con un pico máximo de presentación a los 60 años de edad6. Es ligeramente más frecuente en hombres con una relación 2:1 comparado con mujeres, especialmente la variedad intestinal asociada a gastritis crónica atrófica por Helicobacter pylori7,8.
Desde el punto de vista fisiopatológico hay dos grupos de factores de riesgo, aquellos que predispone al cáncer gástrico esporádico que es el más frecuente y es el responsable del 90% de los casos y factores de riesgo asociados al tipo heredado menos frecuente; lo anterior refleja un papel importante de influencias ambientales en el desarrollo de esta neoplasia, de ahí que personas que migran de sitios de baja incidencia de esta neoplasia como Estados Unidos a sitios de alta incidencia como Japón y México con el tiempo desarrollan factores de riesgo para desarrollar carcinoma gastrico9,10.
Dentro de los factores ambientales se han identificado infección crónica por Helicobacter pylori, dietas ricas en sal, alimentos ahumados, nitritos, nitratos, tabaquismo, obesidad, pólipos gástricos y bajo nivel socioeconómico, etnias (asiáticos, afroamericanos, indígenas americanos, hispanos y blancos), entre otros11,12. El modelo de carcinogénesis más conocido y estudiado es la secuencia de gastritis crónica por Helicobacter pylori, que genera metaplasia intestinal, atrofia, displasia glandular que puede terminar en un adenocarcinoma gástrico de tipo intestinal infiltrante13,14. Para el cáncer gástrico heredado que representa del 8-10% se presenta por algunas mutaciones (P53, BRCA2, e-cadherina, Her2/neu, entre otras), antecedentes familiares, síndrome de Peutz-Jeghers y poliposis adenomatosa familiar15,16.
Desde el punto de vista histopatológico hay varios sistemas de clasificación, la más utilizada y que tiene en cuenta los factores de riesgo, comportamiento y mecanismos patogénicos, es la clasificación de Lauren que los divide en intestinal, difuso y mixtos17. El segundo sistema de clasificación también ampliamente utilizado en oncología es el propuesto por la Organización Mundial de la Salud, la que es más amplia y los divide en: intestinal, difuso, tubular, mucinoso, papilar, en anillo de sello y mixtos18.
En los últimos años se ha dado inicio al estudio de las bases moleculares del cáncer y el adenocarcinoma gástrico no es la excepción, es así como se han venido identificando diferentes mutaciones como la oncoproteína Her2, conocida también como p185, Her2/neu, ErbB-2 o C-erb-2, que hace referencia a un receptor de factor de crecimiento epidérmico que regula diferentes procesos celulares, ubicado en el cromosoma 17q21, codifica una proteína transmembrana con actividad de tirosina quinasa que funciona como receptor del factor de crecimiento para Her2/neu19,20. En neoplasias malignas se ha estudiado ampliamente en busca de un valor predictivo de mal pronóstico independiente como en el caso de carcinoma de mama, endometrio, colon, cérvix, vejiga, pulmón, ovario, estómago y de la unión gastro-esofágica22. Su expresión en el carcinoma gástrico es variable de 8% a 91% y se ha demostrado su valor como indicador de mal pronóstico independiente en pacientes con carcinoma gástrico avanzado dando un comportamiento más agresivo, mayor posibilidad de dar metástasis y menor respuesta al tratamiento convencional23. Debido a la alta incidencia de cáncer gástrico en Colombia, en Santander y en el Área Metropolitana de Bucaramanga, se hace necesario estudiar más a fondo este tipo de neoplasias en busca de factores pronóstico que ayuden a mejorar la sobrevida de pacientes con esta patología. Por lo tanto el objetivo de este estudio es determinar la frecuencia de expresión de Her2/neu en carcinoma gástrico y su correlación histopatológica durante un período de 4 años (2006 a 2009) en el Área Metropolitana de Bucaramanga.
MATERIALES Y MÉTODOS
Se realizó un estudio de base poblacional de tipo corte transversal. La población a estudio fue pacientes con diagnóstico de carcinoma gástrico del Registro Poblacional de Cáncer del Área Metropolitana de Bucaramanga (RPC-AMB) en un periodo de cuatro años entre enero de 2006 a diciembre de 2009. Como criterios de inclusión se tuvo en cuenta: diagnóstico de carcinoma gástrico en el RPC-AMB en biopsias incisionales o gastrectomías durante el periodo de tiempo del estudio; bloques de parafina con material representativo del tumor y adecuado procesamiento. Se excluyeron bloques de parafina con extensa necrosis o con escaso material para estudio. Las variables a estudiar fueron: edad, sexo, lugar de nacimiento, tipo de biopsia, localización topográfica, variante histopatológica y expresión de la oncoproteína Her2/neu; información que fue tomada de los registros de historias clínicas y de los bloques de parafina.
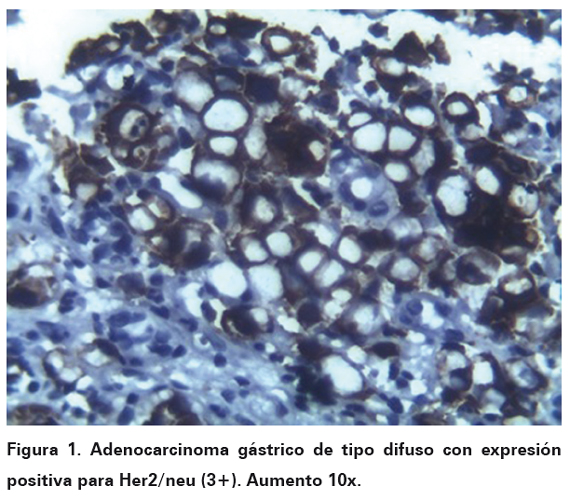
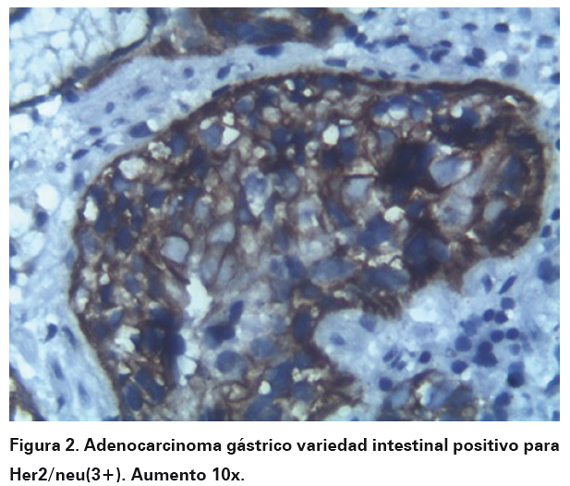
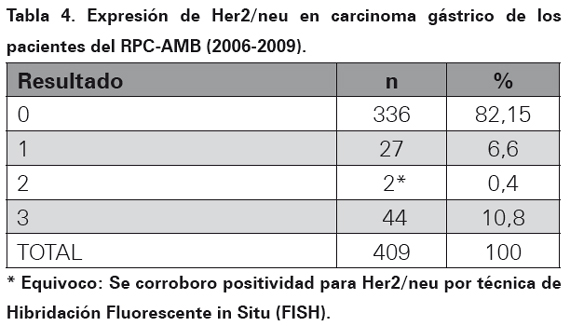
Una vez seleccionados los bloques se procedió a la realización de inmunohistoquímica por técnica manual estandarizada por DAKO (k 5204 HercepTestTM , For Manual Use, Ac policlonal A0485 y SA-Px, DAKO) 24, utilizándose en todos los casos control positivo para el anticuerpo en cada corrida de la coloración. Para la interpretación de la prueba se tuvo en cuenta la escala estandarizada para lectura de Her2/neu en carcinoma gástrico (Adaptada por Dutra AP, et al): expresión 0 (negativa), cuando la tinción fue ausente, o cuando la tinción de membrana se evidenció débil e incompleta en menos del 10% de las células tumorales. Expresión 1 (negativa), tinción débil e incompleta de membrana en más del 10% de las células tumorales. Expresión 2 (equívoca), cuando la tinción fue positiva débil a moderada y completa en el 10% de las células tumorales. Expresión 3 (positiva), tinción fuerte y completa de membrana en más del 10% de las células tumorales (Ver Figura 1 y 2). A las pruebas que fueron interpretadas con expresión 2 (equívoca), se les realizó hibridación fluorescente in situ (FISH, por sus siglas en inglés), para corroborar la positividad de prueba.
TRASTORNOS DE LA CONDUCTA ALIMENTA RIA EN EL
CONTEXTO DEL EMBARAZO
El análisis estadístico descriptivo incluyó medidas de tendencia central y dispersión, variables numéricas, medidas de proporción, porcentaje y variables nominales. Para el manejo estadístico de los datos se utilizó el programa STATA Versión 10.0 y como programa validante Epi Info versión Abril 2007 (CDC, USA).
RESULTADOS
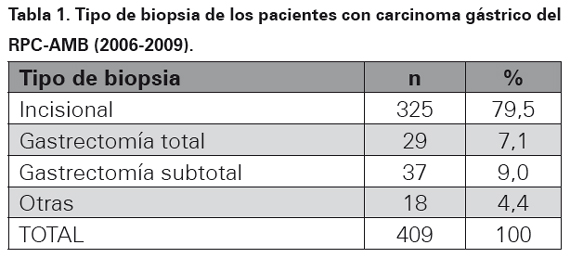
La base de datos de pacientes con diagnóstico de adenocarcinoma gástrico en el periodo de 2006 a 2009 del RPC-AMB arrojó inicialmente 520 casos, se excluyeron 111 pacientes por no cumplir los criterios de inclusión o por la imposibilidad de conseguir el bloque de parafina para la realización de la prueba de inmunohistoquímica.
CARACTERÍSTICAS DE LA POBLACIÓN
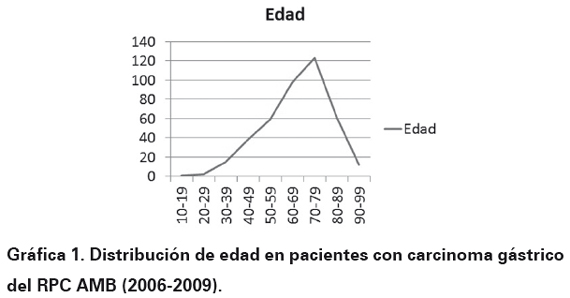
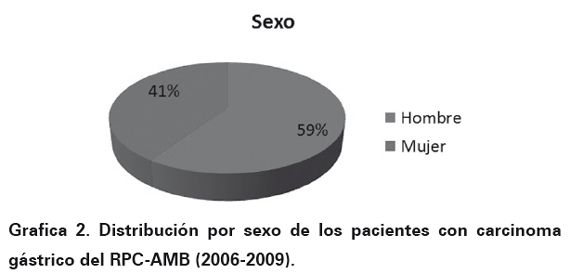
El número final de casos para el estudio fue de 409 casos (100%) y los resultados fueron los siguientes: la edad mostró un pico máximo a los 66,3 años (Ver Gráfica 1). La distribución por género se aprecia en la Gráfica 2. El lugar de procedencia mostró una distribución de la siguiente manera: Bucaramanga 226 casos (55,4%), Floridablanca 90 casos (22 %), Girón 37 casos (9%), Piedecuesta 46 casos (11,2%) y en 10 casos (2,4%) no se encontró información del sitio de procedencia al revisar las historias clínicas.
CARACTERÍSTICAS DE LA POBLACIÓN
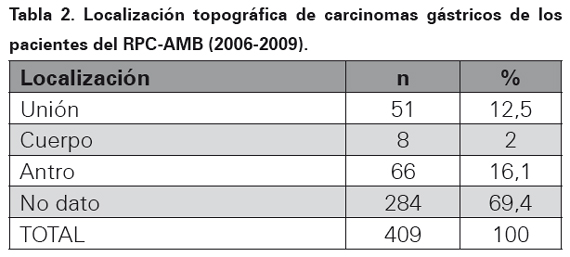
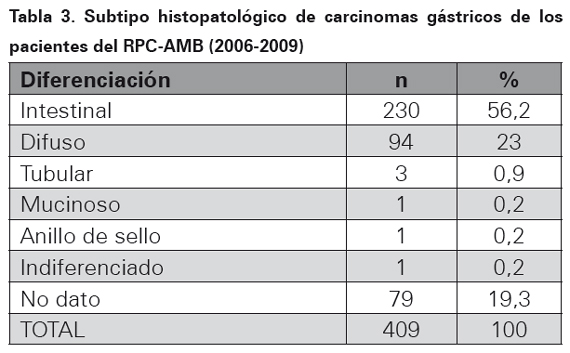
El tipo de biopsia donde se realizó el diagnóstico de adenocarcinoma gástrico para este periodo de tiempo se muestra en la Tabla 1. La localización topográfica del cáncer dentro del estómago se ilustra en la Tabla 2, en el 69,4 % de los casos no hubo información en el reporte histopatológico de la ubicación de la neoplasia. El subtipo histopatológico se muestra en la Tabla 3.
PERFIL DE INMUNOHISTOQUÍMICA
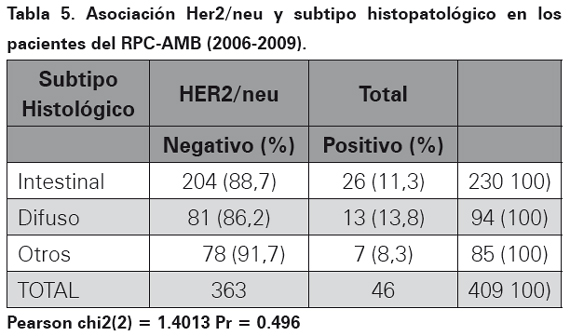
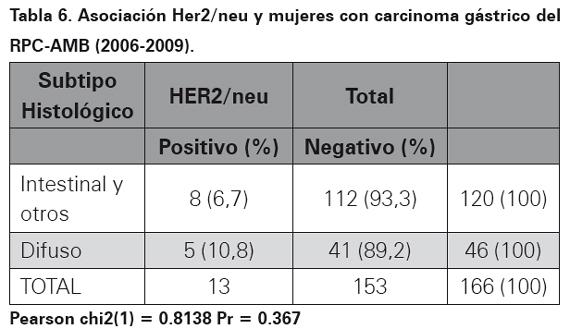
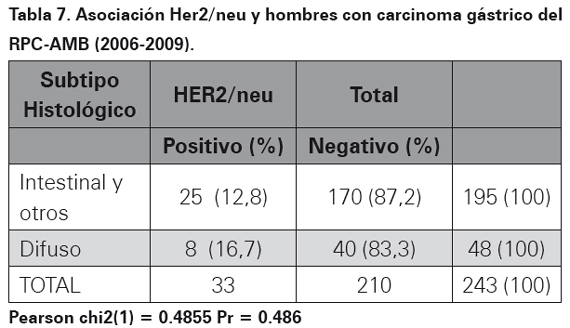
Los resultados del perfil de inmunohistoquímica para la oncoproteina Her2/neu realizado por el método manual HERCEPTEST en bloques de parafina se observa en la Tabla 4. En las Tablas 5, 6 y 7 se muestra la asociación entre el perfil de inmunohistoquímica, el subtipo histopatológico y el género.
DISCUSIÓN
El adenocarcinoma de estómago sigue siendo un problema de salud pública en varios países del mundo incluido Colombia, presentando altas tasas de incidencia y de mortalidad. GLOBOCAM para el 2008, estimó que ocurrirían 738 000 muertes aproximadamente por cáncer gástrico en todo el mundo1. Para Colombia según las estadísticas del DANE, en el periodo de tiempo de 2000 y 2009 se registraron 43 759 defunciones siendo el cáncer gástrico la principal causa de muerte por cáncer, ubicándolo como la neoplasia maligna más letal, siendo responsable de un mayor número de muertes que la causada por cáncer de cuello uterino y cáncer de pulmón2. Al observar las tasas de mortalidad presentadas por el Instituto Nacional de Cancerología de Colombia para esta neoplasia en este mismo período se mantuvieron estables, con una ligera disminución en el año 2009, con una tasa cruda de mortalidad de 9,68 por 100 000 habitantes, cifras que contrastan con otros estudios realizados en Colombia por Pardo y colaboradores en 1980 y 1998, donde se reportaron tasas de mortalidad de 19,5 por 100 000 habitantes3. Estudios similares de cáncer gástrico en Chile realizados por Painemal y colaboradores en 2009, reportan tasas de mortalidad de 20 por 100 000 habitantes y en el Japón en este mismo año Nakamura y colaboradores, encontraron tasas de mortalidad que mostraron un descenso de 69,9 por 100 000 habitantes a 34,5 por 100 000 habitantes en la población masculina y de 41,1 por 100 000 habitantes a 13,2 por 100 000 habitantes en las mujeres25,26. En el AMB para los años de 2003 a 2007 en el informe del Registro Poblacional de Cáncer, el cáncer gástrico se comportó muy similar a lo descrito en estos países de alta incidencia, con unas tasa de mortalidad que lo ubicaron como la primera causa de muerte por cáncer en hombres y la segunda causa en mujeres después del cáncer de mama4.
Cuando se comparan las tasas de mortalidad con la edad en países de alta incidencia como Chile, el Registro Poblacional de Cáncer 2003-2007 de este país, mostró un incremento marcado luego de los 50 años, donde tasas de 0,35 por 100 000 habitantes en pacientes de 20 a 24 años de edad ascienden a tasas de hasta 32,7 por 100 000 habitantes en pacientes con edades de 55 a 59 años27. Otros estudios realizados en Chile por Vallebuona y colaboradores en 2003 a 2007, muestran que el grupo más afectado por cáncer gástrico son los pacientes de 65 años de edad en promedio28. Las variaciones anteriores pueden ser explicadas por la aparición de enfermedades crónicas, las cuales se incrementan con la edad, historia natural de la enfermedad, diagnósticos en estadios más avanzados de la enfermedad, formas histológicas más agresivas, entre otros factores. La edad promedio de 66,3 años, encontrada en los pacientes del RPC-AMB es consistente a la encontrada en México, por Hernández y colaboradores en el año 201229. Al comparar la edad de los pacientes con los resultados del estudio ToGA (Estudio mundial de carcinoma gástrico y expresión de Her2)7, reportados en el 2009, se encuentra una diferencia de edad de 12 años, lo que podría ser explicado por la diversidad de factores ambientales que influyen en el desarrollo del carcinoma gástrico23. En el AMB, el adenocarcinoma gástrico fue más frecuente en hombres y no hubo diferencias significativas cuando se comparó con estudios realizados por Beltrány colaboradores en Perú en el año 2009 a 2010, donde también se observó un predominio en el género masculino con una relación hombres/mujeres de 3:130.
La manifestaciones clínicas del cáncer gástrico son en términos generales muy inespecíficas, condición que hace difícil diferenciar de un cuadro de gastritis crónica o ulceras pépticas, es por ello que la prueba de oro para el diagnóstico de esta neoplasia es el estudio de vías digestivas altas con endoscopia y toma de biopsias incisionales seriadas de la mucosa gástrica; según las recomendaciones de la Sociedad Americana de Oncología para cáncer gástrico31. En el estudio realizado se encontró un predominio de biopsias endoscópicas con un 79,5% del total de los casos, resultados que son concordantes con estudios realizados en Japón y Chile en los últimos 10 años28,32. La localización topográfica más frecuente para adenocarcinoma gástrico es la región antro pilórica sobre la curvatura menor sitio donde se localizan hasta el 60% de estas neoplasias, en el AMB la mayoría de estos tumores se localizó en el antro con 16,1% y hubo predominio de la variedad intestinal sobre el difuso, datos que son similares a los reportados en el 2009 en el estudio TOGA, donde la mayoría se localizaron en el antro y la variedad intestinal también predominó sobre otros subtipos histológicos23.
La sobreexpresión de la oncoproteina proteína Her2 para cáncer gástrico utilizando el método manual fue empleado y descrito por primera vez en el año de 198633. Desde entonces, países con alta incidencia de cáncer gástrico en busca de factores de mal pronóstico para esta neoplasia han ampliado su conocimiento en esta oncoproteína utilizando un anticuerpo monoclonal (HercepTest) mediante la técnica de inmunohistoquímica o amplificación del gen por medio de FISH24,34. Es así como en Japón se ha encontrado expresión de Her2/neu en carcinomas gástricos hasta en un 23% de los casos por técnica de inmunohistoquímica y de 27% por técnica de FISH26. En el momento el estudio más grande realizado a nivel mundial en carcinomas gástricos y expresión de esta oncoproteína (Her2/neu), es el estudio TOGA, el cual tomó 3807 pacientes con diagnóstico de carcinoma gástrico de 24 países de todo el mundo, realizo el método de HERCEPTEST y encontró una frecuencia de expresión de 22,1%23. En los 409 casos de este estudio, luego de realizar la técnica manual estandarizada (HERPCEPTEST), se obtuvo una expresión de 11,2%, el resultado fue equívoco en dos casos, en ambos se realizó FISH y se corroboró la positivad para la expresión de esta oncoproteina. En Latinoamérica, específicamente en México, Figueroa y colaboradores para el 2009, encontraron expresión de Her2/neu en carcinomas gástricos de 9,2% y 35% en dos estudios que incluyeron 65 y 40 pacientes respectivamente29. En Perú para el año 2008 a 2010 Painemal y colaboradores hallaron una frecuencia de expresión fue de 9,2% en 100 casos de pacientes con adenocarcinoma gástrico30. Con relación a la asociación en la sobreexpresión del oncogén con el subtipo histopatológico teniendo en cuenta la clasificación de Lauren17, en el AMB no se encontró asociación estadísticamente significativa (p= 0,496), así como tampoco en relación con el sexo: mujeres (p=0,367) y hombres (p=0,486). Estos datos son similares a los encontrados en México donde además no se encontró asociación con otras variables como grado de diferenciación y presencia de metástasis a distancia29. En el estudio ToGA se encontró mayor expresión de la oncoproteína Her2/ neu en carcinomas gástricos de variedad intestinal (32,2%, p< 0,001) comparado con los difusos23. Al mirar todos los estudios realizados en el mundo se observa una expresión variable de esta oncoproteína que va desde 8 a 91% de los casos, por lo tanto la expresión de Her2/neu en el 11,2 % de los casos estudiados en el AMB se encuentra dentro del rango reportado en la literatura médica. Diversos factores pueden explicar la variabilidad de los resultados encontrados, el primero de ellos es el tamaño de la muestra, muchos de los estudios realizados utilizan una muestra pequeñas de 30 o 50 casos, lo recomendable es tomar muestras suficientes para que los datos sean estadísticamente significativos, nuestro estudio utilizó 409 casos, por lo tanto se considera que el tamaño de la muestra no influyó en los resultados. El tipo de biopsia utilizada puede disminuir la expresión de esta prueba, en biopsias endoscópicas, la cantidad de células tumorales infiltrantes en menor cuando se compara con gastrectomías totales o subtotales donde hay mayor cantidad de células tumorales para estudio. En el estudio actual, hubo predominio de biopsias endoscópicas en 79,5% de los casos, al comparar con otros estudios realizados solo con gastrectomías la expresión de Her2/neu fue inferior a la observada en nuestra población, por lo tanto se considera que en el estudio actual no hubo influencia del tipo de biopsia35. Otro factor a tener en cuenta es la técnica, cuando no se tiene la experiencia o no se ha estandarizado el método manual de inmunohistoquímica HERCEPTEST, los falsos positivos o falsos negativos aumentan. Una vez se ha estandarizado la técnica, utilizando el anticuerpo correcto, a pesar de que actualmente hay disponibles métodos más avanzados como el de ventana, el método manual sigue siendo una prueba económica, rápida, de fácil acceso con una alta sensibilidad y especificidad. Adicionalmente, cuando por el método manual se interpretan resultados como equívocos, estos deben ser sometidos a FISH, para verificar su positividad. En el actual estudio dos casos fueron equívocos, a los dos se les realizó FISH, situación que ayuda a aumentar la sensibilidad y la especificada al momento de interpretar la expresión de esta oncoproteína.
Finalmente además de la información incompleta de las historias clínicas, otras limitaciones importantes para realizar este tipo de estudios se identifican en la fase pre analítica y consiste en la manera como se fijan las biopsias para su estudio histopatológico. Solo hasta hace aproximadamente unos cinco años en nuestra región se implementó el formol bufferizado o tamponado como medio ideal de fijación, años atrás se fijaban con formol al 10%, por lo tanto la baja expresión relativa de la oncoproteina Her2/neu al compararla con el estudio ToGA, en el AMB, pudo estar influenciada por el medio de fijación utilizado y la forma como se almacenan los bloques de parafina, porque se ha visto que los epítopes que reaccionan en la Inmunohistoquímica no se conservan de la misma manera que en el formol bufferizado y esto disminuye la sensibilidad al momento de realizar la técnica manual
CONCLUSIONES
La frecuencia de expresión de la oncoproteína Her2/ neu en los pacientes con adenocarcinoma Gástrico del AMB en el periodo de 2006 a 2009 fue de 11,2% concordante con lo reportado en la literatura médica. No se encontró asociación estadísticamente significativa entre la expresión de Her2/neu, subtipo histopatológico de carcinoma gástrico y género en los pacientes del AMB. Al igual que en otros estudios la expresión de esta oncoproteína en cáncer gástrico puede ser considerada un factor a tener en cuenta en el momento de definir conducta o pronóstico. La técnica manual de HERCEPTEST una vez esta estandarizada es de gran utilidad y reduce costos en este tipo de investigaciones.
RECOMENDACIONES
Es importante recordar a todo el personal de la salud lo importante que es elaborar historias clínicas completas para evitar perdida de la información en el momento de elaborar estudios de investigación en pacientes. Al realizar la técnica manual para la detección de la expresión de la oncoproteína Her2/ neu es importante tener en cuenta varios aspectos para evitar falsos positivos y falsos negativos: 1. El bloque de parafina seleccionado debe estar fijado con formol bufferizado. 2. Estandarizar la técnica manual. 3. La interpretación debe ser realizada por personal entrenado y con experiencia. 4. Los casos equívocos deben ser sometidos a FISH.
AGRADECIMIENTOS
El más sincero agradecimiento a los pacientes del Registro Poblacional de Cáncer del área metropolitana de Bucaramanga; instituciones de salud y laboratorios de patología del área metropolitana; doctora Laura Valencia y a la Universidad Autónoma de Bucaramanga por su apoyo financiero en esta investigación.
CONSIDERACIONES ÉTICAS
La presente investigación fue realizada acorde con la legislación nacional (Constitución Política Nacional de 1991 y resolución 008430 de 1993) como internacional (Declaración de Helsinki). Fue aprobada por el comité de ética de la Universidad Autónoma de Bucaramanga. Se obtuvo consentimiento informado para procesar los bloques de parafina para inmunohistoquímica. Se consideró un estudio sin riesgo.
CONFLICTO DE INTERÉS
Por las características del estudio realizado, los autores consideran que no existe conflicto de interés en esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. International Agency for Research on Cancer (IARC), World Health Organization (WHO). Cancer incidence and mortality worldwide in 2008. IARC Publ. 2008. [ Links ]
2. Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, et al. Cancer statistics, 2008. CA Cancer J Clin. 2008;58(2):71-96. [ Links ]
3. Pardo Ramos C, Cendales Duarte R. Incidencia estimada y mortalidad por cáncer en Colombia 2002 -2006. Bogotá: Instituto Nacional de Cancerología; 2010. [ Links ]
4. Uribe CJ, Osma S, Herrera V. Cancer incidence and mortality in the Bucaramanga Metropolitan Area, 2003-2007. Colomb Med. 2012;43(4):290-7. [ Links ]
5. Bosman FT, Carneiro F, Hruban RH, Theise ND. WHO Classification of Tumours. IARC WHO. 2008;3:2000-320. [ Links ]
6. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [ Links ]
7. Crew KD, Neugut Al. Epidemiology of upper gastrointestinal malignancies. Semin Oncol. 2004;31:450-64. [ Links ]
8. Correa P. Helicobacter pylori and gastric cancer: state of the art. Cancer Epidemiol Biomarkers Prev. 1996;5(6): 477-81. [ Links ]
9. Kurtz RC, Sherlock P. The diagnosis of gastric cancer. Semin Oncol. 1985;12(1):11-8. [ Links ]
10. Corley DA, Buffer PA. Oesophageal and gastric cardia adenocarcinomas: analysis of regional variation using the Cancer Incidence in five continents database. Int J Epidemiol. 2001;30:1415-25. [ Links ]
11. Piñeros M, Hernández G, Bray F. Increasing mortality rates of common malignancies in Colombia: an emerging problem. Cancer. 2004;101(10):2285-92. [ Links ]
12. Huang XE, Tajima K, Hamajima N, Kodera Y, Yamamura Y, Xiang J, et al. Effects of dietary, drinking, and smoking habits on the prognosis of gastric cancer. Nutr Cancer. 2000;38:30-6. [ Links ]
13. Correa P. Chronic gastritis: a clinico-pathological classification. Am J Gastroenterol. 1988;83:504-9. [ Links ]
14. Nomura A, Stemmermann GN, Chyou PH, Kato I, Perez- Perez GI, Blaser MJ. Helicobacter pylori infection and gastric carcinoma among Japanese Americans in Hawaii. N Engl J Med. 1991;325(16):1132-6. [ Links ]
15. Shand AG, Taylor AC, Banerjee M, Lessels A, Coia J, Clark C, et al. Gastric fundic gland polyps in south-east Scotland: absence of adenomatous polyposis coli gene mutations and a strikingly low prevalence of Helicobacter pylori infection. J Gastroenterol Hepatol. 2002;17:1161-4. [ Links ]
16. Abraham SC, Nobukawa B, Giardiello FM, Hamilton SR, Wu TT. Sporadic fundic gland polyps: common gastric polyps arising through activating mutations in the beta-catenin gene. Am J Pathol. 2001;158(3):1005-10. [ Links ]
17. Lauren P. The two histological main types of gastric carcinoma: Diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand. 1965;64:31-49. [ Links ]
18. Bosman F T, Carneiro F, Hrubran RH, Theise N D. Classification of Tumours of the Digestive System. IARC Monogr Eval Carcinog Risks Hum. 2010. [ Links ]
19. Akiyama T, Sudo C, Ogawara H, Toyoshima K, Yamamoto T. The product of the human c-erbB–2 gene: a 185-kilodalton glycoprotein with tyrosine kinase activity. Science. 1986;232(4758):1644-6. [ Links ]
20. Coussens L, Yang-Feng Tl, Liao YC, Chen E, Gray A, McGrath J, et al. Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene. Science. 1985;230(4730):1132-9. [ Links ]
21. Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science. 1989;244(4905):707-12. [ Links ]
22. Kaptain S, Tan LK, Chen B. Her–2/neu and breast cancer. Diagn Mol Pathol. 2001;10(3):139-52. [ Links ]
23. Bang Y, Chung H, Xu J, Lordick F, Sawaki A, Al-Sakaff N, et al. Pathological features of advanced gastric cancer: relationship to human epidermal growth factor receptor 2 positivity in the global screening programme of the ToGA trial. J Clin Oncol. 2009;27(15s):4556. [ Links ]
24. Esquivel HO, Castelan ME, Espinoza BM. Expresión de Her2/neu en adenocarcinoma gástrico. Experiencia de 10 años (2001-2011) en la Unidad Médica de Alta Especialidad No. 25, Centro Médico Nacional Noreste. Patol Rev Latinoam. 2012;50(2):80-6. [ Links ]
25. Painemal C, Berrios M, Gallegos I, San Martín C, Villanueva L, Barajas O, et al [sede web]. Determinación de la expresión del HER2 en Cáncer Gástrico: resultados preliminares. Revista chilena de cancerología y hematología. 2011;18(1):1-2. [actualizada el 31 de julio de 2012]. Disponible en: http://www.cancerologia.cl/revista.htm [ Links ]
26. Nakamura T, Nekarda H, Hoelscher AH, Bollschweiler E, Harbeck N, Becker K, et al. Prognostic value of DNA ploidy and c-erbB-2 oncoprotein overexpression in adenocarcinoma of Barrett's esophagus. Cancer. 1994;73(7):1785-94. [ Links ]
27. Appelbaum FR. Acute myeloid leukemia in adults. En: Abeloff MD, Armitage JO, Niederhuber JE, Kastan MB, McKenna WG, eds. Abeloff's Clinical Oncology. 4 ed. Philadelphia: Elsevier; 2008. p. 2215-34. [ Links ]
28. Vallebuona SC. [sede web]. Primer informe Registro Poblacional de Cancer Chile 2003-2007. Ministerio de Salud. Disponible en: http://epi.minsal.cl/epi/0notransmisibles/cancer/INFORME%20 RPC%20CHILE%202003-2007,%20UNIDAD%20VENT,%20DEPTO.EPIDEMIOLOGIA-MINSAL,13.04.2012.pdf [ Links ]
29. Esquivel O, Castelán EE, Espinoza MP. Expresión de Her-2/neu en adenocarcinoma gástrico. Experiencia de 10 años (2001-2011) en la Unidad Médica de Alta Especialidad No. 25, Centro Médico Nacional Noreste. Patología Rev Latinoam. 2012;50(2):80-6. [ Links ]
30. Beltran B, Yabar A. Expresión de HER2 en cáncer gástrico en el Perú. Rev Gastroenterol Peru. 2010;30(4):324-7. [ Links ]
31. Avital I, Pisters PWT, Kelsen DP, Willett CG. Cancer of the stomach, En: DeVita VT, Lawrence TS, Rosenberg SA, eds. DeVita, Hellman, and Rosenberg's Cancer: Principles and Practice of Oncology. 9 ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2011. [ Links ]
32. Nakamura K, Ueyama T, Yao T, Xuan ZX, Ambe K, Adachi Y, et al. Pathology and prognosis of gastric carcinoma. Findings in 10,000 patients who underwent primary gastrectomy. Cancer. 1992;70(5):1030-7. [ Links ]
33. Gravalos C, Jimeno A. HER2 in gastric cancer: a new prognostic factor and a novel therapeutic target. Ann Oncol. 2008;19(9):1523-9. [ Links ]
34. Brien TP, Odze RD, Sheehan CE, McKenna BJ, Ross JS. Her- 2/neu gene amplification by FISH predicts poor survival in Barrett's esophagus-associated adenocarcinoma. Hum Pathol. 2000;31(1):35-9. [ Links ]
35. Gordon MA, Gundacker HM, Benedetti J, Macdonald JS, Baranda JC, Levin WJ, et al. Assessment of HER2 gene amplification in adenocarcinomas of the stomach or gastroesophageal junction in the INT-0116/SWOG9008 clinical trial. Ann Oncol. 2013;24(7):1754-61 [ Links ]
36. Tanner M, Hollmén M, Junttila TT, Kapanen AI, Tommola S, Soini Y, et al. Amplification of HER-2 in gastric carcinoma: association with Topoisomerase IIa gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab. Ann Oncol. 2005;16(2):273–8. [ Links ]