Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicas UIS
Print version ISSN 0121-0319
Medicas UIS vol.26 no.2 Bicaramanga May/Aug. 2013
Enfoque actual del cáncer gástrico
Olga Blanco Fernández*
Ana Cantillo García*
Jordan Rivera Pallares*
*MD. Universidad del Magdalena. Santa Marta. Magdalena. Colombia.
Correspondencia: Dra. Olga Teresa Blanco Fernández. Dirección: Calle 102ª N7 Turbo. Antioquia. Colombia. Teléfonos: 3015648298 - 3113122977. Correo electrónico: olgablanco15@hotmail.com.
Artículo recibido el 15 de junio de 2013 y aceptado para publicación el 5 de agosto de 2013.
RESUMEN
El adenocarcinoma gástrico representa una neoplasia de origen epitelial en el 90 a 95% de los cánceres gástricos a nivel mundial, con alrededor de un millón de casos nuevos anuales, siendo el cuarto cáncer más común con respecto a su incidencia, con una proporción de 2:1 respecto al género hombre: mujer y una edad de presentación promedio de 65 años. Se sabe que los factores ambientales, genéticos y nutricionales ya estudiados en numerosas publicaciones influyen en su aparición, agresividad y evolución clínica. La infección por Helicobacter pylori continúa siendo uno de los factores más influyentes pero no el único que se relaciona con la aparición de la enfermedad. Generalmente en Colombia, el diagnóstico se realiza tardíamente encontrándose un estadio avanzado con pocas posibilidades de manejo curativo. El tratamiento es quirúrgico dependiendo del estadio, contándose con terapias endoscópicas, resecciones gástricas o derivaciones gastroyeyunales en aquellos casos avanzados donde solo se indica el tratamiento paliativo. La quimioterapia o la radioterapia tienen poca utilidad como monoterapia en esta patología. La siguiente revisión pretende actualizar al lector sobre el tema, especificando los métodos de diagnóstico y las recientes terapias de manejo tanto en la patología incipiente como en la avanzada; con un pequeño apunte en la importancia de las estrategias en detección temprana que se realizan en otros países y que podrían ser implementadas en el país dentro de un programa estructurado de atención en prevención primaria y diagnóstico oportuno. (MÉD.UIS. 2013;26(2):59-70).
Palabras Clave: Neoplasias Gástricas. Helicobacter pylori. Cloruro de Sodio Dietético. Vitamina C. Endoscopía Gastrointestinal.
Current focus of gastric cancer
ABSTRACT
Gastric adenocarcinoma represents epithelial neoplasia in 90-95% of gastric cancers worldwide, with about 1 million new cases annually, the fourth most common cancer regard to incidence, with a 2:1 respect to gender male or female and average age of onset of 65 years. It is known that environmental factors, genetic predisposition associated with nutritional factors studied in numerous publications contribute to its appearance, aggressiveness and clinical outcome. Helicobacter pylori Infection remains one of the most influential factors but is not the sole related to the onset of the disease. Usually in Colombia, the diagnosis is made late finding an advanced stage with little chance of curative intent. Surgical treatment is merely counting depending on the stage with endoscopic therapy, gastric resections or gastrojejunal bypass in advanced cases where only palliative treatment is indicated. Chemotherapy or radiation therapies have poor utility in this disease as monotherapy. The following review pretend update the reader on the subject, specifying the methods of diagnosis and management recent therapies in advanced or emerging pathology, with a view on the importance of early detection strategies that are made in other countries and could be implemented in our country within a structured program of care in primary prevention and timely diagnosis. (MÉD.UIS. 2013;26(2):59-70).
Keywords: Stomach Neoplasms. Helicobacter pylori. Sodium chloride, Dietary. Ascorbic Acid. Endoscopy, Gastrointestinal.
INTRODUCCIÓN
El cáncer gástrico actualmente representa un problema de salud pública debido al aumento de su incidencia. Es el cuarto cáncer más común y el segundo a nivel mundial con las tasas más altas presentadas en Japón, país en donde existen medidas de detección y tratamiento precoz de manera estructurada en un plan de salud pública. De acuerdo a las estimaciones de incidencia, en el periodo 2000-2006 se presentaron en Colombia cerca de 70 887 casos anuales de cáncer: 32 316 en hombres y 38 571 en mujeres, ocupando el segundo lugar en hombres y el tercero en mujeres detectándose a partir de los 65 años. En Colombia, se observan patrones claramente definidos en la mortalidad por este cáncer geográficamente en la zona Andina y las cordilleras. Si se repitiera una Endoscopia de Vías Digestivas Altas (EVDA) tras una prueba de tamizaje con resultado negativo a pacientes jóvenes con síntomas dispépticos podrían identificarse cánceres en estadios tempranos con alta posibilidad de manejo curativo.
La mayor parte de estas tumoraciones son de carácter esporádico, con un origen de novo a partir de los cambios genéticos promovidos por la exposición a múltiples carcinógenos ambientales y agentes infecciosos, dentro de los cuales se incluye el Helicobacter pylori. La infección se adquiere durante la infancia promoviendo un estado de inflamación crónica con un daño significativo y constante que puede precipitar la aparición del cáncer, cuyas manifestaciones se presentan después de los 50 años de edad.
En el momento se cuenta con diversos métodos de estudio y estadiaje, pero sin lugar a duda la EVDA continúa siendo el gold standard para el diagnóstico, que generalmente se realiza tardíamente, cuando el paciente presenta criterios de irresecabilidad solo permitiendo manejos paliativos. Las técnicas de tratamiento quirúrgico dependen estrictamente del estadio contándose desde la mucosectomía endoscópica hasta las derivaciones gastroyeyunales en aquellos enfermos en estadios avanzados, como búsqueda de la paliación de los síntomas del síndrome obstructivo a la salida gástrica. La quimioterapia o radioterapia tienen muy poca influencia en la tasa de supervivencia en estos pacientes, aunque pueden mejorar la respuesta al tratamiento quirúrgico cuando se realizan de manera preoperatoria en aquellos cánceres de carácter resecable.
Cabe destacar que en Colombia no existen estrategias implementadas por el Estado en el plan de salud vigente que busquen la detección temprana de este tipo de cáncer, el que se sabe que tiene posibilidades de curación en aquellos casos incipientes sin evidencia de metástasis distantes asociado a una terapia neo o adyuvante. Esta situación en salud requiere una pronta intervención del sistema estatal y de las diversas instituciones académicas y asistenciales tanto privadas como públicas para la organización de medidas costoefectivas a nivel nacional generalizándose la realización de la EVDA de forma prioritaria en aquellos individuos que presentan factores de riesgo predisponentes a la enfermedad asociados a síntomas dispépticos sean o no relacionados a signos de alarma.
Para la realización de la presente revisión, se realizó una búsqueda sistemática en las diferentes bases de datos médicas en la web (LILACS, Medline, PubMed, Centro Cochrane Iberoamericano, Cochrane, páginas web de la OMS y PAHO) utilizando las palabras claves; se filtró los artículos relevantes sobre tamizaje, diagnóstico y tratamiento estableciendo una vigencia de aproximadamente 10-15 años de antigüedad, por lo que se excluyeron la mayoría de publicaciones antiguas a estas fechas; se incluyeron algunas referencias dado a su importancia no se podían desestimar. De igual manera se enlazaron algunas referencias mencionadas en los artículos guía para complementar datos determinados.
El presente artículo busca enfocar el manejo actual de esta patología oncológica enfatizando los factores de riesgo plenamente conocidos y aquellas recomendaciones de prevención de la enfermedad, diagnóstico, tratamiento y seguimiento, para lograr una terapéutica acorde y oportuna dependiendo del estadio y las necesidades del paciente.
MARCO CONTEXTUAL
El cáncer gástrico representa del 90 al 95% aproximadamente de todas las neoplasias del estómago. Existen otro tipo como los linfomas y los tumores asociados al estroma gastrointestinal con menores tasas de incidencia en comparación al adenocarcinoma1.
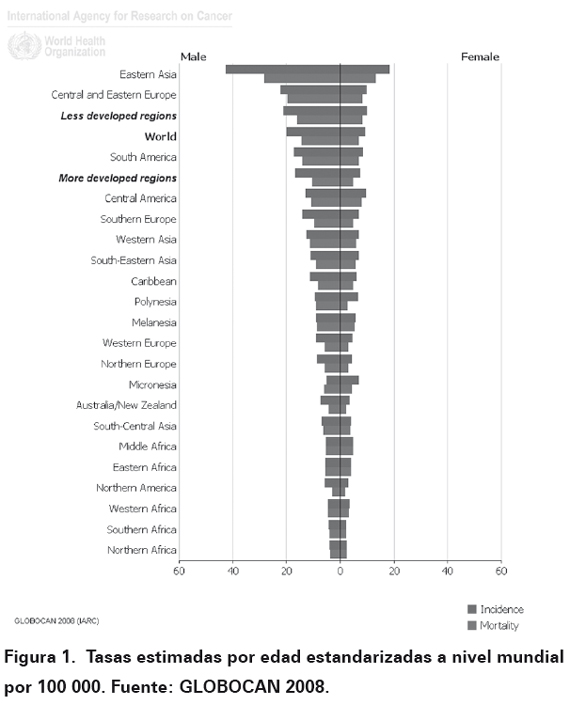
El cáncer de estómago ha producido 989 000 casos, el 7,8% del total, por lo que es actualmente el cuarto cáncer más común en el mundo, detrás de los cánceres de pulmón, de mama y colo-rectal. Esto representa un cambio importante desde los estimados en 1975, cuando el cáncer de estómago era la neoplasia más común. Más del 70% de los casos (714 000 casos) ocurren en países en vías de desarrollo (467 000 en hombres, 247 000 en las mujeres) y la otra mitad del total mundial se produce en Asia oriental. Las tasas de incidencia estandarizadas por edad son dos veces más alta en los hombres que las mujeres, que van desde 3,9 en el norte de África hasta el 42,4 en Asia oriental para los hombres y de 2,2 en el sur de África a 18,3 en Asia oriental para las mujeres2-4. Las tasas más altas en incidencia son Japón, Costa Rica, Singapur, Corea, Chile y Colombia (Ver Figura 1). Es la segunda causa de muerte por cáncer en ambos sexos en todo el mundo (738 000 muertes, 9,7% del total), las mayores tasas de mortalidad se estiman en Asia Oriental (28,1 por 100 000 habitantes en hombres, 13,0 por 100 000 en las mujeres) y las más bajas en América del Norte (2,8 y 1,5 respectivamente)4. Algunas variaciones regionales reflejan la diferencia en la prevalencia de la infección por Helicobacter pylory, cuya tendencia en los últimos años ha sido la disminución en la incidencia de su aparición en los países del occidente debido a la menor ingesta de sal y alimentos preservados, el aumento del consumo de frutas y verduras, la invención de la refrigeración y el uso extendido de antibióticos contra Helicobacter pylory2,3.
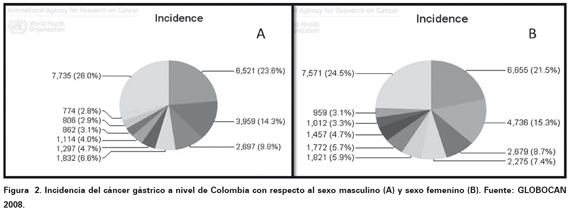
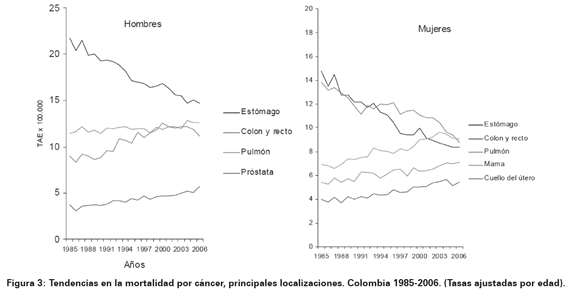
En Colombia la incidencia varía entre 35,62 y 36,78 por 100 000 habitantes en hombres y ocupa el segundo lugar en frecuencia después del cáncer de próstata. En mujeres la incidencia varía entre 22,62 y 24,31 por 100 000 habitantes y ocupa el cuarto lugar en frecuencia después del cáncer de mama y cuello uterino5 (Ver Figura 2). Entre el período 2000-2006 se presentaron cerca de 70 887 casos anuales de cáncer en donde los departamentos de Nariño, Boyacá, Cundinamarca, Tolima, Bogotá, Santander, Antioquia, Valle y Norte de Santander reportan un mayor número de casos (Ver Figura 3). En el Municipio La Cruz, Nariño se registra una de las mayores incidencias del mundo1.
En general se presenta alrededor de la séptima y octava década de la vida, con un promedio de 65 años; en los casos en los cuales el diagnóstico se realiza en etapa precoz o cáncer incipiente, la edad promedio desciende a 40 y 45 años; con una proporción hombre: mujer, 2:11.
Se han identificado numerosos factores de riesgo asociados a este cáncer, la mayoría de ellos de baja magnitud, entre los que se considera factores nutricionales como la dieta baja en proteínas y rica en sal, nitratos o consumo alto de carbohidratos complejos; factores ambientales como la preparación inadecuada de los alimentos, escaso tiempo de refrigeración de los mismos, ingesta de agua no potable y el tabaquismo; factores genéticos como el grupo sanguíneo A positivo6, la anemia perniciosa, antecedentes familiares de cáncer gástrico, cáncer de colon hereditario no asociado a pólipos y el síndrome de Li-Fraumeni; además existen las lesiones precancerosas dentro de las que se incluye la gastritis crónica atrófica, los pólipos adenomatosos, la displasia gástrica, la enfermedad de Menetrier, la metaplasia intestinal y el antecedente de gastrectomía parcial por lo menos con 15 años de anterioridad7. Estos estilos de vida asociados a los hábitos alimentarios del individuo más la susceptibilidad genética y las alteraciones moleculares adquiridas con el paso del tiempo son la base del proceso carcinogénico8-9
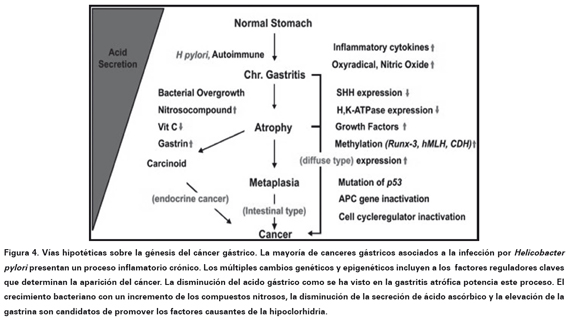
Sin embargo la asociación más fuerte con respecto a su etiología y la más estudiada corresponde a la infección por la bacteria Helicobacter pylori, estimándose que alrededor de 500 000 casos anualmente son producidos por esta infección1-6,7. Se propuso la cascada precancerosa postulando que el avance de un estado a otro depende del proceso inflamatorio en la mucosa gástrica que puede evolucionar hacia la gastritis no atrófica la cual no está relacionada con el cáncer o en su defecto a la gastritis atrófica acompañada de metaplasia intestinal10,11. Algunos factores asociados per se a la bacteria dependen de la virulencia de la cepa, definidos por dos genes que transcriben para dos proteínas principalmente: CagA, citotoxina y el gen VacA para la toxina vacualizadora. Un sistema especial de inyección introduce la toxina CagA en el citoplasma de la célula de la mucosa gástrica, que es fosforilada y posteriormente provoca una modificación del citoesqueleto. La segunda toxina VacA actúa sobre la membrana citoplasmática y disuelve las uniones intercelulares, lo que permite que la bacteria se ubique entre dos células epiteliales10,11. Además el Helicobacter pylori posee la enzima ureasa la que permite la conversión de la urea en amonio y bicarbonato provocando una alcalización del medio, alterando la secreción de somastostatina que es un potente inhibidor de la producción de gastrina e iniciando un proceso inflamatorio con aumento de los mediadores de la inflamación especialmente la interleucina 812,13. Al final se produce una hipoclorhidria con disminución del pH que en conjunto a la alteración de la barrera de defensa de la mucosa gástrica permite el cambio de esta mucosa normal a la gastritis atrófica, posteriormente a la metaplasia intestinal la cual sufre displasia y al final el cáncer gástrico (Ver Figura 4). Cabe destacar que esta fuerte asociación se vincula a la variante intestinal del cáncer según la clasificación de Lauren cuya lesión casi siempre se encuentra en un solo foco y no a la variante difusa a la que no se le ha atribuido lesión atrófica inicial13,14.
Es de mencionar que el alto consumo de sal y de alimentos ahumados están asociados positivamente como factor de riesgo y esto se evaluó en Colombia encontrándose que adicionar sal a un plato antes de probarlo tiene un OR 5,56 IC 95% 1,8-17,1 (p=0,01), el consumo de alimentos asados un OR 3,97 IC 95% 2,2- 7,4 (p = 0,001) y el consumo de alimentos cocinados al horno OR 5,68 IC 95% 1,21 a 26,7 (p 0,014); por lo que se recomienda disminuir el alto consumo de sal en la dieta al igual que los alimentos ahumados o preparados al horno15.
La ingesta de sal en altas concentraciones causa gastritis y puede destruir la barrera de moco estomacal, promover la inflamación y el daño de la mucosa así como la erosión difusa y la degeneración, además de aumentar el riesgo de infección por Helicobacter pylori y de gastritis atrófica16-8. Su coadministración puede aumentar el efecto de algunos carcinógenos gástricos como el N-methyl- N-nitro-N-nitrosoguanidina19. Se habla que las personas con un mayor umbral de sensibilidad al sabor salado tienen un mayor riesgo de desarrollar cáncer gástrico y esto se explica por la asociación de mayor consumo de comida salada como las carnes o el pescado20. El efecto protector de las verduras y las frutas es valedero si el consumo es al menos tres veces por semana y en especial aquellas que son de color verde o amarillo ricas en vitamina C, la cual se ha demostrado como factor protector en diversos estudios muy probablemente debido a la inhibición del crecimiento celular, bloqueando la acción de los compuestos nitrosos, disminuyendo la actividad de la ureasa y reduciendo la concentración de nitritos21,22.
Los signos y síntomas dependen del estadio clínico y la localización. La mayoría de los pacientes con cáncer precoz refieren síntomas dispépticos como epigastralgía leve o recurrente, pirosis, distensión abdominal, náuseas o vómitos. Cuando se presenta dolor abdominal recurrente, anemia, pérdida de peso, vómitos y anorexia, disfagia o síndrome pilórico existe una enfermedad avanzada; los signos indicativos de enfermedad incurable, como el ganglio de Virchow, el signo de Blummer, el ganglio de Irish, la ascitis y el signo de la hermana Mary Joseph, contraindican el tratamiento quirúrgico con intención curativa1,23.
El pilar del diagnóstico es la endoscopia de vías digestivas altas, que permite la visualización de la lesión y sus características, tamaño, ubicación, además de la toma de biopsias para confirmación histológica. Dependiendo de su apariencia
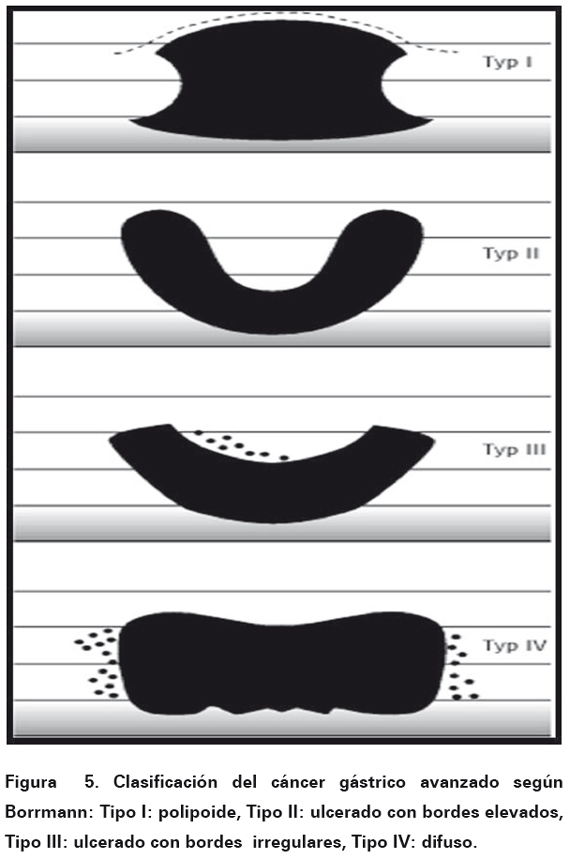
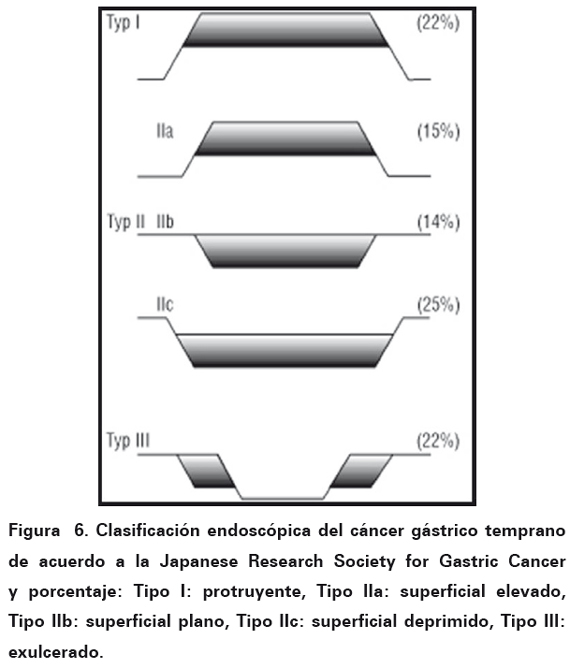
macroscópica y localización se realiza la clasificación ya sea cáncer temprano según la Japanese Gastric Cancer Association o cáncer avanzado por la clasificación Borrmann24 (ver Figura 5-6). Se puede lograr la mejoría en el diagnóstico con las técnicas de coloración endoscópicas convencionales, como el índigo carmín, y con las herramientas de última tecnología, como la cromoendoscopia digital y la endoscopia con amplificación óptica25.
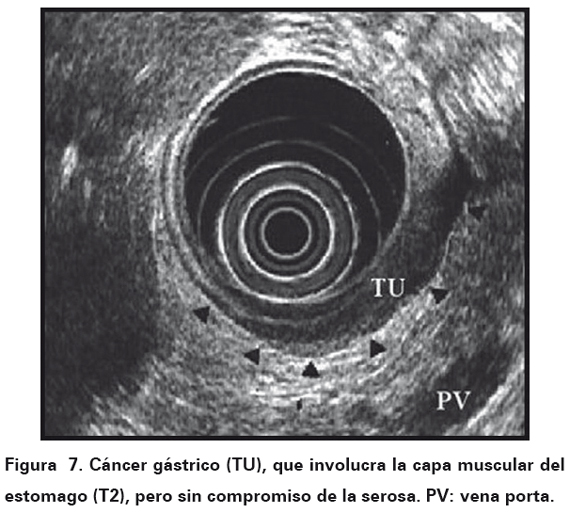
La ultrasonografía endoscópica es el método más sensible para valorar el grado de invasión en la pared en el 90 al 95% de los casos; tiene similar sensibilidad que la tomografía axial computarizada para detectar adenopatías perigástricas (50-80%) aunque no es útil en el diagnóstico de ganglios comprometidos distantes y en el medio es de baja disponibilidad como herramienta de estudio prequirúrgico; una posible causa de esta debilidad, sería el pobre consenso sobre los criterios de malignidad con respecto a los nódulos, donde algunos autores consideran tamaños a partir de 5 mm y en otros casos son positivos cuando miden más de 8 a 10 mm26-8 (Ver Figura 7).
La tomografía axial computarizada toracoabdominal con contraste oral e intravenoso tiene una tasa de exactitud del 60 a 70 % para estadificar el T y del 40 a 70% para el N, un 70% para la carcinomatosis peritoneal y un 60% para las metástasis hepáticas. Tiene un promedio de sensibilidad de 43% a 82%29,30. Con respecto a la Tomografía con Emisión de Positrones (TEP) tiene una especificidad alta (92%) comparada con 62% de la TC y una baja sensibilidad, de 56% vs. 78% para la TC, en la detección de ganglios linfáticos, además que sirve para el estudio de metástasis distantes1-30.
La laparoscopía se solicita en tumores proximales, en indiferenciados y cuando existe la sospecha clínica de carcinomatosis peritoneal, dado a que es el estudio más sensible para descartarla. Si se practica lavado peritoneal, el estudio citológico es positivo en un 40% de los casos, produciéndose en aquellos donde existen metástasis peritoneales. Por lo tanto, la laparoscopia puede prevenir laparotomías exploradoras en enfermos que no requieren de procedimientos paliativos quirúrgicos31. También permite la toma de biopsias y realización de derivaciones gastroyeyunales, gastrostomías y resección tumoral parcial en tumores sangrantes32.
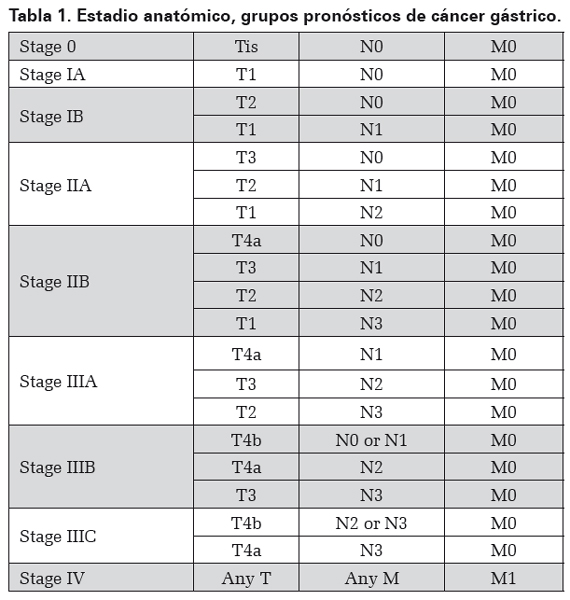
Para la clasificación del cáncer gástrico, se utiliza el TNM (tumor, nódulos, metástasis) propuesto por la American Joint Commission on Cancer, en su última versión del 201033,34 (Ver Tabla 1).
El cáncer gástrico temprano es aquel que compromete hasta la submucosa, tiene excelente pronóstico, con una tasa de sobrevida a los cinco años del 95%35. El cáncer gástrico avanzado cuyo compromiso va más allá de la submucosa, es de mal pronóstico, con una tasa de sobrevida en Occidente a los cinco años del 5 a 20%, lo que se relaciona a la inexistencia de programas de detección precoz debido a su baja incidencia e inadecuada relación costo-beneficio en planes de screening35.
Estudios en Colombia han demostrado que tanto en las mujeres como en los hombres la edad de presentación de esta patología se encuentra por encima de los 30 años y que muy probablemente todo paciente con dispepsia debería remitirse para la realización de EVDA independiente o no de la existencia de síntomas de alarma, ya que la ausencia de estos no predice enfermedad temprana36. El tiempo de duplicación tumoral de los cánceres gástricos tempranos es alrededor de dos a tres años, así que tras una EVDA negativa si se llegase a realizar nuevamente en este laxo de tiempo el procedimiento, se podría diagnosticar un estadio temprano susceptible a tratamiento curativo37,38.
Cabe destacar las experiencias de diferentes países con respecto a la detección temprana de esta patología. El país con mayor experiencia en tamizaje es Japón. Basados en los métodos estandarizados por las Japanese Guidelines for Gastric Cancer Screening, se estudiaron cuatro métodos y se evaluó su uso como prueba de tamizaje: fotofluorografía, endoscopia, niveles de pepsinógeno sérico, y anticuerpos contra Helicobacter pylori; la fotofluorografía con un nivel de evidencia 2++ y un grado B de recomendación se sugiere como una forma oportuna para tamizaje en Japón; la mayoría de estudios de casos-controles muestran una disminución de un 40-60% de la mortalidad por cáncer gástrico con este método. Los otros métodos no tienen suficiente evidencia que soporten su uso como medio de tamizaje39.
Otro ejemplo a nivel de Latinoamérica lo representa Chile, donde el cáncer gástrico es la primera causa de mortalidad por cáncer siendo una prioridad en salud pública, por lo que el Ministerio de Salud del gobierno chileno desarrolló una guía cuyo objetivo es orientar al personal de salud al manejo de esta patología con el fin de disminuir la mortalidad mediante la detección temprana realizando EVDA en población sintomática. Recomiendan realizar endoscopia digestiva alta en todo paciente:
1. Mayor de 40 años
2. Epigastralgía de más de 15 días de duración, asociada o no a:
- Hemorragia digestiva (hematemesis o melena).
- Anemia de causa no precisada.
- Baja de peso no aclarada.
- Sensación de plenitud gástrica, principalmente posprandial.
- Compromiso del estado general (astenia, adinamia y anorexia)
- Disfagia.
Además se recomienda también la endoscopia en los pacientes mayores de 40 años, si poseen antecedente de gastrectomía hace más de 15 años o un familiar directo con historia de cáncer digestivo40.
En Colombia no existe como tal una medida o estrategia que promueva la prevención o la detección temprana mediante screening de esta patología. El Ministerio de Salud y protección social y el Instituto Nacional de Cancerología, diseñaron el plan nacional para el control del cáncer de Colombia, que comprende los años 2012 a 2020. De manera resumida tiene como objetivos el control del riesgo, la detección temprana, el tratamiento y rehabilitación y el cuidado paliativo, dentro de los fines básicos para el control propuestos por la OMS y que a partir de dichos lineamientos y de la mejor evidencia científica sienta las bases para controlar los factores de riesgo, reducir la mortalidad y mejorar la calidad de vida de los pacientes con cáncer. En la primera línea estratégica para el control del riesgo se elaboraron las siguientes metas: incrementar el consumo de frutas y verduras en la población general en un 5%; la segunda línea estratégica comprende la detección temprana de las patologías, la tercera la atención, recuperación y superación de los daños causados por el cáncer, la cuarta línea estratégica el mejoramiento de la calidad de vida y la quinta el conocimiento para el control de cáncer. Dicho plan habla de ciertas metas y acciones que comprenden dentro de su marco el manejo de las neoplasias de mama, cérvix, pulmón, e incluso incluir un medio de tamizaje para el cáncer colorectal para el 2013, pero no realiza ninguna mención de estrategias de manejo del cáncer de estómago41.
Se han realizado algunos trabajos destacándose Emura, et al quienes evaluaron la Cromo Endoscopia Sistemática (CES) en pacientes voluntarios sanos buscando la prevalencia de lesiones gástricas premalignas y cáncer temprano. Un total de 950 sujetos fueron convocados, 800 cumplieron los criterios de inclusión y finalmente 650 fueron analizados. Se observó en sus resultados que ninguno de los participantes presentó mucosa gástrica normal y el 77,4% fueron diagnosticados con gastritis crónica moderada o severa. Con respecto a las lesiones premalignas, llama la atención que el 99% (93/94) de los casos con atrofia sin metaplasia, el grado de atrofia fue leve mientras que todos los casos con atrofia y metaplasia intestinal demostraron atrofia moderada o severa. En cuanto a la infección por Helicobacter pylori, su frecuencia fue más alta en sujetos con gastritis crónica moderada o severa y muy baja o ausente en los dos extremos de la enfermedad: gastritis leve y displasia. Solo dos participantes del estudio (un hombre y una mujer) con promedio de edad de 60 años fueron diagnosticados con cáncer gástrico estado 0. En conclusión se demostró que 1/325 personas voluntarias asintomáticas en Colombia tiene cáncer gástrico, 1/33 presenta lesión premaligna, mostrando la alta prevalencia de gastritis crónica atrófica sea con metaplasia o no en personas sanas. Aunque el costo, la necesidad de entrenamiento en CES, la disponibilidad de equipos de alta definición y los requerimientos de personal puedan impedir su reproductibilidad, los autores de esta investigación creen que estos hallazgos pueden servir de referencia para establecer y reforzar programas de prevención y detección del cáncer gástrico tanto en Colombia como en otros países42. Por el contrario, Oliveros et al consideran la realización del tamizaje para cáncer gástrico, utilizando niveles de pepsinógeno sérico con un adecuado punto de corte, el cual puede resultar efectivo y mejor que la fluoroscopia, ya que la población colombiana presenta una alta prevalencia de infección por Helicobacter pylori y:
- El procedimiento es fácil y no le produce molestias al paciente.
- No hay exposición a radiación, por lo que no hay efectos secundarios
- Es más barato, menos de la mitad del estudio fluoroscópico.
- Es más rápido.
- Es fácilmente aplicado en forma masiva a grandes poblaciones43.
El manejo del cáncer gástrico es totalmente quirúrgico. La cirugía es el único tratamiento curativo o en su defecto el mejor paliativo44. En general la indicación quirúrgica se descarta si se presenta carcinomatosis peritoneal, metástasis hepáticas, invasión de vasos mayores; que se consideran elementos de irresecabilidad. De acuerdo con la clasificación por la Japanese Gastric Cancer Association (JGCA), los ganglios linfáticos perigástricos se definen como grupo 1; mientras que los nódulos perigástricos distantes, a lo largo de la arteria hepática común, la arteria esplénica, tronco celíaco y la arteria hepática son definidos como el grupo 2. Con respecto a la resección de los ganglios linfáticos, la mayoría de los cirujanos del mundo occidental están a favor de una resección en bloque limitado a los nódulos del grupo 1 (D1) debido al aumento de la mortalidad perioperatoria asociada con la resección de los nódulos del grupo 2 (D2)45,46. A diferencia de los estudios en occidente, en el oriente, la resección extendida (D2) se ha aplicado con buenos resultados desde la década de 1960. Los datos actuales de los estudios occidentales indican un creciente consenso que la resección D2 con preservación del páncreas y el bazo (también llamado D1+) no está asociado a una mayor mortalidad perioperatoria. Las gastrectomías asociadas a resección ganglionar D2 están relacionadas con una mayor morbilidad global (46% vs 28%, p < 0,001) y mortalidad (13% vs 6,5%, p = 0,04 IC del 95% 9,18% para D2, 4-11% para D1) en comparación a las D1. Estas desventajas son consecuencia de pancreatectomías y esplenectomías adicionales las que a largo plazo anularían cualquier beneficio de las resecciones D2 debido a que no impactan positivamente en la supervivencia y presumen una mayor mortalidad45,46. En conclusión, el objetivo de toda cirugía es lograr la resección completa con márgenes negativos de aproximadamente 5 cms, con resección de por lo menos 15 ganglios linfáticos para su examinación patológica; la resección de los ganglios regionales dentro de un perímetro de 3 cms alrededor del tumor, más la resección de los ganglios de la transcavidad de los epiplones, mesocolon transverso, arterias hepática, esplénica, tronco celiaco y de la gástrica izquierda se considera la técnica adecuada47.
La gastrectomía subtotal se practica en pacientes con cáncer distal con resultados comparables con la gastrectomía total, cuyos efectos adversos son mayores. En situaciones donde el cáncer es inoperable en los que se encuentra limitada la cirugía, especialmente en pacientes con metástasis peritoneales, hepáticas, ganglionares distales y cáncer Bormann tipo 4; existen otras alternativas como la quimioterapia, hormonoterapia, inmunoterapia, radioterapia, y la hipertermia; que son modalidades adicionales que deben ser utilizadas con el fin de mejorar los resultados terapéuticos48-50. De igual forma en dichos casos, la resección es limitada, aún con márgenes comprometidos se acepta como tratamiento paliativo o en caso de sangrado; al igual el bypass gastroyeyunal para la paliación de los síntomas obstructivos en el síndrome pilórico por un cáncer distal1.
Para que un cáncer gástrico sea resecado vía endoscopia debe cumplir varias condiciones: ser una lesión menor de 10 mm, sobreelevada, bien diferenciada, no ulcerada, que se encuentre ubicada en el cuerpo o el antro, sin compromiso de la submucosa y que no halla ganglios patológicos; en estos casos se indica la vía endoscópica para ablación por electrocoagulación, terapia láser o fotodinámica; en los tumores avanzados se puede inyectar localmente alcohol puro o quimioterápicos para lograr el control del sangrado como tratamiento paliativo51,52.
Algunos estudios de origen oriental soportan el uso de quimioterapéuticos en pacientes con disección D2; por el contrario en el occidente los estudios han demostrado una eficacia débil con respecto a la supervivencia53,54. Se ha evaluado la quimioterapia neoadyuvante cuyos resultados la establecen como otra buena opción para el manejo estándar de los pacientes con cáncer gástrico resecable bajo un régimen de epirubicina, ciplastatino y fluorouracilo, logrando la disminución del tamaño y el estadio con mejoría de la tasa de sobrevida55. En EE.UU el estudio intergrupal INT -0116 demostró una mejora significativa en la supervivencia global libre de enfermedad en pacientes con cáncer gástrico avanzado al ser sometidos a radio-quimioterapia adyuvante frente a cirugía. En contraste con el estudio INT-0116, tres ensayos aleatorios en pacientes occidentales, asignados al azar a quimioterapia adyuvante con diferentes regímenes terapéuticos (pero sin radiación) frente a cirugía no demostró aumentar significativamente la supervivencia. A pesar de los decepcionantes resultados, Cunningham et al, validaron la superioridad de la quimioterapia perioperatoria versus cirugía56. La quimioterapia perioperatoria no ha sido comparada con la radioquimioterapia adyuvante en un entorno aleatorio. Sin embargo, los resultados del ensayo ARTISTA recientemente publicados y los datos de Zhu et al, indican una superioridad de la radio-quimioterapia adyuvante en comparación con la quimioterapia adyuvante en términos de supervivencia libre de enfermedad en pacientes asiáticos con cáncer gástrico avanzado56.
Según la National Comprehensive Cancer Network (NCCN), en sus guías de manejo del año 2011, los regímenes de quimioterapia deben ser elegidos teniendo en cuenta el estadio, las comorbilidades médicas, el perfil tóxico, y la expresión del gen HER2-neu. Recomiendan regímenes con dos drogas citotóxicas para pacientes con enfermedad avanzada debido a su baja toxicidad; aquellos que incluyen tres drogas citotóxicas se prefieren para pacientes medicamente sanos, con un acceso frecuente para la evaluación toxicológica. La radioquimioterapia perioperatoria se indica para el manejo de los adenocarcinomas de la unión esofagogástrica. La quimioterapia perioperativa es una alternativa de menor opción, con mejor recomendación para el tratamiento de tumores locales asociada a radiación y posterior a una intervención quirúrgica donde se realizó disección ganglionar D2. Si el paciente tiene un índice funcional adecuado, con un Karnofsky mayor o igual a 60-80% pueden beneficiarse de tratamientos paliativos diferentes a los mejores cuidados sintomáticos53,54.
El seguimiento se realiza con historia clínica y examen físico cada tres a seis meses por uno a dos años, posteriormente controles cada 6 a 12 meses por tres a cinco años y después anualmente, siempre vigilando los niveles de vitamina B12 en quienes se practicó gastrectomía total. De acuerdo a los hallazgos físicos se solicitaran los exámenes necesarios53,54.
CONCLUSIONES
El cáncer gástrico representa un problema actual de salud pública mundial y localmente debido al aumento de su incidencia y la necesidad de disminuir la mortalidad por esta causa. Se sabe que es el cuarto cáncer más común y la segunda causa de muerte por cáncer a nivel mundial, en el 2008 con aproximadamente 1 000 000 casos nuevos notificados y un total de 738 000 muertes; las que alrededor del 70% ocurren en los países desarrollados, presentandose posterior a los 50 años de edad, con un diagnóstico tardío en donde el tratamiento quirúrgico solo contempla la posibilidad de un manejo paliativo. El objetivo de toda cirugía busca una resección quirúrgica con un margen negativo de 5 cms y disección ganglionar amplia que incluya por los menos 15 ganglios para su estudio patológico; aun así no hay un consenso en lo que respecta al abordaje quirúrgico y extensión de las disecciones ganglionares, aunque en los últimos estudios viene en auge el beneficio en la supervivencia con la realización de resecciones tipo D2. La esplenectomía y la resección de la porción distal del páncreas no se recomiendan de rutina, debido a su alta relación con mayores tasas de morbimortalidad. El manejo paliativo se recomienda en estadios avanzados donde se encuentren presentes los criterios de irresecabilidad. Aunque las técnicas quirúrgicas han mejorado mucho en los últimos años, todavía hay una alta tasa de fracaso en el control local, así como de metástasis a distancia, por lo que se hace hincapié en la importancia de un enfoque terapéutico sistémico además de la cirugía. La radioterapia neoadyuvante mejora el control local de la enfermedad y la supervivencia. Combinar la quimioterapia con la radioterapia adyuvante reduce significativamente la recaída local y regional posterior a la cirugía. Se enfatiza que la única forma viable de reducir la mortalidad por esta causa es la implementación de la EVDA en pacientes sintomáticos para así detectar aquellos casos incipientes, aunque si se busca reducir la mortalidad temprana por esta patología deberían promoverse programas de screening con un alto nivel de evidencia en Colombia. En el 2012 se elaboró el Plan Nacional para el Control del Cáncer creándose cinco líneas estratégicas basadas en gran medida en la prevención integrada de los factores de riesgo de la población, la posibilidad de la detección temprana, también calidad, oportunidad y continuidad de atención de los enfermos para mejorar la calidad de vida y disminuir en el impacto económico y de desarrollo social negativos. Desde el año 2006 el Instituto Nacional de Cancerología elaboró y publicó el modelo para el control del cáncer en Colombia el cual tiene como objetivos el control del riesgo, la detección temprana, el tratamiento y la rehabilitación y cuidado paliativo de dichos pacientes; pero aún así no contempla en sus lineamientos medidas estratégicas para el manejo del cáncer de estómago. Esta situación amerita la implementación de una estrategia que permita una atención en prevención primaria, detección temprana, tratamiento oportuno y seguimiento los cuales no se encuentran contemplados en las actuales guías del Ministerio de salud.
AGRADECIMIENTOS
Recalcamos la ayuda y el apoyo brindando por nuestro tutor el Dr Jorge Zaccaro Arregoces, cirujano oncólogo, quien incondicionalmente guió este trabajo direccionando a la búsqueda de nueva información existente en la temática. De igual forma agradecemos a la Revista Médicas UIS, quien hizo posible la publicación de nuestro artículo en su versión online e impresa. Es para nosotros de vital importancia contar con personas, entidades y editoriales sin ánimo de lucro dispuestas al fomento de la investigación en nuestro país.
REFERENCIAS BIBLIOGRÁFICAS
1. Asociación Colombiana de Cirugía. Cáncer gástrico. Guías de manejo en cirugía. Bogotá, D.C., Junio de 2009. [ Links ]
2. Jemal A, Center MM, DeSantis C, Ward EM. Global patterns of cancer Incidence and mortality rates and trends. Cancer Epidemiol Biomarkers Prev. 2010;19(8):1893-907. [ Links ]
3. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;6182):69-90. [ Links ]
4. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer 2008: GLOBOCAN 2008. Int J Cancer. 2010;127(12):2893-917. [ Links ]
5. Piñeros M, Murillo RH. Incidencia de cáncer en Colombia: importancia de las fuentes de información en la obtención de cifras estimativas. Rev Col Cancerol. 2004;8(1):5-14. [ Links ]
6. Bonney GE, Elston RC, Correa P, Haenszel W, Zavala DE, Zarama G, et al. Genetic association of gastric carcinoma: I. chronic atrophic gastritis. Genet epidemiol. 1986;3(4):213-24. [ Links ]
7. Fuchs CS, Mayer R. Gastric carcinoma. N Engl J Med. 1995;33(1). [ Links ]
8. Resende C, Thiel A, Machado JC, Ristimäki A. Gastric Cancer: Basic Aspects. Helicobacter. 2011;16(1):38-44. [ Links ]
9. Bornschein J, Rokkas T, Selgrad M, Malfertheiner P. Gastric cancer: clinical aspects, epidemiology and molecular background. Helicobacter. 2011;16 Supp 1:45-52. [ Links ]
10. Correa P. Cáncer gástrico: una enfermedad infecciosa. Rev. Colomb. Cir. 2011;26(2):111-7. [ Links ]
11. Correa P, Piazuelo MB, Wilson KT. Pathology of gastric intestinal metaplasia: clinical implications. Am J Gastroenterol. 2010;105:493-8. [ Links ]
12. Wroblewski L, Peek, Wilson K. Helicobacter pylori and gastric cancer: factors that modulate disease risk. CMR. 2010; 23(4):713-39. [ Links ]
13. Fuentes-Pananá E, Camorlinga-Ponce Ma, Maldonado-Bernal C. Infección, inflamación y cáncer gástrico. Sal Pub Mex. 2009;51(5):427-33. [ Links ]
14. De La Torre A, Kettenhofen W, Roesch F, Rodríguez L, Mejía A, Peniche J. Guía de diagnóstico y tratamiento del cáncer gástrico. Epidemiología, factores de riesgo, variedades histológicas e historia natural. Rev Gastroenterol Mex. 2010;2(75):237-9. [ Links ]
15. Gómez M, Otero W, Ruiz X. Factores de riesgo para cáncer gástrico en pacientes colombianos. Rev Col Gastroenterol. 2009;24(2):124-43. [ Links ]
16. Tsugane S, Sasazuki S. Diet and the risk of gastric cancer: review of epidemiological evidence. Gastric cancer. 2007;10:75-83. [ Links ]
17. Fox J, Dangler C, Taylor N, King A, Koh T, Wang T. High- salt diet induces gastric epithelial hyperplasia and parietal cell loss, and enhances helicobacter pylori colonization in c57bl/6 mice. Cancer res. 1999;59:4823-8. [ Links ]
18. Wang X, Terry P, Yan H. Review of salt consumption and stomach cancer risk: epidemiological and biological evidence. World J Gastroenterol. 2009;15(18):2204-13. [ Links ]
19. Takahashi M, Hasegawa R. Enhancing effects of dietary salt on both initiation and promotion stages of rat gastric carcinogenesis. Princess Takamatsu symp. 1985;16:169-82. [ Links ]
20. Wan-Guang Y, Chuan-bo C, Zhi-Xin W, Yu-Pei L, Xiao-Yuan W, Shan-Feng Z, et al. A case-control study on the relationship between salt intake and salty taste and risk of gastric cancer. World J Gastroenterol. 2011;17(15):2049-53. [ Links ]
21. Ngoan Lt, Mizoue T, Fujino Y, Tokui N, Yoshimura T. Dietary factors and stomach cancer mortality British Journal of Cancer. 2002;87:37-42. [ Links ]
22. Jarosz M, Sekuła W, Rychlik E, Figurska K. Impact of diet on long-term decline in gastric cancer incidence in Poland. World J Gastroenterol. 2011 january 7;17(1):89-97. [ Links ]
23. Wanebo HJ, Kennedy BJ, Chmiel J, Steele G Jr, Osteen R. Cancer of the stomach. A patient care study by the American College of Surgeons. Ann Surg. 1993;218:583. [ Links ]
24. Siewert JR, Sendler A. Preoperative staging for gastric cancer. In: Holzheimer RG, Mannick JA, editors. Surgical Treatment: Evidence-Based and Problem-Oriented. Munich: Zuckschwerdt; 2001. Available from: http://www.http://www.ncbi.nlm.nih.gov/books/ NBK6869/. [ Links ]
25. Llorens Sabate P. Diagnóstico endoscópico del cáncer gástrico. Santiago de Chile: Editorial Saval.; 2001. p. 37-98. [ Links ]
26. Akahoshi K, Misawa T, Fujishima H, Chijiiwa Y, Maruoka K, Ohkubo A, et al. Preoperative evaluation ofgastric cancer by endoscopic ultrasound. GUT. 1991;32:479-82. [ Links ]
27. Arocena MG, Barturen A, Bujanda L, Casado O, Ramírez MM, Oleagoitia JM, et al. MRI and endoscopic ultrasonography in the staging of gastric cancer. Rev. esp. enferm. dig. 2006;98(8):582-90. [ Links ]
28. Papanikolaou I, Triantafyllou M, Triantafyllou K, Rosch T. EUS in the management of gastric cáncer. Ann Gastroenterol. 2011;24:9-15. [ Links ]
29. Polkowski M, Palucki J, Wronska E, Szawlowski A, Nasierowska A, Butruk E. Endosonography versus helical computed tomography for locoregional staging of gastric cáncer. Endoscopy. 2004:36(7):617-23. [ Links ]
30. Wen-Zhou W, Jie-Ping Y, Jun L, Chang-Sheng L, Xiao-Hua Z. Evaluation of contrast-enhanced helical hidro-CT in staging gastric cancer. World J Gastroenterol. 2005;11(29):4592-95. [ Links ]
31. Feussner H, Kraemer S, Siewert JR. Staging-Laparoskopie. Chirurg. 1997;68:201. [ Links ]
32. Jarufe N, Ibáñez L, Pérez G, Guzmán S. Laparoscopia y ultrasonografía laparoscópica en cáncer digestivo. Rev Chil Cir. 2002;54(1):65-71. [ Links ]
33. Biondi A. Seventh Edition of TNM Classification for Gastric Cancer. USA: American Joint Commission on Cáncer; 2011. [ Links ]
34. Washington K. 7th edition of the AJCC cancer staging manual: stomach. Ann Surg Oncol. 2010;17:3077-9. [ Links ]
35. Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma - 2nd english edition. Gastric cáncer. 1998;1:10-24. [ Links ]
36. Otero Regino W. Cáncer gástrico en Colombia: un diagnóstico tardío que amerita el compromiso del estado. Rev Col Gastroenterol. 2008;23(4):302-4. [ Links ]
37. Fujita S. Biology of early gastric carcinoma. Pathol Res Pract. 1978;163(4):297-309. [ Links ]
38. Hosokawa O, Tsuda S, Kidani E, Watanabe K, Tanigawa Y, Shirasaki S, et al. Diagnosis of gastric cancer up to three years after negative upper gastrointestinal endoscopy. Endoscopy. 1998;8:669-74. [ Links ]
39. Hamashima C, Shibuya D, Yamazaki H, Inoue K, Fukao A, Saito HH, et al. The Japanese Guidelines for Gastric Cancer Screening. Jpn J Clin Oncol. 2008;38(4):259-67. [ Links ]
40. Ministerio de salud. Guía Clínica Cáncer Gástrico. Santiago: MinSal; 2006. Serie Guías Clínicas MinSal Nº35. [ Links ]
41. Ministerio de salud y protección social, Instituto Nacional de Cancerología. Plan nacional para el control del cáncer en Colombia 2012-2020. Bogotá: MinSalud, INC; 2012. p.1-85. [ Links ]
42. Emura F, Mejía J, Mejía M, Osorio C, Hernández C, González I, et al. Utilidad de la cromoendoscopia sistemática en el diagnóstico del cáncer temprano y lesiones gástricas premalignas. Resultado de dos campañas masivas consecutivas de tamizaje en Colombia (2006-2007). Rev Col Gastroenterol. 2010;25(1):19-30. [ Links ]
43. R, Albis R, Ceballos J, Ospina J, Villamizar, Escobar J, et al. Evaluación de la concentración sérica de pepsinógeno como método de tamizaje para gastritis atrófica y cáncer gástrico. Rev Col Gastroenterol. 2003;18(2):73-7. [ Links ]
44. Camacho Olarte F. Enfoque quirúrgico actual del cáncer gastrointestinal. 1ª Ed. Bucaramanga: Ediciones Universidad Industrial de Santander; 2008. [ Links ]
45. Cuschieri A, Fayers P, Fielding J, Craven J, Bancewicz J, Joypaul V, et al. Postoperative morbidity and mortality after D1 and D2 resections for gastric cancer: preliminary results of the MRC randomised controlled surgical trial. The Surgical Cooperative Group. Lancet. 1996;347(9007):995-9. [ Links ]
46. Bonenkamp JJ, Hermans J, Sasako M, van de Velde CJ, Welvaart K, Songun I, et al. Extended lymph-node dissection for gastric cancer. N Engl J Med. 1999;340(12):908-14. [ Links ]
47. European Society for Medical Oncology. Gastric cancer: ESMO clinical practice guidelines for diagnosis, treatment and followup. Ann Oncol. 2010;21 Supl 5:50-4. [ Links ]
48. Maruyama K, Okabayashi K, Kinoshita T. Progress in gastric cancer surgery in Japan and its limit of radicality. World J Surg. 1987;11:418-25. [ Links ]
49. Noguchi Y, Imada T, Matsumoto A, Coit DG, Brennan MF. Radical surgery for gastric cancer: a review of the Japanese experience. Cancer. 1989;64:2053-62. [ Links ]
50. Japanese Research Society for Gastric Cancer. Treatment results of gastric carcinoma in Japan, 39th report of nation-wide registry in 1979-1982. Tokyo: Kanehana Publishers; 1995. [ Links ]
51. Japanese Gastric Cancer Society. Guidelines for diagnosis and treatment of carcinoma of the stomach. 2004 April. [ Links ]
52. Japanese Gastric Cancer Association. JGCA gastric cancer treatment guidelines. 1ª ed. 2001 March. [ Links ]
53. National Comprehensive Cancer Network. Gastric cancer. Clinical guidelines in oncology. Version 2. NCCN; 2011. [ Links ]
54. National Comprehensive Cancer Network. Gastric cancer. Clinical guidelines in oncology. [ Links ]
55. Cunningham D, Allum WH, Stenning SP, Thompson J, Chir M, Cornelis J, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355:11-20. [ Links ]
56. Buergy D, Lohr F, Baack T, Siebenlist K, Haneder S, Michaely H, et al. Radiotherapy for tumors of the stomach and gastroesophageal junctio- a review of its role in multimodal therapy. Radiat Oncol. 2012;7(1):192. [ Links ]