Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicas UIS
Print version ISSN 0121-0319
Medicas UIS vol.27 no.3 Bicaramanga Sep./Dec. 2014
Eventos adversos y complicaciones del
tratamiento antineoplásico administrados
durante la infancia
Silvia Cristina Martínez Rueda*
Ernesto Rueda Arenas**
* Residente de III año de Pediatría. Departamento de Pediatría. Escuela de Medicina. Facultad de Salud. Universidad Industrial de Santander. Bucaramanga. Santander. Colombia.
** Médico Hemato-oncólogo Pediatra. Hospital Universitario de Santander. Profesor asociado. Universidad Industrial de Santander. Bucaramanga. Santander. Colombia.
Correspondencia: Silvia Cristina Martínez Rueda. Dirección: Autopista Floridablanca 144-114. Villa Firenze Torre I Apto. 101 Floridablanca. Santander. Colombia. Correo electrónico: criss_0704@hotmail.com.
Artículo recibido el 9 de marzo de 2014 y aceptado para publicación el 8 de septiembre de 2014.
RESUMEN
El cáncer infantil es una enfermedad crónica potencialmente mortal, la cual representa un gran impacto no solo para los pacientes, sino para su familia. El niño con cáncer debe enfrentarse al impacto emocional, físico, social, psicológico y a los efectos de la enfermedad y su tratamiento. Se considera que uno de cada 640 adultos jóvenes entre las edades de 20 y 39 años presentaron cáncer en su infancia, esto sumado al aumento de sobrevida debido a los tratamientos actuales, hace que las complicaciones que se puedan presentar en el tratamiento o por su enfermedad sean un marcador de morbimortalidad a largo plazo. Por tal motivo, el niño con cáncer debe hacer frente a los cambios adquiridos y a las complicaciones de la enfermedad y su tratamiento. Todos estos factores pueden poner en peligro la calidad de vida del niño con diagnóstico de cáncer y hacer más difícil el cumplimiento del régimen de terapia antineoplásica propuesto. El objetivo de este artículo es hacer una revisión de las principales complicaciones y efectos adversos que pueden ocurrir en pacientes que son sometidos a tratamientos antineoplásicos detallando las complicaciones por sistemas, las complicaciones propias de los medicamentos y los eventos adversos ocurridos por la atención a estos pacientes. MÉD.UIS. 2014;27(3):77-88.
Palabras Clave: Protocolos antineoplásicos. Oncología por radiación. Metástasis de la neoplasia. Neoplasia residual. Invasividad neoplásica. Quimioterapia. Neutropenia febril.
Adverse events and complications of antineoplastic treatment administered during
childhood
ABSTRACT
Childhood cancer is a life-threatening chronic disease, which represents a great impact not only for patients, but for their family. The child with cancer must face the emotional, physical, social, and psychological effects of the disease and its treatment impact. It is believed that 1 in every 640 young adults between the ages of 20 and 39 years had cancer in their infancy, this added to increased survival due to current treatments, causes complications that may arise in the treatment or their disease be a marker of long-term morbidity. Therefore children with cancer must face the acquired changes and complications of the disease and its treatment. All these factors can impair the quality of life of children with cancer diagnosis and ensure implementation of the proposed scheme antineoplastic therapy more difficult. The aim of this article is to review major complications and side effects that can occur in patients who are undergoing cancer treatments detailing complications systems, the complications of drugs and adverse events that occurred in the care of these patients. MÉD.UIS. 2014;27(3):77-88.
Keywords: Antineoplastic protocols. Radiation oncology. Neoplasm metastasis. Neoplasm, Residual. Neoplasm invasiveness. Drug therapy. Febrile neutropenia.
¿Cómo citar este artículo?: Martínez S, Rueda E. Eventos adversos y complicaciones del
tratamiento antineoplásico administrados durante la infancia. MÉD.UIS. 2014;27(3):77-88.
INTRODUCCIÓN
El cáncer infantil es una enfermedad crónica potencialmente mortal, de gran impacto no solo para los pacientes, sino también para su familia. Se trata de una experiencia traumática para el niño, debido a los numerosos procedimientos invasivos, dolorosos y cambios físicos, producto de las complicaciones de su enfermedad y de los eventos adversos en el tratamiento o el cuidado de estos pacientes1.
En los Estados Unidos, la incidencia anual de cáncer expresada en casos por millón de habitantes pediátricos, asciende a 137, en Inglaterra a 109, en Italia a 141, en Dinamarca a 138, en Cali a 147,9, en el área metropolitana de Bucaramanga para los años 2003 a 2007 fue de 140,2 casos por millón en menores de 15 años2. En cuanto a la mayor frecuencia de presentación se encontró en primer lugar las leucemias, seguido de los tumores del sistema nervioso central en un 17% y linfomas en un 16% con hallazgos similares a lo reportado para los países latinoamericanos y en Cali, leucemias (40,7%), tumores del sistema nervioso central (17,3%) y linfomas (14%)2.
De acuerdo con el informe del Institute of Medicine, se producen un millón de eventos adversos anualmente en Estados Unidos, de los cuales entre 44 000 y 98 000 tienen consecuencias fatales. Estos eventos adversos son producto de la atención de pacientes hospitalizados, algunos ejemplos son errores de medicación o de transfusiones sanguíneas, infecciones hospitalarias, cirugías equivocadas entre pacientes o de localización, caídas y confusiones diagnósticas o terapéuticas. Todos estas situaciones adversas son prevenibles y sumados al gran número de complicaciones propias de la enfermedad oncológica hace un panorama sombrío para estos pacientes3.
El período de enfermedad y los cambios físicos y emocionales son factores estresantes para los niños y sus familiares, quienes deben adaptarse a un entorno hospitalario y deben cumplir con terapias antineoplásicas que con frecuencia causan problemas en la familia, en el ambiente social y en la vida escolar al separar al niño de los hermanos, amigos y compañeros1. Por eso el paciente oncopediátrico debe hacer frente al impacto emocional, físico, social, psicológico y a los efectos de la enfermedad y su tratamiento ya que pueden poner en peligro la calidad de vida del niño con diagnóstico de cáncer1.
Los principales manejos terapéuticos incluyen los protocolos de quimioterapia, radioterapia o en algunos casos procedimientos quirúrgicos, la elección del tratamiento depende del tipo de cáncer diagnosticado, la recurrencia, el estadiaje y la edad del paciente. Secundario a estos manejos se pueden presentar complicaciones en todos los sistemas incluyendo piel y faneras, riñones, hígado, corazón, órganos de los sentidos, entre otros.
El objetivo de este artículo es hacer una revisión de las principales complicaciones y efectos adversos que pueden ocurrir en pacientes pediátricos que son sometidos a tratamientos antineoplásicos y a través de ese conocimiento plantear la posibilidad de realizar un proyecto de investigación que describa los efectos adversos y complicaciones de una cohorte de pacientes que reciban tratamiento contra el cáncer. Teniendo en cuenta lo anterior, es importante tener claro los conceptos de complicación y de evento adverso. Una complicación es un problema que se presenta durante el curso de una enfermedad o después de un procedimiento o tratamiento; puede deberse a la enfermedad, o ser secundaria al manejo instaurado4. Por otro lado, el evento adverso es una lesión o complicación no intencional consecuencia del cuidado de la salud y no de la enfermedad misma del paciente4.
Para la revisión se utilizaron la bases de datos de Medline , Pubmed y Ovid . Las palabras claves fueron definidas teniendo en cuenta los descriptores en ciencias de la salud: DeCS para palabras clave: Cáncer, Protocolos antineoplásicos, Neoplasias, Oncología por radiación, Metástasis de la neoplasia, Neoplasia residual, Invasividad neoplásica, Quimioterapia y MeSH para las keywords: Pediatric oncology, Advanced cáncer, Adverse events, Drug therapy, Febrile neutropenia, Cáncer.
Frecuencia del cáncer pediátrico
El cáncer sigue siendo la principal causa de muerte en los niños, solo superada por los accidentes5. Actualmente, casi el 75% de los niños diagnosticados con cáncer en la infancia, sobreviven a la enfermedad. Pese a esto, los pacientes pediátricos con cáncer tienen mayor riesgo de complicaciones que amenazan su vida, posiblemente debidas a la enfermedad subyacente y al tratamiento intensivo contra el cáncer6.
La incidencia anual de cáncer expresada en casos por millón de habitantes en el área metropolitana de Bucaramanga para los años 2003 a 2007 fue de 140,2 casos por millón en menores de 15 años2. El grupo con mayor número de casos corresponde a los menores de cinco años, seguido por el grupo de cinco a nueve años, en la distribución por sexos la neoplasia más frecuente fue la leucemia que afecta con mayor frecuencia a los varones; estos datos recopilados de un estudio publicado en la revista Med UNAB acerca de cáncer infantil en el área metropolitana de Bucaramanga, Colombia, entre el 2003 a 20072. Al revisar la frecuencia de tipos de cáncer en Colombia, según los datos de globocan 2012, se encontró una distribución por sexo de la siguiente forma, para los hombres los cinco canceres más frecuentes son próstata, estomago, pulmón, colon y recto y linfoma no Hodking, para mujeres son mama, cérvix, colon y recto, estómago y tiroides, esta distribución es en adultos y no tiene en cuenta la edad pediátrica, además también reporta mayor frecuencia de presentación de cáncer en mujeres, a diferencia de la edad pediátrica en la que es más frecuente en los varones7. En los niños los tumores del sistema nervioso central ocupan el segundo lugar por su frecuencia dentro de todas las neoplasias infantiles, solo por debajo de las leucemias y son los tumores sólidos más frecuentes en menores de 15 años. La incidencia anual en la población europea y norteamericana es de tres por cada 100 000 habitantes menores de 15 años, con una relación de un hombre por cada dos mujeres8.
Se estima que hay 328 000 niños sobrevivientes de cáncer en los Estados Unidos, y que uno de cada 640 adultos jóvenes entre las edades de 20 y 39 años, presentó cáncer en su infancia6. Esta población cada vez mayor, es un testimonio de los enormes avances logrados por las modernas terapias contra el cáncer y el adelanto alcanzado en el desarrollo de los cuidados de soporte como lo son la medicina transfusional, antibioticoterapia, etc6.
Del 30 al 35% del cáncer infantil es debido a leucemia y de esas el 75% equivale a Leucemia Linfoide Aguda (LLA), considerándose la enfermedad maligna más frecuente en pediatría. Sin embargo, el pronóstico de la LLA ha tenido una mejoría significativa en los últimos 50 años, teniendo antes mortalidad de casi el 100% en las décadas del 50 y 60 a porcentajes de sobrevida que en algunos sitios puede alcanzar más del 90%9. Lo anterior se ha logrado gracias a una adecuada clasificación de riesgo de recaída tumoral que ha permitido optar por tratamientos de quimioterapia con mayor intensidad dando como resultado mejoría en la sobrevida global y mayor porcentaje de éxito al tratamiento10.
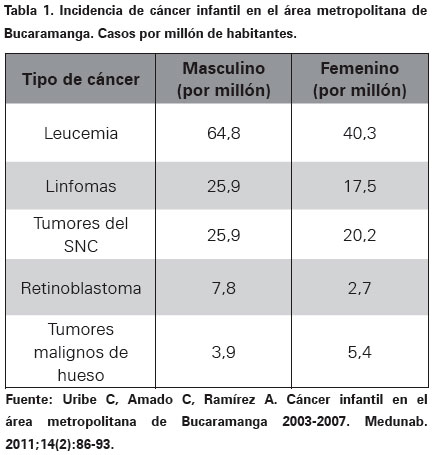
Entre los pacientes sobrevivientes de cáncer se puede presentar una segunda neoplasia en 6 al 10% de los casos. Esto se presenta entre la cuarta y la quinta década de la vida11. De acuerdo al Registro Poblacional de Cáncer de Bucaramanga y el área metropolitana del 2003 al 2007 la frecuencia de presentación de los diferentes cánceres en la edad pediátrica es como se muestra en la Tabla 12.
Efectos del manejo antineoplásico
Los múltiples esquemas terapéuticos y la intensidad de dosis intravenosas hacen que los pacientes oncológicos en su mayoría en algún momento del tratamiento deban usar catéteres implantables, ya sea para manejo y cumplimiento del esquema antineoplásico o para manejo de alguna complicación propia de su inmunosupresión, secundariamente esto puede generar que se vean favorecidas algunas enfermedades infecciosas por la utilización de estos catéteres12.
Otro grupo importante a tener en cuenta son las complicaciones que se presentan con el uso de medicamentos, como por el ejemplo las alteraciones de la hemostasia que se han observado con frecuencia en los paciente con LLA y leucemia promielocítica además de los accidentes tromboembólicos documentados en los niños que reciben asparaginasa como agente único o en combinación con vincristina, esteroides y antraciclinas13.
Las reacciones adversas medicamentosas figuran como una de las diez causas principales de muerte y enfermedad en el mundo en desarrollo9. En la terapia contra el cáncer, el 40% de los pacientes tratados sufren efectos indeseables graves que amenazan la vida o generan incapacidad permanente a largo plazo; estas a menudo son más frecuentes y más graves en los niños14.
En pacientes con LLA, se han evidenciado complicaciones tardías que aumentan el riesgo de morbimortalidad prematura y a menudo son debidas a enfermedades cardíacas o vasculares15. Los sobrevivientes de leucemia tienen un riesgo elevado de infarto de miocardio, insuficiencia cardíaca congestiva y enfermedad pericárdica en relación con una persona que no haya presentado LLA. Todos los sobrevivientes también tienen mayor riesgo de obesidad y trastornos metabólicos15 y además de esto, la terapia con radiación en niños de tres y cuatro años incrementa el riesgo de cáncer de tiroides en un 1 a 7%, después de los 10 a 30 años de tratamiento16.
El aumento en la detección de mayor número de casos se debe a la presencia de sofisticados instrumentos que hacen un diagnóstico oportuno, lo que genera un aumento en la supervivencia y mayor riesgo de tratamientos prolongados así como aparición de complicaciones y recaídas propias de su enfermedad lo que conlleva a una gran población de sobrevivientes con alteraciones físicas, psicológicas, sociales, educativas y profesionales a corto, mediano y largo plazo17.
Los adultos sobrevivientes de cáncer infantil tienen mayor riesgo de desarrollar enfermedades cerebrales y cardiovasculares. Por consiguiente, es importante identificar los factores predisponentes del síndrome metabólico en los sobrevivientes para introducir medidas y disminuir el riesgo de morbimortalidad18. Las complicaciones y eventos adversos antes mencionados, son algunos ejemplos de los sistemas que pueden estar involucrados generando gran morbilidad en estos niños.
Sistema cardiovascular
La enfermedad cardiovascular es la causa no maligna más frecuente de muerte en sobrevivientes de Linfoma Hodgkin (LH). La radioterapia en el mediastino de estos pacientes con LH se ha asociado con la aterosclerosis acelerada así como también la quimioterapia puede conducir a insuficiencia cardíaca no isquémica. Los factores de riesgo cardíacos tradicionales, como la hiperlipidemia, la hipertensión, la diabetes mellitus y el tabaquismo, contribuyen aún más al riesgo de la enfermedad cardíaca en sobrevivientes de LH, siendo de gran importancia el control de estos factores de riesgo en los sobrevivientes a largo plazo19.
Un estudio canadiense de seguimiento a largo plazo luego del diagnóstico de LH en adultos demostró que en pacientes con enfermedad cardíaca preexistente había un riesgo de más del 20% de posibilidad de hospitalización por cardiopatía en pacientes tratados con radioterapia mediastinal asociado a doxorubicina que en los tratados con este último medicamento solo20. Adicionalmente, en pacientes tratados para LH a los 40 años de edad, con radioterapia mediastinal y doxorubicina, el riesgo de hospitalización por enfermedad cardíaca de mujeres y hombres es 5 y 15% mayor que el esperado respectivamente21. Estos dos estudios de seguimiento a largo plazo en adultos con diagnóstico de LH sugieren que el riesgo de enfermedad cardiaca en pacientes con LH es mayor cuando el tratamiento recibido fue combinado que con radioterapia exclusivamente22.
Las complicaciones cardíacas en el resto de pacientes oncológicos, no solo en el LH, están relacionadas con la radioterapia incluyendo enfermedad pericárdica, disfunción valvular, arritmias, cardiomiopatía y enfermedad coronaria. En comparación con la población normal, los sobrevivientes de LH han demostrado de tres a cinco veces más riesgo de enfermedad coronaria en los primeros 10 años del tratamiento, persistiendo hasta 25 años después de finalizado el tratamiento22.
La cardiopatía relacionada con antraciclinas se produce al alterar irreversiblemente la energética de los cardiomiocitos al cambiar la producción de ATP intracelular lo que con llevaría a una alteración de la contracción cardíaca23. Esta cardiomipatía puede manifestarse de tres formas: la forma aguda es poco frecuente y generalmente aparece durante la utilización del medicamento, clínicamente puede ocasionar desde taquicardia supraventricular hasta arritmia ventricular y muerte súbita; otra forma es la subaguda, esta generalmente aparece tres a ocho meses después de la última dosis del medicamento y se manifiesta como insuficiencia cardiaca congestiva por miocardiopatía dilatada; la tercera forma de cardiopatía es la tardía o crónica aparece después de 5 años de terminado el tratamiento y su manifestación clínica es la de insuficiencia cardíaca congestiva asociada también a miocardiopatía dilatada22,23. El riesgo de tromboembolismo esta aumentado en niños, cuyos protocolos antineoplásicos incluyen dexametasona o prednisona más aparaginasa, por tal motivo se deben tener en cuenta los factores de riesgo y las modalidades de tratamiento en el riesgo de tromboembolismo en los niños con LLA13.
Informes recientes del Childhood Cancer Survivor Study, indican que además de un mayor riesgo de muerte por enfermedades del corazón, los sobrevivientes de leucemia tienen un riesgo elevado de infarto de miocardio, insuficiencia cardíaca congestiva y enfermedad pericárdica24. Todos los sobrevivientes también tienen un mayor riesgo de obesidad, trastornos metabólicos, debilidad muscular y daño neurosensorial24. Los datos del mismo estudio revelan que casi tres cuartas partes de los adultos sobrevivientes de cáncer pediátrico sufren condiciones de salud crónicas y que el riesgo de muerte cardíaca fue más de ocho veces superior al esperado para el grupo de edad, por tal motivo es importante realizar un adecuado monitoreo y protección cardíaca en niños con tratamiento antineoplásico24.
Debido a esta problemática se han incrementado las medidas profilácticas que ayuden a evitar estas alteraciones cardíacas y el único compuesto encontrado como protector de las enfermedades cardiacas a largo plazo es el dexrazoxane por lo que en los niños tratados con altas dosis de doxorubicina para la LLA, la administración concomitante de Dexrazoxane genera como resultado una menor elevación de la troponina durante la terapia antineoplásica24,25.
Por otro lado, la Hipertensión Arterial (HTA) es una enfermedad poco frecuente en los niños con una prevalencia estimada del 2% en los recién nacidos y entre 1% y 2% de los niños en general. En oncología pediátrica la HTA se observa principalmente en el contexto de la presencia de un neuroblastoma, tumor de Wilms, feocromocitoma y de tumores cerebrales25. Diversos mecanismos pueden estar involucrados: la secreción de renina por el tumor, la proximidad del tumor al parénquima renal que pudiera comprimir un vaso renal, la trombosis arterial o venosa y la secreción de catecolaminas o glucocorticoides como causantes de HTA en niños con cáncer26,27.
Sistema pulmonar
En la fase aguda y subaguda, los pacientes con cáncer pueden desarrollar neumonitis por radiación y toxicidad pulmonar por bleomicina. Los sobrevivientes a largo plazo tienen riesgo de complicaciones pulmonares como fibrosis pulmonar, bronquiectasias, derrames pleurales crónicos y neumonía recurrente. Además la función pulmonar se reduce afectando la calidad de vida26. La radioterapia y quimioterapia generan lesión en los neumocitos tipo II, en las células endoteliales, fibroblastos y macrófagos. En la clínica se evidencia tos, cianosis, disnea, dolor pleurítico y fiebre y en la radiografía de tórax se pueden encontrar infiltrados y disminución del volumen pulmonar28,29.
Sistema endocrinológico
Nuevas terapias para el cáncer infantil han aumentado el número de sobrevivientes a largo plazo. Sin embargo, estos tratamientos están asociados con morbilidad a corto y largo plazo, incluyendo deficiencias endocrinas. Los sobrevivientes al cáncer tienen riesgo de disfunción del hipotálamo-hipófisis, obesidad, insuficiencia gonadal, osteoporosis y enfermedad de la tiroides16-18. La obesidad y otros factores de riesgo cardiovascular como la diabetes, la hipercolesterolemia y la HTA pueden ser efectos del cáncer infantil mediados por disfunción hormonal18.
La prevalencia del síndrome metabólico, especialmente de resistencia a la insulina, obesidad y dislipidemia se aumenta en los adultos sobrevivientes de cáncer infantil teniendo mayor riesgo de desarrollar enfermedades cerebrovasculares y cardiovasculares18. Por consiguiente, es importante identificar los factores predisponentes del síndrome metabólico en los sobrevivientes para introducir intervenciones médicas que puedan evitar estos desenlaces.
Otra complicación importante asociada a la quimioterapia y a los medicamentos utilizados es la disminución de la masa ósea y en consecuencia fracturas secundarias a osteoporosis30. También, cualquier tratamiento que afecte el eje hipotálamo o la función pituitaria puede conducir a la pérdida de secreción de andrógenos, cortisol y disminución de la secreción de la hormona del crecimiento, lo que puede generar panhipopituitarismo y pubertad precoz o retrasada31. La susceptibilidad del parénquima tiroideo a las radiaciones, incrementa el riesgo de desarrollar nódulos benignos o malignos. La radiación aumenta la secreción de la hormona estimulante de tiroides de forma crónica lo que con lleva a la aparición de nódulos tiroideos16,32.
Entre el 30 y el 60% de los sobrevivientes de LH experimentarán disfunción tiroidea con hipotiroidismo generalmente después de la irradiación del cuello. Aunque la mayoría de los casos se presentan dentro de los primeros cinco años después del tratamiento, su aparición puede retrasarse más allá de 10 años. Las dosis más altas de radioterapia se asocian con un mayor riesgo16,32.
Sistema gastrointestinal
La quimioterapia se asocia con numerosas consecuencias adversas incluyendo síntomas gastrointestinales tales como náuseas, vómitos y estreñimiento y en algunas ocasiones diarrea de componente infeccioso y a medicamentos33.
En cuanto al estreñimiento agudo, un estudio realizado en la ciudad de New Haven por la Universidad de Yale y publicado en el 2011, encontró que el 57% de niños que reciben quimioterapia para el cáncer presentaban como complicación estreñimiento agudo. Los niños que recibían tanto vincristina como opiáceos presentaban alto riesgo de desarrollar estreñimiento. En este mismo artículo se realizó una revisión sistemática de 18 estudios informando una prevalencia de estreñimiento infantil de 0,7% a 29,6% teniendo un aumento de 57% posterior a quimioterapia33.
Por su parte la mucositis consiste en la inflamación y lesión de la mucosa del tracto digestivo altamente sensible a los efectos de la quimioterapia al ser células con alto grado de fracción de crecimiento, se relaciona con la localización del tumor, el régimen de quimioterapia, el grado de mielodepresión y estado nutricional. La incidencia de mucositis oral y gástrica en pacientes sometidos a quimioterapia es del 5 al 15%34,35.
Sistema neurológico
Los efectos neurocognitivos suelen aparecer en los primeros dos años después de finalizado el tratamiento. Sin embargo, el grado de déficit neurológico difiere según factores individuales y asociados a la terapia farmacológica utilizada. Entre los factores de riesgo documentados se incluyen altos niveles de radiación al sistema nervioso central, menor edad del diagnóstico, ubicación del tumor, el tipo de histología y las complicaciones periquirúrgicas36. Además se ha asociado el uso de vinblastina y vincristina con daño neurológico periférico14.
Aproximadamente un tercio de los niños tratados con cáncer tienen dificultades académicas que requieren educación especial. Concomitantemente los problemas de aprendizaje persisten luego de suspender el tratamiento8,31. Estas dificultades cognitivas pueden tener un impacto negativo en la autoestima y funcionamiento social debido al pobre desempeño académico en comparación con otros niños de la misma edad37.
La neuroimágen detecta la leucoencefalopatía precoz y las calcificaciones que aparecen tardíamente en la sustancia gris cortical y en los ganglios basales, siendo éstos los principales cambios cerebrales asociados al tratamiento de los tumores cerebrales en la infancia8. En los niños con LLA que recibieron radioterapia, con o sin metrotexate intratecal, se ha observado además una dilatación ventricular y de los espacios subaracnoideos. Los supervivientes de tumor tienen un riesgo 17 veces mayor que los controles de sufrir deficiencias auditivas, 14 veces mayor de alteraciones visuales, alteraciones de la coordinación en el 49%, alteraciones motoras en el 26%, y el 25% presentaron convulsiones a largo plazo8.
Efectos psicológicos
El cáncer infantil genera una experiencia traumática para el niño que debe enfrentarse a numerosos factores de estrés, como procedimientos dolorosos e invasivos31. El período de enfermedad y tratamiento es física y emocionalmente agotador para los niños y las familias que deben adaptarse a un entorno hospitalario. El cáncer conduce a una alteración en los campos familiar, social y escolar37. Separar al niño de los hermanos, amigos y compañeros de escuela puede ser frustrante y generar problemas para relacionarse con sus pares. El dolor somático, así como la falta de energía y el miedo a lo desconocido, puede comprometer la calidad de vida de los niños con cáncer17,37.
El diagnóstico de cáncer en la infancia provoca problemas psicológicos que pueden afectar el desarrollo psíquico y social de los adultos jóvenes sobrevivientes al cáncer, se pueden presentar miedos intensos secundarios a recuerdos del acontecimiento traumático, entumecimiento y la evitación de sitios o lugares asociados a eventos vividos junto con deterioro laboral y social, cumpliendo así los criterios para el trastorno de estrés postraumático17,37. Las estimaciones de prevalencia del trastorno de estrés postraumático en pacientes con cáncer y supervivientes varían de 2,5 a 20%38.
Sistema reproductivo
La cirugía, la radioterapia o la quimioterapia afectan negativamente cualquier componente del eje hipotálamo-hipófisis-gonadal pudiendo comprometer la reproducción en los sobrevivientes de cáncer infantil39. Las células de Leydig son más resistentes al daño por radiación que el epitelio germinal. La producción de espermatozoides y de óvulos se reduce después de la radiación, de forma directamente proporcional con la dosis utilizada40.
Los tumores germinales gonadales y extragonadales representan sólo el 1% de los tumores primarios en los niños menores de 15 años y sólo el 10% de cáncer primario en los adolescentes y adultos entre los cinco a 29 años. La orquiectomía u ooforectomía realizadas para el tratamiento de estos cánceres infantiles relativamente poco frecuentes pueden reducir números de células germinales39.
Notablemente, la adición de quimioterapia puede evitar la necesidad de resección quirúrgica, pero también puede aumentar el riesgo de infertilidad, especialmente si los agentes alquilantes están presentes en el régimen. Los agentes alquilantes incluyen medicamentos como mecloretamina, las oxazafosforinas (ciclofosfamida e ifosfamida), clorambucil, melfalán, las nitrosoureas (lomustina y carmustina), busulfán y procarbazina. Estos agentes dañan el ADN e inducen la apoptosis a través de la unión covalente de los grupos alquilo a macromoléculas celulares40.
Sistema hematológico
En el sistema hematológico se evidencian complicaciones dadas por trombocitopenia, tales como sangrado y aparición de hematomas con facilidad en sitios tan frecuentes como encías y nariz o sangrado profuso a nivel de cualquier órgano. La hiperleucocitosis se define como una cifra de leucocitos superior a 100 000/mm3 siendo un factor de alto riesgo de recaída y pobre respuesta a la quimioterapia en LLA. También se puede presentar neutropenia febril, siendo una de las complicaciones más frecuentes de la terapia citotóxica y se constituye en una de las principales emergencias oncológicas vistas en pediatría41. Cerca de la mitad de los pacientes con neutropenia febril tiene una infección establecida u oculta, y alrededor del 10% al 30% tienen bacteriemia. Se piensa que el riesgo de infección bacteriana grave es inversamente proporcional al conteo de neutrófilos. Distintos factores predisponen al desarrollo de una infección; siendo la neutropenia por sí misma, el principal factor de riesgo. Además del número de neutrófilos circulantes, la tasa de disminución del conteo absoluto de neutrófilos y la duración de la neutropenia son factores determinantes42.
Sistema urinario
La cistitis hemorrágica es una de las complicaciones que pueden surgir con el uso de algunos citostáticos y se caracteriza por la ulceración parcial o total de la mucosa vesical, causada por la acroleína, un metabolito de la ifosfamida o ciclofosfamida. Para disminuir su presentación se realiza hiperhidratación 12 horas antes y se administra mesna para favorecer la eliminación de la acroleína y prevenir la presentación de cistitis hemorrágica. La afectación de la mucosa vesical contribuye a la formación de cálculos renales de ácido úrico43.
Cuando ocurre invasión tumoral al sistema colector ocurre la hematuria. Se observa en casi el 40% de los pacientes con compromiso renal maligno. Dependiendo del compromiso e infiltración renal, se presentará insuficiencia renal aguda o crónica con hipertensión arterial secundaria48. Puede palparse una masa abdominal la cual es generalmente firme, homogénea, no dolorosa y se mueve con la respiración. Al examen físico se encuentra varicocele, la mayoría de los cuales son del lado izquierdo, el cual se observa hasta en el 11% de los hombres con carcinoma de células renales43.
Estado nutricional
El estado nutricional de los pacientes oncopediátricos es clínicamente importante, ya que se puede generar mayor predisposición a infecciones en niños desnutridos debido al estado de inmunosupresión que acompaña la malnutrición44. La mayoría de los niños con LLA tienen un aumento en el peso y la talla al finalizar la quimioterapia. No obstante, algunos niños tienen baja estatura permanente por el riesgo de daño del eje hipotálamo hipofisario y por consiguiente disminuyen concentraciones de la hormona del crecimiento44. Los niños sobrevivientes de cáncer tienen mayor riesgo de obesidad, síndrome metabólico y factores de riesgo para enfermedad coronaria en la adultez en un 23% comparado con los de la misma edad sin antecedente de cáncer31.
Síndrome de lisis tumoral
Se produce por la destrucción masiva de células neoplásicas con un alto índice de proliferación y liberación de su contenido a la circulación. Los factores que predisponen a su aparición son grandes masas tumorales o leucocitosis mayores a 100 000, altas concentraciones de Lactato deshidrogenasa y uratos antes de empezar el tratamiento, así como una diuresis escasa o una mala función renal previa. Se caracteriza por hiperuricemia mayor de 6,5 mg/dL, hiperpotasemia mayor de 5,5 mEq/L, e hiperfosfatemia mayor de 6,5 mg/dL. Suele presentarse después de iniciar el tratamiento citotóxico, habitualmente en las primeras 12 a 72 horas, pero también puede presentarse de forma espontánea. La morbilidad generada por esta complicación radica en la sospecha y tratamiento oportuno para evitar que se presente y cause afectación al paciente45.
Dolor
El dolor es un síntoma y una complicación muy frecuente cuya frecuencia depende del tipo de cáncer, de su localización y de la clasificación de estado, siendo más frecuente cuando hay compromiso a distancia o metástasis. Se puede presentar dolor óseo en el 21 al 33% de los casos de leucemia, principalmente en articulaciones, pudiendo ser confundido con enfermedades reumatológicas46.
Piel y anexos
Es habitual observar oscurecimiento de la piel con aspecto manchado y sequedad. Durante la administración de ciertos fármacos también pueden aparecer signos de intolerancia o afectación como el rash cutáneo, prurito o dermatitis exfoliativa.
La complicación cutánea más frecuente durante el manejo con quimioterapia y radioterapia es la alopecia, que suele mejorar al culminar el tratamiento, pero en algunos casos puede ser permanente con dosis altas de radioterapia47.
Complicaciones infecciosas
Los pacientes pediátricos con cáncer tienen un mayor riesgo de enfermedades infecciosas que amenazan la vida. La mayoría de estas infecciones son provenientes del torrente sanguíneo, más a menudo asociado con un catéter venoso central y están relacionadas a infecciones nosocomiales48.
Los gérmenes que con mayor frecuencia causan infección en los niños con cáncer son estafilococos catalasa negativo como el estafilococo epidermidis, el saprofiticus, el aureus; el estreptococo viridans, escherichia coli, Klebsiella pneumoniae, pseudomona aeruginosa, enterobacter o acinetobacter, así como las infecciones por hongos siendo más frecuente la candidiasis48.
Los gérmenes que con mayor frecuencia causan infección en los niños con cáncer son estafilococos catalasa negativo como el estafilococo epidermidis, el saprofiticus, el aureus; el estreptococo viridans, escherichia coli, Klebsiella pneumoniae, pseudomona aeruginosa, enterobacter o acinetobacter, así como las infecciones por hongos siendo más frecuente la candidiasis48.
Las infecciones por hongos representan una complicación importante en pacientes con cáncer, en particular en aquellos con leucemia o sometidos a trasplante de células madre hematopoyéticas10. La elevada mortalidad en los pacientes con infección por aspergillus invasiva u otras micosis diseminadas, hacen que la profilaxis antifúngica contribuya a una mayor tasa de éxito en la prevención de estas infecciones a menudo fatales en pacientes inmunosuprimidos49.
Las infecciones respiratorias virales equivalen al 44% de los episodios febriles en los pacientes de oncología, siendo el rinovirus el 22% de los casos, el virus sincitial respiratorio el 11% además del virus de la parainfluenza y el adenovirus entre otros50. Los pacientes oncológicos presentan una especial susceptibilidad a sufrir infecciones potencialmente graves. Ello depende de diferentes factores de riesgo como puede ser la alteración de barreras cutáneas y mucosas; sin embargo, el principal factor de riesgo es la presencia de neutropenia que puede generar complicaciones. Entre las más frecuentes está la fiebre como marcador de un proceso infeccioso incipiente48.
Los niños también pueden tener fiebre como síntoma cardinal de su enfermedad. Una fiebre prolongada, recurrente, sin mejoría y sin sospecha de que se acompañe de un proceso infeccioso debe alarmar al clínico a pensar que se trate de una neoplasia, entre otros diagnósticos diferenciales5. De ahí la gran importancia de determinar el origen de la fiebre, su forma de presentación para definir los estudios pertinentes y el manejo a instaurar. Los síntomas constitucionales como pérdida de peso, astenia, adinamia, fiebre y sudoración nocturna, pueden estar presentes tanto en las neoplasias como en los procesos infecciosos. Al examen físico, se pueden encontrar linfoadenopatías, que en los procesos infecciosos pueden ser dolorosas y móviles a diferencia a las que se presentan en las neoplasias, las cuales son duras, inmóviles y sin dolor, pudiendo ser esto una herramienta importante al definir la etiología de un proceso febril5.
Complicaciones asociadas a medicamentos
Una de las importantes limitaciones de los quimioterápicos es la toxicidad, la cual se explica por su mecanismo de acción el cual interfiere con el ciclo celular de todas las células del organismo, especialmente aquellas que tienen una gran multiplicación celular como es el sistema hematopoyético. Su alteración da como resultado anemia, neutropenia y trombocitopenia, en el sistema digestivo puede ocurrir mucositis, diarrea y tiflitis, en la piel alopecia, dermatitis y en las gónadas después de la pubertad esterilidad31.
También son afectados otros sistemas u órganos tales como el riñón, debido a medicamentos como los derivados del platino, metotrexato y ciclofosfamida, el hígado por metotrexato, mercaptopurina y nitrosureas. Las antraciclinas afectan el miocardio, el pulmón se encuentra lesionado por bleomicina y metotrexato, el sistema nervioso central por vincristina, aracytin, metotrexato y el oído por cisplatino. Estas complicaciones pueden estar presentes en más del 95% de los pacientes14.
Los efectos tardíos en el corazón comúnmente se manifiestan como una disminución en la función cardíaca global resultante de lesión miocárdica14. De inicio tardío, se presenta la cardiotoxicidad crónica progresiva a la antraciclina, definida como la enfermedad que ocurre después del primer año de supervivencia, se debe al deterioro progresivo, incluyendo adelgazamiento de la pared, la dilatación del ventrículo izquierdo y la disminución de contractilidad. Este descenso es consecuencia directa de los daños durante el tratamiento23.
Las antraciclinas pueden causar efectos adversos como mucositis, alopecia, supresión de la medula ósea, náuseas y vómito pese a esto la mayor complicación es la cardiotoxicidad. Existe una relación lineal entre el aumento de la dosis y la presencia de cardiotoxicidad, teniendo en cuenta que con dosis de 500 mg/m2 es del 25% y con dosis mayores de 800 mg/m2 es del 100%. Puede existir tres formas de presentación: aguda, durante la administración del medicamento o minutos después como hipotensión y vasodilatación; la forma subaguda dada por pericarditis o micocarditis en los días siguientes a la administración y la forma crónica se da en meses o incluso años después de culminado el tratamiento y se presenta como cardiomiopatía dilatada o restrictiva21,23,51.
El cisplatino se utiliza ampliamente para el tratamiento de un amplio espectro de tumores malignos, sin embargo, ha sido asociado con nefrotoxicidad y ototoxicidad52. La ototoxicidad representa una importante limitación a la utilización eficaz de este agente, esta toxicidad se centra principalmente en las células ciliadas externas en la cóclea y se caracteriza por ser irreversible, bilateral y neurosensorial de alta frecuencia52. El grado de deterioro es dependiente de la dosis total administrada, la edad, la función renal, la exposición a otros ototóxicos y la susceptibilidad individual43. La incidencia de ototoxicidad después de cisplatino puede ser tan alta como 50% y los niños parecen estar en mayor riesgo que los adultos, por lo que es importante evaluar la función auditiva en estos pacientes52.
Complicaciones asociadas a la radioterapia
Los efectos de la radiación se acumulan gradualmente con el tiempo. La mayoría de los pacientes tienen muy pocos efectos secundarios iniciales. El efecto secundario más frecuente de la radioterapia es la irritación cutánea en el área del cuerpo que se está tratando. La reacción cutánea puede ir desde un leve enrojecimiento y sequedad hasta una descamación intensa de la piel en algunos pacientes. La mayoría de las reacciones cutáneas a la radioterapia desaparecen unas pocas semanas después de terminado el tratamiento. El cansancio, el cual es uno de los efectos secundarios más frecuentes de la radioterapia y se caracteriza por ser una sensación de fatiga, debilidad, agotamiento o una profunda falta de energía53. La radioterapia que se administra al área de la cabeza y el cuello puede producir mucositis y xerostomía, además pueden generar alteraciones del gusto o el olfato que típicamente se van una vez terminado el tratamiento, puede causar alopecia del sitio donde se aplica la radioterapia la cual típicamente comienza de dos a cuatro semanas después del inicio de la misma. Puede generar síntomas gastrointestinales como náuseas, vómito y diarrea, lo que puede conllevar a hiporexia. Además produce leucopenia, trombocitopenia y si es aplicada en el tórax genera fibrosis pulmonar, disnea y problemas tiroideos como hipotiroidismo53.
DISCUSIÓN
Los factores genéticos y prenatales como radiación, el dietilestilbestrol y la exposición posnatal a virus, son conocidos por aumentar el riesgo de desarrollar algunos tipos de cáncer infantil, pero para la mayoría de los casos de cáncer en la infancia, la causa se desconoce54. El tratamiento del cáncer, particularmente en la edad pediátrica, conlleva a un alto riesgo de complicaciones y eventos adversos cuyas características y frecuencia de presentación en la región no han sido cuantificadas. Estas complicaciones pueden tener un curso progresivo o por el contrario, pueden ser de urgencia porque pueden ser potencialmente mortales y requieren una valoración y tratamiento inmediato, además pueden afectar a diferentes órganos o sistemas empeorando el pronóstico inicial1.
Cuando se realiza el diagnóstico de cáncer la mayoría de los niños ya se encuentran con alguna complicación, pues a menudo es difícil de detectar en sus primeras etapas porque los signos y síntomas asociados son inespecíficos e insidiosos y pueden imitar otra enfermedad. El tiempo desde el inicio de los síntomas hasta el diagnóstico de cáncer pediátrico es variable y va de un tiempo medio de 21 días para el neuroblastoma y 72 días para el sarcoma de Ewing55. Un diagnóstico temprano y oportuno pueden ayudar a prevenir la aparición de complicaciones y la muerte en estos niños. A pesar de esto, la supervivencia ha aumentado en los últimos 15 años y ha disminuido la tasa de mortalidad en menores de 19 años de 34,2% a 27,3% entre 1990 y 200456.
El conocimiento de las complicaciones cardiovasculares generadas por los protocolos de quimioterapia o radioterapia, hace que se puedan modificar factores ambientales o alimentarios con el fin de disminuir la presencia de enfermedad cardiaca prevenible como la isquemia coronaria. La gravedad de las consecuencias de los efectos tardíos es evidente
en los estudios sobre la muerte prematura después del tratamiento del cáncer. En un estudio de la mortalidad tardía entre los 20 227 sobrevivientes a cinco años diagnosticados con cáncer infantil entre 1970 a 1986, hubo un exceso de 10,8 veces en la mortalidad general54.
El riesgo de aparición de segundas neoplasias es de 10 veces o más, con mayor frecuencia en neoplasias del sistema nervioso central y la glándula tiroides, ante esto surgen dudas de si se presenta secundario a susceptibilidad individual a presentar neoplasias o secundarias al manejo antineoplásico, estos interrogantes aún no han sido determinados y se deben realizar mayores estudios para llegar a conclusiones concretas57,58.
La incidencia y descripción de los eventos adversos y las complicaciones en el diagnóstico y tratamiento del cáncer en pediatría es de suma importancia, sin embargo, ya conociéndolos, es necesario tomar medidas preventivas, por lo que se considera que, aun no siendo el objetivo de esta revisión, se debe ahondar más en dicho punto y realizar investigaciones futuras para determinar el orden de frecuencia de aparición de las complicaciones y eventos adversos según el tipo de cáncer y según determinados protocolos antineoplásicos utilizados. Solo en esta medida se puede disminuir los índices de aparición de estos efectos que en muchas ocasiones pueden ser mortales y cambiar la medicina tradicional hacia una medicina preventiva. Esto solo se puede realizar cuando se conoce la historia natural de la enfermedad, la recurrencia, complicaciones y los tratamientos actuales para cada tipo de neoplasia.
CONCLUSIÓN
Son numerosos los sistemas u órganos que pueden ser afectados con el tratamiento antineoplásico, sean estos quimioterapia, radioterapia o cirugía. Estas complicaciones anteriormente citadas, pueden ser a corto y a largo plazo, por ende estos niños requieren seguimiento de por vida, con el fin de identificar, prevenir y curar cualquier alteración que se pueda presentar. Aunque se conocen las complicaciones y los efectos adversos, aun no se conoce en qué orden de frecuencia comienzan a aparecer, tampoco se puede determinar la asociación de determinado protocolo antineoplásico y el inicio de alguna complicación. Por este motivo, se considera de gran importancia describir las formas clínicas de presentación de dichas complicaciones y relacionarlas con el tipo de tratamiento y las características sociodemográficas de los pacientes que las sufren, con lo cual se pretende poder realizar un manejo precoz de las mismas y en lo posible, hacer un tratamiento preventivo, así como evitar secuelas a corto y largo plazo. Adicionalmente, es necesario describir y cuantificar los posibles eventos adversos que se puedan presentar durante el tratamiento de estos pacientes que contribuyan a empeorar el pronóstico de la enfermedad.
REFERENCIAS BIBLIOGRÁFICAS
1. Gerali M, Servitzoglou M, Paikopoulo D, Madianos M, Vasilatou- Kosmidis H. Problems in children with cancer in the initial period of treatment. Cancer Nurs. 2011:269-75. [ Links ]
2. Uribe C, Amado C, Ramírez A. Cáncer infantil en el área metropolitana de Bucaramanga 2003-2007. Medunab. 2011;14(2):86-93. [ Links ]
3. Bañeres J, Orrego C, Suñol R, Ureña V. Los sistemas de registro y notificación de efectos adversos y de incidentes: una estrategia para aprender de los errores. Rev Calidad Asistencial. 2005;20(4):216-22. [ Links ]
4. Instituto de Investigaciones Epidemiológicas, Academia Nacional de Medicina. Seguridad del paciente y error en medicina [en línea]. Disponible en: http://www.errorenmedicina.anm.edu.ar/ [con acceso el 1 de Julio de 2014] [ Links ].
5. Lois Van C, Muñoz C, Saavedra M, Riggs M, Bossert E. Symptoms in children with advanced cancer. Cancer Nurs. 2012;35(2):115-25. [ Links ]
6. Enska K, Bertero C. Young adult survivors of childhood cancer; experiences affecting self-image, relationships, and present life. Cancer Nurs. 2010;33(1):1-18. [ Links ]
7. International Agency for Research on Cancer, World Health Organization. GLOBOCAN 2012: estimated cancer incidence, mortality and prevalence worldwide in 2012 [en línea]. Disponible en: http://globocan.iarc.fr/Pages/DataSource_and_methods.aspx [con acceso el 1 de Julio de 2014] [ Links ].
8. Martínez MJ, García A, Garaizar C; Asociación Española de Pediatría, Sociedad Española de Neurología Pediátrica. Tumores cerebrales infantiles: diagnóstico y semiología neurológica. Protocolos Diagnóstico Terapeúticos de la AEP: Neurología Pediátrica.2008:203-9. [ Links ]
9. Hui Chen M, Colan S, Diller L. Cardiovascular Disease Cause of Morbidity and Mortality in Adult Survivors of Childhood Cancers. Circ Res. 2011;108(5):619-28. [ Links ]
10. Pui CH, Evans WE. Treatment of Acute Lymphoblastic Leukemia. N Engl J Med. 2006;354:166-78. [ Links ]
11. Kudret C, Ali Varan A, Akyuz C, TezerKutluk S. Second neoplasms in pediatric patients treated for cancer: a center's 30- year experience. J Pediatr Hematol Oncol. 2006;28(6):374-8. [ Links ]
12. Simon A, Ammann R, Bode U, Fleischhack G, Wenchel HM, Schwamborn D, et al. Healthcare-associated infections in pediatric cancer patients: results of a prospective surveillance study from university hospitals in Germany and Switzerland. BMC Infect Dis. 2008;8:70-9. [ Links ]
13. Nowak-Go U, Ahlke E, Fleischhack G, Schwabe D, Schobess R, Schumann C, et al. Thromboembolic events in children with acute lymphoblastic leukemia (BFM protocols): prednisone versus dexamethasone administration. Blood. 2003;101(7):2529-33. [ Links ]
14. Ross C, Visscher H, Rassekh S, Castro-Pastrana L, Shereck E, Carleton B, et al. Pharmacogenomics of serious adverse drug reactions In pediatric oncology. J Popul Ther Clin Pharmacol. 2011;18(1):134-51. [ Links ]
15. Ness K, Armenian S, Kadan-Lottick N, Gurney JG. Adverse effects of treatment in childhood acute lymphoblastic leukemia: general overview and implications for long-term cardiac health. Expert Rev Hematol. 2011;4(2):185-7. [ Links ]
16. Massimino M, Gandola L, Seregni E, Bongarzone I, Morosi C, Collini P. Thyroid iatrogenic sequelae after treatment of pediatric cancer. Q J Nucl Med Mol Imaging. 2009;53(5):526-35. [ Links ]
17. Salcedo C, Chaskel R. Impacto psicosocial del cáncer en niños y adolescentes. Precop SCP. 20098(3):5-18. [ Links ]
18. vanWaas M, Neggers S, van der Lelij AJ, Pieters R, van den Heuvel-Eibrink M. The metabolic syndrome in adult survivors of childhood cancer, a review. J Pediatr Hematol Oncol. 2010;32(3):171-9. [ Links ]
19. Aleman B, Van den Belt-Dusebout A, De Bruin M, Van't Veer M, Baaijens M, Boer J, et al. Late cardiotoxicity after treatment for Hodgkin lymphoma. Blood. 2007;109(5):1878-86. [ Links ]
20. Myrehaug S, Pintilie M, Yun L, Crump M, Tsang R, Meyer R, et al. A population-based study of cardiac morbidity among Hodgkin lymphoma patients with preexisting heart disease. Blood. 2010;116(13):2237-40. [ Links ]
21. Myrehaug S, Pintilie M, Tsang R, Mackenzie R, Crump M, Chen Z, et al. Cardiac morbidity following modern treatment for Hodgkin lymphoma: supra-additive cardiotoxicity of doxorubicin and radiation therapy. Leuk Lymphoma. 2008;49(8):1486-93. [ Links ]
22. Hull M, Morris C, Pepine C, Mendenhall N. Valvular dysfunction and carotid, subclavian, and coronary artery disease in survivors of Hodgkin lymphoma treated with radiation therapy. JAMA. 2003;290(21):2831-7. [ Links ]
23. Picot B, Levitt G, Sullivan I, Baxter L, Clegg A. Cardioprotection against the toxic effects of anthracyclines given to children with cancer: a systematic review. Health Technol Assess. 2007;11(27):1-84. [ Links ]
24. D'Ortencio A, Navigante A. Insuficiencia cardíaca relacionada a quimioterapia. Nuevo enfoque. Insuf Card. 2006;1(1):28-32. [ Links ]
25. Lipshultz S, Adams M, Colan S, Constine L, Herman E, Hsu D, et al. Long-term cardiovascular toxicity in children, adolescents, and young adults who receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions a scientific statement from the american heart association. Circulation. 2013;128:1927-95. [ Links ]
26. Chen M, Colan SD, Diller L. Cardiovascular disease cause of morbidity and mortality in adult survivors of childhood cancers. Circ Res. 2011;108:619-28. [ Links ]
27. Madre C, Orbach D, Baudouin V, Brisse H, Bessa F, Schleiermacher G, et al. Hypertension in Childhood Cancer A Frequent Complication of Certain Tumor Sites. J Pediatr Hematol Oncol. 2006;28(10):659-64. [ Links ]
28. Abratt R, Morgan G, Silvestri G, Willcox P. Pulmonary complications of radiation therapy. Clin Chest Med. 2004;25(1):167-77. [ Links ]
29. Marina N. Long-term survivors of childhood cancer. Pediatr Clin North Am. 1997;44:1021-42. [ Links ]
30. Adler R. Cancer treatment-induced bone loss. Current Opinion in Endocrinology. 2007;14:442-5. [ Links ]
31. Alvarez J, Armstrong M, Constined L, Friedmane D. Long-term effects of treatments for childhood cancers. Curr Opin in Pediatr. 2007;19(1):23-31. [ Links ]
32. Sklar C, Whitton J, Mertens A, Stovall M, Green D, Marina N, et al. Abnormalities of the thyroid in survivors of hodgkin's disease: data from the childhood cancer survivor study. J Clin Endocrinol Metab. 2000;85(9):3227-32. [ Links ]
33. Pashankar F, Season J, McNamara J, Pashankar D. Acute Constipation in Children Receiving Chemotherapy for Cancer. J Pediatr Hematol Oncol. 2011;33(7):300-3. [ Links ]
34. Gallego C. La mucositis, un efecto del tratamiento quimioterapéutico: fisiopatología y manejo. Rev Fac Odont Antioq. 2007;18(2):84-92. [ Links ]
35. Figueiredo MC, Faustino-Silva DD, Pozatti S, Squef R. Mucositis oral en pacientes pediátricos: una revisión de literatura. Acta Odont Venez. 2011;49(4):1-7. [ Links ]
36. Patel S, Katz E, Richardson R, Rimmer M, Kilian S. Cognitive and problem solving training in cancer: a pilot project. J Pediatr Hematol Oncol. 2009;31(9):670-7. [ Links ]
37. Gerali M, Servitzoglou M, Paikopoulou D, Theodosopoulou H, Madianos M, Vasilatou-Kosmidis H. Psychological problems in children with cancer in the initial period of treatment. Cancer Nurs. 2011;34 (4):1-11. [ Links ]
38. Afify M, Elshahawib H, Adly A. Posttraumatic stress disorders in long-term Egyptian survivors after childhood cancer. MECPsych. 2012;19(1):40-7. [ Links ]
39. Hudson M. Reproductive Outcomes for Survivors of Childhood Cancer. Obstet Gynecol Int. 2010;116(5):1171-83. [ Links ]
40. Vargas P. Cáncer en pediatría. Aspectos generales. Rev chil pediatr. 2000;71(4):1-13. [ Links ]
41. López P, López E. Neutropenia Febril en Pediatría. Infect.2008; 12(1):291-7. [ Links ]
42. Rueda E, Trujillo ML, Díaz LA. La neutropenia severa febril en niños con cáncer. Estudio descriptivo en el Hospital Universitario de Santander. Salud UIS. 2010;42:103-11 [ Links ]
43. Gudbjartsson T, Thoroddsen A, Petursdottir V, Hardarson S, Magnusson J, et al. Effect of incidental detection for survival of patients with renal cell carcinoma: results of population-based study of 701 patients. Urology. 2005;66(6):1186-91. [ Links ]
44. Collins L, Nayiager T, Doring N, Kennedy C, Webber C, et al. Nutritional Status at Diagnosis in Children with Cancer I. An Assessment by Dietary Recall Compared With Body Mass Index and Body Composition Measured by Dual Energy X-ray Absorptiometry. J Pediatr Hematol Oncol. 2010;32(8):299-3 [ Links ]
45. Amat J, Torrent M. Urgencias oncológicas. Protocolos diagnósticoterapéuticos de Urgencias Pediátricas SEUP-AEP 2010. 239-45. [ Links ]
46. Barbosa C, Nakamura C, Terreri M, Lee M, Petrilli A, et al. Musculoskeletal manifestations as the onset of acute leukemias in childhood. J Pediatr (Rio J). 2002;78(6):481-4. [ Links ]
47. Lawenda B, Gagne H, Gierga D, Niemierko A, Wong WM, et al. Permanent alopecia after cranial irradiation: dose-response relationship. Int J Radiat Oncol Biol Phys. 2004;60(3):879-87. [ Links ]
48. Ruhnke M, Böhme A, Buchheidt D, Cornely O, Donhuijsen K, Einsele K, et al. Diagnosis of invasive fungal infections in hematology and oncology-guidelines from the Infectious Diseases Working Party in Haematology and Oncology of the German Society for Haematology and Oncology (AGIHO). Ann Oncol. 2011;23:1-11 [ Links ]
49. Barreto J, Beach C, Wolf R, Merten J, Tosh P, Wilson J, et al. The incidence of invasive fungal infections in neutropenic patients with acute leukemia and myelodysplastic syndromes receiving primary antifungal prophylaxis with voriconazole. Am J Hematol. 2013;88:283-88. [ Links ]
50. Koskenvuo M, Merja Mo Rahiala J, Ulla M, Pihkala S, Riikonen P, et al. Respiratory Viral Infections in Children with Leukemia. Pediatr Infect Dis J. 2008;27:974-80. [ Links ]
51. Castillo M. Evaluación de la validez de criterio de la Troponina T para el diagnóstico de cardiotoxicidad por antraciclinas. Hospital Universitario de Santander. Universidad Industrial de Santander. 2012. [ Links ]
52. Coradini P, Cigana M, Selistre S, Rosito L, Brunetto A . Ototoxicity From Cisplatin Therapy in Childhood Cancer. J Pediatr Hematol Oncol. 2007;29(6):355-60 [ Links ]
53. Villani F, Viviani S, Bonfante V, De Maria P, et al. Late pulmonary effects in favorable stage I and IIA Hodgkin's disease treated with radiotherapy alone. Am J Clin Oncol. 2000;23(1):18-21. [ Links ]
54. National Cancer Policy Board: WeinerSL, SimoneJV, HewittM, editors. Childhood cancer survivorship: Improving care and quality of life. Washington, DC: National Academy of Sciences 2003: 32 [ Links ]
55. Pollock B, Krischer J, Vietti T. Interval between symptom onset and diagnosis of pediatric solid tumor. J Pediatr. 1991;119(5):725-32. [ Links ]
56. Centers for Disease Control and Prevention (CDC).Trends in childhood cancer mortality--United States, 1990-2004. MMWR Morb Mortal Wkly Rep. 2007; 56(48):1257-61. [ Links ]
57. Robison, L, Green, D, Hudson, M, Meadows, A, Mertens, A, Packer, R, et al. Long-term outcomes of adult survivors of childhood cancer. Cancer. 2005;104(11 suppl):2557-64. [ Links ]
58. Neglia JP, Friedman DL, Yasui Y, Mertens A, Hammond S, Stovall M, et al. Second malignant neoplasms in five-year survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. J Natl Cancer Inst. 2001;93(8): 618-29. [ Links ]