Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicas UIS
Print version ISSN 0121-0319
Medicas UIS vol.28 no.2 Bucaramanga May/Aug. 2015
Efecto de la adición de metformina a un
pretratamiento con esteroides en pacientes
adultos con leucemia linfoblástica aguda y en la
viabilidad de la línea celular MOLT-4
Christian Omar Ramos Peñafiel*
Irma Olarte Carrillo**
Adolfo Martínez Tovar**
Humberto Castellanos Sinco***
Jorge Zamora Domínguez**
Adrián Santoyo Sánchez****
Etta Rozen Fuller*
Enrique Miranda Peralta**
Juan Collazo Jaloma*
*Médico Hematólogo. MSc en Ciencias Médicas. Docente Investigador. Departamento de Hematología. Hospital General de México "Dr. Eduardo Liceaga". Ciudad de México. México.
**Biólogo. Doctor en Biología Molecular. Docente Investigador. Laboratorio de Biología Molecular del Hospital General de México "Dr. Eduardo Liceaga". Ciudad de México. México.
***Médico Hematólogo Adscrito. Clínica No. 48 del Instituto Mexicano del Seguro Social. Ciudad de México. México.
****Estudiante de Medicina de sexto semestre. Universidad Nacional Autónoma de México. Ciudad de México, México.
Correspondencia: Sr. Christian Omar Ramos Penafiel. Dirección: Dr Balmis no. 148 colonia Doctores. México. Distrito Federal. Celular: 5523351588. Correo electrónico: leukemiaCHOP@hotmail.com.
Artículo recibido el 18 de enero de 2015 y aceptado para publicación el 20 de mayo de 2015
RESUMEN
Introducción: metformina es un medicamento antidiabético evaluado en varios modelos in vitro e in vivo de cáncer ya que es capaz de incrementar la proteincinasa activada por adenosin monofosfato y bloquear las vías de señalización tumoral. Objetivo: evaluar los efectos antitumorales de metformina en línea celular MOLT-4 en pacientes bajo tratamiento de inducción a la remisión. Materiales y métodos: fase in vitro: ensayo en línea celular MOLT-4 adicionando metformina 40 mM evaluando la viabilidad y ciclo celular mediante citometría de flujo. Fase clínica: Estudio de casos y controles en pacientes portadores de leucemia linfoblástica aguda de novo, adicionando metformina 850 mg cada ocho horas en etapa de pretratamiento e inducción a la remisión, contra el registro histórico del protocolo institucional HGMLAL07. Para el análisis estadístico se utilizó el test de chi-cuadrado, estudio multivariado para factores de riesgo y evaluación del efecto sobre la remisión mediante Odds Ratio. Resultados: ensayo celular: meformina inhibió la viabilidad celular a las 120 horas, reduciendo el porcentaje de células en fase S. Estudio clínico: en un total de 151 pacientes, el 29,1% correspondieron al brazo de metformina. La mayor tasa de respuesta favorable a esteroides como de remisiones completas se encontraron en los pacientes que recibieron metformina (59,1% versus 26,2% y 81,8% versus 57,9%) con significancia estadística (p= 0.000* y 0,006 95% IC). Conclusiones: la adición de metformina a la quimioterapia incremento la respuesta favorable a esteroides y las tasas de remisiones completas. In vitro, y semejante a otros modelos, metformina arresta a las células en G0/G1, induciendo una disminución en la viabilidad celular. MÉD.UIS. 2015;28(2):221-8.
Palabras Clave: Leucemia-Linfoma Linfoblástico de Células Precursoras. Metformina. Esteroides.
Effect of Metformin to a pretreatment with steroids in adult patients with acute
lymphoblastic leukemia and in the viability of the MOLT-4 cell line
ABSTRACT
Introduction: metformin, antidiabetic drug evaluated in several in vitro and in vivo cancer models, is able of increasing the adenosine monophosphate activated protein kinase and block tumor signaling pathways. Objetive: to evaluate the antitumor effects of metformin in MOLT-4 cell line and in patients under treatment for remission induction. Materials and methods: in vitro phase: essay in MOLT-4 cell line adding metformin 40 mM evaluating the viability and cell cycle by flow cytometry. Clinic phase: Case-control study in patients with de novo acute lymphoblastic leukemia, adding metformin three time a day on pretreatment stage and remission induction, against the historical record of the institutional protocol HGMLAL07. Statistical analysis: chi-square analysis, multivariate analysis for risk factors and evaluation of the effect over the remission by Odds ratio. Results: celular assay: metformina inhibited cell viability at 120 hours reducing the percentage of cells in phase S. Clinical assay: 151 patients were studied, 29.1% on metformina arm. The highest rate of good steroid response and complete remissions were found in patients who received metformin (59,1% versus 26,2% and 81,8% vs 57,9%) statistically significant (p= 0.000* and 0.006, 95% IC). Conclusions: the addition of metformin to chemotherapy increased the good steroids response to steroids and rates of complete remissions. In vitro, and similar to other models, metformin arrest cells in G0/G1, inducing a decrease in cell viability. MÉD.UIS. 2015;28(5):221-8.
Keywords: Precursor Cell Lymphoblastic Leukemia-Lymphoma. Metformin. Steroids.
¿Cómo citar este artículo?: Ramos CO, Olarte I, Martínez A, Castellanos H, Zamora J, Santoyo A, et al. Efecto de la adición de metformina a un pretratamiento con esteroides en pacientes adultos con leucemia linfoblástica aguda y en la viabilidad de la línea celular MOLT-4. MÉD.UIS. 2014;27(1):221-8.
INTRODUCCIÓN
La Leucemia Linfoblástica Aguda (LLA) es una neoplasia linfoproliferativa caracterizada por el aumento descontrolado de precursores linfoides B o T, desplazando la hematopoyesis, generando invasión de órganos como hígado y bazo, modificaciones en el microambiente y fibrosis medular1,2. La célula neoplásica desarrolla cuatro características primordiales, la primera es la autorenovación mediante crecimiento clonal desmedido; la segunda es la evasión a la supresión por parte del sistema inmune y a las vías celulares de regulación; la tercera es la escasa o nula diferenciación como resultado de las alteraciones que permiten una división acelerada y perdida de funciones celulares, y por último la multipotencialidad, es decir, la clona tiene potencial de expresar marcadores de superficie y cumplir funciones para la cual estaba destinada3,4.
Esta enfermedad se sitúa a nivel mundial dentro de los primeros 20 tipos de cáncer con respecto a la incidencia, prevalencia y mortalidad. La incidencia promedio en Latinoamérica es de 2,7 casos por cada 100 000 habitantes, aunque países como Colombia y México superan esta cifra, 3,7 y 4,3 casos por cada 100 000 personas, respectivamente5. El cuadro clínico es amplio e inespecífico, solo 50% de los pacientes reportan manifestaciones clínicas6. Los síntomas más comunes son astenia, adinamia, vértigo, disnea, somnolencia y dolor óseo. Los signos más reportados son fiebre, pérdida de peso, adenomegalia local o generalizada, taquicardia, palidez cutánea y de mucosas, petequias, equimosis, gingivorragia y crecimiento abdominal debido a la hepatomegalia o esplenomegalia. Es importante recordar que la severidad de las manifestaciones clínicas no se relaciona con la gravedad ni con el tipo de leucemia1,3,6.
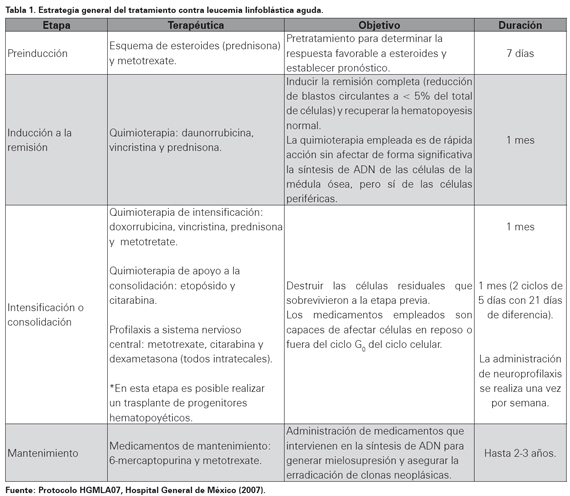
La estrategia general de tratamiento se basa en cuatro etapas las cuales son: preinducción, inducción a la remisión, intensificación o consolidación (en la que se incluye la profilaxis al sistema nervioso central) y otra etapa prolongada de mantenimiento (Ver Tabla 1)7. De forma general, la mayor parte de los esquemas de inducción alrededor del mundo contienen alcaloides de la vinca, antraciclinas, L-asparaginasa y esteroides8,9, siendo estos últimos parte fundamental del tratamiento debido a su capacidad de inducir apoptosis en las células leucémicas en especial en las etapas tempranas de la enfermedad. La resistencia principalmente a los esteroides se ha asociado a que los pacientes no integran una respuesta al primer esquema de tratamiento, es decir, no logran la remisión completa caracterizada por la disminución de las células neoplásicas en médula ósea a una cifra menor al 5% del total de células, denominándose a esta situación leucemia refractaria. Es importante no confundir con leucemia recurrente, que es aquella en la cual se obtiene la remisión pero posteriormente reaparecen e incrementa la cifra de blastos7. Ante la falta de nuevas opciones terapéuticas solo se dispone en la práctica de algunas modificaciones liposomales de los fármacos como vincristina y citarabina7,10.
El tratamiento de la LLA ha avanzado drásticamente gracias a la biología molecular y a la inmunoterapia siendo la quimioterapia y el trasplante de progenitores hematopoyéticos las partes fundamental del tratamiento11. A pesar de todos los avances, la tasa de leucemias refractarias no se ha modificado siendo en promedio de un 8% en países desarrollados y de hasta un 25% en países en vía de desarrollo disminuyendo la supervivencia de los pacientes8,9,12-4.
Curiosamente en la última década se ha identificado el efecto pleiotrópico de una gran variedad de fármacos. Uno de estos fármacos es el clorhidrato de metformina (N-dimetilmidodicarbonomídico diamida), utilizado desde el siglo XIX para el tratamiento de la halitosis y autorizado desde 1950 para el tratamiento de la diabetes mellitus no insulinodependiente. Tal vez el enlace de metformina con la oncología surgió de las cohortes retrospectivas en donde se logró establecer un efecto protector de metformina sobre el desarrollo de diversas neoplasias en comparación con otras estrategias hipoglucemiantes15,16. Fue hasta los modelos celulares donde se identificó los efectos antitumorales directos de metformina siendo el principal la activación de la proteincinasa activada por AMPc, seguido del bloqueo de la vía mTOR (mammalian target of rapamycin)/PI3K/AKT/ que se encuentra activa en diversos tipos de cáncer sirviendo como punto de convergencia, además de participar en el control de procesos celulares que contribuyen en la génesis y mantenimiento de la clona neoplásica17-9. Dichos efectos se han establecido fuertemente en las líneas celulares de cáncer como la línea HER-2 de cáncer de seno como en líneas de cáncer de ovario20-3. Otros mecanismos antitumorales y que pueden impactar con el microambiente del tumor son el bloqueo de una serie de adipocinas, TNF-α e IL-624,25.
La piedra angular del tratamiento es obtener la remisión completa durante la inducción, etapa en la cual los esteroides son parte primordial26,27. Aquellos pacientes que no logran la remisión debido a una respuesta desfavorable a los esteroides tienen mal pronóstico, requiriendo regímenes de tratamiento de mayor intensidad, razón por la cual continua la búsqueda de estrategias que eviten esta última situación mencionada8,9,27. Metformina ha demostrado efectos biológicos capaces de coadyuvar a los efectos de los fármacos empleados en quimioterapia, e inclusive existen pequeños ensayos clínicos que han obtenido resultados satisfactorios en el manejo de diversas neoplasias como el hepatocarcinoma y el glioblastoma, aunque ninguno se ha aplicado a neoplasias hematopoyéticas16,19. El objetivo de este estudio es evaluar los efectos de la adición de metformina al régimen de pretratamiento basado en dosis progresivas de prednisona mediante ensayos in vitro desarrollados en la línea celular MOLT-4 de LLA de linfocitos T, así como los efectos in vivo mediante un estudio de casos y controles.
MATERIALES Y MÉTODOS
EL ESTUDIO SE REALIZÓ EN DOS FASES : LA FASE IN VITRO Y LA FASE CLÍNICA.
Estudio in vitro: La primera fase consistió en un ensayo in vitro sobre la línea celular MOLT-4 de la LLA de linfocitos T disponible en el departamento de biología molecular del Hospital General de México, obtenida del American Type Culture Collection y mantenida en medio de cultivo RPMI 1640 suplementado con 10% de suero fetal bovino, penicilina 100 UI/mL, estreptomicina 100 mg/mL y L-glutamina 2 mM. Se seleccionó esta línea celular debido a que las células T expresan una gran cantidad de mTOR, el cual es el blanco principal de metformina. La línea celular fue cultivada en una atmósfera húmeda de 37°C con 5% de CO2. El análisis de viabilidad celular se llevó a cabo por triplicado adicionando metformina a los diferentes pozos de cultivo y como análisis secundario se realizó la medición del ciclo celular en conjunto con un control analizado también por triplicado.
Fase clínica: La fase clínica consistió en un estudio de casos y controles en pacientes portadores de LLA de novo atendidos en el departamento de hematología del Hospital General de México entre el período de marzo de 2010 a diciembre de 2012. Estos pacientes constituyeron el brazo experimental con metformina, a los cuales se les administró 850 mg vía oral cada ocho horas más la quimioterapia, los resultados se compararon con la cohorte histórica del protocolo HGMLAL07 que incluye casos desde el 2007. El objetivo primario del análisis fue valorar el efecto de la combinación sobre la Respuesta Favorable a Esteroides (RFE) y las tasas de Remisiones Completas (RC). El diagnóstico se realizó mediante los criterios de la asociación Franco-Américo-Británica y fue corroborado mediante citometría de flujo. Se incluyeron solamente pacientes con LLA de novo, descartando aquellos atendidos con otros esquema de inducción a la remisión que no sean del protocolo institucional HGMLAL07. Se excluyeron a todos los pacientes sin registros médicos completos y en los que no se pudieran evaluar la respuesta de inducción a la remisión. Todos los pacientes contaban con consentimiento informado de la institución previo al inicio del estudio.
ENSAYO DE VIABILIDAD CELULAR
método de exclusión del colorante azul de tripano. Se adicionó un total de 0,8x106 células MOLT-4 a placas de seis pozos con 3 mL de medio RPMI 1640 suplementado. A las células experimentales se les adicionó metformina 40 mM y a los cultivos de control solo se le adicionó medio de cultivo. Las células se incubaron durante 120 horas. Cada 24 horas se determinó el número de células y el porcentaje de viabilidad mediante un conteo a través de la cámara de Neubauer doble rayado línea regular (No. serie 2.660.091, MARIENFELD, GERMANY) y un microscopio invertido (Ametican optical, Modelo 1820, serie 1640).
ANÁLISIS POR CITOMETRÍA DE FLUJO
Para determinar el perfil del ciclo celular tanto de las células tratadas con metformina como del grupo control, cada 24 horas las células se fijaron con etanol al 70% y se almacenaron a -20°C toda la noche. Posteriormente, se lavaron con buffer de fosfato salino, se trataron con RNAasa a 100 mg/mL durante 30 minutos a temperatura ambiente y se tiñeron con ioduro de propidio 50 mg/mL durante una hora. El análisis del ciclo celular se realizó con un equipo FACSCalibur y por medio del software ModFit© (Verity Software House).
CRITERIOS DE REMISIÓN COMPLETA Y RESPUESTA FAVORABLE A ESTEROIDES
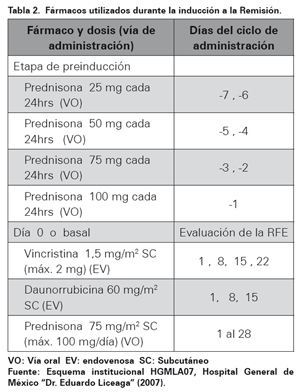
El objetivo primario fue evaluar el efecto de metformina sobre las tasas de RC y RFE. Se consideró como RFE la presencia menor de 1x103 blastos/mcL en sangre periférica al día cero del pretratamiento. La inducción a la remisión contó con una duración de 26 a 28 días, la RC al primer ciclo de quimioterapia se evaluó al día mediante la toma por aspiración de médula ósea al final de las cuatro primeras semanas de tratamiento. Se consideró RC a una cifra de blastos en médula ósea menor al 5% y una hematimetría de sangre periférica normal. En caso de presentar toxicidad grado I o II, acorde lo especificado por el National Cancer Institute Common Terminology Criteria for Adverse Events, versión 4.028, la dosis de metformina se redujo a dos veces al día y se suspendió en caso de toxicidades mayores. Los fármacos utilizados durante la inducción a la remisión se presentan en la Tabla 2. En caso de pacientes portadores de cromosoma Philadelphia positivo [Ph (+)] se administró en conjunto con su esquema de quimioterapia, Imatinib a dosis de 400 mg vía oral cada 24 horas durante los primeros 15 días de cada uno de los ciclos. Todos los pacientes recibieron tratamiento de soporte con factor estimulante de colonias de granulocitos hasta la recuperación.
ANÁLISIS ESTAD ÍSTICO
La estadística descriptiva al igual que el análisis estadístico se evaluó mediante el software SPSS Versión 20.0 (Chicago ILL, USA). Las variables a contrastar fueron tanto el tratamiento con metformina como la RFE. El primer análisis fue mediante el test chicuadrado considerándose significativo a un valor de p ≤0,05 a un intervalo de confianza del 95%. El análisis multivariado se realizó con base en los factores de riesgo como la edad, cifra de leucocitos al diagnóstico, presencia del cromosoma Philadelphia, en conjunto a la adición de metformina al régimen de tratamiento. El tercer análisis fue el establecimiento del valor de Odds Ratio para los pacientes que no desarrollaron una RFE.
RESULTADOS
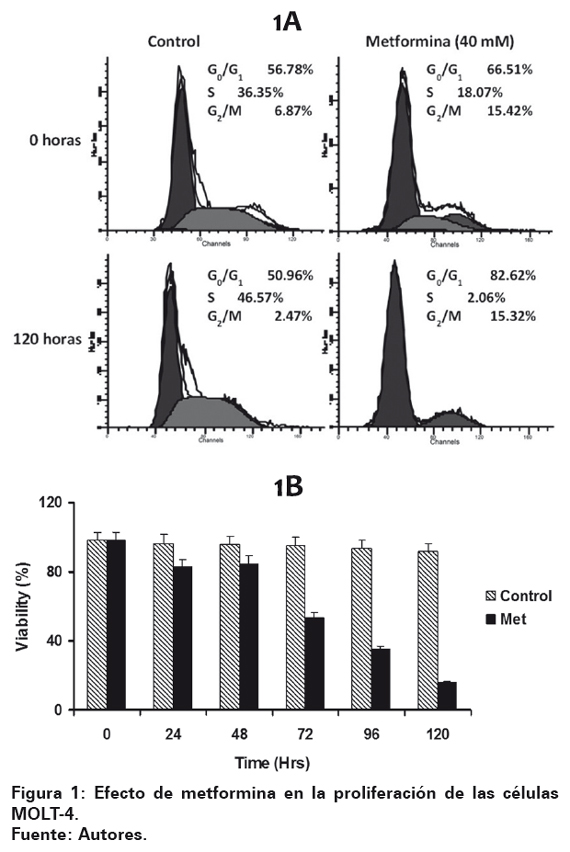
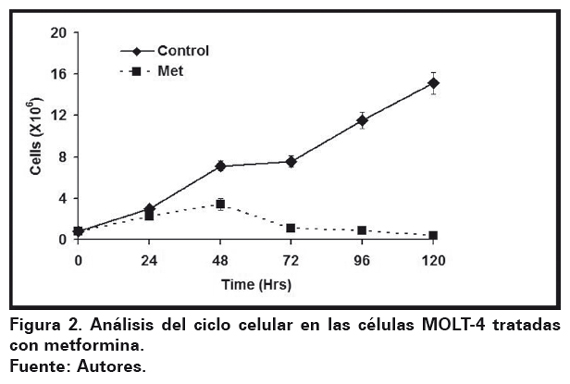
En el ensayo celular se adicionó 40 mM de metformina a la línea celular MOLT-4 (5x104/ml), demostrando que su adición inhibe el crecimiento (Ver Figura 1-A) y la viabilidad celular (Ver Figura 1-B) en comparación con el control, siendo más representativo a las 120 horas de cultivo (p < 0,001), aunque el efecto se aprecia desde las 24 horas para ambos casos.
Metformina bloqueó la progresión del ciclo celular de las células MOLT-4 al evaluar el contenido de DNA mediante citometría de flujo donde se evidenció que incrementa el número de células que se arrestan en fase G0/G1 y G2/M reduciendo la fracción de células en fase S. Dicho efecto es más significativo a las 120 horas de inicio del experimento (Ver Figura 2).
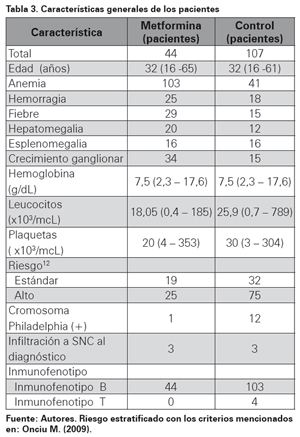
Para la fase clínica se incluyeron 151 pacientes, de los cuales el 29,15% (n=44) correspondieron al brazo terapéutico con metformina. Un 4% de los casos contaban con diabetes mellitus previo al diagnóstico. La mediana de edad fue de 30 años (intervalo de 16 a 66 años) sin diferencia significativa entre los dos grupos de tratamiento. La presentación clínica se caracterizó principalmente por anemia, hemorragia, organomegalias; y los valores del laboratorio fueron similares en ambos grupos. Las demás características de los pacientes se describen en la Tabla 3.
RESULTADOS DE TRATAMIENTO DE PREINDUCCIÓN E INDUCCIÓN A LA REMISIÓN
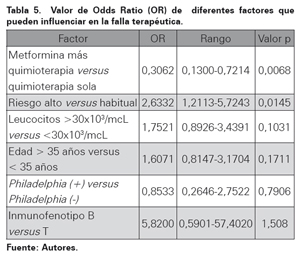
Del total de los pacientes se registró un mayor número de casos con RFE en el grupo de metformina en comparación con el grupo control (59,1% versus 26,2%). En cuanto a la respuesta a los 28 días, también se registró un mayor número de RC en el grupo de metformina (81,8% versus 57,9%). En donde no se apreciaron diferencias significativas fue en el porcentaje de leucemias refractarias al primer tratamiento (13,1% versus 11,4%). Al evaluar el Odds Ratio, la adición de metformina al esquema de quimioterapia mostró ser un factor protector para que el paciente contara con una RFE al igual para que completara una respuesta a las cuatro semanas de tratamiento (OR; 0,2454 y 0,3062 respectivamente) (Ver Tabla 4 y Tabla 5).
DISCUSIÓN
La ausencia de respuesta a las cuatro semanas de inicio de tratamiento (RC) y la ausencia de RFE son factores que impactan en el pronóstico de los pacientes con LLA tanto en adultos como en pacientes pediátricos29,30. Para intentar mejorar el rendimiento del esquema de inducción se adicionó metformina a un medio de cultivo que contenía células leucémicas MOLT-4; la adición de metformina al modelo logró el arresto de las células en la etapa G0/G131,32.
Dentro de la gran cantidad de mecanismos antitumorales descritos para el clorhidrato de metformina los dos mecanismos principales se centran en el incremento del AMPc como en el bloqueo de la vía de señalización mTOR33,34. En este modelo se consideró que mTOR es el principal mecanismo de acción, ya que se encuentra implicada en los mecanismos de diferenciación de la células T y natural killer35,36. Existen pocos ensayos en líneas celulares hematológicas, uno de ellos realizado por Huai y colaboradores, en una línea celular de leucemia promielocítica demostraron que la adición de metformina mejora la respuesta sobre la diferenciación celular mediada por ácidotransretinóico37. Pan y colaboradores evidenciaron la eficacia de diversos fármacos antidiabéticos (metformina 500 μM y rosiglitazona 10 μM) en líneas celulares de leucemia linfoblástica en conjunto con quimioterapia (daunorrubicina, etoposido, L-asparaginasa) logrando un efecto sinérgico sobre la tasa de apoptosis38. Estos resultados son de gran utilidad ya que la mayoría de los fármacos utilizados durante la inducción a la remisión se analizaron en este modelo celular39.
Los ensayos in vivo también son limitados, pero semejante al ensayo de Honjo y colaboradores en cáncer de esófago, la adición de metformina mejora la respuesta a los diferentes tipos de quimioterapia reduciendo el tamaño del tumor40. A pesar de que los estudios se centran en la adición de metformina a regímenes de quimioterapia, existen ensayos que también han establecido su efecto al asociarse a la radioterapia, y muy escasos estudios analizan su adición a inhibidores de cinasa de tirosina como el gefitinib41,42. No existen ensayos clínicos que evalúen la adición de metformina a regímenes de tratamiento contra leucemia linfoblástica aguda como tampoco existe suficiente evidencia en la literatura acerca de la dosis óptima a emplear, por lo regular se emplean las dosis usadas en pacientes diabéticos33,41.
En hematología, se desconoce si metformina conserva dichos efectos sinérgicos con inhibidores de cinasa de tirosina que se utilizan rutinariamente en patologías como la leucemia mieloide crónica. Debido a esto, se llevarán a cabo ensayos sobre la línea celular K562 de leucemia mieloide crónica adicionando diferentes dosis de metformina a medios de cultivo con los tres inhibidores de cinasa de tirosina disponibles (imatinib, nilotinib, dasatinib).
CONCLUSIONES
En conclusión metformina posee efectos antitumorales in vitro al bloquear la progresión del ciclo celular, manteniéndolas en fase G0/G1 y G2/M, y disminuir significativamente la viabilidad celular. Adicionar metfomina durante la preinducción e inducción a la remisión fue un factor protector para que los pacientes alcanzaran la remisión completa y obtuvieran una RFE, esto último de relevancia clínica puesto que una RFE implica un pronóstico favorable. Sin embargo, para el caso particular de su adición al esquema de quimioterapia empleado en leucemias, aún se desconoce los posibles efectos sinérgicos que pueda tener con los inhibidores de cinasa de tirosina, fármacos de uso habitual en estos pacientes. Por ello el siguiente paso consistirá establecer si existen nuevos mecanismos antitumorales además de los ya descritos, y más relevante aún será la identificación de la dosis terapéutica óptima para llevar a cabo futuros ensayos clínicos más precisos, preferentemente doble ciegos, alatorizados y de amplio seguimiento.
FINANCIAMIENTO
Este trabajo fue apoyado por el CONACyT con el número de proyecto 80085 y 162269 y por la dirección de investigación del Hospital General de México DI/08/204/04/017 y DI/09/204/03/11.
CONFLICTO DE INTERÉS
Los autores declaran que no tienen algún tipo de conflicto de intereses para el desarrollo de este proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. World Health Organization; 2008. [ Links ]
2. Nath SV, Nicholson I, Tapp H, Zola H, Zannettino AC, Revesz T. Reticulin fibres anchor leukaemic blasts in the marrow of patients with acute lymphoblastic leukaemia. Med Hypotheses. 2011;77(3):333-5. [ Links ]
3. Hillman RS, Ault KA, Leporrier M, Rinder HM. The acute myeloid leukemias. Hematology in Clinical Practice. 5th ed. New York: McGraw-Hill; 2010. p. 215-28. [ Links ]
4. Jabbour E, O'Brien S, Konopleva M, Kantarjian H. New insights into the pathophysiology and therapy of adult acute lymphoblastic leukemia. Cancer. 2015. Doi: 10.1002/cncr.29383. [ Links ]
5. World Healt Organization[Internet]. International Agency for Research on Cancer. Lyon, France. Globocan 2012: Estimated Cancer Incidence, Mortality, and Prevalence Worldwide in 2012. 2015; [citado 15 Mar 2015]. Disponible en: http://globocan.iarc.fr/Default.aspx. [ Links ]
6. Hurtado-Monroy R, Solano-Estrada B, Vargas-Viveros P. Leucemia para el médico general. Rev Fac Med Univ Nac Auton Mex. 2012;55(2):11-25. [ Links ]
7. Rabin KR, Poplack DG. Management strategies in acute lymphoblastic leukemia. Oncology (Willist. Park). 2011;25(4):328-35. [ Links ]
8. Arteaga-Ortiz L, Buitrón-Santiago N, Rosas-López A, Rosas-Arzate G, Armengolt-Jiménez A, Aguayo A, et al. Acute lymphoblastic leukemia: experience in adult patients treated with hyperCVAD and 0195 Protocol, at the Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Cohort 2003-2007. Rev Invest Clin. 2008;60(6):459-69. [ Links ]
9. Ramos C, Rozen E, León M, Martínez TA, Olarte I, Catellanos H, et al. Results of treatment of acute lymphoblastic leukemia in two cohorts of Mexican patients. Rev Med Chil. 2011;139(9):1135-42. [ Links ]
10. Pathak P, Hess R, Weiss MA. Liposomal vincristine for relapsed or refractory Ph-negative acute lymphoblastic leukemia: a review of literature. Ther Adv Hematol. 2014;5(1):18-24. [ Links ]
11. Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia. Lancet. 2013;381(9881):1943-55. [ Links ]
12. Onciu M. Acute lymphoblastic leukemia. Hematol Oncol Clin North Am. 2009;23(4):655-74. [ Links ]
13. Rowe JM, Buck G, Burnett AK, Chopra R, Wiernik PH, Richards SM, et al. Induction therapy for adults with acute lymphoblastic leukemia: results of more than 1500 patients from the international ALL trial: MRC UKALL XII/ECOG E2993. Blood. 2005;106(12):3760-7. [ Links ]
14. Kantarjian H, Thomas D, O'Brien S, Cortes J, Giles F, Jeha S, et al. Long-term follow-up results of hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone (Hyper-CVAD), a dose-intensive regimen, in adult acute lymphocytic leukemia. Cancer. 2004;101(12):2788-801. [ Links ]
15. Papanas N, Maltezos E, Mikhailidis DP. Metformin and cancer: licence to heal? Expert Opin Investig Drugs. 2010;19(8):913-7. [ Links ]
16. Emami A, Fisel P, Nies AT, Schaeffeler E, Schwab M. Metformin and cancer: from the old medicine cabinet to pharmacological pitfalls and prospects. Trends Pharmacol Sci. 2013;34(2):126-35. [ Links ]
17. Rattan R, Ali Fehmi R, Munkarah A. Metformin: an emerging new therapeutic option for targeting cancer stem cells and metastasis. J Oncol. 2012;2012:1-12. [ Links ]
18. Van der Heijden MS, Bernards R. Inhibition of the PI3K pathway: hope we can believe in? Clin Cancer Res. 2010;16(12):3094-9. [ Links ]
19. Dowling RJ, Niraula S, Stambolic V, Goodwin PJ. Metformin in cancer: translational challenges. J Mol Endocrinol. 2012;48(3):R31-43. [ Links ]
20. Cufi S, Corominas-Faja B, Vazquez-Martin A, Oliveras-Ferraros C, Dorca J, Bosch-Barrera J, et al. Metformin-induced preferential killing of breast cancer initiating CD44+CD24-/low cells is sufficient to overcome primary resistance to trastuzumab in HER2+ human breast cancer xenografts. Oncotarget. 2012;3(4):395-8. [ Links ]
21. Bonanni B, Puntoni M, Cazzaniga M, Pruneri G, Serrano D, Guerrieri-Gonzaga A, et al. Dual Effect of Metformin on Breast Cancer Proliferation in a Randomized Presurgical Trial. J Clin Oncol. 2012;30(21):2593-600. [ Links ]
22. Chan DK, Miskimins WK. Metformin and phenethyl isothiocyanate combined treatment in vitro is cytotoxic to ovarian cancer cultures. J Ovarian Res. 2012;5(1):19. [ Links ]
23. Wu B, Li S, Sheng L, Zhu J, Gu L, Shen H, et al. Metformin inhibits the development and metastasis of ovarian cancer. Oncol Rep. 2012;28(3):903-8. [ Links ]
24. Grisouard J, Dembinski K, Mayer D, Keller U, Müller B, Christ- Crain M. Targeting AMP-activated protein kinase in adipocytes to modulate obesity-related adipokine production associated with insulin resistance and breast cancer cell proliferation. Diabetol Metab Syndr. 2011;3:16. [ Links ]
25. Bánhegyi RJ, Rus-Gal PO, Nagy AK, Martyin T, Wágner R, Varga R, et al. Antidiabetic therapy-a new possibility in the complex therapy of cancer? Magy Onkol. 2010;54(4):315-23. [ Links ]
26. McNeer JL, Nachman JB. The optimal use of steroids in paediatric acute lymphoblastic leukaemia: no easy answers. Br J Haematol. 2010;149(5):638-52. [ Links ]
27. Annino L, Vegna ML, Camera A, Specchia G, Visani G, Fioritoni G, et al. Treatment of adult acute lymphoblastic leukemia (ALL): long-term follow-up of the GIMEMA ALL 0288 randomized study. Blood. 2002;99(3):863-71. [ Links ]
28. National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE) [Internet]. 2010 [cited 2015 May 3]. Disponible in: http://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm#ctc_40 [ Links ]
29. Shah DS, Kumar R. Steroid resistance in leukemia. World J Exp Med. 2013;3(2):21-5. [ Links ]
30. Friedmann AM, Weinstein HJ. The role of prognostic features in the treatment of childhood acute lymphoblastic leukemia. Oncologist. 2000;5(4):321-8. [ Links ]
31. Zhao L, Wen ZH, Jia CH, Li M, Luo SQ, Bai XC. Metformin induces G1 cell cycle arrest and inhibits cell proliferation in nasopharyngeal carcinoma cells. Anat Rec (Hoboken). 2011;294(8):1337-43. [ Links ]
32. Luo Q, Hu D, Hu S, Yan M, Sun Z, Chen F. In vitro and in vivo anti-tumor effect of metformin as a novel therapeutic agent in human oral squamous cell carcinoma. BMC Cancer. 2012;12:517. [ Links ]
33. Suissa S, Azoulay L. Metformin and cancer: mounting evidence against an association. Diabetes Care. 2014;37(7):1786-8. [ Links ]
34. Del Barco S, Vazquez-Martin A, Cufí S, Oliveras-Ferraros C, Bosch-Barrera J, Joven J, et al. Metformin: multi-faceted protection against cancer. Oncotarget. 2011;2(12):896-917. [ Links ]
35. Shin J, Wang S, Deng W, Wu J, Gao J, Zhong XP. Mechanistic target of rapamycin complex 1 is critical for invariant natural killer T-cell development and effector function. Proc Natl Acad Sci U S A. 2014;111(8):776-83. [ Links ]
36. Maciolek J, Pasternak J, Wilson H. Metabolism of activated T lymphocytes. Curr Opin Immunol. 2014;27:60-74. [ Links ]
37. Huai L, Wang C, Zhang C, Li Q, Chen Y, Jia Y, et al. Metformin induces differentiation in acute promyelocytic leukemia by activating the MEK/ERK signaling pathway. Biochem Biophys Res Commun. 2012;422(3):398-404. [ Links ]
38. Pan J, Chen C, Jin Y, Fuentes-Mattei E, Velazquez-Tores G, Benito JM, et al. Differential impact of structurally different antidiabetic drugs on proliferation and chemosensitivity of acute lymphoblastic leukemia cells. Cell Cycle. 2012;11(12):2314-26. [ Links ]
39. Cornell R, Palmer J. Adult acute leukemia. Dis Mon. 2012;58(4):219-38. [ Links ]
40. Honjo S, Ajani J, Scott A, Chen Q, Skinner H, Stroehlein J, et al. Metformin sensitizes chemotherapy by targeting cancer stem cells and the mTOR pathway in esophageal cancer. Int J Oncol. 2014;45(2):567-74. [ Links ]
41. Sandulache V, Yang L, Skinner H. Use of biguanides to improve response to chemotherapy. Methods Mol Biol. 2014;1165:3-9. [ Links ]
42. Morgillo F, Sasso F, Della Corte C, Vitagliano D, D'Aiuto E, Troiani T, et al. Synergistic effects of metformin treatment in combination with gefitinib, a selective EGFR tyrosine kinase inhibitor, in LKB1 wild-type NSCLC cell lines. Clin Cancer Res. 2013;19(13):3508-19. [ Links ]