Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicas UIS
Print version ISSN 0121-0319
Medicas UIS vol.28 no.3 Bucaramanga Sep./Dec. 2015
https://doi.org/10.18273/revmed.v28n3-2015007
DOI: http://dx.doi.org/10.18273/revmed.v28n3-2015007
Consumo de ácido fólico en el embarazo y
reducción del riesgo de trastornos del espectro
autista
Diego Alejandro Rangel-Rivera*
Sonia Esperanza Osma-Zambrano**
* Estudiante de XII nivel de medicina. Hospital universitario de Santander. Facultad de Salud. Grupo de investigación en Genética Humana. Universidad Industrial de Santander. Liga médica colombiana, fundación. Bucaramanga. Santander. Colombia.
** Médico especialista en ginecología y obstetricia. Magister en epidemiología. Grupo PAIDOS. Escuela de medicina. Universidad Industrial de Santander. Bucaramanga. Santander. Colombia.
Correspondencia: Sr. Diego Rangel. Calle 32 # 32-70, apartamento 901B. Bucaramanga. Santander. Colombia.
Correo electrónico: dar_2333@hotmail.com
Artículo recibido el 03 de enero de 2015 y aceptado para publicación el 15 de julio de 2015.
RESUMEN
Introducción: El ácido fólico se considera una molécula fundamental durante el desarrollo cerebral fetal. No hay claridad sobre el beneficio de esta intervención durante el embarazo para la reducción del riesgo de trastornos del espectro autista. Objetivo: Analizar la evidencia disponible entre el consumo de ácido fólico en el período periconcepcional y la presencia de los trastornos del espectro autista a través de una revisión bibliográfica. Materiales y métodos: Búsqueda en base de datos Pubmed y Clinical Trials utilizando los términos MeSH: "folic acid", "autism"y "pregnancy". Se incluyeron artículos de revisión y originales, en inglés y español, sin importar fecha de publicación. Resultados y discusión: Con la estrategia de búsqueda se encontraron inicialmente 90 estudios potenciales pero después de aplicar los criterios de inclusión culmina en cuatro estudios observacionales, dos de casos y controles, uno de cohorte y un estudio ecológico donde se evalua la asociación en cuestión en dicho período crítico. Defectos en la metilación corregidos con la administración de suplementos de ácido fólico podrían explicar el potencial benéfico en la prevención de trastornos del espectro autista. Conclusiones: La evidencia es escasa y poco consistente en evaluar si la ingesta de ácido fólico durante el periodo periconcepcional se constituye en un factor protector para el desarrollo de los trastornos del espectro autista. MÉD UIS. 2015;28(3):327-36.
Palabras clave: Ácido fólico. Trastornos del espectro autista. Embarazo. Prevención primaria.
Periconceptional folic acid intake and risk reduction of autism spectrum disorders
ABSTRACT
Introduction: Folic acid is considered an key molecule during fetal brain development. There have been potential benefits of this intervention during pregnancy such as reducing the risk of autism spectrum disorders. Objective: To analyze the evidence of folic acid in the periconceptional period for the prevention of autism spectrum disorders through a literature review. Materials and methods: A search of scientific articles was conducted in PubMed data base and Clinical Trials during the months of August 2014 to March 2015. The MeSH terms used were "folic acid", "autism" and "pregnancy". Review and original articles in English and Spanish are included, regardless of date of publication. Results: Four observational studies were found where the association is evaluated: two case-control, one cohort and one ecological study. Contradictory results are described, associated with the methodology of the studies. Methylation defects corrected with supplementation of folic acid could explain the potential benefit in preventing autism spectrum disorders. Conclusions: The evidence limited and inconsistent establishing that the intake of folic acid during the periconceptional period constitutes a protective factor for the development of autism spectrum disorders. MÉD UIS. 2015;28(3):327-36.
Keywords: Folic acid. Autistic Disorder. Pregnancy. Primary Prevention.
¿Cómo citar este artículo?: Rangel-Rivera DA, Osma-Zambrano SE. Consumo de ácido fólico en el embarazo y reducción del riesgo de trastornos del espectro autista. MÉD UIS. 2015;28(3):327-36.
INTRODUCCIÓN
Las exposiciones ambientales pueden influir en el desarrollo cerebral durante diferentes etapas, incluyendo la formación y el cierre del tubo neural, la diferenciación y la migración celular, la formación de estructuras tales como columnas corticales, la sinaptogénesis y la mielinización. El ácido fólico se ha posicionado como un nutriente esencial en la dieta de las mujeres embarazadas, pues se ha demostrado la prevención de los defectos del cierre del tubo neural, cuando se administra antes y durante el primer trimestre del embarazo1,2.
La vitamina B9 resulta a su vez fundamental para la adecuada formación, crecimiento y mantenimiento de diversas estructuras del sistema nervioso central, por ello se han hallado otros posibles beneficios como la disminución del riesgo de trastornos severos del lenguaje y atención, esquizofrenia, resultados adversos del desarrollo neurológico, preeclampsia, bajo peso al nacer y parto pretérmino3-6. Las deficiencias en la dieta son particularmente comunes durante el embarazo debido al aumento en las demandas metabólicas hacia la unidad fetoplacentaria y se ha demostrado que influye en el desarrollo estructural y funcional7,8. Basados en estas observaciones y ante el afán de encontrar factores etiológicos a múltiples problemas neurológicos y por ende medidas preventivas, se han realizado estudios con el objeto de determinar el beneficio del consumo de ácido fólico en los hijos de madres que reciben esta intervención antes y durante la gestación.
TRASTORNOS DEL ESPECTRO AUTISTA
Los Trastornos del Espectro Autista (TEA) se consideran un grupo de enfermedades heterogéneas del neurodesarrollo en las cuales de manera característica se presenta afectación de tres aspectos principales: retrasos significativos del lenguaje y las aptitudes comunicativas (comunicación verbal y no verbal), alteraciones del lenguaje cuando este se desarrolla, alteraciones significativas de la conducta social recíproca, repertorio limitado y estrecho de intereses y conductas (relaciones sociales), y presencia de rutinas y comportamientos repetitivos, tales como arreglar objetos obsesivamente o seguir rutinas muy específicas que llevan a un comportamiento estereotipado y restringido6 con espectro clínico que varía desde cambios leves a severos. El manual diagnóstico y estadístico de enfermedades mentales en su cuarta edición clasifica los trastornos del espectro autista dentro de los trastornos generalizados del desarrollo. En este grupo de enfermedades se incluye: el autismo o trastorno autista, 299.00 Autistic Disorder; el síndrome de Asperger, 299.80 Asperger's Disorder; el desorden desintegrativo infantil, 299.10 Childhood Disintegrative Disorder; el síndrome de Rett, 299.80 Rett's Disorder; y, el trastorno generalizado del desarrollo no especificado, 299.80 Pervasive Developmental Disorder Not Otherwise Specified. En la quinta edición de este manual, se incluyen todas las enfermedades dentro de un mismo grupo conocido como trastorno del espectro autista, requiriendo especificar la presencia o no de alteración del desarrollo cognitivo, de alteraciones del lenguaje y si el paciente presenta enfermedad médica o trastorno del desarrollo neurológico asociado10.
La prevalencia de los TEA varía según las poblaciones estudiadas, reportándose estimados desde 4,8 hasta 21,2 afectados por cada 1000 niños11-14. En Estados Unidos para el año 2008 se estimó una prevalencia promedio de 11,3 casos por cada 1000 niños15. De esta manera, se describen diferencias en la distribución por género, siendo los niños los más afectados, con una prevalencia de 18,4 casos por cada 1 000 niños y cuatro casos por cada 1 000 niñas15. Es importante señalar una tendencia al aumento progresivo de la prevalencia de TEA, fenómeno observado principalmente en algunas regiones de Estados Unidos14,16. Es así, que para el año 1970, se reportó una prevalencia de 0,7 casos/1000 niños, en el año 1989, una prevalencia de 2,92 casos/1 000 niños y en el año 2002, 11 casos/1000 niños. Esta observación en el comportamiento epidemiológico puede ser explicado por la modificación de los criterios diagnósticos, la creación de servicios médicos orientados al diagnóstico de la enfermedad, el mayor conocimiento de la enfermedad por parte de la población general, un verdadero aumento del número de casos o una combinación de los anteriores.
Existen pocos datos sobre la incidencia y prevalencia de esta enfermedad en Latinoamérica. Sin embargo, algunos estudios muestran una prevalencia estimada entre 13 a 27 casos por 10 000 niños para países como Argentina, Venezuela y Brasil, estudios realizados entre los años 2004 y 200817-19. No existen cifras exactas de la incidencia y prevalencia de esta enfermedad en Colombia20.
Se han podido documentar ciertos hallazgos estructurales y funcionales en los pacientes con TEA. Entre ellos se destacan, alteraciones en la síntesis de serotonina; actividad cerebral diferente a la de personas sanas; disminución de células de Purkinje a nivel cerebeloso, alteración anatómica en los lóbulos frontal y temporal con presencia de columnas neuronales más numerosas pero más pequeñas y menos compactas, y alteraciones mesencefálicas y neocorticales21,22.
Aún se desconocen totalmente todos los procesos fisiopatológicos de este trastorno neurológico y por ello se han propuesto algunas hipótesis explicatorias. Actualmente, esta enfermedad se considera como el resultado de una combinación de factores genéticos y ambientales que alteran el desarrollo normal del sistema nervioso central21, 23. El componente genético se apoya en el riesgo aumentado de TEA entre hermanos y la asociación estrecha con ciertas enfermedades como síndrome de X frágil, alteraciones en brazo largo del cromosoma 15, síndrome de San Filippo, síndrome de Smith-Magenis, fenilcetonuria, síndrome de Angelman y síndrome de Smith-Lemli-Opitz21,24,25. Se considera como punto clave el descubrimiento de alteraciones en la secuenciación o en transcripción de genes que pudieran asociarse con los TEA. En los niños con antecedente de otro hermano con esta patología14, se describe un aumento del riesgo entre 6 a 18% de presentar TEA26. Igualmente, los cambios epigenéticos son meioticamente y mitóticamente hereditarios e incluyen la metilación del ADN, modificaciones de proteínas histonas, reordenación de cromatina y ARNs no codificantes27.
Por estudios en modelos animales, se ha observado que la metilación de los sitios CpG (regiones del ADN donde existe una gran concentración de pares de citosina y guanina enlazados por fosfatos) son potentes reguladores de la expresión génica y este proceso se ve afectado por varios factores externos entre ellos la dieta. Tales nutracéuticos incluyen moléculas que se prestan directamente donantes de metilo en el ciclo de activación de metilo o sirven como cofactores en estas vías, tales como la metionina, la piridoxina (vitamina B6), ácido fólico (vitamina B9), betaína (trimetilglicina), colina, vitamina B12 y zinc28.
Es por ello el interés creciente en los potenciales efectos protectores que los suplementos dietéticos pueden ejercer sobre estas marcas epigenéticas, muchos de estos compuestos están incluidos en vitaminas periconcepcionales y prenatales, debido a su capacidad para prevenir alteraciones del tubo neural y otros defectos del sistema nervioso central en el desarrollo de fetos; y otros beneficios para la salud. Se piensa que todos estos factores ejercen un papel clave, pero se ha hecho hincapié en el ácido fólico, por lo que se recomienda consumir a las mujeres entre 0,4 y 0,8 mg de ácido fólico un mes antes de la concepción y durante los primeros meses del embarazo1.
A continuación se revisan los otros factores ambientales estudiados en las últimas décadas, se postula asociación con la exposición postnatal a ciertos tóxicos disponibles a través del agua o aire29. Entre los metales pesados se destacan el mercurio, el plomo y el arsénico, bajas concentraciones en sangre de los anteriores se relacionan con alteraciones neurológicas como disminución en el coeficiente intelectual y alteraciones en la memoria30,31. La inmunización con vacunas que contienen timerosal, un compuesto organomercúrico, se ha propuesto como factor de riesgo para TEA, sin embargo, diversos estudios no han demostrado dicha asociación32-34. Algunos estudios apoyan el papel potencial de los pesticidas organofosforados en relación con TEA, así como exposiciones de ftalato35.
Actualmente, varios factores de estilo de vida materno han sido examinados en relación con TEA entre ellos el tabaquismo, alcoholismo, consumo de pescado como fuente de ácidos grasos y vitamina D, pero los estudios son contradictorios e inconsistentes por tanto se incrementa la brecha en el conocimiento de estos factores36-38. Para el diagnóstico de TEA es fundamental el concepto de "médico en casa" puesto que los padres son los primeros que suelen observar ciertas características que podrían corresponder a un trastorno del desarrollo21. Los principales síntomas y signos descritos son: tendencia al aislamiento, evitar miradas con otras personas, poca expresión frente al dolor, ausencia de sonrisa y en general, cualquier alteración en las habilidades sociales y del lenguaje correspondientes a su edad.
El enfoque diagnóstico se basa inicialmente en aplicación de pruebas de tamizaje propuestas para los niños con retardo en las habilidades comunicativas y sociales, antecedente de TEA en uno de sus hermanos y sospecha clínica. Existen diversas escalas de evaluación diseñadas según la edad del paciente. La prueba recomendada para los niños entre 18 a 24 meses es el Checklist for Autism in Toddler y para los pequeños entre 16 a 48 meses es el Modified Checklist for Autism in Toddler21. En los niños mayores se utilizan otros cuestionarios como el Autism- Spectrum Quotient-Child, aplicado a niños entre 4 a 11 años y el Autism Spectrum Screening Questionnaire para escolares y adolescentes entre los 7 a 16 años. Posteriormente, el diagnóstico definitivo se basa en los criterios del manual diagnóstico y estadístico de enfermedades mentales9.
El objetivo de este estudio fue revisar la literatura científica en cuanto a los estudios que evaluen la asociación entre el consumo de ácido fólico durante el embarazo y el riesgo de TEA en los hijos de estas madres. También, se revisan aspectos vinculados con una posible relación fisiopatológica que podría explicar esta asociación de acuerdo a lo descrito en la literatura.
MATERIALES Y MÉTODOS
La estrategia de búsqueda de la información se realizó en pubmed y Clinical Trial durante los meses comprendidos entre agosto de 2014 y marzo de 2015. Los términos MeSH utilizados fueron los siguientes: "folic acid", "autism" y "pregnancy". Se incluyeron monografìas, artículos de revisión y originales, en inglés y español, sin importar la fecha de publicación, con posibilidad de lectura de resumen.
Se encontraron un total de 90 artículos de los cuales cuatro cumplían con los criterios previamente mencionados, todos eran estudios observacionales: uno de cohorte, dos de casos y controles y un estudio ecológico. Para la organización bibliográfica se usó el manejador de bibliografía EndNote 5X®.
RESULTADOS
ÁCIDO FÓLICO COMO FACTOR PROTECTOR PARA TRASTORNOS DEL ESPECTRO AUTISTA
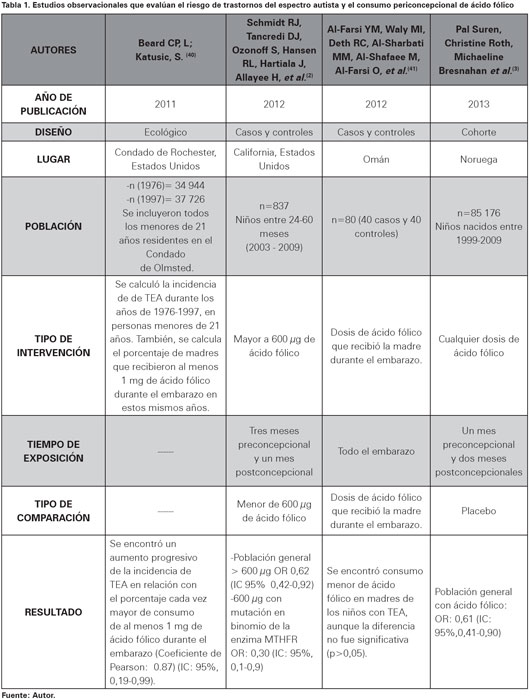
En el año 2012, Schmidt y cols39, publicaron los resultados de un estudio de casos y controles anidado en una cohorte poblacional que hizo parte del estudio Childhood Autism Risks from Genetics and Environment. Es el primer estudio observacional que examina el papel de la ingesta de ácido fólico por parte de la madre en la etiología de los casos de TEA en población general o estratificado por genotipo de la metilentetrahidrofolato reductasa, MTHFR 677 C> T40,41. Se incluyeron niños de edades entre 24 a 60 meses que nacieran y vivieran en California con al menos uno de sus padres. Para determinar el desenlace, es decir presencia de TEA, los autores utilizaron como prueba de tamizaje, las escalas de aprendizaje temprano de Mullen y conducta adaptativa de Vineland, y como prueba confirmatoria Autism Diagnostic Observation Schedule y The Autism Diagnostic Interview y se aplicaron los criterios DSM-4.
Se evaluó la exposición y consumo de ácido fólico desde tres meses antes de la concepción y durante el primer mes de embarazo39. Su medición se realizó por entrevista y encuesta vía telefónica que incluía la cantidad, la frecuencia, el momento de inicio del consumo y la marca comercial de la vitamina B9. Además, se realizaron pruebas de ADN con el objetivo de buscar polimorfismos del gen de la MTHFR.
Se detectaron 278 pacientes sin alteración en el neurodesarrollo o desarrollo típico; 429 con TEA y 130 con algún trastorno en el neurodesarrollo diferente de TEA. El consumo de ácido fólico fue referido en 89,6% de las madres con hijos que presentan desarrollo típico, 85,8% de las madres con hijos con TEA y 89,1% en las mujeres con hijos con trastornos en el neurodesarrollo diferente de TEA. El promedio de consumo de ácido fólico fue mayor para las madres de niños con desarrollo típico en comparación con las madres de niños con TEA, siendo mayor la diferencia observada durante el primer mes de embarazo (123,9±46,4 μg más de ácido fólico). Se evidenció que un consumo mayor de 600 μg/día de ácido fólico durante el primer mes de embarazo en las mujeres conlleva una reducción del riesgo para TEA, OR ajustado por nivel educativo y año de nacimiento del niño de 0,62 IC 95% (0,42-0,92). Sin embargo, en los análisis estratificados, esta asociación solo fue significativa cuando la madre o el niño presentaba el polimorfismo MTHFR 677 C>T de forma homocigota (Ver Tabla 1)39.
Además, en los test de tendencia se observó que el riesgo asociado de TEA disminuyó a medida que aumentó la ingesta materna de ácido fólico durante el primer mes de embarazo inclusive después de ajustar por nivel educativo de la madre y el año de nacimiento del niño. De esta manera, cuando el consumo de ácido fólico era de al menos 500 μg OR: 0,48 IC 95% (0,34- 1,81) y para consumo de al menos 1000 μg OR: 0,42 IC 95% (0,18-0,99)39.
En este estudio se demostró que a pesar de encontrarse una media informada de ingesta de ácido fólico que excede las cantidades recomendadas durante el embarazo, las madres de niños con desarrollo neurológico normal informaron mayor consumo promedio de ácido fólico durante el primer mes de embarazo y tenían más probabilidades de cumplir con estas recomendaciones durante el período periconcepción comparado con las madres de niños con TEA. Estos resultados se ajustaron por factores nutricionales sociodemográficos y otras variables de confusión.
Igualmente se observó una tendencia a la disminución del riesgo de trastornos de neurodesarrollo diferentes a TEA con la ingesta de dosis más altas de ácido fólico desde tres meses antes del embarazo, pero estas diferencias se atenuaron después del ajuste para la educación materna y el año de nacimiento del niño y no se observó después del ajuste para otros nutrientes. La precisión de los estimados se redujo sustancialmente en el modelo de nutrientes ajustados, por lo que estos resultados deben considerarse con cautela. Igualmente hay que considerar la naturaleza retrospectiva de este estudio en el establecimiento de causalidad pero los hallazgos sugieren que podría existir una ventana crítica durante el desarrollo embrionario y si se interviene podría prevenir la aparición de TEA.
El segundo estudio analizado fue realizado en el 2013 por el grupo de trabajo de Surén y colaboradores42 quienes evaluaron la asociación a través de un estudio prospectivo. El análisis se realizó con datos de la cohorte Norwegian Mother and Child Cohort Study que cuenta con 109 020 niños nacidos entre 1999 y 2009. Los niños con TEA fueron reclutados a través del estudio Autism Birth Cohort43. Los casos probables, seleccionados a partir de la sospecha parterna o profesional eran abordados con las pruebas Autism Diagnostic Interview-Revised y Autism Diagnostic Observation Schedule y se aplicaron los criterios del manual diagnóstico y estadístico de enfermedades mentales, cuarta edición. La evaluación del consumo de ácido fólico se realizó a través de un cuestionario aplicado en las semanas 18 y 22 de embarazo. El período de exposición evaluado en este estudio fueron las cuatro semanas antes de la concepción y las ocho semanas siguientes a esta.
Se diagnosticaron 270 casos de TEA (0,32%), distribuidos así: 114 (0,13%) con trastorno autista, 56 (0,07%) con síndrome de Asperger y 100 (0,12%) con trastorno generalizado del desarrollo no especificado. Se encontró una relación inversa entre el consumo de ácido fólico y el riesgo para autismo, con una incidencia 0,10% en los niños de madres con consumo de vitamina B9 frente a un 0,1% para las madres que no tomaban ácido fólico y tenían niños con trastorno autista. La asociación inversa entre el consumo de ácido fólico en varios momentos evaluados, un mes preconcepcional, primera y cuarta semana y cuatro a ocho semanas postconcepción y el riesgo para presentar autismo, inclusive después de ajustar por año de nacimiento, paridad y nivel de educación con un OR estimado 0,61 IC 95% (0,41-0,90) para las madres con esta intervención durante el embarazo temprano (Ver Tabla 1). Esta asociación no se mantuvo cuando se evaluó consumo en una etapa más avanzada de la gestación como las ventidós semanas, con un OR ajustado de 0,96 IC 95%(0,60- 1,55). En un análisis secundario se encontró que los suplementos de aceite de pescado no mostraron esta asociación con el trastorno autista, a pesar de que el uso de aceite de pescado se asoció con las mismas características de la madre como el consumo de ácido fólico42.
Surén y cols concluyen que el uso de suplementos de ácido fólico alrededor del momento de la concepción se asoció con un menor riesgo de trastorno autista en la cohorte estudiada. No se encontró asociación con el síndrome de Asperger o con trastorno generalizado del desarrollo no especificado pues el poder estadístico era limitado dada la baja prevalencia de TEA en la cohorte, la cual es similar a la observada en Noruega44.
ÁCIDO FÓLICO COMO FACTOR DE RIESGO
En Estados Unidos se ha observado un aumento en la incidencia de TEA desde 1998, año a partir del cual se instaura el programa de fortificación de alimentos con ácido fólico45. La relación temporal entre estos dos hechos ha permitido que autores como Leeming y Lucock46 y Rogers47 sugieran la posible asociación entre el consumo de ácido fólico y aumento del riesgo de TEA.
La primera premisa planteada por Leeming y Lucock sugiere que en los pacientes con mutaciones en la enzima dihidrofolato reductasa, quienes no metabolizan adecuadamente los suplementos farmacológicos de folato, estos permanecen en el organismo sin ser reducidos ocasionando efectos adversos especialmente sobre el desarrollo del sistema nervioso central debido a que su presencia disminuiría el metabolismo de otras moléculas como la 7,8-dihidrobiopterina, un metabolito de la síntesis de dopamina y serotonina, que se considera potencialmente dañino para el tejido cerebral. Leeming y Lucock argumentan que el aumento de folato en presencia de mutaciones en la dihidrofolato reductasa, conduce a un aumento de las concentraciones de 7,8-dihidrobiopterina, hallazgos similares a los observados al administrar suplementos de folato a pacientes quienes presentan bloqueo de la enzima antes mencionada por uso de medicamentos como el metotrexato48.
Rogers47 sugiere que las alteraciones en el metabolismo del ácido fólico derivadas de polimorfismos en la enzima MTHFR, conducen a altos nivel de homocisteína produciendo abortos debido a fenómenos trombóticos. Con el uso generalizado de ácido fólico se presenta un aumento en los niveles de folato disponible en el organismo, lo que conduce a mejoramiento en el desarrollo embrionario, con menores tasas de hiperhomocisteinemia y por lo tanto, menores tasas de aborto. La principal explicación expuesta por Rogers es que durante el período postnatal no se mantienen los niveles elevados de ácido fólico del período intrauterino, ocasionando un inadecuado desarrollo del sistema nervioso central, especialmente entre los cuatro a seis meses de edad postnatal, en donde se generarían las anormalidades que conducirían al desarrollo de TEA a consecuencia de los bajos niveles de 5-metiltetrahidrofolato49.
El tercer estudio lo realizó Beard y cols, quienes establecen una correlación entre los porcentajes de prescripción prenatal de al menos 1 mg de ácido fólico y las tasas de incidencia de autismo en el condado de Olmsted entre los años de 1976 a 1997. Se observó un aumento progresivo en la incidencia de autismo a través del tiempo. De manera similar, se describe una tendencia creciente de la prevalencia en el consumo de ácido fólico, siendo la prevalencia de consumo mayor a 1 mg diario en 1976 de 21,9% y 72,7% en el año 1990. El coeficiente de Pearson estimado fue 0,87 IC 95% (0,19-0,99). Ellos concluyen que si bien existe una relación temporal entre las variables anteriormente mencionadas, se requieren estudios de tipo prospectivo para confirmar esta asociación porque los resultados pueden ser producto de una falacia ecológica50.
Un estudio de casos y controles realizado por Al-Farsi y cols51 en Omán, país asiatico, evalúo el consumo de ácido fólico en el año previo al diagnóstico de autismo y se encontró una reducción en los niveles de acido fólico y vitamina B12 en los niños con TEA. Sin embargo, no se encontraron diferencias en el consumo prenatal de acido fólico entre los casos y los controles.
MECANISMO FISIOPATOLÓGICO PARA LA REDUCCIÓN DEL RIESGO
La causalidad de los TEA aún permanece desconocida. El grupo de Menezo52 en el 2011 fue el primero en sugerir la asociación entre los TEA y el folato, sentando las bases para los principios fundamentales actualmente propuestos. En primer lugar, la identificación de genes impresos hipometilados en los casos de TEA proporciona un vínculo plausible entre la disponibilidad de donantes de metilo y esta enfermedad. En segundo lugar, al observar patrones de expresión génica condicionados por múltiples factores extrínsecos como deficiencias nutricionales, exposición al estrés oxidativo, las infecciones y la inflamación, todos ellos pueden perturbar la señalización de la vía de la prostaglandina E2 y contribuir con la presencia de TEA.
Ha sido complejo comprender los mecanismos fisiopatológicos dado que se continuan describiendo diversos subconjuntos de genes candidatos en cada individuo con TEA. Además, existe una gran variabilidad de las diferencias fenotípicas sugiréndose que el componente ambiental exógeno puede contribuir en gran medida al desarrollo de TEA, por tanto se sostiene que su génesis es multifactorial. Sin embargo, uno de los subtipos, el síndrome de Rett, se ha asociado a la disfunción en el gen de la proteína 2 con dominio de unión a metil- CpG. Tanto la duplicación como la deleción del loci de este gen se ha vinculado a defectos del tubo neural y síntomas psiquiátricos. Esta enzima es esencial en la regulación de la transcripción de algunos genes. Las concentraciones de esta proteína son mayores en el sistema nervioso central comparado con otros tejidos53. La proteína 2 con dominio de unión a metil- CpG se ha vinculado a los TEA debido a su función en el desarrollo del sistema nervioso principalmente por la regulación del factor neurotrófico derivado del cerebro y el receptor 2 de glutamato, esenciales para adecuada formación del sistema nervioso central y una red neural funcional54. Estas dos proteínas dependen de una adecuada función de la proteína 2 con dominio de unión a metil-CpG, que de igual manera, requiere secuencias metiladas de ADN para su función.
Como ya se había mencionado previamente, varios estudios individuales y un metanálisis demuestran que los polimorfismos en el gen de la MTHFR, se asocian a un mayor riesgo de autismo, especialemente el C677T55,56. Su presencia ocasiona alteraciones a nivel del metabolismo del folato y la homocisteína que podrían modificar la metilación del ADN conduciendo a expresiones génicas erróneas.
De igual manera, se ha observado en hermanos afectados con TEA la existencia de alteraciones en regiones específicas del genoma, de las cuales las más frecuentemente alteradas son las secuencias que corresponden a los loci 15q11-13 y 7q21.3, donde se encuentran genes asociados al receptor GABA, factores de transcripción implicados en la diferenciación de neuronas gabaérgicas, enzimas implicadas en el metabolismo del colesterol HDL, proteína G asociada al receptor de calcitonina, entre otros57. Además, muchas de las regiones que aparecen alteradas corresponden o se encuentran cerca de secuencias con impronta genética, lo que genera más datos sugestivos acerca del origen epigenético de los TEA. Es así, que los defectos en la metilación de determinados genes se han asociado con mayor riesgo de autismo53,58,59.
Frustaci y cols60 realizaron un metanálisis para determinar marcadores de estrés oxidativo asociados a autismo. Se observó reducción en los niveles sanguíneos de metionina, glutatión, glutatión peroxidasa y cisteína mientras que un aumento de glutatión oxidado. Además, se ha observado daño tisular cerebral generado en ratones por reducción en la dieta de folato y aumento en la cantidad de glutatión oxidado29. Las anteriores afirmaciones sugieren que las alteraciones en la metilación derivadas del estrés oxidativo podrían conducir a modificaciones en la expresión génica asociadas a los TEA.
DISCUSIÓN
Los suplementos de ácido fólico continuan siendo nutracéuticos esenciales dentro de la dieta de la mujer en edad fértil, teniendo en cuenta los efectos protectores bien documentados sobre el sistema nervioso central del feto en desarrollo, principalmente por reducción entre 50% al 70% de los defectos del cierre del tubo neural. Continua en discusión cuál es la dosis recomendada de consumo periconcepcional pues hay varios estudios demostrando reducción de eventos adversos neurológicos y conductuales pero también otras investigaciones actuales presentan resultados contrarios.
A pesar del creciente número de estudios de investigación de la dieta y la nutrición de los niños afectados con TEA, muy poca investigación ha explorado directamente la nutrición materna periconcepcional en asociación con el riesgo de TEA en la descendencia. La evidencia que evalúa esta asociación es escasa y contradictoria, se plantea la necesidad de seguir realizando estudios de causalidad para poder concretar los efectos de esta intervención durante el embarazo, pues muchas de las limitaciones son de tipo metodológico61. De esta manera, no se puede afirmar con certeza y precisión que la administración de ácido fólico durante el embarazo en población general previene los TEA.
Como se explicó previamente, la adición de compuestos de folato a la dieta de las gestantes puede contribuir a mejorar el proceso de metilación del ADN, previniendo la expresión o el silenciamiento erróneo de genes específicos asociados a alteraciones en el desarrollo del sistema nervioso central, algunos relacionadas con los TEA. De esta manera se podría explicar la reducción de los casos de autismo descrito en las series de Schmidt39 y Surén42. Actualmente el momento más adecuado para la recomendación del ácido fólico es el primer mes de gestación, período en el cual se cierra el tubo neural y se generan cambios anatómicos del sistema nervioso central que se han encontrado en autopsias de pacientes con autismo como alteraciones en los núcleos motores de los pares craneales62. Por tanto, administrar ácido fólico en este primer período periconcepcional prevendría los defectos asociados a los TEA, tal y como lo ha estudiado y reportado Surén42.
Adicionalmente, la enzima MTHFR es esencial para la biosíntesis de ADN y el proceso epigenético de metilación del ADN, y sus polimorfismos de genes han sido implicados como factores de riesgo de defectos de nacimiento, trastornos neurológicos y algunos tipos de cáncer. Por tanto, es válida la recomendación de ácido fólico desde el período periconcepcional para reducir el riesgo de TEA en las madres y los niños con el metabolismo ineficiente del folato, es decir, un polimorfismo de un solo nucleótido en la MTHFR, genotipo, MTHFR 677 C> T39.
También se ha evaluado el acido fólico con opción terapeútica, entre ellos un ensayo clínico con veinte hombres y mujeres con trastornos genéticos que cursan con síntomas autistas, incluyendo el síndrome X frágil y el síndrome de Rett, con beneficio reportado solo a edad temprana63. Un subgrupo de niños con TEA o síntomas autistas presentan deficiencia de folato cerebral, posiblemente como resultado de autoanticuerpos del receptor de folato en suero los cuales bloquean el sitio de unión de los receptores y obstaculizan el transporte a través de la barrera hematoencefálica64.
Actualmente cursa un estudio prospectivo con 22 000 familias65 que busca responder ésta pregunta de investigación durante el período periconcepcional con seguimiento a 15 años. A pesar que los desenlaces primarios son leucemia linfoblástica aguda y otros tipos de cáncer en la descendencia, también se analizará la relación entre el ácido fólico y los TEA, diabetes, hipertensión arterial, asma, entre otros.
CONCLUSIONES
La evidencia actual es insuficiente y contradictoria en apoyar la administración de suplementos de ácido fólico en el embarazo para la prevención de TEA. El argumento más sólido que establece la relación inversa encontrada en los estudios de Suren y Schmidt, es la hipótesis de la presencia de estrés oxidativo y dificultades para la metilación del ADN que generan expresión génica errónea. Los estudios apoyan la idea de que la ingesta de ácido fólico durante el período periconcepcional podría constituir un factor protector para el desarrollo de los TEA, especialmente en pacientes con alteraciones en el metabolismo o utilización de los metabolitos del ácido fólico. Se necesitan más estudios para explorar los efectos integrales que las dietas maternas y los suplementos prenatales tienen sobre el epigenoma de la descendencia y la salud general posterior. Es necesario continuar revisando los resultados de esta línea de investigación y esperar más evidencia sólida para mejorar el soporte de las recomendaciones en el campo de la salud sexual y reproductiva.
CONFLICTO DE INTERÉS
Los autores no declaran ninguno.
REFERENCIAS BIBLIOGRÁFICAS
1. Werler MM, Shapiro S, Mitchell AA. Periconceptional folic acid exposure and risk of occurrent neural tube defects. JAMA. 1993;269(10):1257-61. [ Links ]
2. Berry RJ, Li Z, Erickson JD, Li S, Moore CA, Wang H, et al. Prevention of neural-tube defects with folic acid in China. China- U.S. Collaborative Project for Neural Tube Defect Prevention. N Engl J Med. 1999;341(20):1485-90. [ Links ]
3. Song S, Wang W, Hu P. Famine, death, and madness: schizophrenia in early adulthood after prenatal exposure to the Chinese Great Leap Forward Famine. Soc Sci Med. 2009;68(7):1315-21. [ Links ]
4. Roth C, Magnus P, Schjolberg S, Stoltenberg C, Suren P, McKeague IW, et al. Folic acid supplements in pregnancy and severe language delay in children. JAMA. 2011;306(14):1566-73. [ Links ]
5. Catov JM, Bodnar LM, Ness RB, Markovic N, Roberts JM. Association of periconceptional multivitamin use and risk of preterm or small-for-gestational-age births. Am J Epidemiol. 2007;166(3):296-303. [ Links ]
6. Catov JM, Nohr EA, Bodnar LM, Knudson VK, Olsen SF, Olsen J. Association of periconceptional multivitamin use with reduced risk of preeclampsia among normal-weight women in the Danish National Birth Cohort. Am J Epidemiol. 2009;169(11):1304-11. [ Links ]
7. Institute of Medicine. Nutrition During Pregnancy: Part I Weight Gain: Part II Nutrient Supplements. Washington (DC)1990. [ Links ]
8. Picciano MF. Pregnancy and lactation: physiological adjustments, nutritional requirements and the role of dietary supplements. J Nutr. 2003;133(6):1997S-2002S. [ Links ]
9. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. Fourth Edition (DSM-4). 2000. [ Links ]
10. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. Fifth Edition (DSM-5). 2013. [ Links ]
11. Fombonne E. Epidemiology of autistic disorder and other pervasive developmental disorders. J Clin Psychiatry. 2005;66(Suppl 10):3-8. [ Links ]
12. Prevalence of autism spectrum disorders-autism and developmental disabilities monitoring network, 14 sites, United States, 2002. MMWR Surveill Summ. 2007;56(1):12-28. [ Links ]
13. Prevalence of autism spectrum disorders - Autism and Developmental Disabilities Monitoring Network, United States, 2006. MMWR Surveill Summ. 2009;58(10):1-20. [ Links ]
14. Fombonne E. Epidemiology of pervasive developmental disorders. Pediatr Res. 2009;65(6):591-8. [ Links ]
15. Autism and Developmental Disabilities Monitoring Network Surveillance Year 2008 Principal Investigators, Centers for Disease Control and Prevention. Prevalence of autism spectrum disorders--Autism and Developmental Disabilities Monitoring Network, 14 sites, United States, 2008. MMWR Surveill Summ. 2012;61(3):1-19. [ Links ]
16. Williams JG, Higgins JP, Brayne CE. Systematic review of prevalence studies of autism spectrum disorders. Arch Dis Child. 2006;91(1):8-15. [ Links ]
17. Lejarraga H, Menendez AM, Menzano E, Guerra L, Biancato S, Pianelli P, et al. Screening for developmental problems at primary care level: a field programme in San Isidro, Argentina. Paediatr Perinat Epidemiol. 2008;22(2):180-7. [ Links ]
18. Montiel-Nava C, Peña JA. Epidemiological findings of pervasive developmental disorders in a Venezuelan study. Autism. 2008;12(2):191-202. [ Links ]
19. Paula CS, Ribeiro SH, Fombonne E, Mercadante MT. Brief report: prevalence of pervasive developmental disorder in Brazil: a pilot study. J Autism Dev Disord. 2011;41(12):1738-42. [ Links ]
20. Talero-Gutiérrez C, Rodríguez M, De La Rosa D, Morales G, Vélez-Van-Meerbeke A. Profile of children and adolescents with autism spectrum disorders in an institution in Bogota, Colombia. Neurologia. 2012;27(2):90-6. [ Links ]
21. Johnson CP, Myers SM. Identification and evaluation of children with autism spectrum disorders. Pediatrics. 2007;120(5):1183-215. [ Links ]
22. Pickett J, London E. The neuropathology of autism: a review. J Neuropathol Exp Neurol. 2005;64(11):925-35. [ Links ]
23. Muhle R, Trentacoste SV, Rapin I. The genetics of autism. Pediatrics. 2004;113(5):e472-86. [ Links ]
24. Cohen D, Pichard N, Tordjman S, Baumann C, Burglen L, Excoffier E, et al. Specific genetic disorders and autism: clinical contribution towards their identification. J Autism Dev Disord. 2005;35(1):103-16. [ Links ]
25. Grafodatskaya D, Chung B, Szatmari P, Weksberg R. Autism spectrum disorders and epigenetics. J Am Acad Child Adolesc Psychiatry. 2010;49(8):794-809. [ Links ]
26. Ozonoff S, Young GS, Carter A, Messinger D, Yirmiya N, Zwaigenbaum L, et al. Recurrence risk for autism spectrum disorders: a Baby Siblings Research Consortium study. Pediatrics. 2011;128(3):e488-95. [ Links ]
27. Rosenfeld CS. Animal models to study environmental epigenetics. Biol Reprod. 2010;82(3):473-88. [ Links ]
28. Albertini DF. Folate forever--all methyl group donations welcome!. J Assist Reprod Genet. 2013;30(5):607-8. [ Links ]
29. Deth R, Muratore C, Benzecry J, Power-Charnitsky VA, Waly M. How environmental and genetic factors combine to cause autism: A redox/methylation hypothesis. Neurotoxicology. 2008;29(1):190-201. [ Links ]
30. Calderon J, Navarro ME, Jimenez-Capdeville ME, Santos-Diaz MA, Golden A, Rodriguez-Leyva I, et al. Exposure to arsenic and lead and neuropsychological development in Mexican children. Environ Res. 2001;85(2):69-76. [ Links ]
31. Wright RO, Amarasiriwardena C, Woolf AD, Jim R, Bellinger DC. Neuropsychological correlates of hair arsenic, manganese, and cadmium levels in school-age children residing near a hazardous waste site. Neurotoxicology. 2006;27(2):210-6. [ Links ]
32. Madsen KM, Hviid A, Vestergaard M, Schendel D, Wohlfahrt J, Thorsen P, et al. A population-based study of measles, mumps, and rubella vaccination and autism. N Engl J Med. 2002;347(19):1477-82. [ Links ]
33. Wilson K, Mills E, Ross C, McGowan J, Jadad A. Association of autistic spectrum disorder and the measles, mumps, and rubella vaccine: a systematic review of current epidemiological evidence. Arch Pediatr Adolesc Med. 2003;157(7):628-34. [ Links ]
34. Schultz ST. Does thimerosal or other mercury exposure increase the risk for autism? A review of current literature. Acta Neurobiol Exp (Wars). 2010;70(2):187-95. [ Links ]
35. Harari R, Julvez J, Murata K, Barr D, Bellinger DC, Debes F, et al. Neurobehavioral deficits and increased blood pressure in school-age children prenatally exposed to pesticides. Environ Health Perspect. 2010;118(6):890-6. [ Links ]
36. Lee BK, Gardner RM, Dal H, Svensson A, Galanti MR, Rai D, et al. Brief report: maternal smoking during pregnancy and autism spectrum disorders. J Autism Dev Disord. 2012;42(9):2000-5. [ Links ]
37. Tran PL, Lehti V, Lampi KM, Helenius H, Suominen A, Gissler M, et al. Smoking during pregnancy and risk of autism spectrum disorder in a Finnish National Birth Cohort. Paediatr Perinat Epidemiol. 2013;27(3):266-74. [ Links ]
38. Eliasen M, Tolstrup JS, Nybo Andersen AM, Gronbaek M, Olsen J, Strandberg-Larsen K. Prenatal alcohol exposure and autistic spectrum disorders-a population-based prospective study of 80,552 children and their mothers. Int J Epidemiol. 2010;39(4):1074-81. [ Links ]
39. Schmidt RJ, Tancredi DJ, Ozonoff S, Hansen RL, Hartiala J, Allayee H, et al. Maternal periconceptional folic acid intake and risk of autism spectrum disorders and developmental delay in the CHARGE (CHildhood Autism Risks from Genetics and Environment) case-control study. Am J Clin Nutr. 2012;96(1):80-9. [ Links ]
40. Ramaekers VT, Blau N, Sequeira JM, Nassogne MC, Quadros EV. Folate receptor autoimmunity and cerebral folate deficiency in low-functioning autism with neurological deficits. Neuropediatrics. 2007;38(6):276-81. [ Links ]
41. James SJ, Melnyk S, Fuchs G, Reid T, Jernigan S, Pavliv O, et al. Efficacy of methylcobalamin and folinic acid treatment on glutathione redox status in children with autism. Am J Clin Nutr. 2009;89(1):425-30. [ Links ]
42. Suren P, Roth C, Bresnahan M, Haugen M, Hornig M, Hirtz D, et al. Association between maternal use of folic acid supplements and risk of autism spectrum disorders in children. JAMA. 2013;309(6):570-7. [ Links ]
43. Stoltenberg C, Schjolberg S, Bresnahan M, Hornig M, Hirtz D, Dahl C, et al. The autism birth cohort: a paradigm for gene-environment-timing research. Mol Psychiatry. 2010;15(7):676-80. [ Links ]
44. Suren P, Bakken IJ, Aase H, Chin R, Gunnes N, Lie KK, et al. Autism spectrum disorder, ADHD, epilepsy, and cerebral palsy in Norwegian children. Pediatrics. 2012;130(1):152-8. [ Links ]
45. Crider KS, Bailey LB, Berry RJ. Folic acid food fortification-its history, effect, concerns, and future directions. Nutrients. 2011;3(3):370-84. [ Links ]
46. Leeming RL, M. Autism: is there a folate connection ?. J Inherit Metab Dis. 2009;32(3):400-2. [ Links ]
47. Rogers EJ. Has enhanced folate status during pregnancy altered natural selection and possibly autism prevalence ? A closer look at a possible link. Med Hypotheses. 2008;71(3):406-10. [ Links ]
48. Leeming RJ, Blair JA, Melikian V, O'Gorman DJ. Biopterin derivatives in human body fluids and tissues. J Clin Pathol. 1976;29(5):444-51. [ Links ]
49. Ramaekers VT, Hausler M, Opladen T, Heimann G, Blau N. Psychomotor retardation, spastic paraplegia, cerebellar ataxia and dyskinesia associated with low 5-methyltetrahydrofolate in cerebrospinal fluid: a novel neurometabolic condition responding to folinic acid substitution. Neuropediatrics. 2002;33(6):301-8. [ Links ]
50. Beard CM, Panser LA, Katusic SK. Is excess folic acid supplementation a risk factor for autism ?. Med Hypotheses. 2011;77(1):15-7. [ Links ]
51. Al-Farsi YM, Waly MI, Deth RC, Al-Sharbati MM, Al-Shafaee M, Al-Farsi O, et al. Low folate and vitamin B12 nourishment is common in Omani children with newly diagnosed autism. Nutrition. 2013;29(3):537-41. [ Links ]
52. Menezo Y, Mares P, Cohen M, Brack M, Viville S, Elder K. Autism, imprinting and epigenetic disorders: a metabolic syndrome linked to anomalies in homocysteine recycling starting in early life ?. J Assist Reprod Genet. 2011;28(12):1143-5. [ Links ]
53. Currenti SA. Understanding and determining the etiology of autism. Cell Mol Neurobiol. 2010;30(2):161-71. [ Links ]
54. Lv J, Xin Y, Zhou W, Qiu Z. The epigenetic switches for neural development and psychiatric disorders. J Genet Genomics. 2013;40(7):339-46. Epub 2013 May 9. [ Links ]
55. Guo T, Chen H, Liu B, Ji W, Yang C. Methylenetetrahydrofolate reductase polymorphisms C677T and risk of autism in the Chinese Han population. Genet Test Mol Biomarkers. 2012;16(8):968-73. Epub 2012 Jul 9. [ Links ]
56. Pu D, Shen Y, Wu J. Association between MTHFR Gene Polymorphisms and the Risk of Autism Spectrum Disorders: A Meta-Analysis. Autism Res. 2013;6(5):384-92. Epub 2013 May 7. [ Links ]
57. Schanen NC. Epigenetics of autism spectrum disorders. Hum Mol Genet. 2006;15 Spec No 2:R138-50. [ Links ]
58. Gregory SG, Connelly JJ, Towers AJ, Johnson J, Biscocho D, Markunas CA, et al. Genomic and epigenetic evidence for oxytocin receptor deficiency in autism. BMC Med. 2009;7:62. [ Links ]
59. LaSalle JM. A genomic point-of-view on environmental factors influencing the human brain methylome. Epigenetics. 2011;6(7):862-9. Epub 2011 Jul 1. [ Links ]
60. Frustaci A, Neri M, Cesario A, Adams JB, Domenici E, Dalla Bernardina B, et al. Oxidative stress-related biomarkers in autism: systematic review and meta-analyses. Free Radic Biol Med. 2012;52(10):2128-41. Epub 2012 Apr 18. [ Links ]
61. Castro K, Klein LD, Baronio D, Gottfried C, Riesgo R, Perry IS. Folic acid and autism: What do we know? Nutr Neurosci. 2014. [ Links ]
62. Rodier PM, Ingram JL, Tisdale B, Nelson S, Romano J. Embryological origin for autism: developmental anomalies of the cranial nerve motor nuclei. J Comp Neurol. 1996;370(2):247-61. [ Links ]
63. Froster-Iskenius U, Bödeker K, Oepen T, Matthes R, Piper U, Schwinger E. Folic acid treatment in males and females with fragile-(X)-syndrome. Am J Med Genet. 1986;23(1-2):273-89. [ Links ]
64. Ramaekers VT, Blau N. Cerebral folate deficiency. Dev Med Child Neurol. 2004;46(12):843-51. [ Links ]
65. Linet M. Follow-up Study of Late Effects of Periconceptional Folic Acid in Mothers and Offspring in the Community Intervention Program Population: The Chinese Children and Families Study. 2011 [updated 2013/05/23]. Available from: http://clinicaltrials.gov/show/NCT01365975Program Population: The Chinese Children and Families Study. 2011 [updated 2013/05/23]. Available from: http://clinicaltrials.gov/show/NCT01365975. [ Links ]