Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicas UIS
Print version ISSN 0121-0319
Medicas UIS vol.29 no.2 Bucaramanga May/Aug. 2016
https://doi.org/10.18273/revmed.v29n2-2016003
DOI: http://dx.doi.org/10.18273/revmed.v29n2-2016003
Resistencia a isoniazida y rifampicina en aislados
de Mycobacterium tuberculosis en pacientes
con coexistencia de tuberculosis y Virus de la
Inmunodeficiencia Humana, Colombia 2010 -
2012
Claudia Llerena-Polo*
Angélica Valbuena Arias**
Angie Paola Zabaleta-Vanegas***
* Bacterióloga. Magister en Ciencias Biológicas. Grupo de Micobacterias. Subdirección Laboratorio Nacional de Referencia. Dirección Redes en Salud Pública. Instituto Nacional de Salud. Bogotá. Colombia.
** Bacterióloga. Grupo de Micobacterias. Subdirección Laboratorio Nacional de Referencia. Dirección Redes en Salud Pública. Instituto Nacional de Salud. Bogotá. Colombia.
*** Bacterióloga. Especialista en Epidemiología. Grupo de Micobacterias. Subdirección Laboratorio Nacional de Referencia. Dirección Redes en Salud Pública. Instituto Nacional de Salud. Bogotá. Colombia.
Correspondencia: Sra. Claudia Llerena-Polo. Dirección: Avenida Calle 26 N° 51-20, Grupo de Micobacterias. Subdirección Laboratorio Nacional de Referencia. Dirección Redes en Salud Pública. Instituto Nacional de Salud. Bogotá. Colombia. Teléfono: (+571) 220-7700, 1260. Correo electrónico: cllerena@ins.gov.co
Los datos preliminares de este trabajo fueron presentados mediante charla en el XIII Encuentro científico del Instituto Nacional de Salud "Conocimiento, innovación y liderazgo en salud pública", realizado del 10 al 13 de septiembre de 2013 en la ciudad de Bogotá. Colombia.
Artículo recibido el 03 de octubre de 2015 y aceptado para publicación el 30 de marzo de 2016.
RESUMEN
Introducción: la coexistencia de tuberculosis y el Virus de la Inmunodeficiencia Humana es un evento grave en salud pública que incrementa el riesgo de muerte, para el año 2013 la Organización Mundial de la Salud estimó nueve millones de personas con tuberculosis en el mundo, 1,1 millones (13%) serian positivos al Virus de la Inmunodeficiencia Humana y de estos, 360 000 morirían por esta causa. Objetivo: determinar la prevalencia de la resistencia a isoniazida y rifampicina en pacientes con coexistencia de tuberculosis y el Virus de la Inmunodeficiencia Humana durante los años 2010 a 2012. Materiales y Métodos: análisis de una serie de casos, que incluyo 902 casos de tuberculosis con coexistencia del Virus de la Inmunodeficiencia Humana; donde se evaluaron las variables de procedencia, sexo, edad, tipo de muestra y patrón de resistencia en casos nuevos y previamente tratados. Resultados: el 78,4% de los casos eran de sexo masculino, la mediana de edad fue 34 años, se identificó multirresistencia en casos nuevos en un 3,6% y una resistencia a isoniazida y rifampicina de 6,7% y 1,4% respectivamente. En los casos previamente tratados la multirresistencia fue de 16,2%, la resistencia a isoniazida de 6,3% y a rifampicina de 3,7%. Conclusión: se evidenció que la presencia de resistencia es mayor en previamente tratados, en casos nuevos se observó resistencia a rifampicina sin ser multirresistentes, algo que no se documentó en la última encuesta nacional, estos hallazgos indican que es fundamental realizar prueba de sensibilidad. MÉD.UIS. 2016;29(2):31-9.
Palabras clave: Mycobacterium tuberculosis. Tuberculosis. Tuberculosis Resistente a Múltiples Medicamentos. VIH.
Isoniazid and rifampicin resistance in Mycobacterium tuberculosis isolated in patients with
coexisting tuberculosis and Human Immunodeficiency Virus, Colombia 2010 - 2012
ABSTRACT
Introduction: the coexistence of tuberculosis and HIV is a serious public health event that increases the risk of death by 2013 the World Health Organization estimated nine million people with tuberculosis in the world, 1,1 million (13%) would be positive to HIV and of these, 360 000 would die for this cause. Objective: to determine the prevalence of resistance to isoniazid and rifampicin in patients with coexisting tuberculosis and HIV during the years 2010 to 2012. Methods: analysis of a number of cases, which included 902 cases of tuberculosis with coexistence of HIV, the variables of origin, sex, age, sample type and pattern of resistance in new cases were evaluated and previously treated. Results: 78.4% of cases were male, the median age was 34 years multidrug resistance was identified in new cases and 3.6% resistance to isoniazid and rifampicin 6.7% and 1, 4% respectively. In cases previously treated multidrug resistance was 16.2%, resistance to isoniazid and rifampicin 6.3% from 3.7%. Conclusion: it was shown that the presence of drug resistance is higher in previously treated patients; in new cases rifampicin resistance without being multiresistant, something that was not documented in the latest national survey, these findings indicate that it is essential to conduct sensitivity test. MÉD.UIS. 2016;29(2):31-9.
Keywords: Mycobacterium tuberculosis. Tuberculosis. Tuberculosis, Multidrug-Resistance. HIV.
¿Cómo citar este artículo?: Llerena-Polo C, Valbuena A, Zabaleta-Vanegas AP. Resistencia a isoniazida y rifampicina en aislados de Mycobacterium tuberculosis en pacientes con coexistencia de tuberculosis y Virus de la Inmunodeficiencia Humana, Colombia 2010 - 2012. MÉD.UIS. 2016;29(2):31-9.
INTRODUCCIÓN
La coinfección entre la Tuberculosis (TB) y el Virus de la Inmunodeficiencia Humana (VIH) es un evento grave que incrementa el riesgo de muerte en los individuos afectados, debido a la disminución de los linfocitos T CD4, células importantes en la respuesta inmune contra esta enfermedad. Para el año 2013 la Organización Mundial de la Salud (OMS) estimó que nueve millones de personas desarrollarían TB en el mundo, 1,1 millones (13%) serían VIH positivos y de estos 360 000 morirían por esta causa1-3.
En cuanto a la TB Multirresistente (TB-MDR) definida como la resistencia simultánea a los fármacos isoniazida y rifampicina, para ese mismo año se estimaron 300 000 casos nuevos y solo se notificaron 136 000. Las cifras de detección en el mundo son estables en los últimos años, aunque existe una brecha entre los casos estimados y los diagnosticados. La TB Extensamenterresistente (TB-XDR), se presenta en los casos de TB-MDR que adicionalmente tienen resistencia a quinolonas e inyectables, para el 2013, del total de casos multirresistentes notificados en el mundo, el 9% presentó esta forma de la enfermedad2.
En Colombia para el año 2013, se notificaron al Sistema Nacional de Vigilancia (Sivi gila ) 12 062 casos de TB, se registraron 629 muertes, y en el 10,4% de estas se debió a esta enfermedad, las personas con coinfección fueron 1 489 (12%); las entidades territoriales con más personas afectadas fueron: Antioquia, Valle del Cauca y el Distrito de Bogotá. En cuanto a la TB-MDR, desde el año 2010 al 2013 se han diagnosticado aproximadamente 500 casos, con una tendencia al aumento, adicionalmente se identifican cerca de 250 casos de TB farmacorresistente categoría que incluye los resistentes a isoniazida o rifampicina sin ser casos de TB-MDR4,5.
Los mecanismos de resistencia de Mycobacterium tuberculosis son diferentes a los que se encuentran en otras especies bacterianas, se originan por mutaciones cromosómicas que se presentan con determinada frecuencia, teniendo en cuenta el número de bacilos que están en multiplicación y la exposición a fármacos antituberculosis; también se pueden producir por rearreglos en regiones del genoma que son independientes de la exposición a los medicamentos, o por la presencia de bombas de eflujo en la pared celular6,7.
La condición de coexistencia de TB-VIH hace que el diagnóstico en estos pacientes sea complejo, los resultados de la baciloscopia y cultivo son generalmente negativos, con signos y síntomas inespecíficos y menos frecuentes, produciendo una rápida progresión de la enfermedad a formas graves que aumentan las tasas de mortalidad por TB en esta población8.
La aparición de resistencia está asociada a la coinfección entre estos dos patógenos, ensayos clínicos han demostrado que las personas infectadas con VIH tienen un mayor riesgo de desarrollar enfermedades de tipo gastrointestinal, que producen niveles séricos bajos de fármacos antituberculosis, entre ellos tenemos el síndrome de mala absorción intestinal relacionado con la rifampicina, también se produce biovariabilidad de isoniazida, etambutol y pirazinamida en individuos acetiladores rápidos; así la pobre absorción de medicamentos y múltiples alteraciones en el perfil farmacocinético se convierten en factores que contribuyen a generar resistencia adquirida a los fármacos antituberculosis que se describen entre un 2 al 5% de los casos de TB-VIH. El tratamiento en estos pacientes requiere más tiempo y la administración de medicamentos menos efectivos, que generalmente producen mayores efectos secundarios, en especial cuando se administran con antirretrovirales, el panorama se complica, con la aparición de casos de TB-XDR debido a que las opciones terapéuticas son más reducidas3,6,8.
En pacientes de TB con inmunodeficiencia avanzada se complica el seguimiento debido a las interacciones medicamentosas que se presentan entre la rifampicina y los antirretrovirales, favoreciendo la aparición del síndrome de reconstitución inflamatoria inmune que incrementa la perdida al seguimiento del tratamiento (abandono) y con ello la probabilidad de aparición de aislamientos resistentes a los fármacos antituberculosis3,9-11.
El Programa Nacional de Control de la Tuberculosis ha incorporado dentro de sus lineamientos las recomendaciones de la Organización Mundial de la Salud y la Organización Panamericana de la Salud, con las que se busca detener y reducir la incidencia de TB, las actividades se encuentran definidas en el Plan Estratégico Nacional "Colombia Libre de Tuberculosis 2010-2015" con una línea de abordaje que incluye el diagnóstico de TB en personas con VIH a través de consejería y prueba en aquellos individuos que así lo consientan, así mismo, establece la vigilancia de la resistencia a fármacos antituberculosis como prioridad con la Circular 058 del año 200912,13.
Actualmente, el país cuenta con pocos estudios que proporcionan información específica de resistencia a isoniazida y rifampicina en los pacientes con coexistencia de VIH, el objetivo de este trabajo es determinar la prevalencia de la resistencia en los aislados procesados en esta población por la red nacional de laboratorios durante los años 2010 a 2012.
MATERIALES Y MÉTODOS
Se hizo un análisis de una serie de casos con toma de información retrospectiva en personas identificadas como TB-VIH, las fuentes de los datos fueron los formatos únicos de vigilancia de las micobacterias, las bases de datos que consignan los resultados de pruebas de sensibilidad de los laboratorios de la red y el Laboratorio Nacional de Referencia (LNR).
Se incluyeron los aislados de Mycobacterium tuberculosis en que se obtuvo resultado de prueba de sensibilidad a los fármacos isoniazida y rifampicina, no se realizó un cálculo de tamaño de muestra. Se excluyeron aquellos que correspondían a micobacterias no tuberculosas y presentaron contaminación o poca viabilidad de la micobacteria. Los aislados fueron procesados por las metodologías BACTEC MGIT™ 960® en el LNR de acuerdo a las instrucciones del fabricante y proporciones en medio Löwenstein Jensen en los Laboratorios de Salud Pública de Atlántico y Antioquia14-6.
Las variables analizadas fueron procedencia geográfica, sexo, edad, tipo de tuberculosis (pulmonar o extrapulmonar) definida por la procedencia anatómica de la muestra sembrada. Los casos fueron clasificados como nuevos (paciente que no recibió tratamiento antituberculosis, o solo lo recibió por menos de cuatro semanas) y previamente tratados, los cuales se clasificaron como: sospecha de fracaso (persona con baciloscopia positiva al segundo mes de tratamiento), con pérdida al seguimiento (anteriormente llamado abandono recuperado) y recaídas (paciente declarado curado o tratamiento completo que de nuevo presenta una TB con bacteriología positiva). Se calculó el porcentaje de resistencia entre cada uno de estos grupos con un nivel de confianza del 95% y la diferencia de proporciones mediante la prueba de chi cuadrado, se consideró significancia cuando p fue menor de 0,0517,18. Los datos fueron tabulados y analizados mediante la herramienta Microsoft Excel versión 2007 y Epidat 3,1.
RESULTADOS
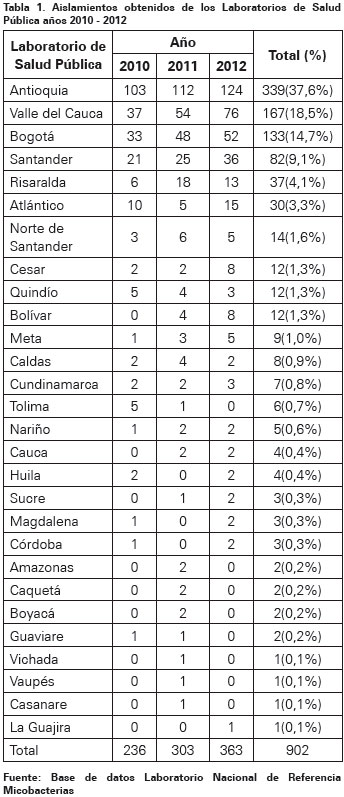
Se recibieron durante el periodo 2010 a 2012 un total de 1112 aislados de personas con TB-VIH de acuerdo a lo registrado en el formato único, provenientes de los LSP del país, se excluyeron del análisis 210 aislados (18%); se analizaron 902 en el marco de las actividades de vigilancia de la resistencia. Durante el año 2010 se recibieron 236 aislamientos, en el 2011 303 y en 2012, 363. Los LSP que enviaron la mayor proporción fueron: Antioquia 339 (37,6%), Valle del Cauca 167 (18,5%), Bogotá 133 (14,7%) y Santander 82 (9,1%) (Ver Tabla 1).
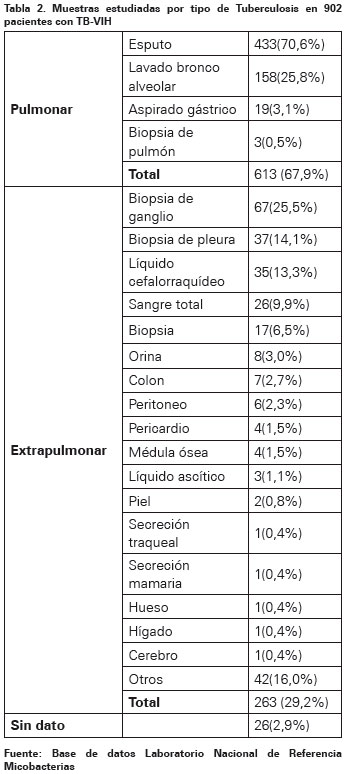
Del total de casos, 707 (78,4%) eran de sexo masculino; los rangos de edad oscilaron entre uno y 87 años con una mediana de 34, el 68,1% de los casos se presentó entre las edades de 20 a 44 años. Se evaluaron 613 (67,9%) casos de TB pulmonar, dentro de las muestras analizadas 433 (70,6%) eran esputos, 158 (25,8%) lavados broncoalveolares, 19 (3,1%) aspirados gástricos y 3 (0,5%) biopsias de pulmón. Adicionalmente, 263 (29,2%) casos fueron TB extrapulmonar, correspondientes a muestras de biopsias de ganglio 67 (25,5%), de pleura 37 (14,1%), líquido cefalorraquídeo 35 (13,3%), sangre total 26 (9,9%), entre otras (Ver Tabla 2).
Se clasificaron como casos nuevos 822 (91%) y 80 (9%) previamente tratados, de los cuales 33 (41,2%) eran pacientes con tratamiento después de pérdida al seguimiento, 31 (38,7%) recaídas a la enfermedad, siete (8,8%) sospecha de fracaso, seis (7,5%) fracasos, en tres (3,8%) no se tuvo claridad de condición de reingreso al Programa Nacional de Control de la Tuberculosis, pero el formato único documentaba que había un antecedente de tratamiento.
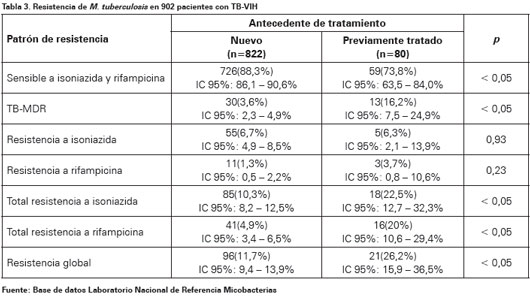
Respecto a los casos nuevos se observó que el 88,3% (IC 95%: 86, 1 - 90,6) eran sensibles a los fármacos evaluados; 3,6% (IC 95%: 2,3-4,9) fueron TB-MDR, la resistencia total a isoniazida y rifampicina fue del 10,3% (IC 95%: 8,2-12,5) y 4,9% (IC 95%: 3,4-6,5) respectivamente, la resistencia global fue del 11,7% (IC 95%: 9,4-13,9). Se encontró resistencia a rifampicina sin ser TB-MDR en 11 casos (1,3%) (Ver Tabla 3).
En previamente tratados el 73,8% (IC 95%: 63,5-84,0) fueron sensibles, la resistencia total a isoniazida y rifampicina fue del 22,5% (IC 95%: 12,7-32,3) y 20% (IC 95%: 10,6-29,4) respectivamente, la resistencia global fue del 26,2% (IC 95 %: 15,9-36,5). Se identificó TB-MDR en 16,2% (IC 95%: 7,5-24,9) de los casos, seis (46,2%) recaídas, tres (23%) pacientes con tratamiento después de pérdida al seguimiento, dos (15,4%) fracasos, uno (7,8%) sospecha de fracaso y uno (7,8%) sin información (Ver Tabla 3). Se observaron diferencias estadísticamente significativas entre los casos nuevos y previamente tratados en las proporciones de resistencia global, el mayor porcentaje se encontró en casos con antecedente de tratamiento predominando la TB-MDR (Ver Tabla 3).
DISCUSIÓN
Los datos analizados muestran que hay un incremento en la vigilancia de la resistencia a fármacos antituberculosis en los casos de TB-VIH, en promedio cada año se aumenta en 100 el número de pruebas realizadas, este comportamiento puede ser debido a la implementación de consejería y prueba a más del 60% de los casos de TB durante los años analizados en las entidades territoriales con mayor aporte de cultivos en este trabajo4,5. En Antioquia, Valle del Cauca y Bogotá, se localiza el 36% de los casos de TB notificados, son territorios con altas tasas de TB, farmacorresistencia y VIH, razón por la cual aportan la mayoría de aislados en este análisis4,5.
Se observó que hay una relación mujer : hombre de 3:5, estudios similares describen un mayor número de casos en hombres con diferencias estadísticamente significativas, el Sivigila reporta una tendencia similar4,5,20,21. La tuberculosis pulmonar se identificó en el 67,9% siendo la más frecuente, las formas extrapulmonares fueron un 29,2%, estos datos son diferentes a los notificados por el Sivigila en población general, donde las formas pulmonares son aproximadamente el 80% de los casos; esto se debe a la presencia de coexistencia de TB con VIH, que acelera la progresión de la enfermedad, originando una variedad de formas clínicas afectando sitios anatómicos como meninges, pleura, entre otros, haciéndose más crítico con el deterioro inmunológico de los pacientes; en este trabajo se identificaron muestras de líquido cefalorraquídeo y sangre total, formas graves que se relacionan con mortalidad1,2,22-5.
Un estudio realizado por Walls y colaboradores, evalúo la prevalencia de la resistencia a isoniazida y rifampicina en personas TB-VIH, donde encontró en casos nuevos una TB-MDR del 3,7%, la resistencia a rifampicina fue del 1,6% y a isoniazida del 13,9%, datos similares a los encontrados en este trabajo para multirresistencia. En los previamente tratados la TB-MDR fue del 28,9% y la resistencia a rifampicina e isoniazida fue del 7,9%, para cada uno de estos fármacos. La proporción de resistencia fue más alta especialmente para isoniazida en los casos nuevos y para multirresistencia en los previamente tratados, esto puede originarse porque el estudio de Walls evalúo pacientes de TB-VIH que se presentaron en un hospital de tercer nivel de atención con formas graves y cuadros clínicos avanzados, mientras que este trabajo evalúo casos de TB-VIH en Colombia que fueron atendidos en diferentes niveles de atención26.
Por otro lado, Narendran y colaboradores, evaluaron la presencia de resistencia a isoniazida en pacientes de VIH con y sin terapia antiretroviral, identificando que un 7,9% de los casos tenía resistencia a este medicamento, desafortunadamente no clasificaron los casos en nuevos y previamente tratados; sin embargo, dentro de sus hallazgos más relevantes se evidenció que existía un mayor riesgo de resistencia entre el grupo de personas sin terapia antirretroviral27.
En España, a una cohorte de pacientes con VIH se le realizó seguimiento al tratamiento antirretroviral, en aquellos casos que desarrollaron TB activa se hizo prueba de sensibilidad a fármacos antituberculosis; la resistencia global en casos nuevos fue del 11,1%, a isoniazida del 5,9% y a rifampicina del 1,5%. En previamente tratados la resistencia global fue del 36,4%, a isoniazida de 27,3% y a rifampicina del 9,1%. Además, se encontró un caso de multirresistencia en cada grupo. Al comparar estos datos con los obtenidos en este trabajo las tendencias de resistencia son similares sin embargo, en Colombia se observan más casos de TB-MDR en ambos grupos, esto podría deberse a las diferencias de la epidemiologia de la enfermedad en ambos países o a el uso de isoniazida como profilaxis, que puede enmascarar una TB activa, favoreciendo la amplificación de resistencia3,20,21,28.
En Perú, Arsecios y colaboradores, realizaron la descripción de los patrones de resistencia a los fármacos en personas con TB-VIH, donde encontraron en el grupo de casos nuevos una resistencia global del 55,8% y TB-MDR de 32,1%; en previamente tratados la resistencia global fue 93% y la TB-MDR de 74,8%. Estos valores de farmacorresistencia además de ser superiores a los informados en los diferentes estudios nacionales de vigilancia de este país, superan los reportados para nuestro país en todos los otros trabajos referenciados, claramente la situación de TB en Perú en lo referente a resistencia, es una de las más críticas de la región de las Américas más aún cuando son casos de VIH2,20,28-31.
En Colombia en el departamento de Valle del Cauca, De Paz y colaboradores realizaron un estudio con pacientes TB-VIH, evaluaron la sensibilidad a fármacos en 25 casos y describieron en casos nuevos una resistencia a isoniazida del 28,5%, no encontraron TB-MDR ni resistencia a rifampicina. Dentro de los casos previamente tratados, la resistencia a isoniazida fue del 50% y para rifampicina del 25%; las diferencias con este trabajo pueden ser debidas al número de pacientes que ellos evaluaron con pruebas de sensibilidad o a las altas tasas de resistencia que esta región del país presenta de forma regular5,28.
En Medellín, Colombia, González y colaboradores analizaron la presencia de resistencia primaria a los medicamentos antituberculosis en pacientes VIH positivos y negativos, donde encontraron una resistencia global del 18,2%, monorresistencia a la rifampicina y TB-MDR en un aislamiento respectivamente (4,5%). Las diferencias en los hallazgos pueden ser debidas a que los individuos incluidos en este análisis solo eran 22; sin embargo los autores indican que no encontraron diferencias estadísticamente significativas en lo relacionado con la presencia de resistencia en casos VIH positivos y negativos. No se incluyeron en este estudio casos de resistencia adquirida, es decir previamente tratados20.
Son pocos los trabajos que documentan la prevalencia de la resistencia a fármacos en pacientes con TB-VIH, esto debido que las acciones colaborativas entre los programas no garantizan el 100% de la evaluación de casos de TB con prueba de VIH, ni la búsqueda de TB entre pacientes con VIH, y en aquellos casos confirmados por laboratorio, no siempre se obtiene una prueba de sensibilidad.
Este trabajo se realizó con fuentes secundarias de información en las cuales puede haber sesgo por la calidad del dato registrado, es posible que durante los años evaluados hayan llegado más aislados que no especificaban el estado de VIH, no siendo considerados para este análisis; sin embargo los datos analizados provienen del 85% de las entidades territoriales del país en especial aquellas que concentran la mayor carga de TB3.
Los últimos datos oficiales de resistencia del país, hacen referencia al estudio nacional de vigilancia que se realizó en los años 2004-2005, donde se encontró una TB-MDR en casos nuevos de 2,38% (IC 95%: 1,5 - 3,5), resistencia a isoniazida del 7,46% (IC 95%: 5,9 -9,3), a rifampicina de 2,38% (IC 95%: 1,5 - 3,5); en los casos previamente tratados la TB-MDR fue del 31,4% (IC 95%: 26,1 - 37,2), para isoniazida del 37,8% (IC 95%: 32,2 - 43,8) y rifampicina del 32,2% (IC 95%: 26,8 - 38,0). A pesar de que los datos obtenidos en este trabajo, no pueden compararse con este estudio, se observa que el mayor número de casos farmacorresistentes se encuentra en el grupo de previamente tratados, estos hallazgos también son descritos por otros autores. Una diferencia es la presencia de resistencia a rifampicina en casos nuevos sin ser TB-MDR30,31.
Al revisar las condiciones de ingreso de los casos previamente tratados en varios de los trabajos consultados, se encuentra que las tasas de TB-MDR son más altas y frecuentes en los casos con perdida al seguimiento y recaída; lo que debe llevar a fortalecer las de seguimiento al tratamiento de TB y vigilancia después de lograr su curación, en cualquiera de los ingresos como previamente tratado se debe garantizar una prueba de sensibilidad3,13,21.
Los resultados de este análisis constituyen una línea de base de la resistencia a isoniazida y rifampicina en los pacientes con TB-VIH para el país, esta evaluación demuestra que existe transmisión de cepas farmacorresistentes por la presencia de resistencia en casos nuevos. La colisión de TB y VIH es una causa importante del aumento de la mortalidad que se suma a las dificultades con el diagnóstico oportuno, la farmacorresistencia y la garantía de un tratamiento adecuado2,3,10.
Es importante que el Programa Nacional de Control de la tuberculosis mejore el cumplimiento de los protocolos y guías en el manejo de pacientes con TB-VIH para garantizar la identificación correcta de casos infectados y enfermos, el acceso a consejería y prueba de VIH en todos los casos de TB. Adicionalmente se requiere que se implemente un algoritmo de diagnóstico que incluya las metodologías de reacción en cadena de la polimerasa avaladas por la OMS / Organización Panamericana de la Salud, para la detección rápida de TB y resistencia a fármacos32-4.
Este trabajo evaluó con prueba de sensibilidad en promedio un 35% de los casos, para esto se tuvo en cuenta que algunos autores describen que en aproximadamente en el 65% de las personas con TB-VIH se logra la comprobación bacteriológica, esto se comparó con lo notificado por el Sivigila durante el periodo analizado, indicando que es fundamental mejorar la confirmación de casos por métodos de laboratorio, el cruce de las fuentes de información con calidad del dato y el acceso a pruebas de sensibilidad; fortaleciendo esto, sería posible realizar otro trabajo que permita conocer con mayor certeza la prevalencia de la resistencia21,35-7.
Finalmente, el LNR cuenta con el material biológico con el que es posible realizar trabajos de epidemiologia molecular que permitan caracterizar los linajes de Mycobacterium tuberculosis que circulan en este grupo de riesgo e identificar posibles asociaciones entre pacientes, fortaleciendo la vigilancia en salud pública.
CONCLUSIÓN
Con este trabajo se evidenció que la presencia de resistencia en casos de TB-VIH es mayor en pacientes previamente tratados (26,2% de resistencia global) con respecto a los casos nuevos (11,7%), así mismo los datos de resistencia total a isoniazida (22,5% y 10,3%) y rifampicina (20% y 4,9%) son diferentes en ambos grupos, mientras que la resistencia solo a isoniazida fue similar (6,7% nuevos y 6,3% previamente tratados); y en casos nuevos se observó resistencia a solo a rifampicina (1,3%) sin ser multirresistentes, algo que no se había documentado para el país de acuerdo con los datos de la última encuesta nacional. Es fundamental mejorar la cobertura con prueba de sensibilidad en estos pacientes con el fin de tener mejor información al respecto de la tendencia de la resistencia.
CONSIDERACIONES ÉTICAS
Este trabajo no representa ningún riesgo para las personas evaluadas de acuerdo a lo definido en la Resolución 008430 de 1993 del Ministerio de Protección Social, porque es una revisión de datos consolidados por la red de laboratorios y el LNR del INS, como parte de sus funciones. La recolección de las muestras se llevó a cabo en diferentes instituciones de salud cumpliendo los protocolos éticos de cada entidad. Se aplicaron las normas de bioseguridad para el procesamiento de las pruebas de sensibilidad de acuerdo al manual de laboratorios de tuberculosis de la Organización Mundial de la Salud / Organización Panamericana de la Salud y las descritas en la Resolución 008430 de 1993 del Ministerio de Protección Social19.
FINANCIAMIENTO
Este trabajo se realizó con los recursos del Instituto Nacional de Salud, Dirección Redes en Salud Pública.
AGRADECIMIENTOS
A los Laboratorios de Salud Pública de Atlántico y Antioquia, por el envio de la información de las pruebas realizadas.
REFERENCIAS BIBLIOGRÁFICAS
1. Chang C, Crane M, Zhou J, Mina M, Post J, Cameron B, et al. HIV and co-infections. Immunol Rev. 2013;254(1):114-42. [ Links ]
2. World Health Organization. Global Tuberculosis Report 2014. Geneva. 2014;171. [ Links ]
3. Matteelli A, Richardson MD, Sotgiuc G, Centis R, Migliori GB. Multidrug- and extensively drug-resistant TB in persons living with HIV. Expert Rev Respir Med. 2009;3(3):245-54. [ Links ]
4. Instituto Nacional de Salud. Informe del evento de Tuberculosis, año 2013. Dirección de Vigilancia y Análisis del Riesgo en Salud Pública. Bogotá, Colombia; 2013. [ Links ]
5. Instituto Nacional de Salud. Informe del evento de Tuberculosis Farmacorresistente. Dirección de Vigilancia y Análisis del Riesgo en Salud Pública. Bogotá, Colombia; 2013. [ Links ]
6. Caminero J. Likelihood of generating MDR-TB and XDR-TB under adequate National Tuberculosis control programme implementation. Int J of Tuberc Lung Dis. 2008;12(8):869-77. [ Links ]
7. Coll P. Fármacos con actividad frente a Mycobacterium tuberculosis. Enferm Infecc Microbiol Clin. 27(8):474-80. [ Links ]
8. Farga V, Caminero J. Tuberculosis. 3a ed. Santiago y Buenos Aires: Editorial Mediterráneo, 2011. [ Links ]
9. Dean A, Zignol M, Falzon D, Getahun H, Floyd K. HIV and multidrug-resistant tuberculosis: overlapping epidemics. Eur Respir J. 2014;44(1):251-4. [ Links ]
10. Mesfin Y, Hailemariam D, Biadgilign S, Biadglign S, Kibret K. Association between HIV/AIDS and multi-drug resistance tuberculosis: a systematic review and meta-analysis. PLoS ONE. 2014;9(1):e82235. [ Links ]
11. Müller M, Wandel S, Colebunders R, Attia S, Furrer H, Egger M. Immune reconstitution inflammatory syndrome in patients starting antiretroviral therapy for HIV infection: a systematic review and meta-analysis. Lancet Infect Dis. 2010;10(4):251-61. [ Links ]
12. Ministerio de Salud. Dirección General de Salud Colombia. Plan Estratégico "Colombia Libre de Tuberculosis 2010-2015. Para la Expansión y Fortalecimiento de la Estrategia Alto a la TB". Bogotá, Colombia: Ministerio de la Protección Social; 2009. [ Links ]
13. Ministerio de Salud y Protección Social. Circular 058 de 2009 "Lineamientos del Manejo Programático de Tuberculosis y Lepra en Colombia. Colombia. 2009. [ Links ]
14. Becton Dickinson and Company. Inserto técnica de MGIT 960® para evaluación de resistencia a fármacos antituberculosos. [ Links ]
15. Becton Dickinson and Company. Manual Epicenter técnica de MGIT 960® para evaluación de resistencia a fármacos antituberculosos. 2009 [ Links ]
16. Canetti G, Rist N, Grosset J. Medida de la sensibilidad del bacilo tuberculoso a las drogas antibacilares por el método de las proporciones. Buenos Aires: Dirección Lucha Antituberculosa; 1965. [ Links ]
17. Instituto Nacional de Salud. Protocolo de vigilancia de tuberculosis. [Internet]. Bogotá, Colombia: Dirección de Vigilanica y Análisis del Riesgo en Salud Pública; 2014. Disponible en: http://www.ins.gov.co:81/lineas-de-accion/Subdireccion-Vigilancia/sivigila/Protocolos%20SIVIGILA/PRO%20Tuberculosis.pdf [ Links ]
18. Instituto Nacional de Salud. Protocolo de Vigilancia en Salud Pública. Tuberculosis Farmacoresistente. [Internet] Bogotá, Colombia: Dirección de Vigilanica y Análisis del Riesgo en Salud Pública; 2014. Disponible en: http://www.ins.gov.co:81/lineas-de-accion/Subdireccion-Vigilancia/sivigila/Protocolos%20SIVIGILA/PRO%20Tuberculosis-Resistente.pdf [ Links ]
19. Ministerio de la Protección Social. Resolución 08430 de 1993. Normas científico técnicas para la investigación en salud. Colombia; 1993. [ Links ]
20. González JC, Estrada S, Alvarez H. Resistencia primaria a los medicamentos anti tuberculosos en pacientes VIH positivos y pacientes VIH negativos con tuberculosis en Medellín, Colombia. Infectio. 2001;5(4):223-34. [ Links ]
21. Monge S, Diez M, Pulido F, Iribarren JA, Campins AA, Arazo P, et al. Tuberculosis in a cohort of HIV-positive patients: epidemiology, clinical practice and treatment outcomes. Int J Tuberc Lung Dis. 2014;18(6):700-8. [ Links ]
22. Castiblanco C, Ribón W. Coinfección de tuberculosis en pacientes con VIH/SIDA: un análisis según las fuentes de información en Colombia. Infectio. 2006;10(4):232-42. [ Links ]
23. Sterling TR, Pham PA, Chaisson RE. HIV infection-related tuberculosis: clinical manifestations and treatment. Clin Infect Dis. 2010;50 Suppl 3:223-30. [ Links ]
24. Mayer K, Dukes C. Synergistic pandemics: confronting the global HIV and tuberculosis epidemics. Clin Infect Dis. 2010;50 Suppl 3:67-70. [ Links ]
25. Reyes A, Díaz M, Pérez A. Tuberculosis y SIDA: algunos aspectos clínicos y epidemiológicos en 72 enfermos cubanos. Rev Cuba Med Trop. 2004;56(1):35-41. [ Links ]
26. Walls G, Bulifon S, Breysse S, Daneth T, Bonnet M, Hurtado N, et al. Drug-resistant tuberculosis in HIV-infected patients in a national referral hospital, Phnom Penh, Cambodia. Glob Health Action. 2015;8:25964 [ Links ]
27. Narendran G, Menon PA, Venkatesan P, Vijay K, Padmapriyadarsini C, Ramesh Kumar S, et al. Acquired rifampicin resistance in thrice-weekly antituberculosis therapy: impact of HIV and antiretroviral therapy. Clin Infect Dis. 2014;59(12):1798-804. [ Links ]
28. De Paz D, Potes L, Quiñonez E, Martínez L, Cepeda M, Guarín N, et al. Resistencia a fármacos antituberculosis en pacientes coinfectados con tuberculosis y virus de la inmunodeficiencia humana, en un hospital de referencia de 2007 a 2010 en Cali (Colombia). Infectio. 2013;16(3):161-65. [ Links ]
29. Asencios L, Vásquez L, Leo E, Quispe N, Huaroto L, Cabezas C. Niveles de resistencia a drogas antituberculosas en pacientes con coinfección VIH/tuberculosis, Lima, 1998-2001. Rev Peru Med Exp Salud Pública. 2006,23(2):93-103. [ Links ]
30. Campos PE, Suarez PG, Sanchez J, Zavala D, Arevalo J, Ticona E, et al. Multidrug-resistant Mycobacterium tuberculosis in HIV-Infected Persons, Peru. Emerg Infect Dis. 2003;9(12):1571-78. [ Links ]
31. Garzón M, Angée D, Llerena C, Orjuela D, Victoria J. Vigilancia de la resistencia del Mycobacterium tuberculosis a los fármacos antituberculosos, Colombia 2004-2005. Biomédica. 2008;28(3):319-326. [ Links ]
32. Fujiwara P, Dlodlo R, Ferroussier O, Nakanwagi-Mukwaya A, Cesari G, Boillot F. Implementing Collaborative TB-HIV Activities. A Programmatic Guide. [Internet] Paris, France: International Union Against Tuberculosis and Lung Disease, 2012. Disponible en: http://www.theunion.org/what-we-do/publications/technical/english/pub_tb-hivguide_eng_web-1.pdf [ Links ]
33. World Health Organization. Nucleic Acid AmplificationTechnology for Rapid and Simultaneous Detection of Tuberculosis and Rifampicin Resistance: Xpert MTB/RIF System. Policy statement. 2011. WHO/HTM/TB/2011.4 [ Links ]
34. World Health Organization. Xpert MTB/RIF assay for the diagnosis of pulmonary and extrapulmonary TB in adults and children. Policy statement. 2013. WHO/HTM/TB/2013.16 [ Links ]
35. Instituto Nacional de Salud. Informe del evento, Comportamiento de la notificación de Tuberculosis en Colombia, semana 1 - 52, periodo 13 (cierre) año 2010. Subidrección de Vigilanica y Control en Salud Pública. Bogotá, Colombia; 2010. [ Links ]
36. Instituto Nacional de Salud. Informe del evento, Comportamiento de la notificación de Tuberculosis en Colombia, semana 1 - 52, periodo 13 (cierre) año 2011. Subidrección de Vigilanica y Control en Salud Pública. Bogotá, Colombia; 2011. [ Links ]
37. Instituto Nacional de Salud. Informe del evento de Tuberculosis, hasta el periodo epidemiológico 13 (cierre) año 2012. Subidrección de Vigilanica y Control en Salud Pública. Bogotá, Colombia; 2012. [ Links ]