Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicas UIS
Print version ISSN 0121-0319
Medicas UIS vol.29 no.2 Bucaramanga May/Aug. 2016
https://doi.org/10.18273/revmed.v29n2-2016008
DOI: http://dx.doi.org/10.18273/revmed.v29n2-2016008
Decúbito prono en el Síndrome de Dificultad
Respiratoria Aguda, de la fisiología a la práctica
clínica
Ruben Dario Rodriguez-Buenahora*
Sergio Alexander Ordoñez-Sánchez**
Jimmy Leandro Gómez-Olaya***
Marly Esperanza Camargo-Lozada****
* Médico General. Médico unidad de cuidados intensivos. Clínica la Merced. Bucaramanga. Santander. Colombia.
** Médico y Cirujano. Residente I año de Anestesiología y Reanimación. Fundación Universitaria Ciencias de la Salud. Bogotá. Cundinamarca. Colombia.
*** Médico y Cirujano. Médico unidad de cuidados intensivos. Clínica la Merced. Bucaramanga. Santander. Colombia.
**** Médico General. Médico unidad de cuidados intensivos. Clínica La Merced. Bucaramanga. Santander. Colombia.
Correspondencia: Dr. Ruben Dario Rodriguez Buenahora. Dirección: Calle 45 No. 22-107, El Poblado. Girón. Santander. Colombia. Correo electrónico: rudar31@hotmail.com
Artículo recibido el 21 de diciembre de 2015 y aceptado para publicación el 17 de febrero de 2016
RESUMEN
El síndrome de dificultad respiratoria aguda incluye una compleja serie de acontecimientos que conducen a daño alveolar, edema pulmonar por aumento de la permeabilidad vascular e insuficiencia respiratoria; muchos procesos están relacionados con su aparición, la característica común es la activación de los neutrófilos en la circulación pulmonar o sistémica. Las manifestaciones clínicas aparecen generalmente 6 a 72 horas posterior al inicio del evento y empeoran rápidamente. El tratamiento se basa en un manejo interdisciplinario por parte del personal de la unidad de cuidados intensivos, se debe realizar un reconocimiento precoz de los pacientes descartando otras causas de hipoxemia, identificar y tratar la causa subyacente, y emplear la ventilación mecánica para asegurar correcta oxigenación, intentando siempre proteger los pulmones de la lesión pulmonar inducida por la técnica. La ventilación en decúbito prono favorece el aumento de la oxigenación en pacientes con este síndrome, los mecanismos que producen este incremento son probablemente múltiples e interdependientes y no han sido dilucidados en su totalidad. Es un procedimiento de bajo costo, recomendado implementar en pacientes categoría grave, y preferentemente en etapa tempana de la enfermedad, aunque es necesario realizar estudios futuros que puedan establecer el verdadero impacto en la mortalidad para evaluar su uso sistemático en todos los pacientes con Síndrome de Dificultad Respiratoria Aguda. MÉD.UIS. 2016;29(2):81-101.
Palabras clave: Síndrome de Dificultad Respiratoria del Adulto. Posición Prona. Postura. Posicionamiento del Paciente. Ventilación Pulmonar. Lesión Pulmonar Aguda. Terapia por Inhalación de Oxígeno.
Prone position in the Acute Respiratory Distress Syndrome, physiology to clinical practice
ABSTRACT
The Acute Respiratory Distress Syndrome involves a complex series of events leading to alveolar damage, pulmonary edema due to increased vascular permeability and respiratory failure; many processes are related to its appearance, the common feature is the activation of neutrophils in the pulmonary or systemic circulation. Clinical manifestations usually appear 6 to 72 hours after the event start the event and get worse quickly. The treatment is based on an interdisciplinary handling by the staff of the intensive care unit, making an early recognition of patients ruling out other causes of hypoxemia, identifying and treating the underlying cause, and using mechanical ventilation to ensure proper oxygenation and ventilation, always trying to protect the lungs from mechanical ventilation induced lung injury. Prone position ventilation promotes increased oxygenation in patients with this syndrome, the mechanisms that cause this increase are probably multiple and interdependent and have not been fully elucidated. It is a low-cost procedure, recommended in patient in serious category, and preferably in early stage of the disease. Future studies are needed that can establish the real impact on mortality to assess their systematic use in all patients with Acute Respiratory Distiess Syndrome. MÉD.UIS. 2016;29(2):81-101.
Keywords: Respiratory Distress Syndrome. Prone Position. Posture. Patient positioning. Pulmonary Ventilation. Acute Lung Injury. Oxygen Inhalation Therapy.
¿Cómo citar este artículo?: Rodriguez-Buenahora RD, Ordoñez-Sánchez SA, Gómez-Olaya JL, Camargo-Lozada ME. Decúbito prono en el Síndrome de Dificultad Respiratoria Aguda, de la fisiología a la práctica clínica. MÉD.UIS. 2016;29(2):81-101.
INTRODUCCIÓN
El Síndrome de Dificultad Respiratoria Aguda (SDRA) es un síndrome clínico devastador de lesión pulmonar aguda, caracterizado por un cuadro de edema pulmonar no cardiogénico con aumento de la permeabilidad vascular1. Es altamente frecuente en pacientes en estado crítico y se asocia con elevada morbilidad y mortalidad a largo plazo2. El tratamiento actual se basa en la ventilación mecánica con bajos volúmenes y la aplicación de presión positiva al final de la espiración (PEEP, por sus siglas en inglés)3, aunque muchos pacientes persisten hipoxémicos y por consiguiente se ha obligado a la utilización de alternativas terapéuticas que mejoren el intercambio gaseoso. Una de ellas es la ventilación en posición de Decúbito Prono (DP), que ha demostrado ser una técnica segura para mejorar la oxigenación arterial4,5; sin embargo, su papel en la práctica clínica no está aun claramente definido6. El objetivo de este artículo fue hacer una revisión exhaustiva de la literatura científica actual sobre el SDRA, revisando aspectos relevantes en epidemiologia, etiología, características clínicas, criterios diagnósticos, avances en fisiopatología y estrategias de tratamiento con énfasis en la ventilación en decúbito prono y su efecto en los resultados clínicos relevantes de esta patología.
MATERIALES Y MÉTODOS
Se realizó una búsqueda en las bases de datos de Lilacs, PubMed, Scielo, Imbiomed, Cochrane, Clinicalkey y Biblioteca Virtual en salud. Los términos empleados fueron: síndrome de dificultad respiratoria aguda, posición prona, postura, posicionamiento del paciente, fisiopatología, ventilación pulmonar, lesión pulmonar aguda, terapia por inhalación de oxígeno; teniendo en cuenta los aspectos que se querían revisar de la enfermedad. Se eligieron artículos publicados entre los años 2000 y 2015, a excepción de artículos de referencia para definiciones, clasificaciones y soporte histórico, teniendo en cuenta el objetivo de la publicación, el tipo de artículo, el impacto que estos generaron y el aporte para enriquecer este trabajo. Se seleccionaron artículos en inglés y español o traducidos a estos idiomas, incluyéndose artículos de trabajos originales, revisiones de tema, meta-análisis, estudios observacionales de magnitud suficiente, preferentemente multicéntricos y estudios controlados aleatorizados. Se contó con 1114 referencias en total, aunque solo se emplearon los artículos que se encuentran referenciados en el trabajo.
PERSPECTIVA HISTÓRICA
Esta patología ha recibido diversas denominaciones, entre ellas pulmón de shock, pulmón húmedo y edema pulmonar por fuga capilar. Sin embargo, la más popular ha sido síndrome de distress (dificultad) respiratorio del adulto, sustituido posteriormente por síndrome de distress respiratorio agudo, puesto que no se limita solo a la población adulta7. La primera descripción del SDRA apareció en 1967, cuando Ashbaugh8 y sus colaboradores describieron 12 pacientes con dificultad respiratoria aguda, cianosis refractaria a la terapia con oxígeno, disminución de la distensibilidad pulmonar e infiltrados difusos evidentes en la radiografía de tórax; debido que no permitía tener criterios específicos para identificar pacientes sistemáticamente, hubo controversia sobre la incidencia, historia natural del síndrome y mortalidad asociada. En 1988, se propuso una definición ampliada que cuantificaba el empeoramiento de la fisiología respiratoria a través del uso de un sistema marcador de lesión pulmonar de cuatro puntos (puntaje de Murray9), el cual se basa en el nivel de PEEP, el rango de presión parcial de oxígeno arterial con la fracción inspirada de oxígeno (PAFI, PaO2/FiO2), la distensibilidad pulmonar estática y el grado de infiltración evidente en la radiografía de tórax. Otros factores incluidos fueron la enfermedad o desorden clínico desencadenante y la presencia o ausencia de disfunción orgánica no pulmonar. Este puntaje ha sido ampliamente usado para cuantificar la gravedad de la lesión pulmonar, tanto en investigación como en trabajos clínicos, pero tiene la limitación de no predecir el pronóstico durante las primeras 24 a 72 horas después del inicio de la enfermedad, lo cual condiciona su uso clínico10,11.
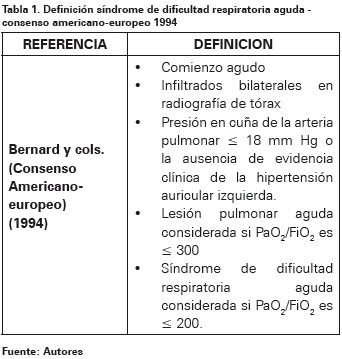
En 1994 se recomendó una nueva definición por el Comité de consenso americano-europeo7 (Ver Tabla 1), la cual presenta dos ventajas. Primero, reconoce que la severidad de lesión pulmonar varía, clasificando los pacientes en lesión pulmonar aguda y SDRA de acuerdo al grado de hipoxemia, el reconocimiento de pacientes con lesión pulmonar aguda puede facilitar registros tempranos de los pacientes afectados en los estudios clínicos; segundo, la definición es simple para aplicar en el escenario clínico, sin embargo, esta simplicidad también es una desventaja, ya que los factores que influyen en el resultado tales como la causa subyacente y el compromiso de otros sistemas no pueden ser valorados12-14. Adicionalmente, el criterio para la presencia de infiltrados bilaterales en la radiografía de tórax compatible con la presencia de edema pulmonar no es suficientemente específico para ser aplicado consistentemente por los clínicos experimentados15,16.
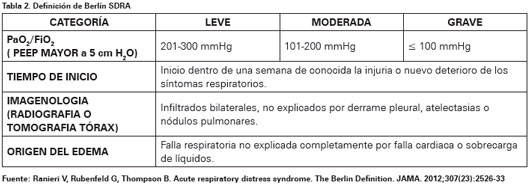
En busca de mejorar la definición y criterios diagnósticos de SDRA, un reconocido grupo de expertos propuso la denominada definición de Berlín17. En ella se crean tres categorías de gravedad, para lo cual el paciente debe presentar PEEP > 5 cm H2O; cabe destacar que la insuficiencia respiratoria no debe ser secundaria a insuficiencia cardiaca o sobrecarga de líquidos, y en caso de no tener causa desencadenante clara, requerirá una prueba subjetiva para descartar el edema hidrostático, como por ejemplo un ecocardiograma (Ver Tabla 2).
Los beneficios de la ventilación en DP se describieron hace bastante tiempo, pero relativamente hace poco se consideró como terapéutica potencialmente aplicable en el tratamiento del SDRA. En 1922, Beams y Christiel4 reportaron que la capacidad vital disminuía cuando se media en la posición supina del paciente con respecto a la posición en pie. En 1933, Hurtado y Frey18 extendieron esta observación al incluir la capacidad residual funcional. En 1955 Blair y Hickham19 fueron los primeros en notar que la posición del cuerpo altera el intercambio gaseoso. La afirmación que la posición prona podría contrarrestar estos efectos adversos data de 1961, cuando Moreno y Lyon20 señalaron que la capacidad residual funcional medida en posición prona fue mayor que la medida en posición supina.
En 1974 Brayan21 en su estudio sugirió que la reducción en la capacidad residual funcional en los pacientes en posición supina se presentó principalmente en las regiones dorsales del pulmón, y fue el primero en sugerir que el método viable para la expansión de estas regiones era ventilar los paciente en DP modificando el efecto de la masa abdominal por una manipulación postural. En 1976, Piehl y Brown22 describieron el marcado incremento de la oxigenación en cinco pacientes con falla respiratoria hipoxémica, y años más tarde, Douglas y Finlayson23, reportaron hallazgos similares en seis individuos. Sin embargo, a pesar de esos pequeños éxitos iniciales, la posición prona se olvidó por una década; tal vez porque colocar a un paciente en prono conlleva ciertos riesgos en el contexto de la atención de este en estado crítico, con métodos de monitorización y terapia invasivos24.
En 1987, Albert et al.25 realizaron un modelo de lesión pulmonar aguda para medir el shunt intrapulmonar, usando múltiples técnicas de gas inerte, mostraron una disminución del 23% en posición supina a 8% en posición prona, cambios que ocurrieron sin alteración en el gasto cardiaco, presión vascular pulmonar, distribución de la perfusión regional o volumen pulmonar espiratorio. Desde estos ensayos clínicos y hallazgos fisiológicos iniciales, múltiples estudios en animales y humanos han mostrado que la posición prona incrementa la oxigenación y reduce el daño pulmonar inducido por ventilación en el marco del SDRA, aunque el beneficio de la sobrevida no ha sido claramente establecido26.
Probablemente sea el estudio de Gattinoni et al.27 el que logró que la comunidad médica pusiera su atención en la terapéutica con ventilación en DP. Ellos publicaron los resultados de un trabajo multicéntrico acerca de los efectos del DP en pacientes con SDRA. El estudio mostró que no hay diferencia significativa en la mortalidad entre los pacientes asignados por aleatorización al DP y al tratamiento convencional, pero los pacientes ventilados en DP presentaron una mejoría significativa en la presión parcial de oxígeno. En el IV Congreso de la Asociación Latinoamericana de Tórax y 32do Congreso Argentino de Medicina Respiratoria y la Asociación Argentina de Medicina Respiratoria, Gorrasi et al.28, expusieron los resultados de un estudio acerca del comportamiento de la ventilación en DP durante 34 períodos en 25 pacientes, cuyo origen del SDRA fue pulmonar. Registraron medidas en posición supina antes de ventilación en DP y después de 1, 6, 12, 18 y 24 horas de estar el paciente en DP y luego diariamente. La duración total promedio fue de 9,5 ± 10 horas. La relación PAFI antes de la ventilación en DP fue 150 ± 16 mmHg y 223 ± 15 mmHg luego de estar la primera hora en DP. Esta diferencia significativa de PAFI con el valor basal en decúbito supino se mantuvo hasta el final de la ventilación en DP. Los valores de la PaCO2 no disminuyeron significativamente. El Score de Injuria Pulmonar de Murray fue significativamente menor a las 72 horas de DP, concluyendo que la ventilación en DP tiene efectos positivos en el intercambio gaseoso aún después de las seis horas.
El grupo de estudio prono-supino I29 incluyó 225 pacientes y reportó que la disminución en los valores de CO2 se asoció con una mejoría de la sobrevida a 28 días, mientras que la mejoría en la PaO2 no se relacionó con cambios en mortalidad, también reportó menor incidencia de neumonía asociada a la ventilación en los pacientes colocados en DP. Mancebo et al.30 demostraron que los factores determinantes en el éxito de la DP son su inicio temprano, así como el tiempo en que se mantiene a los pacientes en esta posición. Los resultados del estudio prono-supino II31 permitieron corroborar la mejoría en el intercambio gaseoso (de mayor significancia en los pacientes en categoría grave). En 2011 Abroug et al.32 reportaron no solo mejoría en el intercambio gaseoso, sino también disminución de la mortalidad en pacientes con SDRA grave, colocados en DP.
EPIDEMIOLOGÍA
Una estimación exacta de la incidencia de la lesión pulmonar aguda y el SDRA ha sido obstaculizada por la falta de una definición uniforme, la heterogeneidad de las causas y manifestaciones clínicas3. En el 2005, la incidencia estimada por año en los Estados Unidos fue de 190 600 casos; el impacto fue reflejado con 74 500 muertes y 3,6 millones de días de estancia hospitalaria33. La incidencia en la Unidad de Cuidados Intensivos (UCI) se encuentra entre 4 a 9%, dependiendo de la edad del paciente y la población de estudio34. Por su parte las estimaciones europeas oscilan entre 4,2 y 13,5 casos por cada 100 000 personas/año35,36. En el estudio realizado por Li et al.37 se encontró tendencia a disminución de la incidencia del SDRA en adultos hospitalizados, quizá debido al uso generalizado de la Ventilación Mecánica de Protección Pulmonar (VMPP), la reducción de las infecciones nosocomiales, las estrategias transfusionales más restrictivas y la mejora del soporte global de los pacientes críticos.
La mortalidad también es muy variable según la población estudiada, alcanzando en algunas series hasta el 75% 38. Factores como edad avanzada (> 70 años), inmunodeprimidos, la presencia de disfunción orgánica, choque, falla hepática, altos scores de gravedad al ingreso, la acidosis, barotrauma precoz (en las primeras 48 horas), el aumento del infiltrado radiológico, inicio precoz del SDRA respecto al ingreso en UCI o tardío respecto al ingreso en el hospital, representan aumento en las tasas de mortalidad. En su gran mayoría, los pacientes fallecen debido a sepsis o disfunción multiorgánica antes que por causas respiratorias primarias39. El empeoramiento de la disfunción pulmonar durante la primera semana de tratamiento40 y la hipoxemia extrema41 (PaO2/FiO2 <50 mmHg) son factores de pronóstico adverso; pacientes con politraumatismo jóvenes presentan pronóstico más favorable con respecto a edad avanzada42.
La predisposición genética también influye en el desenlace clínico del paciente. Se han descrito variantes en más de 25 genes que han sido asociados al desarrollo de SDRA y el pronóstico clínico, entre estos se incluyen variantes comunes de genes reguladores del proceso inflamatorio como reactantes de fase aguda (MBL2) y citoquinas (IL10, IL1β, IL6, TNFα), de reguladores de la respuesta inmunitaria (NKβIA), de reguladores de coagulación, de reguladores de función de la célula endotelial y de reguladores de la apoptosis43-45. Estos genes estarían relacionados en todos los procesos asociados a la fisiopatología del SDRA y su recuperación46. Diversos estudios parecen mostrar una mayor predisposición y mortalidad en pacientes afroamericanos e hispanos que en los caucásicos47. En el desarrollo del SDRA también parecen influir polimorfismos genéticos que predisponen a efectos perjudiciales de determinadas bacterias o virus, varios se han asociado con infecciones pulmonares más graves por neumococo, Legionella e infecciones virales48.
En algunos pacientes que sobreviven la función pulmonar retoma casi a lo normal dentro de los 6 a 12 meses, a pesar de la lesión severa del pulmón; la severidad de la enfermedad primaria y la ventilación mecánica prolongada identifican pacientes con el más alto riesgo de anormalidades persistentes31,49,50. El deterioro residual de la mecánica pulmonar puede incluir restricción, obstrucción, deterioro de la capacidad de difusión por monóxido de carbono, o anormalidades en el intercambio gaseoso con el ejercicio, pero estas anormalidades usualmente son asintomáticas51,52. Aquellos que sobreviven la enfermedad tienen una calidad de vida disminuida tanto por factores relacionados con secuelas pulmonares como también con factores físicos y emocionales medidos en escalas generales53-56.
ETIOLOGÍA
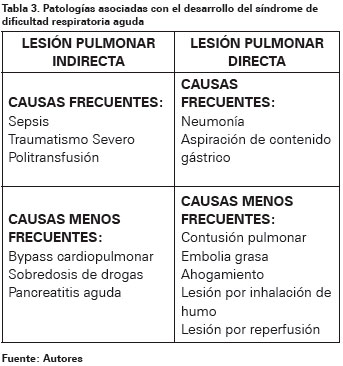
Muchos procesos están relacionados con la aparición del SDRA (Ver Tabla 3), su característica común es la activación de los neutrófilos en la circulación pulmonar o sistémica como se expone más adelante, de manera que las situaciones que producen una respuesta inflamatoria sistémica predisponen la aparición de este síndrome3. Los desórdenes clínicos comúnmente asociados pueden dividirse en aquellos que producen una lesión directa del pulmón y aquellos que causan una lesión indirecta del pulmón como respuesta de un proceso sistémico. Las causas intrapulmonares representan entre el 55-75% de los casos de SDRA, siendo la neumonía bacteriana o viral la más común; entre las causas extrapulmonares la más frecuente es la sepsis57.
FISIOLOGÍA RESPIRATORIA
Los pulmones son estructuras elásticas, que contienen componentes fibrilares que le confieren resistencia a la expansión de volumen, en condiciones normales contienen aire en su interior gracias a la diferencia entre su presión positiva interna y la presión negativa externa en el espacio pleural58, se denomina presión transpulmonar a la diferencia de presión, y el cambio de volumen en relación al cambio de presión se denomina compliance o distensibilidad, la presión transpulmonar debe ser mayor que la presión alveolar en aras de mantener el alveolo abierto 59.
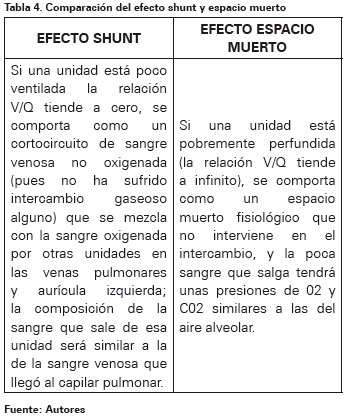
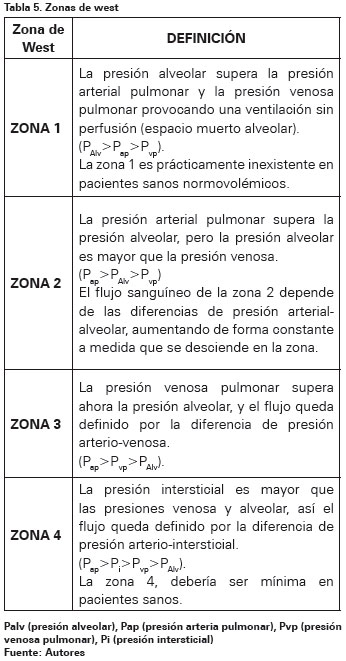
Para que el aparato respiratorio realice de forma adecuada el intercambio gaseoso es necesaria la integridad de tres mecanismos que intervienen en dicho proceso: la ventilación adecuada de los espacios aéreos, la difusión de los gases a través de la membrana alveolo-capilar, y la adecuada perfusión de las unidades alveolares de intercambio60. Dado que todo el gasto cardíaco pasa por los pulmones, la relación entre Ventilación y Perfusión (V/Q) del sistema cardiopulmonar global es aproximadamente uno1. Los cocientes V/Q varían considerablemente debido al efecto hidrostático y a diferencias intrarregionales de la distribución del flujo sanguíneo, esta heterogeneidad de los cocientes V/Q aumenta con la edad y durante las afectaciones pulmonares, ya sea por dispersión de la ventilación, de la perfusión, o de ambas1. La adecuada relación entre la ventilación y la perfusión de las unidades alveolares de intercambio es necesaria para asegurar un correcto intercambio gaseoso; es decir, que los alveolos bien ventilados deben estar, además, bien perfundidos para que dicha ventilación sea útil1 (Ver Tabla 4).
La situación ideal es un adecuado acoplamiento entre la ventilación y la perfusión, con lo que la relación V/Q tiende al valor de 1. No obstante, en bipedestación existe un gradiente de ventilación al aumento desde los vértices hasta las bases por la disposición anatómica, y un gradiente de perfusión a reducción desde las bases hasta los vértices, por efecto de la gravedad61. Los trabajos de West y colaboradores, realizados con isótopos radioactivos de gases como el xenón, mostraron que la ventilación y la perfusión aumentaban en sentido cefálico-caudal, diferencias que se explicaron por los cambios en la presión pleural ocasionados por el peso mismo del pulmón para la ventilación y por el efecto de la fuerza de la gravedad para la perfusión62 (Ver Tabla 5).
FISIOPATOLOGÍA DEL SDRA
El SDRA incluye una compleja serie de acontecimientos que conducen a daño alveolar, edema pulmonar por aumento de la permeabilidad vascular e insuficiencia respiratoria57. Inicialmente se presenta una intensa reacción inflamatoria dirigida a la membrana intersticial y alveolo-capilar, caracterizada por ocupación alveolar con un edema rico en proteínas que reduce la superficie disponible para el intercambio gaseoso, incrementando las áreas pulmonares con pobre o nula relación V/Q63. La atracción de los leucocitos polimorfonucleares a los pulmones lesionados se ha relacionado con la presencia de citosinas proinflamatorias, endotoxinas, trombina, sistema de complemento y factor vascular del crecimiento endotelial64,65. Se presenta un desbalance entre las enzimas proteolíticas (liberadas por macrófagos) y sustancias anti-proteasas como la alfa 1 anti-tripsina, lo que favorece el daño por parte de las mismas66. A medida que el SDRA progresa, se producen fenómenos vasculares que afectan de forma diferente al intercambio gaseoso, dando lugar a mayor heterogeneidad en la relación V/Q67. Esta situación se agrava por la aparición de zonas con nula ventilación en relación con la aparición de atelectasias en zonas dependientes del pulmón (basales en posición bipedestación, dorsales en posición supina)1.
Se han descrito tres fases en la patogenia del SDRA65. La primera fase, fase aguda o exudativa (1 a 6 días), es caracterizada por la rápida aparición de disnea, hipoxemia, insuficiencia respiratoria y radioopacidades bilaterales en la radiografía de tórax que son coherentes con edema pulmonar. La rápida aparición de insuficiencia respiratoria por lo general requiere ventilación mecánica con evidencia clínica de hipoxemia arterial debido a la ocupación alveolar de líquido rico en proteínas, disminución de la distensibilidad pulmonar por edema intersticial y alveolar, y disfunción del surfactante con posterior colapso alveolar; el aumento del espacio muerto es debido a la destrucción de la red microvascular pulmonar, puede evidenciarse aumento de la presión intra-abdominal con disminución de la distensibilidad de la pared torácica lo cual contribuye al aumento del trabajo respiratorio68. El epitelio alveolar se interrumpe y la membrana basal suele se recubierta por abundantes membranas hialinas ricas en fibrina67.
En la segunda fase, subaguda (7 a 14 días), se observa intentos de reparación con proliferación de células tipo II del epitelio alveolar, una parte del edema ha sido reabsorbido y puede haber infiltración de fibroblastos y depósitos de colágeno64.
En la tercer fase, fase crónica (después de 14 días), se presenta resolución del infiltrado neutrófilo y abundan las células mononucleares, macrófagos alveolares y fibrosis65. Denominada también fase de alveolitis fibrosante, cursa con hipoxemia persistente, incremento del espacio muerto alveolar y mayor disminución de la distensibilidad pulmonar69. La hipertensión pulmonar por obliteración del lecho capilar pulmonar puede ser severa y puede conducir a falla ventricular derecha70. En algunas ocasiones, el paciente presenta resolución progresiva sin fibrosis residual, con resolución gradual del edema y de la inflamación aguda, resolución de la hipoxemia y mejoría de la distensibilidad del pulmón64.
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO
Las manifestaciones clínicas de SDRA aparecen generalmente 6 a 72 horas posterior al inicio del evento y empeoran rápidamente, típicamente el paciente cursa con disnea, cianosis y crépitos difusos. La dificultad respiratoria suele ser evidente, observándose taquipnea, taquicardia, diaforesis y uso de músculos accesorios de la respiración; tos y dolor torácico también pueden estar presentes71.
La gasometría arterial revela hipoxemia, que a menudo se acompaña de alcalosis respiratoria aguda, son necesarias altas concentraciones de oxígeno suplementario para mantener una adecuada oxigenación71. La radiografía de tórax inicial presenta infiltrados alveolares bilaterales, en parches o asimétricos, y puede presentar derrame pleural72. La tomografía computarizada de tórax por lo general revela opacidades del espacio aéreo generalizadas, irregulares o coalescentes, que suelen ser más evidentes en las zonas pulmonares dependientes, también pueden estar presentes atelectasias73,74. Se pueden observar hallazgos clínicos relacionados con la causa desencadenante de SDRA, como fiebre, hipotensión, leucocitosis, acidosis láctica y coagulación intravascular diseminada3. La progresión del cuadro clínico con frecuencia obliga a aplicar ventilación mecánica en las primeras 48 horas de evolución3.
El diagnóstico de SDRA se realiza cumpliendo los criterios de la definición de Berlín, este puede apoyarse con ayudas adicionales como ecocardiograma75,76, cateterismo cardiaco derecho77,78, fibrobroncoscopia y lavado broncoalveolar79,80, incluso biopsia pulmonar en caso de que otras causas de insuficiencia respiratoria aguda hipoxémica no puedan ser excluidas sobre la base del contexto clínico, pruebas menos invasivas o cuando algunas de estas posibilidades de diagnóstico en estudio pueda justificar cambio sustancial en el manejo iniciado o cambiar sustancialmente el pronóstico del paciente81,82.
Una variedad de condiciones alternativas pueden presentar insuficiencia respiratoria hipoxémica aguda con infiltrados alveolares bilaterales y, por lo tanto, deben considerarse siempre que se sospeche SDRA para diagnóstico diferencial, entre ellas se encuentran83:
- Edema pulmonar cardiogénico: generalmente ocasionado por una disfunción ventricular izquierda sistólica o diastólica, pero también puede ser producido por sobrecarga de líquidos, hipertensión severa, estenosis de la arteria renal, o enfermedad renal grave. Su presentación es casi idéntica a SDRA, excepto que puede haber evidencia de disfunción cardíaca (por ejemplo, un galope S3 o S4, soplo cardiaco), presiones de llenado derecho elevadas (por ejemplo, presión venosa yugular elevada), o alteraciones radiológicas relacionadas (por ejemplo, congestión pulmonar venosa, líneas B de Kerley, cardiomegalia y derrame pleural). Para descartar edema pulmonar cardiogénico se pueden usar niveles de péptido natriurético cerebral, ecocardiografía y cateterismo cardíaco derecho83.
- Exacerbación de fibrosis pulmonar idiopática y otras enfermedades pulmonares intersticiales crónicas: pueden asemejarse en la presentación clínica y en las anormalidades radiográficas presentadas en SDRA. Los hallazgos patológicos están dominados por el daño alveolar difuso igual que el SDRA, pero el pronóstico es mucho peor. Esta posibilidad diagnóstica se pasa por alto con facilidad en pacientes con enfermedad pulmonar intersticial subyacente desconocida o de severidad leve o moderada. El diagnóstico puede ser revelado por una cuidadosa revisión de imágenes radiográficas de tórax previas y el descubrimiento de infiltrados reticulares subpleurales entremezclados con opacidades alveolares en una tomografía computarizada de tórax, o por biopsia pulmonar quirúrgica83.
- Neumonía eosinofílica idiopática aguda: se presenta en individuos previamente sanos y se caracteriza por tos, fiebre, disnea, y algunas veces dolor en el pecho. Las muestras de lavado broncoalveolar siempre contienen un gran número de eosinófilos, típicamente de 35 a 55% de todas las células recuperadas, la eosinofilia periférica puede o no estar presente84,85.
- Neumonía organizada criptogénica: es un síndrome clínico-patológico que se caracteriza por la presencia de tejido de granulación organizado en la luz de los bronquiolos y de los espacios aéreos distales. A menudo se asemeja a la neumonía con síntomas iniciales similares como fiebre, malestar general, fatiga y tos. Las características más comunes de presentación son tos persistente no productiva, disnea de esfuerzo, y pérdida de peso. El lavado broncoalveolar por lo general contiene menor porcentaje de macrófagos y mayor porcentaje de linfocitos, neutrófilos y eosinófilos que los pacientes sanos. El diagnóstico se realiza descartando causas infecciosas de neumonía y documentando los cambios típicos patológicos en el tejido obtenido por biopsia pulmonar abierta86.
- Cáncer: las células cancerígenas pueden difundir a través de los pulmones tan rápidamente que la insuficiencia respiratoria resultante puede ser confundida con SDRA. Más frecuente en linfomas o leucemia aguda, aunque la propagación linfangítica de tumores sólidos en ocasiones puede comportarse de esta manera. Estudios citológicos de muestras de lavado broncoalveolar pueden revelar la existencia de las células malignas3.
TRATAMIENTO
El tratamiento del paciente con SDRA se basa en un manejo interdisciplinario por parte del personal de la unidad de cuidados intensivos, se debe realizar un reconocimiento precoz de los pacientes descartando otras causas de hipoxemia, identificar y tratar la causa subyacente, y emplear la ventilación mecánica para asegurar correcta oxigenación y ventilación, intentando siempre proteger los pulmones de la lesión pulmonar inducida por esta técnica. Se debe realizar una búsqueda cuidadosa de la causa con especial atención en infecciones tratables como sepsis o neumonía; la prevención y tratamiento precoz de infecciones nosocomiales en el paciente con SDRA es fundamental, una elevada proporción fallece a causa de estas87. Se debe proporcionar adecuado soporte nutricional, se prefiere nutrición enteral frente a la parenteral, puesto que esta ruta evita el riesgo de sepsis asociada a catéter, previene hemorragia de vías digestivas y traslocación bacteriana88,89.
Una mejor comprensión de la patogénesis del SDRA ha llevado a la evaluación de nuevas estrategias de tratamiento, aunque muchas de ellas no han demostrado ser beneficiosas o provocar el impacto esperado en el paciente38.
VENTILACIÓN MECÁNICA EN EL TRATAMIENTO DEL SDRA
Quizás el avance más importante en la investigación del SDRA ha sido el reconocer que la ventilación mecánica, aunque necesaria para preservar la vida, puede potenciar o lesionar directamente los pulmones a través de una variedad de mecanismos denominados lesión pulmonar asociada a ventilador90,91. Estos mecanismos incluyen exposición a presiones de inflación altas o sobredistensión (barotrauma o volutrauma)92, apertura y cierre repetitivo del alveolo (atelectrauma)93, y mecanotransducción que produce liberación de citocinas inflamatorias sistémicas (biotrauma)94.
Los pulmones de los pacientes con SDRA, como se ha planteado anteriormente, se encuentran afectados en forma heterogénea, lo cual ha sido demostrado gracias a los estudios de tomografía computarizada6. Algunas áreas del pulmón (dependientes) presentan mayor atelectasia y consolidación, lo cual las hace menos distensibles y disponibles para la ventilación; mientras que otras áreas (no dependientes) se comportan normalmente. Esta heterogeneidad ha conducido al concepto de "pulmón de bebe", el cual sugiere que, por lo general, un volumen marcadamente reducido del pulmón en el paciente con SDRA está disponible para la ventilación, es decir, un pulmón funcional del tamaño de un bebe dentro del cuerpo de un adulto95,96. De esta forma, la ventilación mecánica puede producir barotrauma o volutrauma cuando las presiones y volúmenes, respectivamente, son programadas para pulmón de adulto y se distribuyen únicamente dentro de la pequeña porción funcional del pulmón con SDRA. Además, se generan grandes fuerzas de estrés tangencial en la interfase entre las unidades del pulmón con apertura y cierre cíclico produciendo atelectrauma. Ambos tipos de lesión pueden conducir a la liberación de citoquinas desde el pulmón, las cuales tienen efectos adversos sistémicos que contribuyen al desarrollo de falla multiorganica93,94.
Los objetivos de la ventilación mecánica en SDRA han cambiado en la última década, tradicionalmente se priorizó la normalización de los valores de oxigenación, dióxido de carbono y pH, ventilando con Volumen Corriente (VC) entre 10 a 15 mL/Kg, para alcanzar gases arteriales "normales", en comparación con 5 a 6 mL/Kg de una respiración normal en reposo97,98. Actualmente, con el conocimiento sobre lesión pulmonar asociada a ventilador, se han diseñado estrategias de Ventilación Mecánica de Protección Pulmonar (VMPP)99, basada en manejo de VC bajos, uso de PEEP y monitorización de las presiones (Presión Plateau menor 35 cmH20). Seis grandes ensayos clínicos controlados y aleatorizados han evaluado el efecto de la ventilación mecánica protectora en comparación con los enfoques convencionales en pacientes con SDRA.
En primer lugar, Amato et al.100 publicaron el primer gran estudio que analizaba la estrategia de VMPP, se utilizó mayor nivel de PEEP y se introdujeron maniobras de reclutamiento asociadas a la ventilación limitada de presión y volumen en el grupo de intervención. Observaron disminución en la mortalidad, una menor incidencia de barotrauma y mayor facilidad de destete del grupo de VMPP, sugiriendo firmemente que las estrategias ventilatorias podrían impactar la mortalidad. Por otra parte, los estudios de Stewart et al.101, Brochard et al.102 y Brower et al.103 mostraron mayor mortalidad en el grupo intervención. El estudio SDRA Network6, el más grande de VMPP, llevado a cabo en el año 2000, observó una menor mortalidad en el grupo intervención (31% vs 40% p=0.07) al usar menor VC (objetivo de 6 mL/Kg de peso, con rango de 4 a 8 mL/Kg dependiendo de la presión plateau y el pH) y presión plateau inferior a 30 cmH2O. Posteriormente Villar et al.104 corroboraron la reducción de la mortalidad tanto en unidad de cuidado intensivo (32% vs 53%) como hospitalaria (34% vs 55%) en el grupo de VMPP.
Se han realizado tres importantes metaanálisis de los ensayos clínicos controlados y aleatorizados expuestos anteriormente, Eichacker et al.105 presentaron que el beneficio sobre la supervivencia observada en dos de los anteriores ensayos podría estar relacionado con la estrategia usada en el brazo control, con un VC mayor al usado en la clínica habitual. Por otra parte, en los brazos control de los tres ensayos "no beneficiosos", los VC usados se tradujeron en una menor presión plateau (28 a 32 cm H2O) que en los estudios "benéficos" (34 a 37 cm H2O), lo cual conlleva a interrogantes de la metodología empleada, ya que las presiones alcanzadas en el brazo control de estos tres ensayos parecen ser más congruentes con los detectados habitualmente y fueron consistentes con los valores pre-randomización. Además, los autores sugirieron que los VC bajos usados en el grupo intervención del estudio SDRA Network pueden ser peligrosos y perjudiciales para los pacientes. Este metaanálisis ha sido criticado por tener defectos metodológicos importantes, tales como agrupar inapropiadamente los resultados; sus hallazgos son contradictorios a los otros dos metaanálisis, realizados por Petrucci et al.106 y Moran et al.107, los cuales sugirieron que la ventilación limitada de volumen, particularmente la utilización de una presión plateau máxima de 30 cmH2O, tiene un beneficio en la supervivencia a corto plazo. De acuerdo con esto, algunos autores han recomendado que los VC deben ser valorados con el objetivo de lograr "presiones seguras" (presión plateau menor de 30 a 32 cm H2O), en lugar de estandarizar el uso de VC bajos para todos los pacientes con SDRA108. Más del 95% de los pacientes con SDRA deben tener VC menor de 8 mL/Kg y presión plateau menor de 30 cmH2O según los indicadores de calidad de Sociedad Española de Medicina Intensiva y Unidades Coronarias, siendo considerado un indicador de calidad relevante109.
En muchos casos, la VMPP puede conducir a elevación del dióxido de carbono arterial, denominada hipercapnia permisiva, la cual puede tener efectos nocivos en el paciente; sin embargo, datos experimentales sugieren que la hipercapnia permisiva no solo es segura sino potencialmente beneficiosa, con mejoras hemodinámicas por la liberación de catecolaminas. Debe tenerse precaución en pacientes cardiópatas y estaría relativamente contraindicada en pacientes con presión intracraneal elevada110.
La hipoxemia refractaria, una de las características del SDRA, trae consigo requerimiento de altas concentraciones de oxígeno, su uso prolongado puede derivar en una toxicidad por oxígeno y emporar el cuadro clínico del paciente. Una solución consiste en administrar PEEP para mejorar la oxigenación y poder disminuir la FIO2. La PEEP puede mantener la arquitectura pulmonar dado que previene el colapso de las vías aéreas pequeñas y los alveolos, y reduce el shunt intrapulmonar mejorando la oxigenación y la relación V/Q111. Niveles altos de PEEP puede disminuir la lesión pulmonar por reducción de los fenómenos cíclicos de reclutamiento/desreclutamiento de los alveolos en las zonas límites de alveolos aireados y colapsados112. A pesar de esto, se debe tener en cuenta los posibles efectos perjudiciales de la PEEP, ya que puede llegar a sobredistender los alveolos, empeorar la relación V/Q e incluso crear mayor espacio muerto, también por aumento de la presión intratorácica puede disminuir el retorno venoso y provocar hipotensión arterial112.
El nivel óptimo de PEEP en pacientes con SDRA no está bien definido, tres grandes estudios realizados para comparar niveles altos de PEEP vs niveles bajos de PEEP han sido negativos, Alveoli113, Express114, y Lovs115, puesto que no demuestran mejoría significativa de la supervivencia. El estudio Lovs observó menor incidencia de hipoxemia refractaria y en el estudio Express se observó una mejor compliance pulmonar así como oxigenación en el grupo intervención. Un metaanálisis de los mencionados estudios, realizado por Briel et al.116 no encontró diferencias estadísticamente significativas en la mortalidad hospitalaria (32.9% vs 35.3%). Analizando por separado los pacientes con SDRA, los mayores niveles de PEEP se asociaron con una reducción de la mortalidad hospitalaria en el subgrupo SDRA (34.1% vs 39.1%). Estos resultados recomiendan que la estrategia de VMPP con altos niveles de PEEP puede beneficiar a los pacientes con mayor reclutamiento previniendo los ciclos de colapso alveolar.
Las maniobras de reclutamiento alveolar, consistentes en el aumento transitorio de la presión transpulmonar en un intento de abrir o reclutar los alveolos colapsados, no han registrado superioridad hacia alguna de las estrategias usadas para tal fin. La presión óptima, duración y frecuencia de las maniobras de reclutamiento no han sido definidas en estudios clínicos. Un metaanálisis realizado por Fan et al.117 registró una mejoría en la oxigenación al realizar maniobras de reclutamiento pero con un efecto transitorio, observando frecuentes complicaciones como desaturación e hipotensión, por lo cual recomienda valorar su uso en forma individual, y en última instancia, usarse como estrategia de rescate en situación de hipoxemia refractaria.
El papel preciso de los métodos alternativos de ventilación mecánica, tales como ventilación de alta frecuencia y ventilación de liberación de presión de la vía aérea no ha sido establecidas. La ventilación de alta frecuencia consiste en el uso de VC muy bajos sumado a una alta frecuencia (180 a 1800 ciclos/ minuto) en un intento de mantener una alta presión media en vía aérea pero con mínimas diferencias de presiones durante el ciclo, permitiendo, en teoría, reclutar los alveolos y mantenerlos abiertos durante todo el ciclo evitando el colapso espiratorio118. La ventilación de liberación de presión de la vía aérea no solo proporciona presiones de la vía respiratoria media más altas, sino también tiene en cuenta la respiración espontanea, que puede estar asociada con un mejor intercambio gaseoso, requerimientos hemodinámicos y reducción de la sedación119.
De estos modos alternativos de ventilación mecánica, solo la ventilación de alta frecuencia ha sido estudiada con ensayos aleatorizados, analizando su impacto respecto a la ventilación convencional. El estudio realizado por Derdak et al.120 analizó 148 pacientes con SDRA, observando una mejoría precoz (menor a 24 horas) pero transitoria de la oxigenación, y una tendencia a una menor mortalidad en el grupo de alta frecuencia (a los 30 días y 6 meses). El metaanálisis realizado por Sud et al.121 sugirió una tendencia menor en la mortalidad y duración de la ventilación en los pacientes con ventilación de alta frecuencia. Un estudio más reciente, realizado por Young et al.122 investigó el impacto de este tipo de ventilación con respecto a la ventilación convencional en fase precoz de SDRA, donde no se observó diferencia significativa en mortalidad a 30 días.
VENTILACIÓN MECÁNICA EN DECÚBITO PRONO
Bases Fisiopatológicas
Diversos cambios anatómicos y fisiológicos se presentan al cambiar el paciente de posición supina a prona, estos afectan tanto a pulmones sanos como enfermos pero las consecuencias son más pronunciadas en presencia de atelectasias o condiciones que favorezcan su aparición123. Los pacientes con SDRA presentan más masa en el tejido pulmonar debido a la presencia de edema, lo cual favorece el desarrollo de atelectasias por transmisión vertical de fuerzas gravitatorias que comprimen las regiones pulmonares más dependientes (dorsales), favoreciendo mejor ventilación en las áreas no dependientes (ventrales). A ello se añaden el peso del corazón y el efecto de la masa abdominal, que en posición supina comprime en dirección cefálica las partes posteriores del diafragma. Este efecto se exacerba con la presencia de distensión abdominal, parálisis diafragmática y disminución del surfactante pulmonar124,125. El aumento de áreas atelectasicas en las zonas dependientes del pulmón, favorece el aumento de espacio muerto pulmonar, aumentando la relación V/Q, teniendo en cuenta, las áreas mejor perfundidas son las dependientes, como se expuso anteriormente, y las áreas mejor ventiladas en el SDRA son las no dependientes.
Inicialmente fue propuesto que el mecanismo por el cual se incrementa la oxigenación en el paciente en DP era la redistribución de la perfusión a las áreas ventrales, mejor ventiladas, por efecto de la gravedad126. Sin embargo, Wiener et al.127 reportaron que el incremento del gradiente de perfusión de la posición supina a prona es mínimo, hallazgos que han sido confirmados por otros autores, llevando a reconsiderar esta teoría128.
Para mejorar la relación V/Q, teniendo en cuenta que la perfusión regional presenta cambios mínimos, la distribución regional de la ventilación debe variar en el DP. Cabe mencionar, debido a los efectos de la gravedad, la presión pleural en la posición supina es menos negativa (o más positiva) en las zonas dependientes del pulmón a diferencia de las zonas no dependientes129,130, lo que incrementa la presión transpulmonar en las áreas ventrales en comparación de las áreas dorsales y favorece la aparición de atelectasias en estas últimas131,132. Varios estudios experimentales han mostrado que la posición DP disminuye el gradiente de presión pleural, conllevando que la presión pleural de las áreas dorsales sea más negativa130,133, lo cual incrementa la presión transpulmonar, superando la presión de cierre alveolar, esto mantiene abierto el alveolo (reclutado). Por otra parte, la presión pleural en las áreas ventrales en esta posición es menos negativa, disminuyendo la presión transpulmonar, pero manteniéndose por encima de la presión de cierre alveolar, lo cual conlleva que permanezcan ventiladas134.
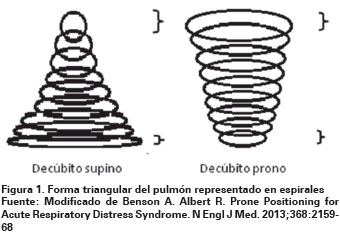
El cambio posicional afecta múltiples variables, la masa del corazón y mediastinal comprime las áreas dorsales pulmonares en la posición supina, pero no en la posición prona135,136; además, teniendo en cuenta la forma triangular que generalmente presenta el pulmón en el plano ventral-dorsal, se presentan diferencias en la forma de compresión diafragmática en las zonas ventrales y dorsales; en posición supina las áreas dorsales pulmonares son comprimidas por el contenido abdominal, no así en la posición prona, donde solo pequeñas porciones de las áreas ventrales pulmonares son afectadas, conllevando a un efecto más uniforme y menor tendencia al colapso alveolar137 (Ver Figura 1).
En algunos pacientes se ha observado que la posición prona favorece el drenaje de secreciones respiratorias, ya que en esta posición las vías aéreas tienen ángulos hacia abajo y el movimiento de las vías aéreas pequeñas hacia las grandes, por fuerza de gravedad, se ve favorecido138.
Los efectos benéficos en la tasa de supervivencia de los pacientes pueden ser atribuidos a la prevención de la lesión pulmonar asociada a ventilador139,140. Se atribuyen dos mecanismos relacionados, sobredistensión alveolar (volutrauma) y apertura-cierre cíclico de las vías aéreas pequeñas (atelectrauma)141,142. La sobredistensión puede ser resultado de una muy negativa presión pleural, lo cual puede ocurrir en las áreas pulmonares ventrales en respuesta a altos volúmenes pulmonares, o la heterogeneidad en la distensión alveolar que se presenta en el SDRA, expuesta anteriormente, con áreas atelectásicas predominio en las regiones pulmonares dorsales, que dirige el volumen pulmonar a las áreas no colapsadas. La posición DP disminuye la presión pleural de las áreas pulmonares no dependientes y además reduce la aparición de atelectasias en las áreas dependientes impactando en los dos factores anteriormente expuestos130.
El segundo mecanismo propuesto es la apertura-cierre cíclico que conlleva a fuerzas de cizallamiento en las vías aéreas, lesionando las células epiteliales143. Si todas las vías aéreas pudiesen permanecer abiertas al final de la espiración, este mecanismo de lesión pulmonar asociada a ventilador sería eliminado. Existen diversas opiniones acerca del manejo de las presiones de apertura y cierre de la vía aérea debido a los altos niveles de PEEP necesarios para garantizar que todas las vías aéreas se mantengan abiertas al final de la espiración. Además, la ventilación con VC bajo administrada con la idea de reducir la sobredistension tiende a limitar la capacidad de abrir las vías aéreas colapsadas y la producción de surfactante pulmonar por los neumocitos tipo 2 llevando a un aumento del cierre de la vía aérea144. Sin embargo, el DP reduce algunas de las fuerzas que contribuyen al cierre de la vía aérea y parcialmente alcanza el objetivo de mantener la permeabilidad de la vía aérea sin PEEP adicional. Estudios en varias especies han mostrado menos lesión pulmonar asociada a ventilador en animales ventilados en DP145.
Indicación y Método
Anteriormente se recomendaba el uso del DP para todos aquellos pacientes con SDRA; sin embargo, actualmente la indicación precisa es para aquellos pacientes con SDRA grave (PaO2/Fio2 menor 100), pues se ha visto que es en este grupo de pacientes en los que se han observado mejores resultados, sobre todo cuando se inicia en forma temprana. Gattinoni147 definió como respondedores a todos aquellos pacientes sometidos a ventilación mecánica y colocados en DP que aumentaron sus valores de PaO2/FiO2 en al menos 20%. Describió como respondedores a CO2 a todos aquellos pacientes que modificaron sus valores de CO2 en al menos 1 mmHg. Lo anterior debido a que, desde un punto de vista fisiológico, la variación en 1 mmHg en la PaCO2 equivale a 10 mmHg en la PaO2. También observó una correlación en el grupo de pacientes en los que aumentó la PaCO2, la sobrevida fue menor del 40%, mientras que en el grupo cuya PaCO2 disminuyó, la sobrevida fue de 65-70%.
La respuesta gasométrica se observa entre los 30 y 60 minutos del cambio de decúbito y se mantiene o aumenta con el tiempo hasta las 12 a 48 horas. Por ello, los pacientes deberían mantenerse en DP durante un tiempo prolongado148-151. Actualmente no existe conceso de cuál es el tiempo idóneo en el que debe mantenerse el DP en los pacientes con SDRA; sin embargo, existen reportes en los cuales el tiempo o duración de la estrategia ha ido de dos horas hasta 18 horas al día, en algunas series se han reportado periodos tan largos como 16 días. Sin embargo, existe certeza de que después del día 15 de iniciar la estrategia no existe ninguna mejoría adicional en el intercambio de gases, solo se incrementa el riesgo de complicaciones inherentes a la maniobra. De esta manera en el metaanálisis realizado por Alsghir et al.152 y en el ensayo clínico multicéntrico aleatorizado realizado por Fernandez et al.153 se concluye que el periodo mínimo de duración para mantener esta maniobra es de dos horas y el máximo de 15 días.
A continuación se expondrá la técnica para colocar el paciente en decúbito prono154: La colocación del paciente en decúbito prono requiere tiempo y preparación. Es necesaria la colaboración de cuatro personas para el giro de supino a prono, y una persona para asegurar la cabeza y el tubo endotraqueal. Se deben tener preparadas en forma previa tres almohadas para los hombros, la pelvis y los tobillos, además de un cojín para apoyo de la cabeza.
El giro consta de dos fases: lateralización y pronación. Antes de lateralizar el paciente, este deberá ser ubicado lo más próximo posible al borde de la cama, con el fin de disponer de espacio suficiente para la pronación. El brazo del lado sobre el cual va a ser girado deberá colocarse bajo la cadera homolateral, mientras que el otro brazo se colocará flexionado sobre el tórax. Al realizarse la lateralización y posterior pronación, deberá tenerse cuidado para que no se salgan los tubos, lo catéteres o drenajes que tenga insertados el paciente.
Al realizar la pronación, la cabecera de la cama deberá elevarse (posición antitrendelemburg), el brazo situado inicialmente en la cadera se colocará extendido a lo largo del costado del paciente y el otro brazo se flexionará por encima del hombro, girando la cabeza hacia el lado opuesto, es decir, hacia el brazo extendido. Se colocará una almohada bajo los hombros y otra bajo la pelvis, de manera que el abdomen quede libre. Otra almohada será colocada en los tobillos, con el fin de evitar excesiva flexión plantar. Debajo de la cabeza se situará el cojín.
Los brazos y la cabeza deberán cambiarse de posición cada 2 a 4 horas, flexionando el brazo previamente extendido y extendiendo el brazo previamente flexionado, girando a su vez la cabeza hacia el brazo que quede extendido, de esta manera se evitaran lesiones por estiramiento del plexo braquial. Los electrodos del electrocardiograma se colocaran en la espalda del paciente. Se deben proteger con crema o apósitos hidrocoloides los puntos de presión, tales como pómulos, cara y rodillas.
Contraindicaciones
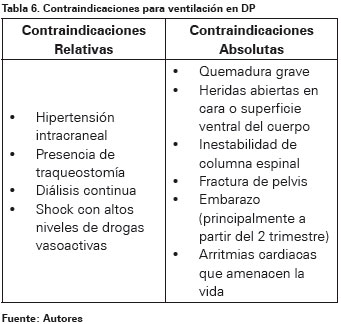
Aunque no hay consenso acerca de las contraindicaciones absolutas para ventilación en DP en la literatura, se deben tener en cuenta situaciones especiales que pueden aumentar el riesgo de complicaciones155. Entre ellas se encuentran las pacientes embarazadas, principalmente a partir del segundo trimestre, y quemaduras graves o heridas abiertas en cara o superficie ventral del cuerpo que podría aumentar el riesgo de infección. La fractura o lesión espinal inestable requieren extremo cuidado en el proceso de giro, podría incluir el apoyo de la espalda en un tablero. Las fracturas pélvicas puedes ser desestabilizadas al ser girado el paciente. La presión intracraneal puede aumentar con un marcado giro de la cabeza de un lado a otro, o simplemente con el giro en bloque a posición prona, pero ambos pueden ser minimizados aplicando posición antitrendelenburg156,157 (Ver Tabla 6).
Complicaciones
La ventilación en DP no se asocia con el aumento de complicaciones cuando se compara con la ventilación en decúbito supino34. Los informes de efectos adversos muestran baja frecuencia de presentación y la mayoría de ellos son evitables158,159. Las complicaciones más frecuentemente descritas son pérdida de catéter venoso central y periférico, sondas de alimentación y catéteres arteriales. Otra complicación frecuente son las lesiones en piel, principalmente cara y cabeza. Otras más graves, son pérdida o desplazamiento del tubo endotraqueal, inestabilidad hemodinámica transitoria, episodio de sepsis atribuidos a dehiscencia de área quirúrgica abdominal, y lesiones del plexo braquial160-163.
En el Estudio Prono-Supino I, Guerin et al.29 reportaron complicaciones relacionadas con úlceras de presión en 36% de la pacientes y pérdida del tubo orotraqueal en 1,2% de los pacientes. Las úlceras se distribuyeron de forma heterogénea: 46% de los pacientes las presentaron en la pelvis, 21% en el tórax y 19% en las piernas. En el más reciente estudio, Prono-Supino II,31 una proporción significativamente mayor de pacientes en el grupo prono presento al menos una de las complicaciones mencionadas (94,6% versus 76,4%) y la mayor incidencia de complicaciones se presentó en el grupo prono.
Respecto a la nutrición enteral precoz, los pacientes en DP presentan más episodios de intolerancia (82% versus 49%) con menores volúmenes de nutrición. Los agentes procinéticos y las sondas nasoyeyunales son dos opciones que se deben tener en cuenta para evitar estas complicaciones, aunque no constituyen contraindicación alguna para el empleo de DP164,165. Es importante tener en cuenta la posibilidad de episodios de paro cardiaco causados por inadvertido desplazamiento del catéter Swan-Ganz durante el giro, han sido reportado casos de desplazamiento, aunque se solucionan de forma sencilla reacomodando el catéter30. El DP también requiere aumento de la sedación y relajantes musculares, hasta en un 25% de los casos31.
MANEJO HEMODINáMICO Y BALANCE HíDRICO
La razón fundamental para restringir líquidos en pacientes con SDRA es el edema pulmonar. Algunos estudios sugieren que al aumentar la permeabilidad capilar del pulmón el agua se acumula en mayor grado (incluso con presiones capilares bajas); además, estudios en animales subrayan que la reducción de agua pulmonar extravascular mejora tanto la oxigenación como la compliance pulmonar166. Si bien son importantes para mantener una presión intravascular que permita adecuada perfusión a los órganos, el aumento de la presión hidrostática capilar por un aporte excesivo de líquido puede desembocar en un empeoramiento del edema pulmonar en pacientes con SDRA. Por su parte, un balance de líquidos positivo se asocia con una peor evolución en estos pacientes167.
Un estudio realizado por SDRA Network, Fluids and Catheters Treatment Trial (FACTT study)168, evaluó el efecto de una estrategia liberal de líquidos frente a una conservadora en pacientes con SDRA. A pesar de no encontrar diferencias significativas en mortalidad entre los grupos, en el grupo conservador se observó una mejoría en la oxigenación, en la estancia hospitalaria y en la duración de la ventilación mecánica, sin un aumento de la disfunción de otros órganos como riñón. Por tanto, se recomienda una estrategia conservadora en la gestión de los líquidos buscando una adecuada perfusión sistémica, determinada por el balance acido-base, metabólico y la función renal. Si la perfusión sistémica no se puede mantener después de la restauración del volumen intravascular, como puede suceder en pacientes con choque séptico, el tratamiento con vasopresores está indicado para la perfusión distal orgánica y normalizar la entrega de oxígeno70.
SOPORTE EXTRACORPOREO
El ECMO (Extra Corporeal Membrane Oxigenation) es un dispositivo en el cual se asegura el intercambio de gases por el paso de la sangre del paciente por un oxigenador de membrana. En el estudio multicentrico Cesar study169, en el cual se comparó ECMO con la ventilación mecánica convencional, se observó mejoría en la supervivencia en el brazo estudio (63% versus 47%), aunque en el análisis del estudio se plantearon dudas por la estrategia ventilatoria del grupo control. Se debe tener en cuenta la complejidad de esta y sus altos costos, en ocasiones requiere el traslado del paciente a un centro especializado, accesos vasculares de gran calibre y anticoagulación completa, por lo cual sería razonable reservarla para situaciones de hipoxemia refractaria y en centros con disponibilidad de la misma. Otra estrategia más reciente es el ECCO2-R (extracorporeal carbon dioxide removal), la cual consiste en una membrana de oxigenación extracorpórea de pequeña superficie que únicamente tiene capacidad para eliminar CO2 (entre 15% a 25%), con escasa capacidad de oxigenación (alrededor del 8%). Todavía existe escasa experiencia clínica publicada para esta estrategia, el ensayo clínico realizado por Gattinoni et al.170, no mostró mejoría sobre la mortalidad de los pacientes. En el estudio realizado por Morris et al.171 donde se asoció a VMPP se apreció mejoría de la mecánica pulmonar. A pesar de estos resultados, son necesarios estudios más amplios para conocer el verdadero impacto de estas estrategias en pacientes con SDRA.
OXIDO NíTRICO INHALADO Y OTROS VASODILATADORES
El óxido nítrico es un vasodilatador potente que puede ser liberado a la vasculatura pulmonar por inhalación sin causar vasodilatación sistémica, reduce las alteraciones V/Q mejorando la oxigenación por una vasodilatación selectiva de las unidades alveolares ventiladas172, aunque los estudios realizados han demostrado resultados discordantes. En un estudio fase 2 realizado por Dellinger.173 y en el estudio realizado por Payen et al174. no se observó reducción en la mortalidad o en la duración de la ventilación mecánica. Por su parte, una revisión de la base de datos Cochrane175, analizando 14 ensayos clínicos donde se incluían pacientes pediátricos y adultos mostró una mejoría transitoria en la oxigenación sin beneficio en la supervivencia, en la duración de la ventilación mecánica o estancia en unidad de cuidados intensivos/hospitalaria, y encontró mayor incidencia de fracaso renal en el grupo tratado con óxido nítrico inhalado, por lo que su aplicación no puede ser recomendada actualmente en forma rutinaria para el manejo del SDRA. Adicionalmente, se deben evaluar los efectos adversos, que son metahemoglobinemia, productos citotóxicos de nitrógeno (dióxido de nitrógeno) y disfunción plaquetaria172. El tratamiento con otros vasodilatadores menos selectivos como el nitropusiato de sodio176, hidralazina178 y prostaglandina E1178, tampoco se pueden recomendar en forma rutinaria y su impacto se encuentra en revisión.
AGENTES ANTIINLAMATORIOS
El proceso patogénico del SDRA inicia con un proceso inflamatorio severo seguido de cambios fibroproliferativos, motivo por el cual se consideró que el uso de esteroides podría reducir el proceso y moderar la fibrosis. Sin embargo, se ha demostrado que altas dosis de corticoides no previenen la aparición del SDRA en paciente de alto riesgo, ni cambian el curso de la enfermedad al administrarse en etapas tempranas179,180. En un ensayo clínico controlado realizado por SDRA Network181, donde se evaluó el efecto de los esteroides en la fase tardía del SDRA, caracterizada por fibrosis, no se encontró efecto significativo sobre la mortalidad a 60 días. Se necesitan estudios adicionales para evaluar el efecto de los esteroides en el curso de la evolución del SDRA.
El ketoconazol182, la pentoxifilina183 y la N-acetilcisteina184 han sido evaluados en el manejo de pacientes con SDRA, por su capacidad antiinflamatoria y antioxidante, no encontrando mejoría en la mortalidad y desaconsejando su uso en el tratamiento de esta patología.
La resolución del SDRA depende de la adecuada reducción del edema alveolar, una reabsorción defectuosa del mismo se asocia con menor supervivencia del paciente185. Los beta agonistas mejoran la remoción del líquido de edema, incrementan en cierta medida la secreción de surfactante y pueden llegar a ejercer un efecto antiinflamatorio ayudando a restaurar la permeabilidad vascular del pulmón186,187. El efecto de los beta agonistas ha sido estudiado en forma amplia, un estudio realizado por Matthay et al.188 analizó el efecto del albuterol nebulizado sin encontrar beneficio en su uso. El salbutamol intravenoso se analizó en dos estudios, en el BALT-1189, se observó disminución del edema pulmonar en el grupo tratado con salbutamol; sin embargo, en el BALT-2190, no se encontró mejoría en la supervivencia de los pacientes, incluso se apreció una tendencia a elevar la mortalidad, por lo que los beta agonistas no se recomiendan para el manejo de pacientes con SDRA.
TERAPIA SURFACTANTE
El surfactante pulmonar es una mezcla compleja de fosfolípidos, proteínas y lípidos neutros producidos por las células alveolares tipo II; ayuda a mantener la tensión superficial alveolar y está involucrado en la respuesta inmune. El lavado broncoalveolar de los pacientes con SDRA muestra cambios en la composición de los fosfolipidos así como una disminución de los niveles de proteínas tensoactivas191. Múltiples estudios han intentado probar el potencial efecto beneficioso del tratamiento con surfactante en los pacientes con SDRA; sin embargo, a diferencia de lo ocurrido en recién nacidos y niños, no se ha podido demostrar impacto favorable sobre la mortalidad o la oxigenación192,193.
CéLULAS MADRE MESENQUIMALES
Las células madre mesenquimales son células derivadas de la medula ósea con capacidad de dar origen a diferentes tipos de células. En modelos animales con SDRA y ex-vivos con pulmón humano, el manejo con estas células por vía intravenosa generó una reducción en la liberación de citoquinas pro-inflamatorias; además conllevó a la normalización de la permeabilidad vascular y epitelial a proteínas, reduciendo el edema pulmonar y mejorando el porcentaje de remoción del líquido alveolar, actualmente se están desarrollando estudios en humanos para evaluar su efecto194.
OTRAS ESTRATEGIAS
Adicional a las estrategias mencionadas anteriormente, se han evaluado un importante número de alternativas con resultados no convincentes. Entre estas se encuentran las estatinas, que por sus potenciales efectos antiinflamatorios se evaluaron en el manejo de SDRA, con datos preclínicos preliminares prometedores, pero con estudios clínicos muy dispares195. Otros son la proteína C activada, interferon beta, heparina nebulizada y CytoSorb (cartucho de absorción de citoquinas)193. Se postula como principal inconveniente para el avance de estudios de alternativas terapéuticas la no disponibilidad de modelos animales que representen adecuadamente la patogénesis del SDRA en humanos193.
CONCLUSIONES
El SDRA es una patología relevante, tanto por su alta morbimortalidad como por el elevado coste y consecuente consumo de recursos. En las últimas décadas se ha avanzado mucho en el conocimiento de las situaciones que producen una respuesta inflamatoria sistémica predisponiendo a la aparición de este síndrome, siendo las causas intrapulmonares las más frecuentes, y dentro de las mismas la neumonía bacteriana o viral. Típicamente el paciente cursa con disnea, cianosis, crépitos difusos, taquipnea, taquicardia, diaforesis e hipoxemia que hace necesaria altas concentraciones de oxígeno suplementario conllevando a necesidad de ventilación mecánica. Su diagnóstico se realiza cumpliendo los criterios de Berlín, destacando que la insuficiencia respiratoria no debe ser secundaria a insuficiencia cardiaca o sobrecarga de líquidos.
El reconocimiento de que la ventilación mecánica, aunque fundamental en el tratamiento del SDRA, puede contribuir a la morbilidad y mortalidad del paciente, ha sido el avance más importante en el manejo de estos pacientes. La ventilación mecánica de protección pulmonar claramente conduce a mejorar la supervivencia y el uso conjunto de altos niveles de PEEP beneficia a los pacientes con mayor reclutamiento previniendo los ciclos de colapso alveolar. El papel de las maniobras de reclutamiento permanece controversial y es tema de estudio. El uso de modos alternativos de ventilación mecánica y las terapias adjuntas como óxido nítrico, nitropusiato de sodio, hidralazina, prostaglandina E1, esteroides, pentoxifilina, N-acetilcisteina, terapia surfactante y células madres mesenquimales deberían limitarse a estudios clínicos futuros y a la terapia de rescate para pacientes con SDRA e hipoxemia refractaria que amenaza la vida con falla máxima de la ventilación de protección pulmonar convencional.
Por su parte, la ventilación en decúbito prono favorece el aumento de la oxigenación en pacientes con SDRA.
Los mecanismos que producen este incremento son probablemente múltiples e interdependientes y no han sido dilucidados en su totalidad. La aparición de complicaciones que coloquen en riesgo la vida del paciente es extremadamente infrecuente. Además, es un procedimiento de bajo costo, recomendado implementar en pacientes con SDRA categoría grave, y preferentemente en etapa tempana de la enfermedad. Sin embargo, es necesario realizar estudios futuros que puedan establecer el verdadero impacto en la mortalidad para evaluar su uso sistemático en todos los pacientes con SDRA, por lo cual se acepta actualmente implementar en este subgrupo de pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Fernández R. Fisiopatología del intercambio gaseoso en el SDRA. Med Intensiva. 2006;30(8):374-378. [ Links ]
2. Herridge M, Cheung A, Tansey C, et al. One-year outcomes in survivors of the acute respiratory distress syndrome. N Engl J Med. 2003;348:683-93. [ Links ]
3. Kollef M, Schuster D. The acute respiratory distress syndrome. N Engl J Med. 1995;332:27-37. [ Links ]
4. Ward N. Effects of prone position ventilation in ARDS, an evidence-based review of the literature. Crit Care Clin. 2002;18(1):35-44. [ Links ]
5. Blanco A, Moreno R. Efectos del decúbito prono en el tratamiento del síndrome de dificultad respiratoria aguda en pacientes pediátricos. Arch argent pediatr. 2006;104:138-149. [ Links ]
6. The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000;342:1301-8. [ Links ]
7. Bernard G, Artigas A, Brigham K, et al. The American-European Consensus Conference on ARDS: definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994;149:818-24. [ Links ]
8. Ashbaugh D, BigeIow D, Petty T, Levine B. Acute respiratory distress in adults. Lancet. 1967;2:319-23. [ Links ]
9. Murray I, Matthay M, Luce J, et al. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis. 1988;139:1065-70. [ Links ]
10. Doyle R, Szaflarski N, Modin G, Wiener-Kronish J, Matthay M. Identification of patients with acute Iung injury: predictors of mortality. Am J Respir Crit Care Med. 1995;152:1818-24. [ Links ]
11. Zilberberg M, Epstein S. Acute lung injury in the medical ICU: comorbid conditions, age, etiology, and hospital outcome. Am J Respir Crit Care Med. 1998;157: 1159-64. [ Links ]
12. Sloane P, Gee M, Gottlieb J, et al. A multicenter registry of patients with acute respiratory distress syndrome: physiology and outcome. Am Rev Respir Dis. 1992;146:419-26. [ Links ]
13. Monchi M, Bellenfant F, Cariou A, et al. Early predictive factors of survival in the acute respiratory distress syndrome: a multivariate analysis. Am J Respir Crit Care Med. 1998;158:1076-81. [ Links ]
14. Abraham E, Matthay M, Dinarello C, et al. Consensus conference definitions for sepsis, septic shock, acute lung injury, and acute respiratory distress syndrome: time for a reevaluation. Crit Care Med. 2000;28:2325. [ Links ]
15. Rubenfeld G, Caldwell E, Granton J, Hudsou L, Matthay M. Interobserver variability in applying a radiographic definition ARDS. Chest. 1999;116:1347-53. [ Links ]
16. Meade M, Cook R, Guyatt G, et al. Interobserver variation in interpreting chest radiographs for the diagnosis of acute respiratory distress syndrome. Am J Respir Crit Care Med. 2000;161:85-90. [ Links ]
17. Ranieri V, Rubenfeld G, Thompson B. Acute respiratory distress syndrome. The Berlin Definition. JAMA. 2012;307(23):2526- 2533. [ Links ]
18. Hurtado A, Frey W. Studies of total pulmonary capacity and its subdivisions. IE Changes with body posture. J Clin Invest. 1933;12:825-831. [ Links ]
19. Blair E, Hickham J. The effect of change in body position on lung volume and intrapulmonary gas mixing in normal subjects. J Clin Invest. 1955;34(3):383-389. [ Links ]
20. Moreno F, Lyons H. Effect of body posture on lung volumes. J Appl Physiol. 1961;16:27-29. [ Links ]
21. Bryan A. Comments of a devil's advocate. Am Rev Respir Dis. 1974;110:143-44. [ Links ]
22. Piehl M, Brown R. Use of extreme position changes in acute respiratory failure. Crit Care Med. 1976;4(1):13-4. [ Links ]
23. Douglas F, Finlayson D. Effect of positive end expiratory pressure on lung mechanics during anaesthesia in dogs. Can Anaesth Soc J. 1977;24(4):425-32. [ Links ]
24. Hernández G, Mondragón T, Torres L, Magdaleno G. Posición prono, más que una estrategia en el manejo de pacientes con síndrome de insuficiencia respiratoria aguda. Rev Hosp Jua Mex. 2012;79(4):263-270. [ Links ]
25. Albert R, Leasa D, Sanderson M, et al. The prone position improves arterial oxygenation and reduces shunt in oleic-acidinduced acute lung injury. Am Rev Respir Dis. 1987;135(3):628-33. [ Links ]
26. Valdés A, Bustamante R, Hernández J. Ventilación mecánica en posición prona en el síndrome de dificultad respiratoria aguda. Rev Cub Med Int Emerg. 2009;8(2):1561-1568 [ Links ]
27. Gattinoni L, Tognoni G, Pesenti A, et al. Effect of prone positioning on the survival of patients with acute respiratory failure. N Engl J Med. 2001;345:568-73. [ Links ]
28. Gorrasi J, Pracca F, Iturralde A, La Torre M, Santos C, Cancela M. Efecto de la ventilación en decúbito prono por más de 6 horas en el intercambio gaseoso en pacientes con SDRA de origen pulmonar. IV Congreso de la ALAT Y 32° Congreso Argentino de Medicina Respiratoria. Asociación Latinoamericana de Tórax (ALAT) y la Asociación Argentina de Medicina Respiratoria (AAMR); 2004. Disponible en: http://www.congresosaamr.org.ar/Congresos%202004. [ Links ]
29. Guerin C, Gaillard S, Lemasson S. Effects of systematic prone positioning in hypoxemic acute respiratory failure: a randomized controlled trial. JAMA. 2004;292:2379-81. [ Links ]
30. Mancebo J, Fernandez R, Blanch L, et al. A multicenter trial of prolonged prone ventilation in severe acute respiratory distress syndrome. Am J Respir Crit Care Med. 2006;173(11):1233-9. [ Links ]
31. Taccone P, Presenti A, Latini R, et al. For the Prone-Supine II Study Group. Prone positioning in patients with moderate and severe acute respiratory distress syndrome. A randomized controlled trial. JAMA. 2009;302(18):1977-84. [ Links ]
32. Abroug F, Ouane-Besbes L, Dachraoui F. An updated study level meta-analysis of randomized controlled trials on proning in ARDS and acute lung injury. Critical Care. 2011;15:6-15. [ Links ]
33. Rubenfeld G, Caldwell E, Peabody E. Incidence and outcomes of acute lung injury. N Engl J med. 2005;353:1685-1693. [ Links ]
34. Zambon M, Vincent J. Mortality rates for patients with acute lung injury/ARDS have decreased over time. Chest. 2008;133(5):1120-1127. [ Links ]
35. Wbster N, Cohen A, Nunn J. Adult respiratory distress syndrome-how many cases in the UK?. Anaesthesia. 1988;43:923-6. [ Links ]
36. Luhr O, Antonsen K, Karlsson M, Aardal S, Thorsteinsson A, Frostella C, et al. Incidence and mortality after acute respiratory failure and acute respiratory distress syndrome in Sweden, Denmark, and Iceland. The ARF Study Group. Am J Respir Crit Care Med. 1999;159:1849-61. [ Links ]
37. Li G, Malinchoc M, Cartin-Ceba R, Venkata C, Kor D, Peters S, et al. Eight-year trend of acute respiratory distress síndrome: A population-based study in Olmsted County, Minnesota. Am J Respir Crit Care Med. 2011;183:59-66. [ Links ]
38. Cortes I, Peñuelas O, Esteban A. Acute respiratory distress síndrome: Evaluation and management. Minerva Anestesiol. 2012;78:343-57. [ Links ]
39. Montgomery A, Stager M, Carrico C, Hudson L. Causes of mortality in patients with the adult respiratory distress syndrome. Am Rev Respir Dis. 1985;132:485-9. [ Links ]
40. Heffner J, Brown L, Barbieri C, Harpel K. T- Prospective validation of an acute respiratory distress syndrome predictive score. Am J Respir Crit Care Med. 1995;152:1518-26. [ Links ]
41. Herner J, Brown L, Barbieri C, Harpel K, Deleo J. Prospective validation of an acute respiratory distress syndrome predictive score. Am J Respir Crit Care Med. 1995;159:1849-61. [ Links ]
42. Ely E, Wheeler A, Thompson B, Steinberg K, Bernard G. Recovery rate and prognosis in older persons who develop acute lung injury and the acute respiratory distress syndrome. Ann Intern Med. 2002;136:25-36. [ Links ]
43. Christie J, Wurfel M, Feng R, O'keefe G, Bradfield J, Ware L. Trauma ALI SNP consortium (TASC) investigators. Genome wide association identifies PPFIA 1 as a candidate gene for acute lung injury risk following major trauma. PLOS ONE. 2012;7:28268. [ Links ]
44. Meyer N, Li M, Feng R, Bradfield J, Gallop R, Bellamy S, et al. ANGPT 2 genetic variant is associated with trauma-associated acute lung injury and altered plasma angioprotein-2 isoform ratio. Am J Respir Crit Care Med. 2011;183:1344-53. [ Links ]
45. Gong M. Gene association studies in acute lung injury: Replication and future direction. Am J Physiol Lung Cell Mol Physiol. 2009;296:711-2. [ Links ]
46. Matthay M, Zimmerman G, Esmon C, Bhattacharya J, Coller B, Doerschuk C, et al. Future research directions in acute lung injury: summary of a National Heart, Lung, and Blood Institute Working group. Am J Respir Crit Care Med. 2003;167:1027-35. [ Links ]
47. Erickson S, Shilipak M, Martin G, Wheeler A, Ancukiewics M, Matthay M, et al. National Institutes of Health National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome Network. Racial and ethnic disparities in mortality from acute lung injury. Crit Care Med. 2009;37:1-6. [ Links ]
48. Mizgerd J. Acute lower respiratory tract infection. N Engl J Med. 2008;358:716-27. [ Links ]
49. McHugh L, Milberg J, Whitcomb M, Schoene R, Maunder R, Hudson L. Recovery of function in survivors of the acute respiratory distress syndrome. Am J Respir Crit Care Med. 1994;150:90-4. [ Links ]
50. Suchyta M, Elliott C, Jensen R, Crapo R. Predicting the presence of pulmonary function impairment in adult respiratory distress syndrome survivors. Respiration. 1993;60:103-8. [ Links ]
51. Ghio A, Elliott C, Crapo R, Berlin S, Jensen R. Impairment alter adult respiratory distress syndrome: an evaluation based on American Thoracic Society recommendations. Am Rev Respir Dis. 1989;139:1158-62. [ Links ]
52. Elliott C, Rasmusson B, Crapo R, Morris A, Jensen R. Prediction of pulmonary function abnormalities alter adult respiratory distress syndrome (ARDS). Am Rev Respir Dis. 1987;135:634-8. [ Links ]
53. Weinert C, Gross C, Kangas J, Bury C, Mm·inelli W. Health related quality of life after acute lung injury. Am J Respir Crit Care Med. 1997;156:1120-8. [ Links ]
54. Davidson T, Caldwell E, Curtis J, Hudson L, Steinberg K. Reduced quality of life in survivors of acute respiratory distress syndrome compared with critically ill control patient. JAMA. 1999;281: 354-60. [ Links ]
55. Heyland D, Groll D, Caeser M. Survivors of acute respiratory distress syndrome: Relationship between pulmonary dysfunction and longterm health-related quality of life. Crit Cm e Med. 2005;33:1549-1556. [ Links ]
56. Hopkins R, Weaver L, Collingridge D, Parkinson R, Chan K, Orme J. Two year cognitive, emotional, and quality of life Outcomes in Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med. 2005;171:340-347. [ Links ]
57. Ware L, Matthay M. The acute respiratory distress syndrome. N Engl J Med. 2000;342:1334-49. [ Links ]
58. Elastic forces and lung volume. En: Lumb A, Nun J, editores. Applied respiratory physiology. 5th ed. Edinburgh:Butterworth Heinemann; 2000.p.37-57. [ Links ]
59. Balcells J. Monitorización de la función respiratoria: curvas de presión, volumen y flujo. An Pediatr. 2003;59:252-85. [ Links ]
60. Vargas C, Gochicoa L, Velázquez M, et al. Pruebas de función respiratoria, ¿cuál y a quién? Neumol Cir Torax. 2011;70(2):101- 117. [ Links ]
61. Duke J. Fisiología pulmonar y respiratoria. Secretos de Anestesia. 4th Edición. Cap 2, pag 19-23. [ Links ]
62. Herrera P, Duarte G. Flujo sanguíneo y ventilación pulmonares: ¿nuevo paradigma?. Rev colomb anestesiol. 2013;41(4):280- 282. [ Links ]
63. Sapru A, Flori H, Quasney M, Dahmer M. Pediatric Acute Lung Injury Consensus Conference Group. Pathobiology of Acute Respiratory Distress Syndrome. Pediatr Crit Care Med. 2015;16(5):6-22. [ Links ]
64. Bachofen M, Weibel E. Structural alterations of lung parenchyma in the adult respiratory distress syndrome. Clin Chest Med. 1982;3-35-56. [ Links ]
65. Park W, Goodman R, Steinberg K, et al. Cytokine balance in the lungs of patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2001;164:1896-1903. [ Links ]
66. Wygrecka M, Morty R, Markart P, Kanse S, et al. Plasminogen activator inhibitor-1 is an inhibitor of factor VII-activating protease in patients with acute respiratory distress syndrome. J Biol Chem. 2007;282:21671-82. [ Links ]
67. Bachofen M, Weibel E. Alterations of the gas exchange apparatus in adult respiratory insufficiency associated with septicemia. Am Rev Respir Dis. 1977;116:589-615. [ Links ]
68. Pelossi O, D'Onofrio D, Chiumello D, Paolo S, et al. Pulmonary and extrapulmonary acute respiratory distress syndrome are different. Eur Respir J. 2005;42:48-56. [ Links ]
69. Pratt P, Vollmer R, Sbelburne J, Crapo J. Pulmonary morphology in a multihospital collaborative extracorporeal membrane oxygenation project. Am J Pathol. 1979; 95:191-214. [ Links ]
70. Matthay M, Broaddus V. Fluid and hemodynamic management in acute lung injury. Semin Respir Crit Care Med. 1994;15:271- 88. [ Links ]
71. Hudson L, Milberg J, Anardi D, Maunder R. Clinical risks for development of the acute respiratory distress syndrome. Am J Respir Crit Care Med. 1995;151:293-301. [ Links ]
72. Aberle D, Wiener-Kronisb J, Webb W, Matthay M. Hydrostatic versus increased permeability pulmonary edema: diagnosis based on radiograpbic criteria in critically ill patients. Radiology. 1988;168:73-9. [ Links ]
73. Goodman L. Congestive heart failure and adult respiratory distress syndrome. New insights using computed tomography. Radiol Clin North Am. 1996;34:33-46. [ Links ]
74. Gattinoni L, Presenti A, Torresin A, et al. Adult respiratory distress syndrome profiles by computed tomography. J Thorac Imaging. 1986;1:25-30. [ Links ]
75. Bouhemad B, Nicolas-Robin A, Arbelot C, et al. Acute left ventricular dilatation and shock-induced myocardial dysfunction. Crit Care Med. 2009;37:441-7. [ Links ]
76. Landesberg G, Gilon D, Meroz Y, et al. Diastolic dysfunction and mortality in severe sepsis and septic shock. Eur Heart J. 2012;33:895-903. [ Links ]
77. Wheeler A, Bernard G, et al. Pulmonary-artery versus central venous catheter to guide treatment of acute lung injury. N Engl J Med. 2006;354:2213-2224. [ Links ]
78. Richard C, Warszawski J, Anguel N, et al. Early use of the pulmonary artery catheter and outcomes in patients with shock and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2003;290:2713-20. [ Links ]
79. Idell S, Cohen A. Bronchoalveolar lavage in patients with the adult respiratory distress syndrome. Clin Chest Med. 1985;6:459-471. [ Links ]
80. Steinberg K, Mitchell D, Maunder R, et al. Safety of bronchoalveolar lavage in patients with adult respiratory distress syndrome. Am Rev Respir Dis. 1993;148:556-561. [ Links ]
81. Patel S, Karmpaliotis D, Ayas N, et al. The role of open-lung biopsy in ARDS. Chest. 2004;125:197-202. [ Links ]
82. Papazian L, Thomas P, Bregeon F, et al. Open-lung biopsy in patients with acute respiratory distress syndrome. Anesthesiology. 1998;88:935-44. [ Links ]
83. Schwarz M, Albert R. "Imitators" of the ARDS: implications for diagnosis and treatment. Chest. 2004;125:1530-1535. [ Links ]
84. Pope-Harman A, Davis W, Allen E, et al. Acute eosinophilic pneumonia. A summary of 15 cases and review of the literature. Medicine (Baltimore). 1996;75:334-42. [ Links ]
85. Buchheit J, Eid N, Rodgers G, et al. Acute eosinophilic pneumonia with respiratory failure: a new syndrome? Am Rev Respir Dis. 1992;145:716-8. [ Links ]
86. Alcolea S, Santiago A, Prados M. Neumonia organizada criptogénica y adenopatias mediastinicas. Arch Bronconeumol. 2004; 40:384-86. [ Links ]
87. Bell R, Coalson J, Smith J, Johanson W. Multiple organ system failure and infection in adult respiratory distress syndrome. Ann Intern Med. 1983;99:293-298. [ Links ]
88. Heyland D, Cook D, Guyatt G. Enteral nutrition in the critically ill patient: a critical review of the evidence. Intensive Care Med. 1993;19:435-442. [ Links ]
89. Saint S, Matthay M. Risk reduction in the intensive care unit. Am J Med. 1998;105:515-523 [ Links ]
90. Gattinoni L, Protti A, Carioni P, Carlesso E. Ventilator induced lung injury: The anatomical and physiological framework. Crit Care Med. 2010;38:539-48. [ Links ]
91. American Thoracic Society. International consensus conferences in intensive care medicine: ventilator-associated lung injury in ARDS. Am J Respir Crit Care Med. 1999;160:2118-24. [ Links ]
92. Dreyfuss D, Soler P, Basset G, Saumon G. High inflation pressure pulmonary edema: respective effects of high airway pressure, high tidal volume, and positive end-expiratory pressure. Am Rev Respir Dis. 1988;137:1159-1164. [ Links ]
93. Slutsky A. Lung injury caused by mechanical ventilation. Chest. 1999;116:9-15. [ Links ]
94. Tremblay L, Slutsky A. Ventilator-induced lung injury: from barotrauma to biotrauma. Proc Assoc Am Physicians. 1998;110:482-488. [ Links ]
95. Gattinoni L, Pesenti A. ARDS: the non homogeneous lung; facts and hypothesis: Intensive Crit Care Digest. 1987;6:1-4. [ Links ]
96. Gattinoni L, Pesenti A. The concept of "baby lung". lntensive Care Med. 2005;31:776-784. [ Links ]
97. Wheeler A, Bernard G. Acute lung injury and the acute respiratory distress syndrome: A clinical review. Lancet. 2007;369:1553-65. [ Links ]
98. Maclntyre N. Currente issues in mechanical ventilation for respiratory failure. Chest. 2005;128:51-67. [ Links ]
99. Marinii J. Presssure-targeted, lung protective ventilatory support in acute lung injruy. Chest. 1994;105:109-115. [ Links ]
100. Amato M, Barbas C, Medeitos D, et al. Effect of a protective ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998;338:347-354. [ Links ]
101. Stewart T, Meade M, Cook D, et al. Evaluation of a ventilation strategy to prevent barotrauma in patients at high risk for acute respiratory distress syndrome: pressure and volume limited ventilation strategy group. N Engl J Med. 1998;338:355-361. [ Links ]
102. Brochard L, Roudot-Thoraval F, Roupie E, et al. Tidal volume reduction for prevention of ventilator induced lung injury in acute respiratory distress syndrome. Ani J Respir Crit Care Med. 1998;158:1831-1838. [ Links ]
103. Brower R, Shanholtz C, Fessler H, et al. Prospective, randomized controlled clinical trial comparing traditional versus reduced tidal volume ventilation in acute respiratory distress syndrome patients. Crit Care Med. 1999;27:1492- 1498. [ Links ]
104. Villar J, Kacmarek R, Perez-Mendez L, Aguirre-Jaime A. A high positive end expiratory pressure, low tidal volume ventilatory strategy improves outcome in persistent acute respiratory distress syndrome: A randomized, controlled trial. Crit Care Med. 2006;34:1311-8. [ Links ]
105. Eichacker P, Gerstenberger E, Banks S, Ciu X, Natanson C. Metaanalysis of acute lung injury and acute respiratory syndrome trials testing low tidal volumes. Am J Respir Crit Care Med. 2002;166:1510-1514. [ Links ]
106. Petrucci N, lacovelli W. Ventilation with smaller tidal volumes: a quantitative systematic review of randomized controlled trials. Anesth Anals. 2004;99:193-200. [ Links ]
107. Moran J, Bersten A, Solomon P. Metanalysis of controlled trials of ventilator therapy in acute lung injury and acute respiratory distress syndrome: an alternative perspective. Intensive Care Med. 2005;31:227-235. [ Links ]
108. Gattinoni L, Chiumello D, Russo R. Reduced trial volumes and lung protective ventilatory strategies: where do we go from here?. Curr Opin Crit Care. 2002;8:45-50. [ Links ]
109. Semicyuc [internet]. España: Sociedad española de medicina intensiva y unidades coronarias. Indicadores de calidad en el enfermo critico. Actualizacion 2011. Disponible en: http://www.semicyuc.org/sites/default/files/actualizacion_indicadores_calidad_2011.pdf. [ Links ]
110. Kavanagh B, Laffey J. Hypercapnia: Permissive and therapeutic. Minerva Anestesiol. 2006;72:567-76. [ Links ]
111. Falke K, Pontpoppidian H, Kumar A, Leith D, Geffin B, Laver M. Ventilation with end expiratory pressure in acute lung disease. J Clin Invest. 1972;51:2315-23. [ Links ]
112. Guerin C. The preventive role of higher PEEP in treating severely hypoxemic ARDS. Minerva Anestesiol. 2011;77:835- 45. [ Links ]
113. Brower R, Lanken P, Maclntyre N, Matthay M, Morris A, Ancukiewicz M, et al. National Heart, Lung and Blod Institute ARDS clinical trials Network. Higher versus lower positive end expiratory pressure in patients with the acute respiratory distress syndrome. N Engl J Med. 2004;351:327-36. [ Links ]
114. Mercat A, Richard J, Vielle B, Jaber S, Osman D, Diehl J, et al. Expiratory pressure (express) Study Group. Positive end expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: A randomized controlled trial. JAMA. 2008;299:646-55. [ Links ]
115. Meade M, Cook D, Guyatt G, Slutsky A, Arabi Y, Cooper D, et al. Lung Open Ventilation Study Investigators. Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end expiratory pressure for acute lung injury and acute respiratory distress syndrome: A randomized controlled trial. JAMA. 2008;299:637-45. [ Links ]
116. Briel M, Meade M, Mercat A, Brower R, Talmor D, Walter S, et al. Higher vs Lower Positive End Expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome. Systematic Review and Metanalisis. JAMA. 2010;303:865-73. [ Links ]
117. Fan E, Wilcox M, Brower R, Stewart T, Mehta S, Lapinsky S, et al. Recruitment maneuvers for acute lung injury: A sistematic review. Am J Respir Crit Care Med. 2008;178:1156-63. [ Links ]
118. Downar J, Metha S. Bench to bedside review: High frequency oscillatory ventilation in adults with acute respiratory distress syndrome. Crit Care. 2006;10:240. [ Links ]
119. Habashi N. Other approaches to open-Iung ventilation: airway pressure release ventilation. Crit Care Med. 2005;33:228-240. [ Links ]
120. Derdak S, Mehta S, Stewart T, Smith T, Rogers M, Buchman TG et al. High frequency oscillatory ventilation for acute respiratory distress syndrome in adults: A randomized controlled trial. Am J Respir Crit Care Med. 2002;166:801-8. [ Links ]
121. Sud S, Sud M, Friedrich J, Meade M, Ferguson N, Wunsch H, et al. High frequency oscillation in patients with acute lung injury and acute respiratory distress syndrome (ARDS): Systematic review and metanalysis. BMJ. 2010;340:2327. [ Links ]
122. Young D, Lamb S, Shah S, Mackenzie I, Tunnicliffe W, Lall R. OSCAR study Group. High Frequency oscillation for acute respiratory distress syndrome. N Engl J Med. 2013;368:806-13. [ Links ]
123. Benson A. Albert R. Prone Positioning for Acute Respiratory Distress Syndrome. N Engl J Med. 2013;368:2159-2168. [ Links ]
124. Gaillard S, Couder P, Urrea V. Prone position effects on alveolar recruitment and arterial oxygenation in acute lung injury. Intensive Care Med. 2003;29:12-14. [ Links ]
125. Slutsky A. Improving outcomes in critically ill patients: the seduction of physiology. JAMA. 2009;302:2030-2. [ Links ]
126. Nyre'n S, Radell P, Lindahl E. Lung ventilation and perfusion in prone and supine postures with reference to anesthetized and mechanically ventilated healthy volunteers. Anesthesiology. 2010;112:682-7. [ Links ]
127. Wiener C, Kirk W, Albert R. Prone position reverses gravitational distribution of perfusion in dog lungs with oleic acid-induced injury. J Appl Physiol. 1990;68(4):1386-92. [ Links ]
128. Glenny R, Lamm W, Albert R, et al. Gravity is minor determinant of pulmonary blood flow distribution. J Appl Physiol. 1991;71(2):620-9. [ Links ]
129. Wiener-Kronish J, Gropper M, Lai-Fook S. Pleural liquid pressure in dogs measured using a rib capsule. J Appl Physiol. 1985;59(2):597-602. [ Links ]
130. Mutoh T, Guest R, Lamm W, et al. Prone position alters the effect of volume overload on regional pleural pressures and improves hypoxemia in pigs in vivo. Am Rev Respir Dis 1992;146(2):300-6. [ Links ]
131. Beitler J, Shaefi S, Montesi S. Prone positioning reduces mortality from acute respiratory distress syndrome in the low tidal volume era: a meta-analysis. Intensive Care Med. 2014;40(3):332-41. [ Links ]
132. Martínez O, Nin N, Esteban A. Evidencias de la posición en decúbito prono para el tratamiento del síndrome de distrés respiratorio agudo: una puesta al día. Arch Bronconeumol. 2009;45(6):291-296. [ Links ]
133. Wiener C, Kirk W, Albert R. Prone reverses gravitional distribution of perfusion in dogs with oleic acid-induced injury. J Appl physiol. 1990;68(4):1386-92. [ Links ]
134. Fessler H, Talmor D. Should prone positioningbe routinely used for lung protection during mechanical ventilation? Respir Care. 2010;55:88-99. [ Links ]
135. Albert R, Hubmayr R. The prone position eliminates compression of the lungs by the heart. Am J Respir Crit Care Med. 2000;161:1660-5. [ Links ]
136. Malbouisson L, Busch C, Puybasset L, Lu Q, Cluzel P, Rouby J. Role of the heart in the loss of aeration characterizing lower lobes in acute respiratory distress syndrome. AM J Respir Crit Care Med. 2000;161:2005-12. [ Links ]
137. Krayer S, Rehder K, Vettermann J, Didier E, Ritman E. Position and motion of the human diaphragm during anesthesia paralysis. Anesthesiology. 1989;70:891-8. [ Links ]
138. Gillart T, Bazin J, Guelon D, Constantin J, Mansoor O, Conio N, et al. Effect of bronchial drainage on the improvement in gas Exchange observed in ventral decubitus in ARDS. Ann Fr Anesth Reanim. 2000;19:156-63. [ Links ]
139. Albert R, Keniston A, Baboi L, et al. Prone position-induced improvement in gas exchange does not predict improved survival in the acute respiratory distress syndrome. Am J Respir Crit Care Med. 2014;189(4):494-496. [ Links ]
140. Broccard A, Shapiro R, Schmitz L, et al. Prone positioning attenuates and redistributes ventilator-induced lung injury in dogs. Crit Care Med. 2000;28:295-303. [ Links ]
141. Silversides J, Ferguson N. Clinical review: acute respiratory distress syndrome clinical ventilator management and adjunct therapy. Crit Care. 2013;17(2):225. [ Links ]
142. Guérin C. Prone ventilation in acute respiratory distress syndrome. Eur Respir Rev. 2014;23(132):249-257. [ Links ]
143. Gattinoni L, Taccone P, Carlesso E, et al. Prone position in acute respiratory distress syndrome. Rationale, indications, and limits. Am J Respir Crit Care Med. 2013;188(11):1286-93. [ Links ]
144. Pelosi P, Goldner M, McKibben A, et al. Recruitment and derecruitment during acute respiratory failure: an experimental study. Am J Respir Crit Care Med. 2001;164(1):122-30. [ Links ]
145. Valenza F, Guglielmi M, Maffioletti M, et al. Prone position delays the progression of ventilator-induced lung injury in rats: does lung strain distribution play a role? Crit Care Med. 2005;33(2):361-7. [ Links ]
146. Nishimura M, Honda O, Tomiyama N, et al. Body position does not influence the location of ventilator induced lung injury. Intensive Care Med. 2000;26(11):1664-9. [ Links ]
147. Gattinoni L, Protti A. Ventilation in the prone position: For some but not for all? CMAJ. 2008;178(9): 1174-6. [ Links ]
148. Servillo G, Roupie E, De Robertis E, et al. Effects of ventilation in ventral decubitus position on respiratory mechanics in adult respiratory distress syndrome. Intensive Care Med. 1997;23:1219-24. [ Links ]
149. Jolliet P, Bulpa P, Chevrolet J. Effects of prone position on gas exchange and hemodynamics in severe acute respiratory distress syndrome. Crit Care Med. 1998 26:1977-85. [ Links ]
150. McAuley D, Giles S, Fichter H, et al. What is the optimal duration of ventilation in the prone position in acute lung injury and acute respiratory distress syndrome? Intensive Care Med. 2002;28:414-18. [ Links ]
151. L' Her E, Renault A, Oger E, et al. A prospective survey of early 12-h prone position effects in patients with acute respiratory distress syndrome. Intensive Care Med. 2002;28:570-75. [ Links ]
152. Alsaghir A, Martin C. Effect of prone positioning in patients with acute respiratory distress syndrome: a metaanalysis. Crit Care Med. 2008;36:603-9. [ Links ]
153. Fernandez R, Trenchs X, Klamburg J. Prone positioning in acute respiratory distress syndrome: a multicenter randomized clinical trial. Intensive Care Med. 2008;34:1487-91. [ Links ]
154. Ramos L, Benito S. Ventilación Mecánica en situaciones específicas. Fundamentos de la Ventilación Mecánica. Primera edición. Barcelona (España):Marge Medica Books, 2012.p.149- 160. [ Links ]
155. Messerole E, Peine P, Wittkopp S, Marini J, Albert R. The pramatics of prone positioning. Am J Respir Crit Care Med. 2002;165:1359-63. [ Links ]
156. Pelosi P, Brazzi L, Gattinoni L. Prone position in acute respiratory distress syndrome. Eur Respir J. 2002;20:1017-28. [ Links ]
157. Reinprecht A, Greher M, Wolsberger S, et al. Prone position in subarachnoid hemorrhage patients with acute respiratory distress syndrome: effects on cerebral tissue oxygenation and intracranial pressure. Crit Care Med. 2003;31:1831-38. [ Links ]
158. Chatte G, Sab J, Dubois J, et al. Prone position in mechanically ventilated patients with severe acute respiratory failure. Am J Respir Crit Care Med. 1997;155:473-78. [ Links ]
159. Guerin C, Gaillard S, Lemasson S, et al. Effects of systematic prone positioning in hypoxemic acute respiratory failure. A randomized controlled trial. JAMA. 2004;292:2379-87. [ Links ]
160. Fridrich P, Krafft P, Hochleuthner H, et al. The effects of long-term prone positioning in patients with trauma-induced adult respiratory distress syndrome. Anesth Analg. 1996;83:1206- 1211. [ Links ]
161. Jolliet P, Bulpa P, Ritz M, et al. Additive beneficial effects of the prone position, nitric oxide, and almitrine bismesylate on gas exchange and oxygen transport in acute respiratory distress syndrome. Crit Care Med. 1997;25:786-794. [ Links ]
162. Stocker R, Neff T, Stein S, et al. Prone positioning and low-volume pressure-limited ventilation improve survival in patients with severe ARDS. Chest. 1997;111:1008-1017. [ Links ]
163. Goettler C, Pryor J, Reilly P. Brachial plexopathy after prone positioning. Crit Care. 2002;6(6):540-2. [ Links ]
164. Van der Voort H, Zandstra F. Enteral feeding in the critically ill: comparison between the supine and prone positions. A prospective crossover study in mechanically ventilated patients. Critical Care. 2001;5(4): 216-20. [ Links ]
165. Kirkpatrick W, Pelosi P, De Waeles J. Clinical review: Intraabdominal hypertension: does it influence the physiology of prone ventilation. Critical Care. 2010;14:232-44. [ Links ]
166. Humphrey H, Hall J, Sznajder I, Silverstein M, Wood L. Improved survival in ARDS patients associated with a reduction in pulmonary capillary wedge pressure. Chest. 1990;97:1176-80. [ Links ]
167. Sakr Y, Vincent J, Reinhart K, Groeneveld J, Michalopoulos A, Sprung C, et al. High tidal volume and positive fluid balance are associated with worse outcome in acute lung injury. Chest. 2005;128:3098-108. [ Links ]
168. Wiedemann H, Wheeler A, Bernard G, Thompson B, Hayden D, de Boisblanc B, et al. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med. 2006;354:2564- 75. [ Links ]
169. Peek G, Mugford M, Tiruvoipati R, Wilson A, Allen E, Thalanany M, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): A multicentre randomised controlled trial. Lancet. 2009;374:1351-63. [ Links ]
170. Gattinoni L, Pesenti A, Mascheroni D, Marcolin R, Fumagalli R, Rossi F, et al. Low frequency positive pressure ventilation with extracorporteal CO2 removal in severe acute respiratory failure. JAMA. 1986;256:881-6. [ Links ]
171. Morris A, Wallace C, Menlove R, Clemmer T, Orme J, Weaver L, et al. Randomized clinical trial of pressure controlled inverse ratio ventilation and extracorporeal CO2 removal for adult respiratory distress syndrome. Am J Respir Crit Care Med. 1994;149:295-305. [ Links ]
172. Hsu C, Lee D, Lin S, Sun S, Chang H. The initial response to inhaled nitric oxide treatment for intensive care unit patients with acute respiratory distress syndrome. Respiration. 2008;75:288-95. [ Links ]
173. Dellinger R, Zimmerman J, Taylor R, et al. Effects of inhaled nitric oxide in patients with acute respiratory distress syndrome: results of a randomized phase II trial. Crit Care Med. 1998;26:15-23. [ Links ]
174. Payen D, Vallet B, Genoa Group. Results of the French prospective multicentric randomized double-blind placebo-controlled trial on inhaled nitric oxide in ARDS. Intensive Care Med. 1999;25:166. [ Links ]
175. Afshari A, Brok J, Moller A, Wetterslev J. Inhaled nitric oxide for acute respiratory distress syndrome (ARDS) and acute lung injury in children and adults. Cochrane Database Syst Rev. 2010:CD002787. [ Links ]
176. Prewitt R, Wood L. Effect of sodium nitroprusside on cardiovascular function and pulmonary shunt in canine oleic acid pulmonary edema. Anesthesiology 1981;55: 537-41. [ Links ]
177. Bishop M, Kennard S, Artman L, Cheney F. Hydralazine does not inhibit canine hypoxic pulmonary vasoconstriction. Am Rev Respir Dis. 1983;128:998-1001. [ Links ]
178. Abraham E, Baughman R, Fletcher E, et al. Liposomal prostaglandin El (TLC C-53) in acute respiratory distress syndrome: a controlled, randomized, double-blind, multicenter clinical trial. Crit Care Med. 1999;27:1478-85. [ Links ]
179. Pete J, John P, Graham P, Moran J, George I, Berstein A. Corticosteroids in the prevention and treatment of acute respiratory distress syndrome (ARDS) in adults: Metanalysis. BMJ. 2008;336:1006-9. [ Links ]
180. Bernard G, Luce J, Sprung C, Rinaldo J, Tate R, Sibbald W, et al. High dose corticosteroids in patients with the adult respiratory distress syndrome. N Engl J Med. 1987;317:1565- 70. [ Links ]
181. Steinberg K, Hudson L, Goodman R, Hough C, Lanken P, Hyzy R, et al. National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. N Engl J Med. 2006;354:167-84. [ Links ]
182. The ARDS Network. Ketoconazole for early treatment of acute lung injury and acute respiratory distress syndrome: A randomized controlled trial. JAMA. 2000;283:1995-2002. [ Links ]
183. The ARDS Network. Randomized, placebo controlled trial of lisofylline for early treatment of acute lung injury and acute respiratory distress syndrome. Crit Care Med. 2002;30:1-6. [ Links ]
184. Adhikari N, Burns K, Meade M. Pharmacologic therapies for adults with acute lung injury and acute respiratory distress syndrome. Cochrane Database Syst Rev. 2004;18:cd004477. [ Links ]
185. Ware L, Matthay M. Alveolar flluid clearance is impaired in the majority of patients with acute lung injury and the acute respiratory distress syndrome. Am J Respir Crit Care Med. 2001;163:1376-83. [ Links ]
186. Barnard J, Seibert A, Prasad V, et al. Reversal of pulmonary capillary ischemia reperfusion injury by rolipram, a cAMP phosphodiesterase inhibitor. J Appl Pbysiol. 1994;77: 774-81. [ Links ]
187. Masclans J, Barbera J, MacNee W, et al. Salbutamol reduces pulmonary neutrophil sequestration of platelet-activating factor in humanos. Am J Respir Crit Care Med. 1996;154: 529- 32. [ Links ]
188. Matthay M, Brower R, Carson S, Douglas I, Eisner M, Hite D, et al. National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Neetwork. Randomized, placebo controlled clinical trial of an aerosolized B2 agonist for treatment of acute lung injury. Am J Respir Crit Care Med. 2011;184:561-8. [ Links ]
189. Perkins G, McAuley D, Thickett D, Gao F. The beta agonist lung injury trial (BALT1): A randomized placebo controlled clinical trial. Am J Respir Crit Care Med. 2006;173:281-7. [ Links ]
190. Smith G, Perkins G, Gates S, Young D, McAuley D, Tunnicliffe W, et al. For the BALTI-2 study investigators. Effect of intravenous beta 2 agonist treatment on clinical outocomes in acute respiratory distress syndrome (BALTI-2): A multicentre, randomised controlled trial. Lancet. 2012;379:229-35. [ Links ]
191. Gregory T, Longmore W, Moxley M, Whitsett J, Reed C, Fowler A, et al. Surfactant chemical composition and biophysical activity in acute respiratory distress syndrome. J Clin Invest. 1991;88:1976-81. [ Links ]
192. Zhang L, Sun J, Xue X, Wang J. Exogenous pulmonary surfactant for acute respiratory distress syndrome in adults: A sistematic review and metanalisys. Exp Ther Med. 2013;5:237- 42. [ Links ]
193. Spragg R, Lewis J, Walmrath H, Johannigman J, Bellingan G, Laten'e P, Witte M, et al. Effect of Recombinant Surfactant Protein C Based Surfactant on the Acute Respiratory Distress Syndrome. N Engl J Med. 2004;351:884-92. [ Links ]
194. Gupta N, Su X, Popov B, Lee J, Serikov V, Matthay M. Intrapulmonary delivery of bone marrow derived mesenchymal stem cells improves survival and attenuales aendotoxin induced acute lung injury in mice. J Immunol. 2007;179:1855-63. [ Links ]
195. Dushianthan A, Grocott M, Postle A, Cusack R. Acute respiratory distress syndrome and acute lung injury. Postgrad Med J. 2011;87:612-22. [ Links ]