Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicas UIS
versión impresa ISSN 0121-0319
Medicas UIS vol.29 no.2 Bucaramanga may./ago. 2016
https://doi.org/10.18273/revmed.v29n2-2016009
DOI: http://dx.doi.org/10.18273/revmed.v29n2-2016009
Miocardiopatía periparto: patología
potencialmente mortal
María Angélica Durán-Morales*
Edwin J. Ariza-Parra**
* Médico. Universidad Autónoma de Bucaramanga. Fundación Médico Preventiva. Medellín. Antioquia. Colombia.
** Residente II año de Medicina Interna. Universidad de Antioquia. Hospital San Vicente Fundación. Medellín. Antioquia. Colombia.
Correspondencia: Dra. María Angélica Durán Morales. Dirección: Cra 74#53-55 apartamento 810, edificio Nuevo Mundo Los colores. Medellín. Antioquia. Colombia. Teléfono: 5778285. Correo electrónico: angelik0105@hotmail.com
Artículo recibido el 04 de octubre de 2015 y aceptado para publicación el 01 de marzo de 2016.
RESUMEN
Introducción: la cardiomiopatía periparto es una condición clínica subestimada, lo que conlleva a que sea una entidad olvidada, con un retraso en su diagnóstico y tratamiento y con ello a altas tasas de morbi-mortalidad. El diagnóstico se basa en síntomas y signos clínicos, además de la evidencia de falla cardíaca que se desarrolle durante el último mes de embarazo y los primeros cinco meses posparto con una disfunción ventricular izquierda evidenciada ecocardiográficamente. Objetivo: realizar una revisión actual de los diferentes componentes de la enfermedad, desde su epidemiología, etiología, fisiopatología, avances en diagnóstico clínico y tratamiento. Metodología de búsqueda: se realizó una búsqueda en múltiples bases de datos como PubMed, Cochrane, Science Direct y Google académico en donde se encontraron 96 artículos de los cuales fueron seleccionados 38 artículos descartándose varios que no cumplían criterios de inclusión. Resultados: se escogió la información más actualizada de las bases de datos encontradas, en donde se hallaron 55 artículos. Se revisó clasificación, etiología, fisiopatología, diagnóstico, Tratamiento y pronóstico de la enfermedad. Conclusiones: la cardiomiopatía Periparto continua siendo un gran reto médico diagnóstico y de tratamiento para todo un gran equipo multidisciplinario; debe existir una sospecha diagnostica para poder iniciar un adecuado abordaje y tratamiento oportuno en donde pueda lograrse una disminución en la morbimortalidad tanto para la madre como para el feto. Existen nuevos avances para el tratamiento de forma quirúrgica, que ayudan a mejorar la calidad de vida en aquellas mujeres que quedan con una falla cardiaca posterior. MÉD.UIS. 2016;29(2):103-11.
Palabras clave: Cardiomiopatías. Complicaciones del Embarazo. Insuficiencia cardiaca. Prolactina. Diagnóstico. Terapéutica.
Cardiomyopathy peripartum: potentially deadly disease
ABSTRACT
Introduction: peripartum cardiomyopathy is a clinical condition underestimated, leading to a forgotten it, with a delay in diagnosis and treatment and thus to high rates of morbidity and mortality entity. The diagnosis is based on clinical signs and symptoms, plus evidence of heart failure that develops during the last month of pregnancy and the first five months postpartum echocardiography evidenced a left ventricular dysfunction. Objective: a current review of the different components of the disease, from the epidemiology, etiology, pathophysiology, clinical advances in diagnosis and treatment. Searching methodology: a search was performed in multiple databases such as PubMed, Cochrane, Sciencedirect and academic Google; where 96 articles were found, 38 were selected ruling out several items that did not meet inclusion criteria. Results: the most current databases of information found was chosen, 55 articles were selected and classification, etiology, pathophysiology, diagnosis, treatment and prognosis were reviewed. Conclusions: peripartum cardiomyopathy remains a major medical diagnosis and treatment for all large multidisciplinary team challenge; there must be a suspicion diagnosis to initiate appropriate and timely treatment approach wherein a decrease in morbidity and mortality can be achieved for both mother and fetus. There are new developments for the treatment of surgically, that help improve the quality of life for women who are with subsequent heart failure. MÉD.UIS. 2016;29(2):103-11.
Keywords: Cardiomyopathy. Pregnancy Complications. Heart Failure. Prolactin. /Diagnosis. Therapeutics.
¿Cómo citar este artículo?: Durán-Morales MA, Ariza-Parra EJ. Miocardiopatía periparto: patología potencialmente mortal. MÉD.UIS. 2016;29(2):103-11.
INTRODUCCIÓN
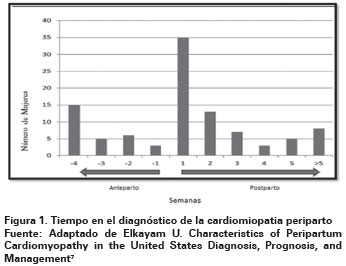
Se define a la Cardiomiopatía Periparto (CMPP) como una forma de miocardiopatía dilatada que se manifiesta con signos de insuficiencia cardíaca en el último mes del embarazo o dentro de los cinco meses del parto1. Es la Sociedad Europea de Cardiología quien simplifica su definición incluyendo a toda miocardiopatía dilatada idiopática asociada a insuficiencia cardíaca secundaria a disfunción del ventrículo izquierdo al final del embarazo o en los meses siguientes al posparto2. Si bien la CMPP es una entidad del último trimestre del embarazo, la presentación de forma temprana no es infrecuente, y múltiples estudios muestran que aumenta su diagnóstico en la primera semana posparto (Ver Figura 1).
Epidemiológicamente, corresponde a una entidad relativamente infrecuente pero que puede llegar a ser mortal si no se hace un diagnóstico y tratamiento oportuno; su incidencia varía según la población estudiada, encontrándose en Estados Unidos una incidencia de aproximadamente uno en 3186 nacidos vivos, en Asia uno en 2600, en Sudáfrica uno en 1000, y en Haití de uno en 300 nacimientos; aún sin conocerse porque es más frecuente en Afroamericanos3. En Colombia, según un estudio realizado en la clínica el prado del Medellín, entre el 2005 y 2009 de 37 pacientes estudiadas cinco de ellas tuvieron diagnóstico de CMPP, datos que no están lejos de estadísticas comparados con los demás países en vía de desarrollo4-6.
Aún es considerada como la primera causa de mortalidad materna por enfermedad cardíaca, con valores que van entre un 0% a 19% y se asocia a numerosos factores de riesgo tales como edad materna mayor a 30 años, embarazos múltiples, obesidad, trastornos hipertensivos del embarazo, raza negra, terapia tocolítica prolongada y aumento de las técnicas de reproducción asistida. Su etiología aún es desconocida, y no es debida a un solo factor sino a la presencia de múltiples condiciones tales como infecciones virales, alteración en el funcionamiento hemodinámico e inmunológico, influencia del feto y la placenta, fenómenos apoptósicos y hormonales7,8.
Es en 1971 cuando se acuña el término miocardiopatía periparto junto con tres criterios diagnósticos clásicos los cuales incluyen el desarrollo de la insuficiencia cardíaca en el último mes de embarazo o cinco meses postparto; ausencia de una etiología evidenciada para falla cardíaca y la ausencia de antecedente de cardiopatía en el último mes de embarazo2. Es en 1997 en donde gracias al Instituto Nacional de Corazón, Pulmón y Sangre de los Estados Unidos en conjunto con el departamento de enfermedades raras se adiciona como criterio adicional la evidencia de disfunción ventricular izquierda por hallazgos ecocardiográficos7.
En Colombia, existen solo seis reportes, un caso del Hospital Universitario del Valle (Cali) y las cinco restantes corresponden a un estudio retrospectivo sobre enfermedad cardíaca en el embarazo realizado del 2005 al 2009 en la Clínica El Prado (Medellín)9. El objetivo de esta revisión es realizar una búsqueda actualizada en los diferentes componentes de esta enfermedad incluyendo epidemiología, fisiopatología, diagnóstico y tratamiento, con el fin de aportar nuevos avances y conocimientos los cuales sean de ayuda para estudiantes y profesionales de la salud.
METODOLOGÍA DE BÚSQUEDA
Se realizó una búsqueda de literatura en agosto del 2015, en las siguientes bases de datos: PubMed, Cochrane, Sciencedirect y Google académico, con las palabras clave "Cardiomiopatías", "Complicaciones del Embarazo", "Insuficiencia cardíaca", "Prolactina", "Diagnóstico", "Terapéutica". Se encontraron 96 artículos de los cuales fueron seleccionados 38 artículos; estos incluían revisiones sistemáticas, artículos originales, monografías en inglés y en español, se escogieron aquellos artículos que cumplían con pertinencia, calidad y actualización de cada uno de los temas escogidos tales como epidemiología, etiología, diagnóstico y tratamiento.
FISIOPATOLOGÍA
Los múltiples cambios fisiológicos que se producen con el embarazo, causan un aumento del gasto cardiaco materno hasta de un 50% hacia finales del primer trimestre, cambios que se suman hasta el final del embarazo, razón por la cual se hace más frecuente la presentación de esta enfermedad. Hacia la sexta semana el volumen sanguíneo materno aumenta, logrando llegar hasta un 50% de su base hacia finales del primer trimestre, esto lleva a un aumento de la precarga y del volumen diastólico final del ventrículo izquierdo, generando una hipertrofia ventricular fisiológica y su consecuente aumento en el diámetro de las cámaras cardiacas. La poscarga se ve disminuida por un descenso en la resistencia vascular periférica por el aumento en la circulación uteroplacentaria en el primer trimestre y la presión arterial se ve aumentada hasta en un 20% hacia finales del tercer trimestre10-12.
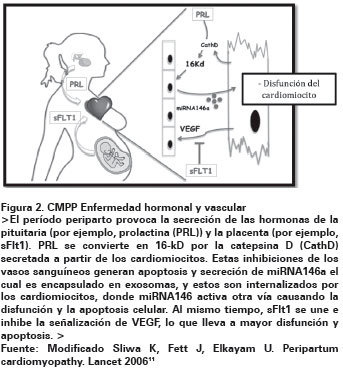
En el posparto algunas mujeres con CMPP tienen aumento en la expresión del gen 16kDa el cual es un fragmento de la prolactina que induce a que exista mayor estrés oxidativo, aumento de apoptosis y alteración en los mecanismos de hipoxia y oxigenación; lo que lleva a mayor daño miocárdico y síntomas de falla cardiaca (Ver Figura 2)11-12. Se habla de la posibilidad que el estrés hemodinámico generado por los cambios en el embarazo contribuye a esta patología, sin embargo, el limitar el estrés por ejemplo con realización de cesárea no ha mostrado que pueda reducir la probabilidad de desarrollarla13.
Un aumento en la intensidad de la respuesta inflamatoria podría ser uno de los factores implicados en su etiopatogenia, en donde hallazgos tales como un aumento significativo de las concentraciones de múltiples citosinas inflamatorias tales como el factor de necrosis tumoral alfa, proteína C-reactiva, y Fas/Apo-1 (marcador de apoptosis); es así como las concentraciones de proteína C-reactiva se correlacionó con los diámetros telediastólico y telesistólico ventricular e inversamente con la fracción de eyección del ventrículo izquierdo; y las concentraciones de Fas/Apo-1 en eran un predictor de mortalidad14.
Existen múltiples procesos etiológicos implicados, desde inflamación, procesos autoinmunes, polimorfismos, infecciones agudas, malnutrición, alteraciones hormonales, apoptosis celular, disfunción y estrés oxidativo endotelial15. Dos teorías están relacionadas con la aparición de MCPP: la primera, en donde un evento agudo como la miocarditis viral podría debilitar las defensas pro-vasculares cardiacas; la segunda situación es la predisposición genética, que es explicada por una asociación que se ha visto entre la MCPP y el polimorfismo con el gen PTHLH el cual es conocido como un inhibidor de la angiogénesis13,16.
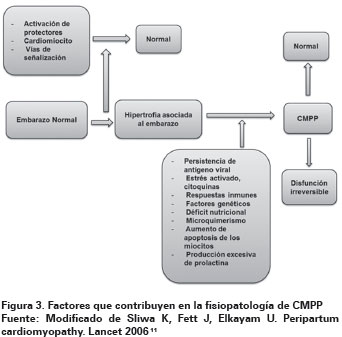
Warraich y colaboradores, documentaron en un estudio de cohorte la relación que existe entre las inmunoglobulinas de clase G (G1, G2, G3) y el impacto de ellas en la inmunidad humoral contra la miosina cardiaca y las pacientes con MCPP, mostrando como los niveles elevados de IgG3 pueden ser de valor pronóstico en la MCPP. Por otro lado, otras causas incluyen una regulación hormonal anormal, influencia de los sistemas inmune innato y adaptativo, autoanticuerpos, células progenitoras dendríticas, linfocitos T y B (Ver figura 3)11.
Para otros, la miocardiopatía periparto es considerada una enfermedad injerto contra huésped dirigida hacia un órgano blanco, que en este caso es el corazón15. Lo que lleva a la etiología multifactorial implicada en esta enfermedad. En algunos países de África, la deficiencia nutricional de selenio y algunos otros micronutrientes como Vitaminas A, C, B12 y E, se evidenció que podrían causar CMPP secundario a un aumento en las infecciones virales cardiacas, sin embargo, esto no es concluyente y podría variar según regiones geográficas9-11.
Finalmente, se debe conocer además que existe una mayor prevalencia de preeclampsia y trastornos hipertensivos en mujeres con CMPP de una forma muy superior comparados con la población general; sin embargo un estudio prospectivo realizado por Ntobeko y colaboradores mostró que la presencia de hipertensión asociada al embarazo no se relacionaba directamente con CMPP sino con los desenlaces esperados de pacientes con alteraciones genéticas, historia familiar de hipertensión y más común aun en pacientes con falla cardiaca de tipo hipertensivo18.
DIAGNÓSTICO
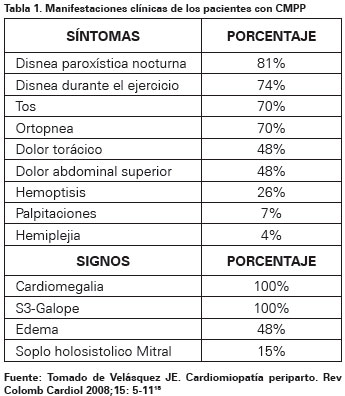
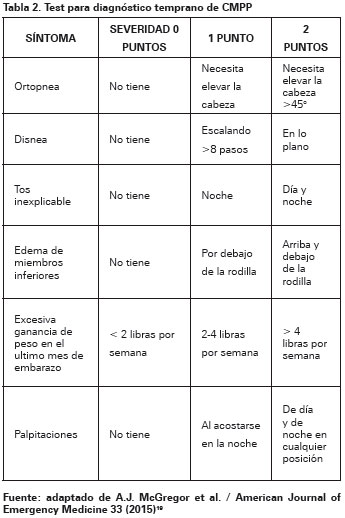
Los signos y síntomas de falla cardiaca en su mayoría son parecidos a los que presenta una mujer durante su embarazo por lo que se hace difícil diferenciarlos y llegar a establecer una sospecha diagnostica; además debuta en mujeres sin antecedentes de falla cardiaca estructural o sintomas de disfunción, por lo que esto ocasiona un dilema y un retraso en diagnóstico y tratamiento (Ver tabla 1)19.
Disnea, debilidad y edema son síntomas causados por la disfunción sistólica generada durante el último mes de embarazo y posparto; sin embargo, síntomas tales como disnea persistente, taquicardia y ortopnea deberían orientar a un un diagnóstico alternativo; se conoce de un test como ayuda para diagnosticar de forma temprana a pacientes con CMPP en donde valores mayores o iguales a cuatro requieren un estudio más exhaustivo (Ver tabla 2)21.
Se cuenta con múltiples ayudas diagnósticas, que si bien no son 100% específicas, orientan el diagnóstico de esta patología. En el electrocardiograma es posible encontrar signos de hipertrofia de ventrículo izquierdo, taquicardia sinusal, cambios inespecíficos a nivel de onda T, dilatación auricular izquierda, o alteraciones de conducción. El BNP y PRO-BNP en la CMPP presenta niveles superiores, a pesar de que en la mujer embarazada se encuentre con niveles altos, por lo que se considera un buen elemento para sospecharlo; contrario a CKMB la cual también se eleva en el embarazo y durante el parto y no tiene valor predictivo para CMPP 21,22.
La radiografiá de tórax puede reportar cardiomegalia, congestión pulmonar y derrame pleural21. En el estudio longitudinal prospectivo realizado por Ntobeko y colaboradores, se evidenció claramente una disminución en la fracción de eyección del ventrículo izquierdo con un valor casi siempre menor a 45%, un aumento de dimensiones del Ventrículo izquierdo en sístole y diástole y una disminución del gasto cardíaco y el volumen sistólico18,23,24. Siendo el ecocardiograma la prueba Gold estándar para el diagnóstico de esta patología.
Por último, la resonancia magnética cardiaca se usa para evaluación de la función cardiaca y la detección de trombos murales o fibrosis miocárdica; en una investigación realizada por Mouquet y colaboradores, se evidenció que esta fibrosis no jugaba un papel importante en la recuperación de la función cardiaca a posteriori, además, este método debe usarse sólo si es necesario dado que el medio de contraste que es usado (gadolinio) atraviesa la placenta 24,25.
El Instituto Nacional de Corazón, Pulmón y Sangre de los Estados Unidos en conjunto con el Departamento de Enfermedades Raras del Instituto Nacional de Salud de los Estados Unidos definen los cuatro componentes que se deben cumplir para el diagnóstico de la enfermedad: el primero, falla cardíaca que se desarrolle durante el último mes de embarazo y los primeros cinco meses posparto; segundo, ausencia de otra causa detectable de insuficiencia cardíaca; tercero, ausencia de enfermedad cardíaca antes del último mes del embarazo y cuarto, características ecocardiográficas de disfunción sistólica del ventrículo izquierdo: fracción de eyección menor al 45%, o fracción de acortamiento menor al 30%, con una dimensión ventricular menor a 2,7 cm/m2 en diástole19.
Se cuenta con múltiples ayudas diagnósticas, que si bien no son 100% específicas, orientan el diagnóstico de esta patología. En el electrocardiograma es posible encontrar signos de hipertrofia de ventrículo izquierdo, taquicardia sinusal, cambios inespecíficos a nivel de onda T, dilatación auricular izquierda, o alteraciones de conducción. El BNP y PRO-BNP en la CMPP presenta niveles superiores, a pesar de que en la mujer embarazada se encuentre con niveles altos, por lo que se considera un buen elemento para sospecharlo; contrario a CKMB la cual también se eleva en el embarazo y durante el parto y no tiene valor predictivo para CMPP26.
TRATAMIENTO
El tratamiento de la falla cardiaca durante el embarazo y postparto no difiere en mucho al empleado en la falla cardiaca en pacientes no embarazadas25. Tiene como meta principal garantizar un adecuado estado hemodinámico, disminuir signos y síntomas y optimizar los resultados a largo plazo. Se debe contar con un adecuado equipo multidisciplinario entre ellos: obstetras, perinatólogos, neonatólogos y cardiólogos. El tratamiento no farmacológico caracterizado principalmente por ingesta baja de sodio (menos de 2g/día), restricción hídrica (menos 2 L/día), actividad física diaria si es tolerada y monitorización hemodinámica27.
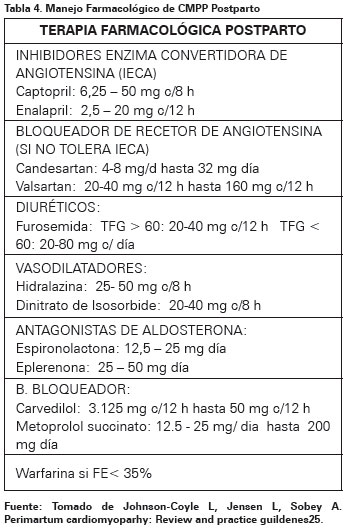
El tratamiento farmacológico convencional incluye diuréticos, vasodilatadores, inotrópicos, Inhibidores de la enzima convertidora de angiotensina, inhibidores de los receptores II de angiotensina, betabloqueadores, digoxina y espironolactona; sin embargo, estos deben ser modificados y ajustados dados los efectos nocivos que muchos de los medicamentos ejercen sobre la lactancia y el feto, además que serán modificados según el estadio en el que se encuentre, si se diagnostica postparto o anteparto (Ver Tablas 3 y 4)27.
Pacientes con CMPP tienen alto riesgo de enfermedad tromboembólica, no solo por el estado hipercoagulable del embarazo, sino por la disfunción endotelial, flujo de sangre anormal y estasis sanguínea favorecidos en la falla cardiaca, por lo que se debe considerar anticoagular a la paciente con HBPM o con heparina no fraccionada prefiriendo esta última por su vida media más corta y efecto reversible ya que no cruzan la placenta, a diferencia de la warfarina con su alto poder teratógeno28.
Es importante mencionar que estudios recientes muestran que cuando esta patología es tratada con diuréticos, inhibidores de la enzima renina-angiotensina- aldosterona y betabloqueadores, la mayoría de los pacientes sobreviven, y más de un 50% recuperan completamente la función sistólica ventricular izquierda.
Si bien los medicamentos inhibidores de la enzima convertidora de angiotensina e inhibidores de los receptores II de angiotensina son pilares fundamentales en el manejo de falla cardiaca, deben ser evitados durante el embarazo dado su alto efecto teratógeno en donde se incluye: anormalidades renales, retardo de crecimiento intrauterino, oligoamnios, prematuridad, malformaciones óseas, hipoplasia pulmonar, síndrome de distres respiratorio y muerte. En su reemplazo aunque también se consideran categoría C, se podría usar hidralazina asociada a nitratos7,10.
En cuanto a los betabloqueadores aprobados para la falla cardiaca metoprolol, carvedilol y bisoprolol, todos son considerados categoría C. Se prefieren los betabloqueadores selectivos (B1) dado que los no selectivos pueden inducir actividad uterina; en cuanto a su uso en la lactancia, si bien son excretados en la leche materna, sus concentraciones son muy bajas por lo que no se limita. Se ha propuesto el uso del carvedilol en mujeres después del parto que continúan teniendo signos y síntomas de falla cardiaca asociado a un compromiso ecocardiográfico de disfunción ventricular izquierda después de dos semanas de tratamiento con mejoría de la sobrevida7,10.
Agentes diuréticos son indicados para corregir el exceso de volumen y disminuir de una forma rápida el volumen intravascular; no obstante, deben ser usados con precaución en el embarazo con el fin de que no haya hipotensión y por consiguiente disminución del flujo uteroplacentario, dentro de estos medicamentos, la furosemida es considerada categoría C en el embarazo10. Los vasodilatadores son recomendados en falla cardiaca descompensada en pacientes inestables hemodinamicamente y muy sintomáticos, dentro de ellos el más recomendado es la nitroglicerina (categoría B) dado que el nitroprusiato no se recomienda por ser categoría C y su alto riesgo de acumulación fetal de tiocianatos7,19.
Los agentes inotrópicos como la dopamina (categoría C), dobutamina (categoría B) y el milrinone (categoría C) pueden ser usados para aquellas pacientes con estadios avanzados de falla, hipotensión e hipoperfusión periférica. La digoxina, otro agente inotrópico, seguro en el embarazo, se recomienda su uso en mujeres con disfunción ventricular izquierda sistólica y una fracción de eyección menor al 40% con signos y síntomas de insuficiencia cardíaca a pesar de estar en tratamiento7.
La ivabradina no ha sido probada en un ensayo clínico en el manejo de esta patología, y su papel en el choque cardiogénico es aún controvertido; sin embargo, se podría administrar para mejorar los síntomas y signos de insuficiencia cardíaca descompensada29. La ivabradina podría ser beneficioso en la intolerancia bloqueador beta e insuficiencia cardíaca congestiva descompensada taquicardia. Otros medicamentos que se han utilizado son el levosimendan del cual se mostró muy poco beneficio, la pentoxifilina usada como inmunomodulador con la cual se ha logrado una disminución en la inflamación y un incremento en la fracción de eyección; además, dada la influencia que genera la prolactina, se ha probado el buen efecto que tiene la bromocriptina como inhibidor dopaminergico en dosis de 2,5 mg cada 12 horas por dos semanas seguido de 2,5 mg diarios por seis semanas, influenciado en disminución en las muertes, y en pacientes con clase funcional NYHA III-IV y con fracción de eyección del ventrículo izquierdo menor a 35%30-32.
Se conoce que existe un aumento en la inmunidad humoral de las mujeres con CMPP, con elevación de anticuerpos contra antígenos de leucocitos específicos. Es ahí donde entra a jugar un papel especial el tratamiento con inmunoglobina intravenosa y la plasmaferesis, los cuales demuestran una mejoría evidente en la función ventricular izquierda en los primeros meses de seguimiento, pero primordialmente en donde se confirma por medio de biopsia endomiocárdica su origen viral; sin embargo, hacen falta más estudios que corroboren este hallazgo5,19,21.
Si una gestante depende de inotrópicos o de balón de contrapulsación a pesar de un tratamiento médico óptimo, se debe considerar la implantación de un dispositivo de asistencia mecánica que puede ser retirado en cuanto exista una recuperación clínica de la paciente o como puente para el trasplante. Los resultados a largo plazo después de la explante del dispositivo de asistencia ventricular son favorables, con una tasa de uno y cinco años de supervivencia del 86% y el 78%, respectivamente24,31.
El trasplante cardíaco es una medida no fácil de realizar y menos en esta patología que puede ser reversible, no obstante, debe ser usada en aquellas pacientes que no recuperan su función ventricular a pesar de tratamiento farmacológico óptimo, dispositivo de asistencia mecánica o inestabilidad hemodinámica. La supervivencia postrasplante oscila entre 0,92 a 17 años, con una media de 7,1 años30.
PRONÓSTICO
Dentro de las principales complicaciones después de cursar con CMPP se encuentran desde falla cardíaca severa, choque cardiogénico, arritmias, complicaciones tromboembolicas hasta la muerte. Los factores de mal pronóstico asociados a CMPP son inicio en las primeras dos semanas post-parto, fracción de eyección anormal a los seis meses post-parto, persistencia de la dilatación del ventrículo izquierdo (mayor a seis centímetros), edad mayor a 30 años y ser multigestante y de raza afroamericana7, 33,34.
Peradejordi y colaboradores realizaron un estudio en Buenos Aires, Argentina entre 1992 y noviembre de 2011 en donde se siguieron 23 pacientes en aquellas con insuficiencia cardíaca descompensada, encontrándose una mortalidad hospitalaria del 4,3% y el requerimiento de trasplante cardíaco o la muerte en el seguimiento fueron del 39%. Siendo los parámetros hemodinámicos al ingreso los principales predictores de mortalidad y de trasplante35.
Otros factores pronósticos evidenciados incluyen la concentración de troponina T superior a 0,04 ng/ml la cual pronostica disfunción persistente del ventrículo izquierdo con sensibilidad de solo el 55% y especificidad del 91%; así como la duración del QRS de 120 mseg o más, es un factor pronóstico de muerte36.
Si bien se conoce que aproximadamente el 50% de las mujeres con CMPP recuperan la función ventricular basal dentro de los seis meses siguientes al parto y el tener una fracción de eyección mayor a 30% al momento del diagnóstico, incrementa la probabilidad de esto. En un estudio de casos y controles realizado por Barasa y colaboradores se evidenció que la mortalidad de las pacientes con CMPP se estabiliza después de 3 años a partir del diagnóstico37.
No se recomienda el embarazo en aquellas mujeres con falla cardíaca persistente, hasta corroborar por medio de ecocardiografía con dobutamina que tanto ventrículo izquierdo se recuperó y así saber cuál es su reserva contráctil frente al estrés; si es normal, esta paciente podría embarazarse bajo el seguimiento médico, de lo contrario no sería seguro un nuevo embarazo38. Las mujeres que no recuperan su función sistólica tienen alto riesgo de episodios recurrentes de CMPP, daño cardíaco irreversible, empeoramiento clínico de la gestante, disminución de la función ventricular hasta la muerte; por lo tanto, el embarazo debe ser evitado24-34.
CONCLUSIÓN
La cardiomiopatía periparto es una entidad multifactorial que puede afectar a cualquier mujer en estado de embarazo o postparto. Es considerada una enfermedad infradiagnosticada de la cual es importante tener una sospecha diagnóstica inicial, un tratamiento rápido y la suma del actuar multidisciplinario de especialistas para poder lograr una recuperación total de la función ventricular además de conseguir menor morbimortalidad en el binomio madre-feto. La tasa de sobrevida a cinco años es del 94% para aquellas que recuperan totalmente la función del ventrículo.
Su diagnóstico es de exclusión, ya que se considera a la cardiomiopatía periparto como una cardiopatía idiopática en la que hay una falla cardiaca secundaria a disfunción sistólica ventricular izquierda en donde no se encuentra otra causa de falla cardíaca. Los objetivos del tratamiento son mejorar los síntomas, retrasar la progresión de disfunción ventricular y mejorar la sobrevida. Este tratamiento no difiere de otras formas de falla cardíaca. Restricción de sodio y agua, control de presión arterial, combinación de tres tipos de medicamentos (inhibidores de la enzima convertidora de angiotensina, inhibidores de los receptores II de angiotensina y los betabloqueadores) teniendo especial atención con riesgos teratógenos; así como puede ser útil el soporte inotrópico, implantes de dispositivos o trasplante cardíaco.
Los embarazos posteriores en este grupo de gestantes dependerán siempre del porcentaje de recuperación del ventrículo izquierdo, siendo un riesgo alto para aquellas que no recuperaron su función y para aquellas con una recuperación total del mismo se podría realizar bajo vigilancia médica. Dado la evidencia clara de un subregistro a nivel estadístico de la incidencia de la enfermedad, es deber como médicos iniciar a reportar cada caso como sospechoso o diagnosticado con el fin de poder crear una buena base de datos y así conocer el comportamiento de esta enfermedad tan importante en el actuar obstétrico.
CONFLICTOS DE INTERES
Los autores declaran no tener ningún conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Sliwa K, Hilfiker-Kleiner D, Mebazaa A, Petrie MC, Maggioni AP, Regitz-Zagrosek V, et al. EURObservational research Programme: a worldwide registry on peripartum cardiomyopathy (PPCM) in conjunction with the Heart Failure Association of the European Society of Cardiology Working Group on PPCM. Eur J Heart Fail. 2014;16(5):583-91. [ Links ]
2. Ramírez EM. Miocardiopatía periparto. Revista médica de costa rica y Centroamérica. 2013;LXX(607):449-55. [ Links ]
3. Elkayam U, Jalnapurkar S, Barakat M. Peripartum Cardiomyopathy. Cardiol Clin. 2012;30(3):435-40. [ Links ]
4. Monsalve G, Martínez C, Gallo T, González MV, Arango G, Upegui Al, et al . Paciente embarazada con enfermedad cardiaca: Manejo periparto basado en la estratificación del riesgo. Serie de casos 2005-2009. Rev. colomb. Anestesiol. 2010;38(3):348-60. [ Links ]
5. Bozkurt B, Villaneuva FS, Holubkov R, Tokarczyk T, Alvarez RJ Jr, MacGowan GA, et al. Intravenous Immune globulin in the therapy of peripartum cardiomyopathy. J Am Coll Cardiol. 1999;34(1):177-80. [ Links ]
6. Mielniczuk LM, Williams K, Davis DR, Tang AS, Lemery R, Green MS, et al. Frequency of peripartum cardiomyopathy. Am J Cardiol. 2006;97(12):1765-8. [ Links ]
7. Elkayam U. Clinical characteristics of peripartum cardiomyopathy in the United States: diagnosis, prognosis, and management. J Am Coll Cardiol. 2011;58(7):659-70. [ Links ]
8. Hernández A, Nieto AJ, Medina V, Delgado J. Cardiomiopatía periparto: reporte de un caso y revisión de la literatura. Rev. Colomb Obstet Ginecol. 2009;60(3):294-9. [ Links ]
9. Laverde CE, Garnica LM, Correa N. Informe de caso sobre cardiomiopatía periparto: rara, desconocida y potencialmente fatal. Rev. Col. Anest. 2016;44(1):63-8. [ Links ]
10. Lewey J, Haythe J. Cardiomyopathy in pregnancy. Semin Perinatol. 2014;38(5):309-17. [Artículo de revista] [ Links ]
11. Sliwa K, Fett J, Elkayam U. Peripartum cardiomyopathy. Lancet. 2006;368(9536):687-93. [ Links ]
12. Bollen IA, Van Deel ED, Kuster DW, Van Der VJ. Peripartum cardiomyopathy and dilated cardiomyopathy: different at heart. Front Physiol. 2015;15:531. [ Links ]
13. Bello NA, Arany Z. Molecular mechanisms of peripartum cardiomyopathy: A vascular/hormonal hypothesis. Trends Cardiovasc Med. 2015;25(6):499-504. [ Links ]
14. Yamac H, Bultmann I, Sliwa K, Hilfiker-Kleiner D. Prolactin: a new therapeutic target in peripartum cardiomyopathy. Heart. 2010;96(17):1352-7. [ Links ]
15. McGregor AJ, Barron R, Rosene-Montella K. The pregnant heart: cardiac emergencies during pregnancy. Am J Emerg Med. 2015;33(4):573-9. [ Links ]
16. Horne BD, Rasmusson KD, Alharethi R, Budge D, Brunisholz KD, Carlquist JF, et al. Peripartum cardiomyopathy-associated sequence variant at the PTHLH locus is not predictive of idiopathic or ischemic cardiomyopathy. Circulation. 2011;124:A16347. [ Links ]
17. Gleicher N, and Elkayam U. Peripartum cardiomyopathy, an autoimmune manifestation of allograft rejection?. Autoimmun Rev. 2009;8(5):384-7. [ Links ]
18. Ntobeko B. A. Ntusi1, Motasim Badri1, Freedom Gumedze. Pregnancy-Associated Heart Failure: A Comparison of Clinical Presentation and Outcome between Hypertensive Heart Failure of Pregnancy and Idiopathic Peripartum Cardiomyopathy. PLoS One. 2015;10(8):e0133466. [ Links ]
19. Polanía DF, Navarrete S, Acuña EM, Álvarez RA. Miocardiopatía periparto. Insuficiencia Cardiaca. 2009;4(4): 177-83. [ Links ]
20. Velásquez JE, Duque M. Cardiomiopatía periparto. Rev. Colomb Cardiol. 2008;15(1):5-11. [ Links ]
21. McGregor AJ, Barron R, Rosene-Montella K. The pregnant heart: cardiac emergencies during pregnancy. Am J Emerg Med 2015;33(4):573-9. [ Links ]
22. Givertz MM. Peripartum Cardiomyopathy. Circulation 2013;127:622-6. [ Links ]
23. Dennis AT, Castro JM. Echocardiographic differences between preeclampsia and peripartum cardiomyopathy. Int J Obstet Anesth 2014;23(3):260-6. [ Links ]
24. Sliwa K, Hilfiker-Kleiner D, Mebazaa A, Petrie MC, Maggioni AP, Regitz-Zagrosek V, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. Eur J Heart Fail 2010;12(8):767-78. [ Links ]
25. Altun I, Akin F, Basaran O, Biteker M. Management of peripartum cardiomyopathy. Int J Cardiol 2014;177(2):714. [ Links ]
26. Mouquet F, Lions C, de Groote P, Bouabdallaoui N, Willoteaux S, Dagorn J et al. Characterisation of peripartum cardiomyopathy by cardiac magnetic resonance imaging. Eur Radiol 2008;18(12):2765-9. [ Links ]
27. Johnson-Coyle L, Jensen L, Sobey A. Perimartum cardiomyoparhy: Review and practice guildenes. Am J Crit Care 2012;21(2):89-98. [ Links ]
28. Karaye KM, Henein MY. Peripartum cardiomyopathy: A review article. Int J Cardiol 2013;164(1):33-8. [ Links ]
29. Demir S, Tufenk M, Karakaya Z, Akilli R, Kanadas M. The Treatment of Heart Failure-Related Symptoms with Ivabradine in a Case with Peripartum Cardiomyopathy. Int Cardiovasc Res J 2013;7(1):33-6. [ Links ]
30. Desplantie O, Tremblay-Gravel M, Avram R, Marquis-Gravel G, Ducharme A, Jolicoeur EM. The Medical Treatment of New- Onset Peripartum cardiomyopathy: A Systematic Review of Prospective Studies. Can J Cardiol 2015;31(12):1421-6. [ Links ]
31. Pillarisetti J, Kondur A, Alani A, Reddy M, Reddy M, Vacek J et al. Peripartum Cardiomyopathy Predictors of Recovery and Current State of Implantable Cardioverter-Defibrillator Use. J Am Coll Cardiol. 2014;63:2831-9. [ Links ]
32. Yıldırım B, Basaran O, Soylu MO, Altun I, iteker B. Inadequately investigated drugs in acute peripartum cardiomyopathy. Int J Cardiol 2015;189:198. [ Links ]
33. Yamada T1, McElderry HT, Muto M, Okada T, Murakami Y, Doppalapudi H et al. Ventricular arrhythmias originating from the epicardial ventricular outflowtract complicated with peripartum cardiomyopathy. J Interv Card Electrophysiol 2009;25(1):53-7. [ Links ]
34. Duran N, Günes H, Duran I, Biteker M, Ozkan M. Predictors of prognosis in patients with peripartum cardiomyopathy. Int J Gynaecol Obstet. 2008;101(2):137-40. [ Links ]
35. Ramaraj R, Sorrell VL. Miocardiopatía del periparto. J Med 2009;76: 289-296. [ Links ]
36. Margarita A, Peradejordi, Liliana E, Favaloro, Bertolotti A, Absi D, Vigliano C. Predictores de mortalidad o trasplante cardíaco en la miocardiopatía periparto. Rev. argent. cardiol. 2013;81:45-52. [ Links ]
37. Barasa A, Rosengren BA, Ladfors L, Swedberg K, Schaufelberger M. Longterm mortality in 272 women with peripartum cardiomyopathy. Circulation 2012;126. [ Links ]
38. Velásquez JE, Duque M. Cardiomiopatía periparto. Rev. Col. Cardiol 2008;15(1):5-11. [ Links ]