Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicas UIS
versión impresa ISSN 0121-0319
Medicas UIS vol.29 no.2 Bucaramanga may./ago. 2016
https://doi.org/10.18273/revmed.v29n2-2016010
DOI: http://dx.doi.org/10.18273/revmed.v29n2-2016010
Acinetobacter baumannii: patógeno
multirresistente emergente
Ruben Dario Rodriguez Buenahora*
Daniel Enrique Bustillo Zarate**
Diana Carolina Caicedo Sanchez***
Diana Cristina Cadena Sarmiento****
Cristhyam Castellanos Gomez *****
* Médico General. Universidad Libre. Médico unidad de cuidados intensivos. Clínica la Merced. Bucaramanga. Santander. Colombia.
** Médico General. Universidad Libre. Médico Urgencias. Centro de atención de Urgencias y especialistas avenida 68. Bogotá. Cundinamarca. Colombia.
*** Médico y Cirujano. Universidad Pedagogica y Tecnologica de Colombia. Médico unidad de cuidados intensivos. Clínica la Merced. Bucaramanga. Santander. Colombia.
**** Médico y Cirujano. Universidad Industrial de Santander. Médico unidad de cuidados intensivos. Clínica la Merced. Bucaramanga. Santander. Colombia.
***** Médico General. Universidad de Santander. Médico unidad de cuidados intensivos. Clínica la Merced. Bucaramanga. Santander. Colombia.
Correspondencia: Dr. Ruben Dario Rodriguez Buenahora. Dirección: Calle 45 No. 22-107, el poblado. Giron. Santander. Colombia. Correo electrónico: rudar31@hotmail.com
Artículo recibido el 28 de Noviembre de 2015 y aceptado para publicación el 30 de Marzo de 2016.
RESUMEN
Introduccion: Acinetobacter baumannii es un bacilo Gram negativo oportunista, clasificado por la Sociedad Americana de Enfermedades Infecciosas como uno de los seis más importantes microorganismos multirresistentes alrededor del mundo. En Colombia, según informes del Ministerio de Salud y Protección Social, dentro de los microorganismos multirresistente aislados en unidades de cuidados intensivos del país en el año 2014, A. baumannii representó el 3,1%. Objetivo: revisar los aspectos relevantes en la epidemiología, hábitat natural, factores de riesgo y virulencia para la infección por A. baumannii, sus manifestaciones clínicas y diferentes mecanismos de resistencia frente a múltiples fármacos, las estrategias de manejo actual y en desarrollo para enfrentar este microorganismo y mecanismos encaminados a prevenir y controlar la aparicion del mismo. Metodologia de búsqueda: se realizó una búsqueda en las bases de datos LILACS, PubMed, SciELO, Imbiomed, Cochrane, Clinicalkey, Biblioteca Virtual en Salud, de 890 articulos se seleccionaron 254. Resultados: las especies de Acinetobacter pueden ser aisladas de objetos animados e inanimados. Crecen en casi todas las muestras de suelos y agua fresca. En el medio hospitalario, estos microorganismos han sido aislados de humidificadores, equipos de ventilación, hojas de laringoscopio, cortinas, piel del personal de salud, colchones, cojines y otros equipos. Sus factores de virulencia no han sido dilucidados en totalidad, entre ellos se encuentran proteína de membrana externa OmpaA, lipopolisacáridos y polisacáridos capsulares, vesículas de membrana externa, fosfolipasa C y D y alteración de las proteínas de unión de penicilina. Las manifestaciones clínicas son variadas, principalmente en entorno asociado a cuidado de la salud. Sus mecanismo de resistencia son múltiples, los cuales se agrupan en tres categorías: enzimas inactivadoras de antimicrobianos, limitación del acceso a las dianas bacterianas y mutaciones que alteran las dianas o funciones celulares. Los carbapenémicos aún son considerados como agentes de elección para las infecciones graves por A. Baumannii, con opciones terapeuticas adicionales como sulbactam, tobramicina, amikacina, tigeciclina, minociclina, doxiciclina y colistina. Investigadores han reportado interrupción de la transmisión de A. baumannii posterior al reforzamiento de medidas para prevención y control de infecciones, tales como higiene de manos, uso de métodos de barrera (tapabocas, guantes, entre otros) y exhaustiva limpieza y desinfección del ambiente hospitalario. En otros casos la transmisión es más difícil de interrumpir, requiriendo aislamiento de pacientes, asignación de personal asistencial para vigilancia, cultivos de vigilancia activa y cierre de las unidades. Conclusiones: consideramos primordial el manejo de los pacientes de acuerdo a la localización de la infección y el patrón de resistencia presente en las cepas de la unidad en particular. Es importante la creación de protocolos institucionales con escalones terapéuticos, considerando el sitio de la infección, gravedad del paciente, sensibilidad de la cepa propia de cada institución y el uso previo de antibióticos. MÉD.UIS. 2016;29(2):113-35.
Palabras clave: Acinetobacter Baumannii. Bacterias Gramnegativas. Epidemiologia. Factores de riesgo. Farmacorresistencia bacteriana. Virulencia.
Acinetobacter baumannii: emerging multidrug-resistant pathogen
ABSTRACT
Introduction: Acinetobacter baumannii is an opportunistic gram-negative bacillus, classified by the American Society of Infectious Diseases as one of the six major multiresistant microorganisms worldwide. In Colombia, according to reports from the Ministry of Health and Social Protection, within the MDR microorganisms isolated in intensive care units in the country in 2014, A. baumannii accounted for 3.1%. Objective: to review the relevant aspects of the epidemiology, natural habitat and virulence risk factors for infection by A. baumannii, its clinical manifestations and different mechanisms of multidrug resistance, current management strategies and developing to address this microorganism and mechanisms to prevent and control the appearance of it. Methodology: search in the LILACS, PubMed, SciELO, Imbiomed, Cochrane, ClinicalKey, Virtual Health Library of 890 data items were selected 254. Results: Acinetobacter species can be isolated from animate and inanimate objects. They grow in almost any soil samples and fresh water. In the hospital environment, these microorganisms have been isolated from humidifiers, ventilation equipment, laryngoscope blades, curtains, skin health personnel, mattresses, cushions and other equipment. Virulence factors have not been elucidated at all, including OmpaA outer membrane protein, lipopolysaccharides and capsular polysaccharides, outer membrane vesicles, phospholipase C and D and alteration of penicillin binding proteins are. The clinical manifestations are varied, mainly in environment associated with health care. Its mechanism of resistance are many, which are grouped into three categories: antimicrobial-inactivating enzymes, limiting access to bacterial and mutations that alter cell functions targets or targets. Carbapenems are still regarded as agents of choice for serious infections by A. baumannii, with additional therapeutic options such as sulbactam, tobramycin, amikacin, tigecycline, minocycline, doxycycline and colistin. Researchers have reported outage of A. Baumannii after the strengthening of measures for prevention and control of infections, such as hand hygiene, use of barrier methods (masks, gloves, etc.) and thorough cleaning and disinfection of the hospital environment. In other cases the transfer is more difficult to terminate, requiring isolation of patients, caregivers allocation for surveillance, active surveillance cultures and closing units. Conclusions: in the primary treatment of patients according to the location of the infection and the resistance pattern present in the strains of the particular unit. It is important to create institutional protocols for therapeutic steps, considering the site of infection, severity of the patient's own strain sensitivity of each institution and previous use of antibiotics. MÉD.UIS. 2016;29(2):113-35.
KEYWORDS: Acinetobacter baumannii. Gram-negative Bacteria. Epidemiology. Risk factors. Drug Resistance Bacterial. Virulence.
¿Cómo citar este artículo?: Rodríguez RD, Bustillo DE, Caicedo DC, Cadena DC, Castellanos C. Acinetobacter baumannii: patógeno multirresistente emergente. MÉD.UIS. 2016;29(2):113-35.
INTRODUCCIÓN
La resistencia a los antimicrobianos en bacilos gram negativos es un reto diario en el entorno hospitalario. De hecho, son responsables del 45% al 70% de la neumonía asociada a ventilación mecánica1, el 20% al 30% de las infecciones del torrente sanguíneo relacionadas con el catéter, y comúnmente causa de sepsis adquirida en sitio de herida quirúrgica o infección de vías urinarias2. En estas situaciones, la temprana administración de un adecuado cubrimiento antibiótico es crucial para la evolución del paciente, principalmente cuando los criterios de sepsis severa están presentes3.
Tasas de resistencia alarmantes han sido reportadas alrededor del mundo, restringida casi exclusivamente al entorno hospitalario hasta comienzo del presente siglo, este problema se ha registrado en forma creciente en pacientes en ambientes asociados al cuidado de la salud4,5, e incluso infecciones adquiridas en la comunidad6. Las bacterias de la familia Enterobactereaceas y los bacilos Gram negativos no fermentadores, Pseudomona spp., Acinetobacter baumannii y Stenotrophomonas malthopilia, representan la mayor parte del problema7. Esta resistencia puede ser el resultado de la síntesis de enzimas inactivadoras del antibiótico o debido a mecanismos no enzimáticos8. Ambos pueden ser expresados intrínsecamente por una determinada especie (cromosómico) o adquirido de un subconjunto de cepas especiales (selección clonal) que los desarrolla como consecuencia de mutaciones de genes cromosómicos que conllevan a un aumento de la expresión de mecanismos de resistencia intrínsecos, por ejemplo enzimas inactivadoras del antibiótico, bombas de flujo, entre otros; o por transferencia horizontal de elementos genéticos móviles que transportan los genes de resistencia, principalmente plásmidos, que puede conferir un fenotipo de resistencia a múltiples fármacos8.
A. baumannii es un bacilo Gram negativo oportunista, responsable del 2% al 10% de las infecciones hospitalarias causadas por bacterias Gram negativas9. Es clasificado por la Sociedad Americana de Enfermedades Infecciosas como uno de los seis más importantes microorganismos multirresistentes alrededor del mundo10. El género Acinetobacter ha sufrido muchos cambios taxonómicos en los últimos años, y la especie A. baumannii no fue designada formalmente hasta el año 198611. La infección por esta bacteria tiene una alta incidencia entre individuos inmunocomprometidos, particularmente con estancia hospitalaria prolongada, igual o mayor a 90 días12. Sobreviven en ambientes acuáticos13, colonizan la piel y han sido aisladas de secreciones bronquiales y orofaríngeas en individuos infectados14.
La Organización Mundial de la Salud ha designado recientemente la resistencia a los antimicrobianos como una de los tres problemas más importantes que enfrenta la salud humana15. Los más importantes patógenos multirresistentes han sido agrupados en el acrónimo ESKAPE, encontrando el Enterococcus faecium, Staphylococus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomona aeruginosa y Enterobacter sp.16. En este artículo se tiene como objetivo revisar los aspectos relevantes en la epidemiologia, hábitat natural, factores de riesgo y virulencia para la infección por A. baumannii, sus manifestaciones clínicas y diferentes mecanismos de resistencia frente a múltiples fármacos, las estrategias de manejo actual y el desarrollo para enfrentar este microorganismo y mecanismos encaminados a prevenir y controlar la aparicion del mismo.
METODOLOGÍA DE BÚSQUEDA
Se realizó una búsqueda en las bases de datos de LILACS, PubMed, SciELO, Imbiomed, Cochrane, Clinicalkey, Biblioteca Virtual en Salud (BVS). Se utilizó como palabras clave Acinetobacter baumannii, epidemiología, factores de riesgo, hábitat, farmacorresistencia bacteriana, virulencia, quinolonas, polimixina, colistina, carbapenémicos, β-láctamicos, tetraciclina, aminoglicósidos. Se decidió usar estas palabras teniendo en cuenta los objetivos del artículo; se eligieron artículos publicados entre los años 2000-2015, se seleccionaron artículos publicados en inglés y español o traducidos a estos idiomas publicados en revistas indexadas a estas bases de datos. Se seleccionaron artículos de trabajos originales, revisiones de tema, metanálisis, estudios observacionales de magnitud suficiente, preferentemente multicéntricos y estudios controlados aleatorizados. Se evaluaron manualmente los artículos, se excluyeron estudios realizados fuera del intervalo de tiempo mencionado, a excepción de artículos de referencia para definiciones, clasificaciones y soporte histórico. Se contó con 890 referencias en total, seleccionando sólo los artículos que se encuentran referenciados en este trabajo teniendo en cuenta el objetivo de la publicación, el tipo de artículo, el impacto que estos generaron y el aporte para enriquecer este trabajo (Ver Figura 1).
RESULTADOS
CLASIFICACIÓN TAXONÓMICA DE A. BAUMANNII
El microbiólogo holandés Beijerinck fue el primero en describir este microorganismo que denominó Micrococcus calcoaceticus, el cual aisló del suelo17. La designación del género actual, Acinetobacter (del griego "akinetos", es decir, no móviles), fue propuesto inicialmente por Brisou y Prevot18 en 1954 para diferenciar los microorganismos móviles de los inmóviles dentro del género Achromobacter, el reconocimiento oficial del género Acinetobacter fue dado en 1971 por el Subcomité de Taxonomía de Moraxella y bacterias afines en 197119.
El género Acinetobacter actualmente comprende cocobacilos Gram negativos, estrictamente aeróbicos, no fermentadores, inmóviles, no esporulados, catalasa positivos, oxidasa negativos, con un contenido de ADN G + C de 39% a 47%20. Con los estudios de hibridación ADN-ADN realizados por Bouvet y Grimnot11 en 1986 se referenciaron 12 especies, el género ahora consta de 26 especies nombradas y nueve especies genómicas21. Cuatro especies de Acinetobacter, A. calcoaceticus, A. baumannii, Acinetobacter especie genómica 3 o A. pitii y Acinetobacter especie genómica 13TU o A. nosocomialis, tienen fenotipo similar que los hace difícil de diferenciar, denominándose frecuentemente como complejo A. baumannii-calcoaceticus22. Esta designación puede ser engañosa ya que la especie A. calcoaceticus no ha sido implicada en enfermedad clínica, mientras las otras tres especies del complejo son quizás las especies clínicamente más significativas en infección adquirida en la comunidad y nosocomial; la especie A. calcoaceticus es la que ha dado nombre al complejo, siendo a su vez benigna, por lo cual no es apropiado el uso de esta denominación en el contexto clinico21.
Los organismos pertenecientes a este género son a menudo difícil de decolorar, identificándose a menudo como gram positivos. Crecen bien en medios sólidos que son usados en forma rutinaria en laboratorios de microbiología clínica, tales como agar sangre de carnero o agar de soja tríptico. Forman suaves, a veces mucoides, colonias de color blanco grisáceo; las colonias del complejo A. baumannii-calcoaceticus se asemejan a las de las Enterobacterias, con un diámetro de colonia de 1.5 a 3 mm, mientras la mayoría de las otras especies de Acinetobacter producen colonias más pequeñas y translúcidas21.
No existe una prueba metabólica definitiva que permita distinguir Acinetobacter de otras bacterias Gram-negativas no fermentadores. Un método que se utiliza a menudo para identificarla a nivel de género se basa en la capacidad de la cepa mutante A. baylyi BD413 trpE27 de ser transformado por cualquier especie de Acinetobacter de un fenotipo tipo ADN crudo a ADN salvaje, es decir, el ensayo de transformación de Juni17. Mientras que para la identificación a nivel de especie, las 28 pruebas fenotípicas disponibles han demostrado ser 95,6% efectivas en la identificación de Acinetobacter derivados de la piel humana. Sin embargo, las pruebas fenotípicas solo han demostrado ser ineficaces en la identificación de las cepas genómicas de Acinetobacter descubiertas más recientemente23. Métodos de diagnóstico moleculares más avanzadas han sido desarrollados para la identificación de Acinetobacter a nivel de especies, éstas incluyen: análisis amplificado del gen de restriccion 16S ARNr24, análisis de alta resolución de huellas digitales por polimorfismo de la longitud de los fragmentos amplificados 25, ribotipificación26, espaciador huellas digitales ARNt27, análisis de restricción de la secuencia del espaciador intergenico 16S-23S ARNr28, análisis de secuencia de la región espaciadora del gen 16S-23S ARNr29 y secuenciación del gen rpoB (ARN polimerasa subunidad β)30.
EPIDEMIOLOGÍA
En los Estados Unidos, se reporta que entre las infecciones asociadas al cuidado de la salud causadas por A. baumannii, las del torrente sanguíneo y la neumonía asociada a ventilador mecánico son la más prevalentes con el 2% y 6%, respectivamente31, en Europa, se reporta como el noveno patógeno más común en infecciones hospitalarias del torrente sanguíneo32 y en Latinoamérica alcanza el 5,3% de todos los aislados de bacteriemias nosocomiales33. De acuerdo a lo establecido por el reporte global34 y para Latinoamerica35 de SENTRY, programa de vigilancia internacional que inició en 1997 para monitorizar la incidencia y la susceptibilidad antimicrobiana de los patógenos causantes de infecciones adquiridas en la comunidad y nosocomial, las tasas de resistencia a carbapenémicos son más elevadas en Latinoamérica a comparación de Estados Unidos y Europa, se estableció que Acinetobacter sp. fue el microorganismo más prevalente y presentó las mayores tasas de resistencia bacteriana en Latinoamérica (10%) a comparación de otras regiones evaluadas, en las cuales se observó resistencia alrededor del 5%. De acuerdo al programa de vigilancia MYSTIC, programa de recolección de información de test de susceptibilidad anual a meropenem, las tasas de resistencia al meropenem, imipenem, ceftazidima, piperacilina-tazobactam, ciprofloxacina y gentamicina en América Latina parecen estar entre las más altas en el mundo36. Por ejemplo, solo el 71% de las cepas aisladas fueron sensibles a meropenem o imipenem en una evaluación de un programa de vigilancia en el período 2002-200436 y en un estudio de vigilancia realizado en Argentina, Brasil, Chile y Colombia en el periodo 1997-2001, las tasas de resistencia fueron más altas en Argentina, pero ningún país estuvo exento de cepas resistentes a múltiples fármacos37. Una variedad de carbapenemasas se han identificado en A. baumannii aislados en América Latina, incluyendo IMP-1 e IMP-6 en Brasil38,39, OXA-23 en Brasil y Colombia40,41 y OXA- 58 en Argentina42.
En Colombia, según informes del Ministerio de Salud y Protección Social, dentro de los microorganismos multirresistentes aislados en Unidades de Cuidados Intensivos (UCI) del país en el año 2014, A. baumannii representó el 3,1%, con altos porcentajes de resistencia frente a los Carbapenémicos; sin embargo, comparando los datos con los reportados en el año 2013, se observó una ligera disminución en el porcentaje de resistencia a esta familia de antibióticos oscilando entre 46,4% y 54,7%. También se observó incremento en la resistencia frente a colistina en relación a lo reportado el año 201343. De acuerdo con el centro internacional de entrenamiento e investigación medica, a traves de su grupo para el estudio de la resistencia nosocomial en Colombia, en un estudio de vigilancia fenotípica y molecular de la resistencia antimicrobiana de bacilos gram negativos aislados durante el periodo de enero de 2009 a diciembre de 2012 en UCI de 23 clínicas y hospitales en Colombia, se estableció que los bacilos gram negativos continuan siendo los microorganismos más frecuentemente aislados, representando A. baumannii el 19.3%. En este periodo de tiempo A. baumannii conservó un perfil fenotípico de multirresistencia, presentando un incremento en la resistencia a carbapenémicos a lo largo de los años, la OXA-23 fue la carbapenemasa más frecuentemente detectada en el país44.
Debido a la predilección de A. baumannii por colonizar e infectar pacientes en estado crítico, que a menudo tienen un mal pronóstico independientemente de complicaciones infecciosas secundarias, ha sido difícil determinar el verdadero impacto clínico de este patógeno, existiendo controversia en la literatura45,46. La mortalidad asociada por A. baumannii se determina entre el 26% al 68%46,47; sin embargo, es muy difícil determinar en estos pacientes la mortalidad atribuible a la infección independientemente de la gravedad de sus enfermedades subyacentes. Estudios recientes concluyeron que la infección o la colonización por Acinetobacter se asocia a un incremento de la mortalidad47,48, pero muchos de estos estudios estaban limitados por el pequeño tamaño de la muestra, las diferencias metodológicas, y la dificultad para controlar de forma adecuada la gravedad de la enfermedad de base del paciente. Otros estudios que controlaron de forma rigurosa la gravedad de la enfermedad no encontraron que la infección por Acinetobacter fuera un factor independiente de mortalidad46. Por lo cual se puede considerar que la infección por Acinetobacter es un marcador de aumento de la mortalidad en pacientes con enfermedad subyacente grave más que un predictor independiente de mortalidad47.
El control y el manejo de las infecciones hospitalarias se han convertido en un problema fundamental para la atención en salud. Las infecciones adquiridas en los hospitales incrementan la morbilidad, la mortalidad y la estancia hospitalaria, además causan un enorme impacto en los costos. Por ejemplo, se considera que el aumento promedio en los Estados Unidos por cada una de estas infecciones supera los US$ 15.00049. La infección por Acinetobacter se asocia con un incremento en la morbilidad y una prolongación de la estancia hospitalaria. Un estudio retrospectivo mostró que los pacientes con bacteriemia por Acinetobacter presentaban una prolongación del tiempo de requerimiento de ventilación mecánica y de estancia en UCI en 5 días, en comparación con pacientes críticamente enfermos pero sin bacteremia por este microorganismo50. La infección por Acinetobacter multirresistente ha demostrado prolongar en forma significativa la duración de la estancia en UCI, en promedio 6 días, y la media de estancia hospitalaria global en promedio en 18 días46.
Las especies de Acinetobacter se consideran microorganismos poco virulentos, salvo en pacientes críticamente enfermos o inmunocomprometidos, por lo que se asocian más a menudo con infecciones nosocomiales que comunitarias51. Sin embargo, en regiones tropicales existen reportes, de neumonía adquirida en la comunidad ocasionada por A. baumannii, que comúnmente se presentan en meses húmedos y cálidos52,53. Entre los factores de riesgo que predisponen a los pacientes a la colonización o infección por cepas de A. baumannii multirresistente se encuentran los factores dependientes del hospedero como enfermedad grave, infección o sepsis previa, cirugía mayor reciente, traumatismo, quemaduras, y factores externos como la estancia hospitalaria prolongada, ingreso prolongado en UCI, ingreso en un servicio donde A. baumannii sea endémico, exposición a equipo médico contaminado, ventilación mecánica, uso de dispositivos intravasculares, sonda vesical, tubos de drenaje54-56; así mismo se ha asociado el uso previo de antimicrobianos con la colonización e infección por Acinetobacter, situación que refuerza la necesidad de un uso prudente de los antimicrobianos54,57,58.
HÁBITAT NATURAL
Las especies de Acinetobacter pueden ser aisladas de objetos animados e inanimados, crecen en casi todas las muestras de suelos y agua fresca51. En el medio hospitalario, estos microorganismos han sido aislados de humidificadores, equipos de ventilación, hojas de laringoscopio, cortinas, piel del personal de salud, colchones, cojines y otros equipos52,59,60. Se ha reportado una supervivencia en superficies secas mayor a siete días para A. lwoffi y mayor a 25 días para A. baumannii. A. calcoaceticus sobrevive hasta 13 días en superficies de formica61. La persistencia de las especies de Acinetobacter en las superficies medioambientales es su característica más distintiva entre los patógenos nosocomiales, explicando su mayor patogenicidad entre pacientes hospitalizados61. No todas las especies del género Acinetobacter tienen su hábitat natural en el medio ambiente; aunque un estudio sistemático para investigar la presencia natural de los distintas especies de Acinetobacter en el medio ambiente no ha sido realizado62.
Un estudio epidemiológico realizado por Seifert et al.23 encontró que el 43% de los individuos no hospitalizados estaban colonizados por especies del género Acinetobacter. Las especies aisladas con mayor frecuencia fueron A. lwoffii (58%), A. johnsonii (20%), A. Junii (10%), y Acinetobacter especie genómica 3 (6%). En un estudio similar realizado por Berlau et al.63 se aisló especies de Acinetobacter en el 44% de portadores asintomaticos, siendo las especies mas prevalentes A. lwoffii (61%), Acinetobacter especies genómica 15BJ (12%), A. radioresistens (8%) y Acinetobacter especie genómica 3 (5%). De cauerdo a los resultados obtenidos en el estudio de Buxton et al.64 un tercio de los trabajadores sanitarios presentaron colonización transitoria por A. calcoaceticus en sus manos; la faringe, vagina y recto fueron sitios excepcionales de colonización. Existen informes de aislamientos ocasionales de A. baumannii apartir de mamíferos, piojos y verduras, aunque hay controversia si estas cepas, que son poco frecuentes en los animales, sean el resultado de contaminación del medio ambiente por reservorios primarios del ambiente hospitalario o son reservorios naturales alternativos de esta especie65.
FACTORES DE VIRULENCIA
Hasta la fecha, poco se ha dilucidado en relación a los factores de virulencia de A. baumannii (Ver Figura 2). Si bien se cree son varios los factores que pueden contribuir a la potencial virulencia de A. baumannii, un factor en particular, la proteina OmpA, un miembro de las proteínas de membrana externas, se considera es uno de los principales determinantes en su capacidad de virulencia66. OmpA se une a la célula epitelial y a las mitocondrias del hospedero, desencadenando edema y disfunción mitocondrial y finalmente apoptosis, lo que sugiere que esta puede ser una vía por la cual A. baumannii induce daño a humanos durante la infección66. La OmpA es la proteína de superficie más abundante de este patógeno y está implicado en la resistencia al sistema de complemento y la formación de biopelículas, dos importantes mecanismos que ayudan a promover su supervivencia tanto dentro como fuera del hospedero. La capacidad de A. baumannii para formar biopelículas permite su crecimiento constante en condiciones ambientales desfavorables, como vidrio y material inerte de los equipos médicos67,68.
Otro factor de virulencia en estudio es el Lipopolisacárido (LPS) que contiene la fracción de lípido A, el núcleo de hidratos de carbono y el antígeno O. En un estudio realizado por Luke et al.69 se investigó el papel del LPS en la patogénesis de la bacteria, mediante el empleo de una cepa mutante que carecía de la glucotransferasa del LPS tipo B que produjo un LPS con solamente dos residuos de carbohidratos unidos al lípido A. Este mutante mostró menor resistencia al suero humano y menor supervivencia en modelos de ratas con infección de tejidos blandos, a comparación con la cepa no manipulada, lo que indica el papel de los residuos de hidratos de carbono de los LPS en la patogénesis. La proteina CD14 presente en la membrana plasmática de las células del hospedero, desempeña un papel importante en la erradicación de A. baumannii desde el pulmón, mediante la interacción con el LPS, lo que sugiere un rol de estos en la activación la respuesta inmune70.
Fregolino et al.71 reportaron las estructuras de los polisacáridos capsulares de dos cepas aisladas de A. baumannii, revelando un aminopolisacárido lineal conformado por tres residuos de carbohidratos en una cepa y una pentasacárido ramificado en la otra. Además del LPS, los polisacáridos capsulares también han sido identificados como factor de patogenicidad en A. baumannii. En un estudio realizado por Russo et al.72 donde se usaron mutantes en el gen ptk o epsA, condujo a la producción de cápsulas bacterianas alteradas, observándose menor crecimiento en suero humano y liquído ascítico, al compararlas con cepas silvestres. Ademas, se desmostró en un modelo de infección de tejidos blandos en ratas, que las cepas con la capsula alterada fueron completamente eliminadas a las 24 horas posinfección, mientras que cepas silvestres persistieron en una cantidad mayor a 107 bacterias/ml en el mismo tiempo. Por lo que se plantea que los polisacáridos capsulares desempeñan un papel importante en la protección de las bacterias de la respuesta inmune innata del huésped.
Las vesículas de membrana externa están constituida por componentes de la membrana externa, proteínas periplásmicas, fosfolípidos y LPS, estas han sido implicadas tambien en la virulencia del A. baumannii, favoreciendo la entrada de factores de virulencia en las células del hospedero, la transferencia horizontal de los genes y la protección de las bacterias a la respuesta inmune73,74. Un análisis proteómico de estas vesículas identificó la presencia de las proteínas OmpA, proteasas y hemolisinas, de tal forma que las vesículas facilitarían la entrada al interior de las células eucariotas de la OmpA y de esta forma se induciría la muerte celular, como fue desmostrado por los estudios de Jin et al.75 quienes estableceieron que la exposición de células eucariotas a las vesículas de membrana externa de una cepa deficiente de OmpA no producía muerte celular.
Las fosfolipasas bacterianas son enzimas lipolíticas que catalizan la escisión de fosfolipidos, la alteración de genes de la fosfolipasa D presentes en A. baumannii reduce su capacidad de supervivencia en el suero humano y la capacidad para invadir las células epiteliales. Se considera que estas enzimas contribuyen en la patogénesis, favoreciendo la lisis de la células del huésped, mediante la escisión de los fosfolipidos presentes en la membrana celular y degradación de los fosfolipidos presentes en las barreras mucosas, favoreciendo la entrada del patógeno76. En un estudio realizado por Camarena et al.77 se observó que la inactivación de uno los genes responsaables de la Fosfolipasa C conllevó a la disminución de la habilidad del patógeno para inducir muerte celular en las células epiteliales del huésped a comparación con cepas no manipuladas.
Las Proteínas de Unión a Penicilina (PBP) generalmente se asocian con la unión y la inactivación de los antibióticos β-lactámicos. Sin embargo, las proteinas PBP también participan en las etapas finales de la biosíntesis de la capa de peptidoglicano y por tanto contribuyen a la estabilidad de la célula bacteriana78. En un estudio realizado por Russo et al.72 donde se usó una cepa mutante en el gen pbpG, que codifica PBP7/8, mostró un crecimiento reducido en liquido ascítico y suero humano. Un análisis por microscopía electrónica de estas cepas mutantes y silvestres mostró una diferencia en la morfología bacteriana, apoyando la idea de que la falta de PBP7/8 puede afectar a la estabilidad celular, posiblemente a través de efectos sobre la capa de peptidoglicano.
MANIFESTACIONES CLÍNICAS
La neumonía asociada a ventilador es comúnmente vinculada a infección por A. baumannii79. Largos periodos de hospitalización, tiempo prolongado de ventilación mecánica y uso previo de antibióticos son los factores de riesgo reconocidos. Se han descrito brotes nosocomiales por manos de profesionales de la salud colonizadas y pobre higiene personal21. Ventiladores contaminados y equipo de cuidado respiratorio son también otras fuentes de transmisión y factores de riesgo para esta patología80. En grandes estudios de vigilancia realizados en Estados Unidos, entre 5% y 10% de los casos de neumonía adquiridas en UCI se debieron a A. baumannii81.
Han sido reportados casos de neumonía adquirida en la comunidad en regiones tropicales de Australia y Asia82,83. Se caracteriza por un curso clínico fulminante, secundario a bacteriemia, con tasas de mortalidad del 40% al 60%83. Aunque es muy poco frecuente la aparición de enfermedad por este microorganismo en personas inmunocompetentes, se observó en estos casos un historial de excesivo consumo de alcohol, y se asoció como probable fuente de infección la presencia de este microorganismo como parte de la flora de la faringe82.
En un estudio realizado en Estados unidos por Wisplinghoff et al.84 sobre infecciones nosocomiales del torrente sanguíneo, Acinetobacter representó el 1,3% del total de infecciones. Fue la causa más común de infección adquirida en UCI a comparación de las infecciones no adquiridas en UCI, 1,6% frente a 0,9% respectivamente. La tasa de mortalidad oscilo entre 34,0% a 43,4% en UCI y 16.3% fuera de UCI. La infección por A. baumannii tuvo el tercer lugar en las tasa de mayor mortalidad en UCI, sólo superado por P. aeruginosa y Cándida sp.
Se ha observado que A. baumannii puede en forma ocasional causar infecciones de piel y tejido blando fuera de la población militar, en un estudio realizado por Gaynes et al.81 este microorganismo fue responsable del 2,1% de las infecciones en piel y tejidos blandos adquiridas en UCI. Es un patógeno bien conocido en unidades de quemados y puede ser difícil de erradicar en este tipo de pacientes85, en un estudio retrospectivo realizado por Sebeny et al.14 donde observaron 57 pacientes con lesiones de guerra, mostro que ocho casos fueron infectados con Acinetobacter, todos eran varones, de edades entre 13 y 55 años, de nacionalidad estadounidense e iraquí. Todos los pacientes tuvieron una presentación clínica similar, celulitis con una característica apariencia de "piel de naranja", con posterior evolución a formación de ampollas en la superficie de la piel. La tasa de mortalidad que se encontró fue de 12,5%. A. baumannii es una causa ocasional de infección de vías urinarias, en el estudio realizado por Gaynes et al.81 fue responsable del 1,6% de las mismas adquiridas en UCI, asociada a infección o colonización por catéter vesical. La meningitis por A. baumannii es una entidad cada vez más importante, predomina a nivel nosocomial posterior a procedimientos neuroquirúrgicos86-88, la presencia de un drenaje ventricular externo se convierte en el principal factor de riesgo para esta patología. La tasa de mortalidad puede llegar hasta el 70%, aunque es motivo de controversia86.
En la literatura se han encontrado un pequeño número de casos reportados de endocarditis por A. baumannii, la mayoría de ellos con el antecedente de reemplazo valvular89-92. Acinetobacter sp. también puede producir endoftalmitis o queratitis, algunos casos relacionados con uso de lentes de contacto o posterior a cirugías oculares93-95.
RESISTENCIA ANTIBIOTICA
Múltiples estudios han reportado altas tasas de resistencia antimicrobiana en Acinetobacter sp., sus patrones de resistencias varían según la especie aislada y la zona geográfica96. En un estudio realizado por Seifert et al.97 informaron que A. baumannii es generalmente más resistente que A. lwoffi y otras especies de Acinetobacter. Las especies de Acinetobacter pueden adquirir genes de resistencia procedentes de otros microorganismos, desarrollar a lo largo del tiempo mutaciones que ocasionan resistencia o, bajo presión antimicrobiana selectiva, determinadas subpoblaciones con resistencia preexistente emergen y se hacen dominantes. Estos tres procesos no son excluyentes y probablemente coexistan en las cepas de Acinetobacter resistentes.98
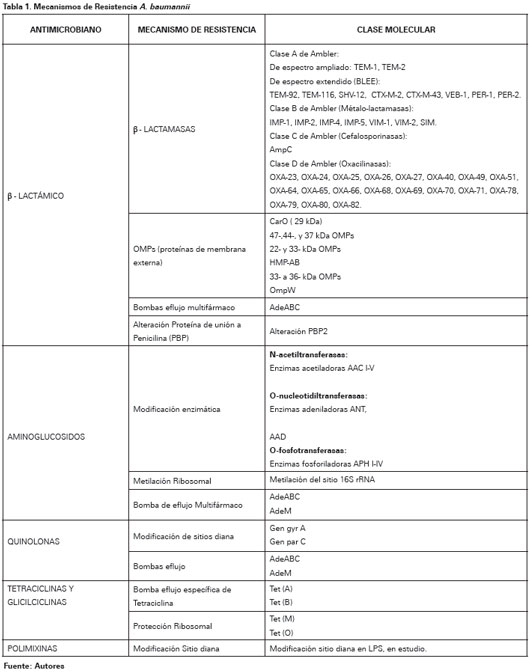
Los mecanismos de resistencia se agrupan en tres categorías: Enzimas inactivadoras de antimicrobianos, limitación del acceso a las dianas bacterianas, y mutaciones que alteran las dianas o funciones celulares.99 A continuación se detallaran los principales mecanismos de resistencia por grupo de antimicrobianos (Ver Tabla 1).
BETALACTÁMICOS
En A. baumannii el mecanismo de resistencia más importante a los antibióticos β-lactámicos es la degradación enzimática por β-lactamasas cromosomales o plasmidiales, aunque múltiples mecanismos actúan en concierto100-101. Las β-lactamasas se dividen en cuatro grupos: clase A de Ambler (Penicilinasas), clase B de Ambler (Metaloenzimas), clase C de Ambler (Cefalosporinasas) y clase D de Ambler (Oxacilinasas)102.
Las β-lactamasas de clase A se han reportado raramente en Acinetobacter sp. y Pseudomonas sp.103,104 Entre estas encontramos β-lactamasas de espectro reducido:TEM-1 y TEM-2105,106, pero su importancia clínica actual es limitada dada la potencia de otros determinantes de resistencia. A este grupo también hace parte las β-lactamasas de espectro extendido, los microorganismos poseedores este tipo de β-lactamasas son distintivamente inhibidos por el acido clavulánico y son resistentes a los oximino-β-lactámicos por ejemplo cefotaxima, ceftriaxona, cefpodoxima o ceftazidima.
Las β-lactamasas clase B, métalo-β-lactamasas, son enzimas dependientes de zinc cuya actividad es inhibida por el ácido etildiaminotetraacético, pero no por carbapenémicos o inhibidores de β-lactamasas como el acido clavulánico, tazobactam y sulbactam. Estas enzimas tienen la capacidad de hidrolizar todos los β-lactámicos, incluyendo los carbapenémicos, excepto el monobactámico aztreonam107. Se ha identificado tres grupos, IMP38,108-110, VIM110-113 y SIM114. Las β-lactamasas clase C, también denominada Cefalosporinasas derivadas de Acinetobacter115, son codificadas cromosómicamente por todas las cepas de A. baumannii115,116. Su presencia se correlaciona con resistencia a cefalosporinas de espectro extendido117. Cefepima y carbapenémicos parecen ser estables frente a estas enzimas115.
Las oxacilinasas (OXA), β-lactamasas de clase D, también se encuentran en especies de Acinetobacter; existen múltiples subtipos que tienen diversos patrones de hidrólisis pero, en general, las oxacilinasas hidrolizan débilmente a carbapenémicos, imipenem y meropenem y no hidrolizan cefalosporinas de espectro extendido ni aztreonam. Su acción hidrolítica es inhibida por ácido clavulánico98. La primera enzima de tipo OXA fue identificada en 1985 en Edimburgo, Escocia118, este determinante de resistencia, inicialmente nombrada ARI-1, se encontró que era transferible, y el gen fue posteriormente secuenciado y nombrado blaOXA-23119,120. OXA-27 y OXA-49 son enzimas estrechamente relacionadas y conforman el grupo del gen blaOXA-23 en A. Baumannii121,122. El blaOXA-24 que codifica OXA-24, 25, 26 y 40119,123,124 y el blaOXA-5842,125,126 son otros 2 genes OXA descritos con actividad carbapenemasa. El gen blaOXA-58 y blaOXA-23 son codificados por plásmidos, lo que puede explicar su distribución generalizada126-128. El gen blaOXA-51 que codifica OXA- 51, 64, 65, 66, 68, 69, 70, 71, 78, 79, 80 y 82 es el único que se manifiesta en forma natural en A. baumannii, de ahí su localización cromosómica129-131.
En resistencia a β-lactámicos se han encontrado mecanismos no enzimáticos, entre los cuales se encuentran cambios en las proteínas de membrana externa OMPs100,101,132,133, bombas de eflujo multifármaco134 y alteraciones en la afinidad o expresión de las proteínas de unión a penicilina PBP132,135. Poco se sabe acerca de las porinas de la membrana externa de A. baumannii, recientemente se estableció que la proteína 29 kDa, también conocida como CarO, se asocia con resistencia a imipenem y meropenem133,136,137. Brotes clínicos de A. baumannii resistente a carbapenémicos debido a pérdida de porinas, incluyen reducción de expresión de 47-, 44- y 37-kDa OMPs en cepas endémicas de A. baumannii en Nueva York138 y reducción de la expresión de 22- y 33-kDa OMPs en asociación con OXA-24 en España139. Otros OMPs identificados relacionados con resistencia a β-lactámicos incluyen la proteína térmicamente modificable HMP-AB140, que es homóloga a OmpA de Enterobacterias y OmpF de P. aeruginosa; proteínas 33 a 36 kDa141 que es homologa con OprD de P. aeruginosa; y OmpW142, que es homóloga a proteína OmpW que se encuentran en E. coli y P. aeruginosa.
En el estudio realizado por Fournier et al.143 se observó que el genoma de cepas A. baumannii multirresistentes codifica una amplia gama de sistemas de bomba eflujo multifármaco. La bomba de tipo familiar AdeABC es la mejor estudiada hasta el momento y favorece resistencia a β-lactámicos, carbapenémicos, aminoglucósidos, eritromicina, cloramfenicol, tetraciclinas, fluoroquinolonas y trimetoprim.134,144-147 AdeABC es cromosómicamente codificada y, normalmente, está regulado por un sistema de dos componentes, un sensor quinasa (AdeS) y su regulador de respuesta asociado146.
AMINOGLUCOSIDOS
La resistencia a aminoglicósidos está mediada por tres mecanismos: alteración del sitio de acción ribosomal, reducción de la captura y modificación enzimática del antimicrobiano148. De estos, el tercer mecanismo es el que da cuenta de la mayoría de cepas resistentes aisladas. Las enzimas modificadoras, tales como O-fosfotransferasas, O-nucleotidiltransferasas y N-acetiltransferasas, son codificadas primariamente por plásmidos y transposones que pueden jugar un importante rol en la diseminación de resistencia, aunque pueden también tener localización cromosomal148. Más recientemente, la metilación del sitio 16S ARNr se ha descrito para A. baumannii en cepas procedentes de Japón, Corea y Estados Unidos149-151. Este mecanismo de resistencia altera el sitio de unión del aminoglicósido y confiere alto nivel de resistencia a todos los aminoglicósidos clínicamente útiles, incluyendo gentamicina, tobramicina y amikacina152. Aparte de la bomba de eflujo AdeABC, que es menos efectiva para transportar amikacina y kanamicina debido a su naturaleza mas hidrófila a comparación de los β-lactámicos,145 recientemente se ha descrito la bomba AdeM, que ofrece resistencia a aminoglucósidos como gentamicina y kanamicina153.
QUINOLONAS
Los mecanismos de resistencia relacionados con este grupo de antibióticos son mutaciones de la ADN girasa y la topo-isomerasa IV, blancos específicos de estos medicamentos154. La ADN-girasa está compuesta de dos subunidades, codificadas por los genes gyr A y gyr B. La topo-isomerasa IV es estructuralmente similar a la ADN-girasa, sus dos subunidades están codificadas por los genes parC y parE. La resistencia en Acinetobacter sp. está mediada por mutaciones en los genes gyr A y par C154. Similar a los aminoglucósidos, muchas quinolonas también son sustratos de bombas de eflujo multifármaco155, incluyendo la bomba AdeABC145 y la bomba AdeM145.
TETRACICLINAS Y GLICILCICLINAS
La resistencia a las tetraciclinas y sus derivados puede ser mediada por bombas de eflujo o protección ribosomal156. Bombas de eflujo especificas para Tetraciclinas incluyen las codificadas por los determinantes tet(A) a tet(E), encontradas con mayor frecuencia en organismos gramnegativos, y el tet(K) determinante encontrado en S. aureus. Se han encontrado tet(A) y tet(B) en A. Baumannii. Tet(A) confiere resistencia a la tetraciclina pero no minociclina157-159. La protección ribosomal está mediada por los determinante tet (M) y tet (O)159. Además de las bombas de eflujo específicos para tetraciclina, estos antibacterianos también son susceptibles de bombas de eflujo multifármacos, como la bomba AdeABC145. Tigeciclina, una clase de antimicrobianos conocidos como glicilciclinas, es también un sustrato para este sistema bombas de eflujo160,161.
POLIMIXINAS
A pesar de los recientes informes que demuestran el aumento de la resistencia in vitro de A. baumannii a las polimixinas, el mecanismo de resistencia se desconoce162,163. Se ha demostrado en otros microorganismos que la reducción de la unión a los sitios diana en los lipopolisacáridos confiere resistencia en E. Coli, Salmonella sp. y P. aeruginosa164,165. También se ha observado que cambios en las proteínas de membrana externa confieren resistencia en P. aeruginosa166,167.
TRATAMIENTO ACTUAL
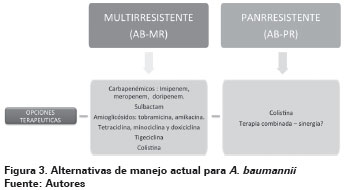
Hasta el momento, los carbapenémicos se han considerado como agentes de elección para las infecciones graves por A. Baumannii, sin embargo, aunque estos fármacos son todavía activos contra la gran mayoría de cepas de A. Baumannii alrededor del mundo, la utilidad clínica de esta clase de antimicrobianos es cada vez más amenazada por el surgimiento de mecanismos de resistencias, como se describió anteriormente.159,145
Esta revisión considera A. baumannii Multirresistente (AB-MR) las cepas con resistencia a más de dos de los siguientes grupos de antibióticos: Cefalosporinas antipseudomónicas, cefepima y ceftazidima; carbapenémicos antipseudomónicos, meropenem e imipenem; fluoroquinolonas, ciprofloxacinay levofloxacino; aminoglucósidos, gentamicina, tobramicina y amikacina, o sulbactam20,168. A. baumannii panrresistentes (AB-PR) son cepas resistentes a los antibióticos de primera línea nombrados anteriormente, incluidos carbapenémicos, y que regularmente son sólo susceptibles a polimixinas como colistina169,170, aunque ya existen reportes de cepas resistentes a colistina162,163 (Ver Figura 3).
Sulbactam es un inhibidor de β -lactamasas, opción en el manejo de infecciones por AB-MR, se ha documentado que además de tener actividad como inhibidor de β-lactamasas, posee cierta actividad antimicrobiana intrínseca contra A. baumannii. Los inhibidores de β-lactamasas son utilizados para proteger antimicrobianos β-lactámicos de la hidrólisis de enzimas bacterianas. Actualmente existen tres tipos de inhibidores: ácido clavulánico, sulbactam y tazobactam. Sulbactam tiene actividad contra Neisseria gonorrhoeae, Neisseria meningitidis, Burkholderia cepacia y Acinetobacter sp, los otros inhibidores de β-lactamasas tienen menor actividad que sulbactam frente a Acinetobacter sp. La actividad antibacteriana de sulbactam es consecuencia de su unión irreversible con PBP 2171. La presencia de un betalactámico, como la ampicilina, en combinación con el inhibidor de las ß-lactamasas, no parece producir sinergia172,173.
Diferentes estudios clínicos han demostrado la eficacia de Sulbactam en infecciones leves a severas de A. baumannii. Urban et al.174 observaron en su estudio que 9 de 10 pacientes con infección severa por A. baumannii y ventilación mecánica presentaron mejoría clínica con el uso de ampicilina-sulbactam a dosis 3g de ampicilina y 1.5g de sulbactam cada 6 u 8 horas intravenoso. En 2003, un estudio realizado en Israel reportó el uso de ampicilina/sulbactam en el manejo de AB-MR comparándolo con el estándar de cuidados en 94 pacientes con bacteriemia, comparados con el grupo estándar, el grupo de ampicilina/sulbactam no mostró diferencias significativas en la mortalidad global con un 40,5% versus 42,4%, respectivamente. En los pacientes más gravemente enfermos, ampicilina/sulbactam se asoció con mortalidad significativamente menor175. Algunas series de casos han mostrado resultados alentadores en el tratamiento de meningitis nosocomial por AB-MR con ampicilina sulbactam, aunque existe aun controversia en su uso para esta patología176,177. La dosis óptima de sulbactam para tratar infecciones graves por A. baumannii es desconocida, pero la mayoría de los autores recomiendan por lo menos 6 g/día divididos en dosis para pacientes con función renal normal. Se ha documentado dosificación de hasta 12 g/día para el tratamiento de neumonía adquirida en el hospital causada por AB-MR, sin mayores efectos adversos; sin embargo, los resultados fueron similares en los que recibieron 9 g/día178. Aun está pendiente por aclarar si dosis más altas son más eficaces o reducen el riesgo de resistencia, o incluso si la ampicilina-sulbactam debe ser usada en combinación con otros agentes179.
A pesar de la ausencia de ensayos clínicos controlados, los carbapenémicos imipenem, meropenem, o doripenem, siguen siendo una de las opciones terapéuticas más importantes para las infecciones graves causadas por AB-MR, puesto que tienen una excelente actividad y estabilidad bactericida frente a varias β-lactamasas. Desafortunadamente, el aumento de la resistencia a los carbapenémicos está creando desafíos terapéuticos, especialmente teniendo en cuenta que la mayoría de las cepas de A. baumannii que son resistente a los carbapenémicos también son resistentes a la mayoría de otros antibióticos, excepto las polimixinas o tigeciclina, los datos disponibles son de estudios in vitro, en animales y estudios observacionales180,181. El programa de vigilancia MYSTIC ha documentado datos que sugieren que imipenem es más potente que meropenem para el tratamiento de infecciones por AB-MR182, las pruebas de sensibilidad de imipenem no predice la susceptibilidad a meropenem o viceversa182. Lesho et al.183 describieron un caso mortal de neumonía por A. baumannii que fue tratado con meropenem, basados en susceptibilidad de la cepa a imipenem, sin embargo, posteriormente se demostró que la cepa era resistente a meropenem. El doripenem es un nuevo carbapenémico con actividad in vitro frente a A. baumannii; aunque no parece tener ventajas en comparación con imipenem y meropenem184.
Dentro de los aminoglicosidos, amikacina y tobramicina son dos agentes que parecen conservar actividad contra A. baumannii, dadas sus características farmacocinéticas y farmacodinamicas generalmente se usan en combinación con otro antimicrobianos, excepto en infecciones de vías urinarias47,185. Debido a sus perfiles de toxicidad a menudo se limita su uso, especialmente para tratamientos de largo tiempo. En un estudio realizado por Gounden et al.186 se comparó la eficacia y toxicidad de la tobramicina frente a la colistina en el tratamiento de infección por A. baumannii, allí no encontraron diferencias estadísticamente significativas en mortalidad en unidades de cuidados intensivos, diferencias en aumento de creatinina sérica o tiempo de aclaramiento sérico.
Minociclina y doxiciclina, que hacen parte del grupo de tetraciclinas, están disponibles por infusión intravenosa y la minociclina está aprobada por la FDA para uso en infecciones por Acinetobacter. La tetraciclina no puede ser utilizada como un marcador sustituto, debido a que muchos aislamientos resistentes a la tetraciclina pueden ser susceptibles a la minociclina187. Son limitados los datos clínicos acerca del uso de minociclina y doxiciclina. Wood et al.188 reportaron una pequeña serie de casos de neumonía asociada a ventilación mecánica por A. baumannii tratados con doxiciclina y minociclina, cinco pacientes tenían cepas resistentes a todos los antimicrobianos salvo minociclina y doxiciclina, seis pacientes se consideraron con mejoría clínica después del tratamiento. Los investigadores concluyeron que estas tetraciclinas podrían ser eficaces para tratar neumonía asociada a ventilación mecánica por AB-MR.
La tigeciclina es un antimicrobiano que hace parte de las glicilciclinas, tiene actividad bacteriostática frente a A. baumannii, es un derivado semisintético de la minociclina e inhibe la subunidad ribosómica 30S; su ventaja sobre antibióticos del grupo tetraciclinas es su capacidad de evadir los tradicionales mecanismos de resistencia específicos para tetraciclinas, bombas de eflujo tet (B) y determinantes tet (M) y tet (O) que proporcionan protección ribosomal, lo que le confiere un espectro de actividad más amplio189. A pesar de la gran actividad in vitro mostrada por tigeciclina, los datos clínicos siguen siendo limitados, en 155 cepas de distintas colecciones internacionales de seguimiento de resistencia, tigeciclina fue activa en 98,7%190. Respuestas clínicas favorables han sido reportadas en el tratamiento de infecciones graves191; sin embargo, debido a la movimiento rápido de la tigeciclina hacia los tejidos después de administración intravenosa, se recomienda evitar el uso de esta en infecciones del torrente sanguíneo por A. baumannii192. Ya se han detectado resistencias de alto a nivel para este antibiótico en algunas cepas, determinadas por la suprarregulación de bombas de eflujo mediadas cromosómicamente193,194.
Las polimixinas fueron descubiertas en 1947, reconociéndose cinco componentes, polimixinas A - E195. Sólo polimixina B y E han sido utilizadas en clínica. Colistín o polimixina E fue descrito por Koyama en 1949, sintetizado por el Bacillus polymyxa subespecie colistinus196. Este agente se utilizó originalmente durante las décadas del sesenta y setenta, pero dada su nefro y neurotoxicidad su prescripción era infrecuente. Su uso ha ido aumentando últimamente gracias a su potente actividad frente a bacterias gram-negativas. La mayoría de los estudios clínicos que investigan el uso de polimixinas frente a microorganismos multiresistentes utilizan más bien colistín que polimixina B197. Son bactericidas, con efecto concentración dependiente, actúan sobre la pared celular bacteriana alterando su permeabilidad, llevando a la muerte celular por lisis196.
Los efectos adversos más frecuentes de colistín son nefrotoxicidad, neurotoxicidad reversible y bloqueo neuromuscular. A nivel renal puede causar un efecto tóxico directo que resulta en necrosis tubular aguda. Los efectos neurotóxicos incluyen ataxia, confusión, disturbios visuales, vértigo e inestabilidad vasomotora. Puede causar bloqueo neuromuscular generador de falla respiratoria196.
Estudios observacionales han reportado tasas de curación o mejoría tras el tratamiento con colistina del 57-77% en pacientes gravemente enfermos con diversas infecciones por AB-MR, incluyendo neumonía, bacteriemia, sepsis, infección intraabdominal e infección del SNC79,198,199. Aunque faltan datos farmacocinéticos de alta calidad, se ha demostrado que la colistina tiene una pobre penetración en liquido cefalorraquideo y tejido pulmonar. En este sentido cobra especial interés la posibilidad de administración de este antibiótico vía intratecal o intraventricular, así como su uso en nebulización47,200.
En un estudio realizado por Levin et al.198 encontraron una tasa baja de respuesta, 25%, en pacientes con neumonía por AB-MR que fueron tratados con colistina parenteral. Otros estudios han reportado tasas de respuesta clínica más favorables entre un 56% a un 61% para el tratamiento con colistina parenteral de neumonía asociada a ventilador por AB-MR201-203. Reportes de casos han mostrado adecuada respuesta de pacientes con meningitis por AB-MR con colistina parenteral, pero su eficacia para esta enfermedad sigue siendo poco clara204,205. Múltiples series de casos informan el uso de polimixina intraventricular e intratecal, con o sin terapia parenteral, para el tratamiento de meningitis bacteriana por gram-negativos206-208. Una revisión realizada por Falagas et al.209 de 31 informes que involucran 64 episodios de meningitis bacteriana por gram-negativos observaron un tasa de curación de 80%, incluyendo recuperación para 10 de 11 pacientes con meningitis por Acinetobacter; la mayoría de los pacientes recibieron terapia antimicrobiana sistémica y administración local de la polimixina, se observo toxicidad neurológica principalmente en los informes publicados antes de 1970, y la irritación meníngea fue la manifestación más común209.
En el boletín entregado en el año 2015 por el grupo para el control de la resistencia antimicrobiana en Bogotá, GREBO, en el cual se incluyeron instituciones de salud de ciudades colombianas como Bogotá, Manizales, Villavicencio, Ibagué, Tunja, Neiva y Valledupar, se estableció que la resistencia de A. baumannii a los carbapenémicos sigue siendo muy alta, (para meropenem 65,7% en 2013 y 69,2% en 2014), ampicilina sulbactam presentó una ligera disminución (46,1% en 2013 y 37% en 2014), y antibioticos de última linea como colisitina fue de 0% y tigeciclina 4,2%. Por lo cual consideraron que en muchas instituciones de salud es probable que el tratamiento empirico para una infeccion por este microorganismo requiera de entrada el uso de polimixina asociada a tigeciclina y un carbapenemico o amikacina segun el escenario clinico, cada institución deberá tomar las medidas necesarias según su perfil de susceptibilidad frente a este microorganismo para evitar el uso masivo de polimixinas, última opción terapeutica disponible para infecciones graves por este y otros microorganismos multirresistentes210.
SINERGIA Y TERAPIA COMBINADA
El uso de la terapia de combinación para tratar microorganismos Gram negativos multiresistentes y panresistentes es un área de amplio interés actual211. Esta estrategia tiene como objetivo crear una combinación de dos agentes a los cuales el organismo no sea susceptible por pruebas de laboratorio. Además de tratar de mejorar la eficacia, la terapia de combinación también puede ayudar a prevenir la aparición de resistencia cuando al menos un agente es activo in vitro212.
La falta de ensayos clínicos controlados hace difícil evaluar el papel de la sinergia o la terapia combinada en el tratamiento de la infección por AB-MR y AB-PR. La mayoría de los datos disponibles proceden de series de casos, modelos animales o estudios in vitro; diferentes estudios han mostrado resultados contradictorios para las mismas combinaciones de antibióticos. Montero et al.213 estudiaron un modelo de neumonía por A. baumannii multirresistente en ratones y encontraron que las combinaciones de rifampicina con imipenem, tobramicina o colistina, tenían las mayores tasas de curación. Un estudio clínico piloto posterior, sin embargo, alertó sobre el uso de rifampicina e imipenem para el tratamiento de infecciones por Acinetobacter resistente a carbapenémicos, debido a que los investigadores observaron una alta tasa de fallos terapéuticos y documentaron la aparición de resistencia a la rifampicina en un 70% de los pacientes tratados con este régimen214. En un estudio realizado por Bernabeu et al.215 la combinación de imipenem y amikacina resultó peor que el imipenem en monoterapia para el tratamiento de las neumonías causadas por Acinetobacter resistente a imipenem, a pesar de la sinergia demostrada in vitro para estos dos agentes. Los resultados de terapias de combinación de quinolonas son variados, en un estudio realizado por Ermertcan et al.216 se observó una baja eficacia con el uso de ciprofloxacina en A. baumannii resistente a ciprofloxacina; en el estudio realizado por Joly-Guillou et al.217 se observó falta de actividad reforzada de levofloxacino al ser combinada con imipenem o amikacina en un modelo de ratón con neumonía. Curiosamente, en el estudio realizado por Sander et al.218 se observó actividad reforzada cuando aztreonam fue probado en combinación con otros β-lactámicos con un grupo de cepas de AB-MR.
Debido a esta disparidad en resultados, la utilidad clínica de la sinergia in vitro sigue siendo dudosa, la mayoría de los resultados para la terapia combinada son comparables a las tasas de curación correspondientes a las terapias con colistina parenteral en monoterapia, y la gran variabilidad de los demás agentes que podemos usar limita la capacidad de extraer conclusiones respecto a la terapia combinada47.
ESTRATEGIAS FUTURAS DE MANEJO
Debido a la amplia resistencia a los antibióticos presentada por A. baumannii, como se mencionó anteriormente, se están desarrollando alternativas de manejo219,220, entre las cuales se encuentran:
BACTERIÓFAGOS
Se están realizando estudios sobre terapia con bacteriófagos como alternativa de tratamiento para tratar de contrarrestar el fenómeno de resistencia a los antibióticos, debido a la alta especificidad de los fagos y su capacidad para trabajar con rapidez221-223. En un estudio reciente realizado por Yang et al.224 se ha aislado y caracterizado el bacteriófago AB1 que ha demostrado ser eficaz contra A. baumannii y representa un nuevo potencial terapéutico.
TERAPIA DE TRANSFERENCIA DE GENES BACTERICIDAS
Se basa en el uso de células donantes atenuadas que introducen por conjugación genes bactericidas al microorganismo patógeno; dentro de los microorganismos atenuados, se han hecho estudios con E. coli atenuada, que transportan el plásmido con genes bactericidas que inhiben la síntesis de proteínas, estos genes se encuentran reprimidos en la bacteria donadora, pero se activan al ser entregados a la bacteria receptora. Un estudio realizado por Shankar et al.225 donde se usó este enfoque en quemadura de murinos, se demostró que los ratones tratados con dosis única de 1.010 Unidades formadoras de colonias de células donantes que contenían genes bactericidas tenían niveles más bajos de A. baumannii en las heridas por quemadura en comparación con los ratones no tratados.
RADIOINMUNOTERAPIA
Aun no ha sido usada como opción terapéutica antimicrobiana en clínica, aunque en teoría tiene la capacidad de seleccionar los microorganismo en forma rápida y eficiente como lo observado con las células cancerígenas220. Este método aprovecha la especificidad de las interacciones antígeno-anticuerpo para entregar radionucleotidos que emanan dosis de radiación citotóxica letales directamente a la célula diana, produciendo solo toxicidad hematológica transitoria en experimentación con animales. La radioinmunoterapia ha sido adaptada con éxito para el tratamiento de infecciones bacterianas226, fúngicas227 y virales228, debido a que varios estudios han demostrado el desarrollo de anticuerpos contra A. baumannii, este método apunta como una clara estrategia de manejo a futuro229,230.
TERAPIA FOTODINÁMICA
Este método usa la combinación de fotosensibilizantes no tóxicos con oxigeno para producir especies reactivas de oxigeno que oxidan biomoléculas y conllevan a la destrucción celular231. El uso de la terapia fotodinámica para tratar infecciones bacterianas localizadas generalmente implica la aplicación tópica de un fotosensibilizante en el tejido infectado, seguido por iluminación con luz infrarroja que es capaz de penetrar en el tejido232. Usando esta técnica en modelos de heridas por quemaduras en murinos, se ha demostrado que es eficaz contra A. Baumannii233.
TECNOLOGÍA DE NANOPARTÍCULAS
El óxido nítrico ha demostrado tener una potente actividad antimicrobiana y jugar un papel importante en la modulación de la inmunidad y la regulación de la cicatrización de heridas. Usando la nanotecnología basada en un hidrogel de silano, Friedman et al.234 han diseñado un óxido nítrico estable liberado por una plataforma de nanopartículas. Este enfoque tiene el potencial de servir como un antimicrobiano tópico novedoso, económico y de fácil aplicación. Ha demostrado ser eficaz para el tratamiento de infecciones cutáneas complejas, tales como las causadas por A. Baumannii. En un estudio realizado por Mihu et al.235 se observó el efecto del oxido nítrico por nanopartículas en infección de piel y tejidos blandos por A. Baumannii en murinos, comparados con los animales control, los ratones tratados con esta técnica mostraron reducciones significativas en carga bacteriana, mayores tasas de curación de las heridas y reducción de la degradación del colágeno por colagenasas bacterianas.
PREVENCIÓN
Múltiples factores trabajan en conjunto para mantener la presencia de especies de AB-MR y AB-PR en el ámbito de la atención de salud, entre los cuales se encontró la presencia de pacientes susceptibles, la presencia de los pacientes ya colonizados o infectados con el patógeno, presión selectiva por el uso de antimicrobianos, y el cumplimiento incompleto de los procedimientos para control de infecciones, esto último favorecido por la capacidad de este patógeno para sobrevivir en el ambiente, como se expuso anteriormente, y una probable resistencia a agentes desinfectantes que se encuentra en estudio236. Este patógeno se puede diseminar a través del aire a distancias cortas mediante gotitas de agua y a través de la descamación de la piel de pacientes que están colonizados, pero el modo de transmisión más común es a través de las manos del personal sanitario. Los pacientes que están colonizados o infectados por una cepa concreta de A. Baumannii pueden portar esta cepa en diferentes partes del cuerpo durante días e incluso semanas, y la colonización puede pasar inadvertida si la cepa epidémica no se aísla en muestras clínicas237.
Investigadores han reportado interrupción de la transmisión de A. baumannii posterior al reforzamiento de medidas para prevención y control de infecciones, tales como higiene de manos, uso de métodos de barrera y exhaustiva limpieza y desinfección del ambiente hospitalario238-40. En otros casos la transmisión es más difícil de interrumpir, requiriendo aislamiento de pacientes, asignación de personal asistencial para vigilancia, cultivos de vigilancia activa y cierre de las unidades241,242.
Además de la transmisión, se reporta aparición de resistencia por presión selectiva debido a terapia antimicrobiana de amplio espectro, entre los cuales se encuentran carbapenémicos243, cefalosporinas de tercera generación244 y fluoroquinolonas245. En muchas instituciones de salud endémicas, infecciones por AB-MR han demostrado perfiles epidemiológicos complejos y coexistencia de múltiples cepas. En un estudio realizado por Abbo et al.246 observaron 118 pacientes con infección por AB-MR en Israel, se encontró diez diferentes clones, así como pequeños grupos de pacientes con fuente común no identificada, a pesar de investigación con pruebas moleculares. Tipificación de cepas basados en métodos moleculares se puede utilizar para identificar brotes de infección y supervisar transmisión interinstitucional, regional e internacional de especies de Acinetobacter multirresistentes247,248. Por ejemplo, durante un período de brote en los Países Bajos que afectó a ocho hospitales, se encontró una de las cepas en tres de esos centros y otra cepa en otros dos249. Hay datos similares que apoyan la diseminación interhospitalaria de cepas multirresistentes en determinadas zonas geográficas de República Checa, Reino Unido, Portugal y Estados Unidos237.
En los últimos años ha crecido la preocupación acerca del papel de la resistencia a los desinfectantes. Susceptibilidad reducida de S. aureus resistente a meticilina, frente S. aureus sensible a meticilina, a la clorhexidina y compuestos de amonio cuaternario han sido reportados250. Observaciones similares fueron hechas en bacterias gramnegativas como P. aeruginosa251. Se ha especulado que la resistencia a desinfectantes puede contribuir a la aparición de brotes epidémicos por A. baumannii, aunque existe controversia. En un estudio realizado por Wisplinghoff et al.252 se comparó la actividad in vitro de diversos desinfectantes, tales como propanol, mecetronium etilsulfato, yodo-polivinilpirrolidona, triclosán, y clorhexidina, contra cepas endémicas y esporádicas de A. baumannii. Llegaron a la conclusión que la resistencia a los desinfectantes probablemente no es un factor importante que favorezca la propagación de epidemias por A. baumannii, ya que todos los desinfectantes inhibieron el crecimiento de todas las cepas de A. baumannii cuando se usaron las concentraciones y tiempos de contacto recomendados por el fabricante. Sin embargo, con la mayoría de los desinfectantes probados, un importante número de bacterias permanecían viables cuando los tiempos de contacto fueron inferior a 30 segundos o cuando estos fueron diluidos, como ocurre frecuentemente en la práctica clínica. Algunas intervenciones de control de infecciones son apropiadas para prevenir y cotrolar brotes de A. baumannii, en forma ideal, deben realizarse estudios de casos y controles en la unidad para determinar que antibióticos aumentan el riesgo de aparición de cepas A. baumannii multiresistentes20, 253. (Ver Figura 4)
CONCLUSIONES
Acinetobacter Baumannii es un patógeno oportunista emergente que causa gran preocupación debido a su alta capacidad de resistencia a los antibióticos y al medio ambiente, y su amplia distribución mundial. En Latinoamérica alcanza el 5,3% de todos los aislados de bacteriemias nosocomiales, en Colombia, según informes del Ministerio de Salud y protección social, dentro de los microorganismos multirresistentes aislados en unidades de cuidados intensivos del país en el año 2014, A. baumannii representó el 3,1%, con altos porcentajes de resistencia frente a los Carbapenémicos, siendo OXA 23 la carbapenemasa mas frecuente encontrada. Las especies de Acinetobacter pueden ser aisladas de objetos animados e inanimados, crecen en casi todas las muestras de suelos y agua fresca, con una alta capacidad para sobrevivir en ambientes secos, que proporciona mayor patogenicidad frente a otros agentes nosocomiales. En el medio hospitalario, estos microorganismos han sido aislados de humidificadores, equipos de ventilación, hojas de laringoscopio, cortinas, piel del personal de salud, colchones, cojines y otros equipos. La proteina OmpA se considera como uno de los principales determinantes en su capacidad de virulencia conllevando a apoptosis en las celulas del hospededero. Son responsables principalmente de infeccion en ambientes asociados al cuidado de la salud, aunque se han reportado casos de infección adquiridas en comunidad en regiones tropicales. Las enzimas inactivadoras de antimicrobianos son el principal mecanismo de resistencia, entre ellas encontramos β-lactamasas, N-acetiltransferasas, O-nucleotidiltransferasas y O-fosfotransferasas. Los carbapenémicos aún son considerados como agentes de elección para las infecciones graves por A. Baumannii, con opciones terapeuticas adicionales como sulbactam, tobramicina, amikacina, tigeciclina, minociclina y doxiciclina, como última linea de manejo se usa colistina, por su gran potencial de aparición de efectos adversos. El uso de terapia con combinación de antimicrobianos para sinergia aún es controvertida y faltan estudios adicionales para su uso genrealizado. De acuerdo al reporte del grupo GREBO sobre el perfil de resistencia antimicrobiana de A. baumannii en Colombia, en muchas instituciones de salud se hace necesario el uso en primera linea de polimixina asociada a tigeciclina y un carbapenémico o amikacina segun el escenario clinico, por lo cual recomienda que cada institución tome las medidas necesarias según su perfil de susceptibilidad frente a este microorganismo para evitar el uso masivo de polimixinas, debido que son la última opción terapeutica disponible para infecciones graves por éste y otros microorganismos multirresistentes. Se encuentran en desarrollo manejos alternativos como la terapia con bacteriofagos, terapia de transferencia de genes bactericidas, radioinmunoterapia, terapia fotodinamica y terapia con tecnologia de nanoparticulas, con un futuro esperanzador. Se considera primordial el manejo de los pacientes de acuerdo a la localización de la infección y el patrón de resistencia presente en las cepas de la unidad en particular. Es importante la creación de protocolos institucionales con escalones terapéuticos, considerando el sitio de la infección, gravedad del paciente, sensibilidad de la cepa propia de cada institución y el uso previo de antibióticos; se debe hacer énfasis en los mecanismos de prevención como el estricto cumplimiento en el uso de las medidas de barrera, higiene de manos, exhaustiva desinfeccion y limpieza del ambiente hospitalario, adecuado proceso de aislamiento de pacientes y uso del recurso humano, investigaciones biológicas moleculares y cultivos de la unidad, encaminadas a prevenir y controlar la aparición de este microorganismo. Se hace necesario el desarrollo de nuevos antibiticos, desafortunadamente, de acuerdo a lo expuesto por la FDA de Estados Unidos10, son pocos los avances en la creación de nuevos antibióticos en las ultimas tres décadas, enfatizando en el poco interés mostrado por las compañías farmacéuticas en el desarrollo de nuevas moléculas debido a la poca rentabilidad que representa para ellas la inversión en investigaciones en esta materia, esperamos el apoyo gubernamental y de la empresa privada para continuar avanzando en el manejo eficaz para este patógeno.
REFERENCIAS BIBLIOGRÁFICAS
1. Barbier F, Andremont A, Wolff M, Bouadma L. Hospital-acquired pneumonia and ventilator-associated pneumonia: recent advances in epidemiology and managment. Curr Opin Pulm Med 2013;19(3):216-228. [ Links ]
2. Rosenthal VD, Bijie H, Maki DG, Mehta Y, Apisarnthanarak A, Medeiros EA et al. International Nosocomial Infection Control Consortium (INICC) report, data summary of 36 countries, for 2004-2009. Am J Infect Control 2012;40(5):396-407. [ Links ]
3. Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Crit Care Med 2013;41(2):580-637. [ Links ]
4. Shindo Y, Ito R, Kobayashi D, Ando M, Ichikawa M, Shiraki A et al. Risk factors for drug-resistant pathogens in community-acquired and healthcare-associated pneumonia. Am J Respir Crit Care Med 2013;188(8):985-995. [ Links ]
5. Aliberti S, Cilloniz C, Chalmers JD, Zanaboni AM, Cosentini R, Tarsia P et al. Multidrug-resistant pathogens in hospitalised patients coming from the community with pneumonia: an European perspective. Thorax 2013;68:997-9. [ Links ]
6. Torres A, Cilloniz C, Ferrer M, Gabarrus A, Polverino E, Villegas S et al. Bacteraemia and antibiotic-resistant pathogens in community acquired pneumonia: risk and prognosis. Eur Respir J 2015;45(5):1353-63. [ Links ]
7. Center for Diseases Control and Prevention. Antibiotic Resistance Threat report 2013. [Internet]. 2013 [Citado 30 Nov 2016]. Disponible en: http://www.cdc.gov/drugresistance/threatreport-2013/pdf/ar-threats-2013-508.pdf. [ Links ]
8. Alekshun MN, Levy S. Molecular mechanisms of antibacterial multidrug resistance. Cell 2007;128(6):1037-50. [ Links ]
9. Joly-Guillou M. Clinical impact and pathogenicity of Acinetobacter. Clin Microbiol Infect 2005;11(11):868-73. [ Links ]
10. Talbot GH, Bradley J, Edwards JE, Gilbert D, Scheld M, Bartlett JG et al. Bad bugs need drugs: an update on the development pipeline from the Antimicrobial Availability Task Force of the Infectious Diseases Society of America. Clin Infect Dis 2006;42(5):657-68. [ Links ]
11. Bouvet P, Grimont P. Taxonomy of the genus Acinetobacter with the recognition of Acinetobacter baumannii sp. nov., Acinetobacter haemolyticus sp. nov., Acinetobacter johnsonii sp. nov., and Acinetobacter junii sp. nov. and emended descriptions of Acinetobacter calcoaceticus and Acinetobacter lwoffii. Int J Syst Bacteriol 1986;36: 228-40. [ Links ]
12. Montefour K, Frieden J, Hurst S, Helmich C, Headley D, Martin M et al. Acinetobacter baumannii: an emerging multidrug-resistant pathogen in critical care. Crit Care Nurse 2008;28(1):15-25. [ Links ]
13. Turton J, Kaufmann M, Gill M, Pike R, Scott P, Fishbain J, et al. Comparison of Acinetobacter baumannii isolates from the United Kingdom and the United States that were associated with repatriated casualties of the Iraq conflict. J Clin Microbiol. 2006;44:2630-4. [ Links ]
14. Sebeny PJ, Riddle MS, Petersen K. Acinetobacter baumannii skin and soft-tissue infection associated with war trauma. Clin Infect Dis. 2008;47(4):444-9. [ Links ]
15. Bassetti M, Ginocchio F, Mikulska M. New treatment options against gram-negative organisms. Crit Care 2011;15(2):215. [ Links ]
16. Rice LB. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE. J Infect Dis 2008;197(8):1079-81. [ Links ]
17. Beijerinck M. Pigmenten als oxydatieproducten gevormd door bacterien. Vers Konin Akad Wet Ams 1911;19:1092-103. [Artículo de revista] [ Links ]
18. Brisou J, Prevot AR. Studies on bacterial taxonomy. The revision of species under Achromobacter group. Ann Inst Pasteur 1954;86(6):722-8. [ Links ]
19. Lessel EF. International Committee on Nomenclature of Bacteria Subcommittee on nomenclature of Moraxella and allied bacteria. Int J Syst Bacteriol 1971;21(2):213-4. [ Links ]
20. Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: emergence of a successful pathogen. Clin Microbiol Rev 2008;21(3):538-82. [ Links ]
21. Di Nocera PP, Rocco F, Giannouli M, Triassi M, Zarrilli R. Genome organization of epidemic Acinetobacter baumannii strains. BMC Microbiol 2011;11:224. [ Links ]
22. Gerner-Smidt P, Tjernberg I, Ursing J. Reliability of phenotypic tests for identification of Acinetobacter species. J Clin Microbiol 1991;29(2):277-82. [ Links ]
23. Seifert H, Dijkshoorn L, Gerner-Smidt P, Pelzer N, Tjernberg I, Vaneechoutte M. Distribution of Acinetobacter species on human skin: comparison of phenotypic and genotypic identification methods. J Clin Microbiol. 1997;35(11):2819-25. [ Links ]
24. Vaneechoutte M, Dijkshoorn L, Tjernberg I, Elaichouni A, De Voz P, Claeys G, et al. Identification of Acinetobacter genomic species by amplified ribosomal DNA restriction analysis. J Clin Microbiol. 1995;33(1):11-5. [ Links ]
25. Janssen P, Maquelin K, Coopman R, Tjernberg I, Bouvet P, Kersters K, et al. Discrimination of Acinetobacter genomic species by AFLP fingerprinting. Int J Syst Bacteriol. 1997;47(4):1179-87. [ Links ]
26. Gerner-Smidt P. Ribotyping of the Acinetobacter calcoaceticus- Acinetobacter baumannii complex. J Clin Microbiol. 1992;30 (10):2680-5. [ Links ]
27. Ehrenstein B, Bernards A, Dijkshoorn L, Smidt P, Towner K, Bouvet P, et al. Acinetobacter species identification by using tRNA spacer fingerprinting. J Clin Microbiol. 1996;34 (10): 2414- 20. [ Links ]
28. Dolzani L, Tonin E, Lagatolla C, Prandin L, Bragadin C. Identification of Acinetobacter isolates in the A. calcoaceticus-A. baumannii complex by restriction analysis of the 16S-23S rRNA intergenic-spacer sequences. J Clin Microbiol. 1995;33(5):1108- 13. [ Links ]
29. Chang H, Wei Y, Dijkshoorn L, Vaneechoutte M, Tang C, Chang T. Species-level identification of isolates of the Acinetobacter calcoaceticus-Acinetobacter baumannii complex by sequence analysis of the 16S-23S rRNA gene spacer region. J Clin Microbiol. 2005;43(4):1632-9. [ Links ]
30. La Scola B, Raoult D. Acinetobacter baumannii in human body louse. Emerg Infect Dis. 2004;10(9):1671-3. [ Links ]
31. Richards M, Edwards J, Culver D, Gaynes R. Nosocomial infections in medical intensive care units in the United States. National Nosocomial Infections Surveillance System. Crit Care Med. 1999;27(5):887-92. [ Links ]
32. Fluit A, Jones M, Schmitz F, Acar J, Gupta R, Verhoef J. Antimicrobial susceptibility and frequency of occurrence of clinical blood isolates in Europe from the SENTRY antimicrobial surveillance program, 1997 and 1998. Clin Infect Dis. 2000;30(3):454-60. [ Links ]
33. Gales A, Jones R, Forward K, Linares J, Sader H, Verhoef J. Emerging importance of multidrugresistant Acinetobacter species and Stenotrophomonas maltophilia as pathogens in seriously ill patients: geographic patterns, epidemiological features, and trends in the SENTRY. Antimicrobial Surveillance Program (1997-1999). Clin Infect Dis. 2001;32(Suppl 2):104-13. [ Links ]
34. Jones R. Global aspects of antimicrobial resistance among key bacterial pathogens. Results from the 1997-1999 SENTRY Antimicrobial Program. Clin Infect Dis. 2001;32(Suppl 2):81-156. [ Links ]
35. Sader H, Jones R, Gales A, Silva J, Pignatari A, The SENTRY participants group (latin america). SENTRY Antimicrobial Surveillance Program Report: Latin American and Brazilian results for 1997 through 2001. Braz J Infect Dis. 2004;8(1):25-79. [ Links ]
36. Unal S, Garcia J. Activity of meropenem and comparators against Pseudomonas aeruginosa and Acinetobacter sp. isolated in the MYSTIC Program, 2002-2004. Diagn Microbiol Infect Dis. 2005;53(4):265-271. [ Links ]
37. Bronharo M, Sgambatti S, Silbert S, Gales A, Jones R, Sader H. Resistance trends of Acinetobacter sp. in Latin America and characterization of international dissemination of multi-drug resistant strains: five-year report of the SENTRY Antimicrobial Surveillance Program. Int J Infect Dis. 2004;8:284-291. [ Links ]
38. Gales A, Tognim M, Reis A, Jones R, Sader H. Emergence of an IMP-like metallo-enzyme in an Acinetobacter baumannii clinical strain from a Brazilian teaching hospital. Diagn Microbiol Infect Dis. 2003;45(1):77-9. [ Links ]
39. Sader H, Castanheira M, Mendes R, Toleman M, Walsh T, Jones R. Dissemination and diversity of metallo-beta-lactamases in Latin America: report from the SENTRY Antimicrobial Surveillance Program. Int J Antimicrob Agents. 2005;25(1):57-61. [ Links ]
40. Dalla-Costa L, Coelho J, Souza H, Castro M, Stier C, Bragagnolo K, et al. Outbreak of carbapenem-resistant Acinetobacter baumannii producing the OXA-23 enzyme in Curitiba, Brazil. J Clin Microbiol. 2003;41(7):3403-3406. [ Links ]
41. Villegas M, Kattan J, Correa A, Lolans K, Guzman A, Woodford N, et al. Dissemination of Acinetobacter baumannii clones with OXA-23 carbapenemase in Colombian hospitals. Antimicrob Agents Chemother. 2007;51(6):2001-4. [ Links ]
42. Coelho J, Woodford N, Afzal-Shah M, Livermore D. Occurrence of OXA-58-like carbapenemases in Acinetobacter sp. collected over 10 years in three continents. Antimicrob Agents Chemother. 2006;50(2):756-8. [ Links ]
43. Ovalle M. Vigilancia de Resistencia antimicrobiana a través del software Whonet Informe año 2014. 2015. Minsalud Colombia [internet] Disponible en: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/IA/INS/informe%20-resistenciawhonet%20-2014.pdf#search=acinetobacter%2520baumannii. [ Links ]
44. Hernandez C, Blanco V, Motoa G, Correa A, Maya J, Cadena E, et al. Evolución de la resistencia antimicrobiana de bacilos Gram negativos en unidades de cuidados intensivos en Colombia. Biomédica. 2014;34(Supl. 1):91-100. [ Links ]
45. Falagas M, Bliziotis I, Siempos I. Attributable mortality of Acinetobacter baumannii infections in critically ill patients: a systematic review of matched cohort and case-control studies. Crit Care. 2006;10(2):48. [ Links ]
46. Sunenshine R, Wright M, Maragakis L, Harris A, Song X, Hebden J, et al. Multidrug-resistant Acinetobacter infection mortality rate and length of hospitalization. Emerg Infect Dis. 2007;13(1):97- 103. [ Links ]
47. Maragakis L, Perl T. Acinetobacter baumanii: Epidemiology, Antimicrobial Resistance and Treatment Options. Clin Infec Dis. 2008;46(8):1254-63. [ Links ]
48. Falagas M, Kopterides P, Siempos L. Attributable mortality of Acinetobacter baumanii infection among critically ill patients. Clin Infect Dis. 2006;43:389-90. [ Links ]
49. Owens R, Rice L. Hospital based strategies for combating resistance. Clin Inf Dis. 2006;42(Suppl.4):173-181. [ Links ]
50. Blot S, Vandewoude K, Colardyn F. Nosocomial bacteremia involving Acinetobacter baumanii in critically ill patients: a matched cohort study. Intensive Care Med. 2003;29(3):471-5. [ Links ]
51. Bergogne-Berezin E, Towner K. Acinetobacter sp. as nosocomial pathogens: microbiological, clinical, and epidemiological features. Clin Microbiol Rev. 1996;9(2):148-65. [ Links ]
52. Allen D, Hartman B. Acinetobacter Species. In: Mandell GL, Bennett JE, Dolin R. Douglas and Bennett editors. Principles and Practice of Infectious Diseases. 6th ed. Elsevier Churchill Livingstone, Philadelphia. 2005:2632-5. [ Links ]
53. Chen M, Hsueh P, Lee L, Yu C, Yang P, Luh K. Severe community acquired pneumonia due to Acinetobacter baumannii. Chest. 2001;120(4):1072-7. [ Links ]
54. Mahgoub S, Ahmed J, Glatt A. Underlying characteristics of patients harboring highly resistant Acinetobacter baumannii. Am J Infect Control. 2002;30:386-90. [ Links ]
55. Playford E, Craig J, Iredell J. Carbapenem-resistant Acinetobacter baumanii in intensive care unit patients: risk factors for acquisition, infection and their consequences. J Hosp Infect. 2007;65(3):204-211. [ Links ]
56. Lee S, Kim N, Choi S, Hyong T, Chung J, Woo J, et al. Risk factors for adquisition of Imipenem resistant Acinetobacter baumanii: a case-control study. Antimicrob Agents Chemother. 2004;48(1):224-8. [ Links ]
57. Husni R, Goldstein L, Arroliga A, Hall G, Fatica C, Stoller J, et al. Risk factors for an outbreak of multidrug resistant Acinetobacter nosocomial pneumonia among intubated patients. Chest. 1999;115(5):1378-82. [ Links ]
58. García-Garmendia JL, Ortiz-Leyba C, Garnacho-Montero J, Jiménez-Jiménez F, Pérez-Paredes C, Barrero-Almodóvar A, et al. Risk factors for Acinetobacter baumannii nosocomial bacteremia in critically ill patients: a cohort study. Clin Infect Dis. 2001;33(7):939-46. [ Links ]
59. Gerner-Smidt P. Acinetobacter: epidemiological and taxonomic aspects. APMIS Suppl. 1994;47:1-41. [ Links ]
60. Cefai C, Richards J, Gould FK, McPeake P. An outbreak of Acinetobacter respiratory tract infection resulting from incomplete disinfection of ventilatory equipment. J Hosp Infect. 1990;15(2):177-82. [ Links ]
61. Hirai Y. Survival of bacteria under dry conditions; from a viewpoint of nosocomial infection. J Hosp Infect. 1991;19(3):191- 200. [ Links ]
62. Seifert H, Baginski R, Schulze A, Pulverer G. The distribution of Acinetobacter species in clinical culture materials. Zentralbl Bakteriol. 1993;279(4):544-552. AR [ Links ]
63. Berlau J, Aucken H, Malnick H, Pitt T. Distribution of Acinetobacter species on skin of healthy humans. Eur J Clin Microbiol Infect Dis. 1999;18(3):179-83. [ Links ]
64. Buxton AE, Anderson RL, Werdegar D, Atlas E. Nosocomial respiratory tract infection and colonization with Acinetobacter calcoaceticus. Epidemiologic characteristics. Am J Med. 1978;65(3):507-13. [ Links ]
65. Eveillard M, Kempf M, Belmonte O, Pailhori H, Joly-Guillou M. Reservoirs of Acinetobacter baumannii outside the hospital and potential involvement in emerging human community-acquired infections. Int J Infect Dis. 2013;17(10):802-05. [ Links ]
66. Choi CH, Lee EY, Lee YC, Park TI, Kim HJ, Hyun SH, et al. Outer membrane protein 38 of Acinetobacter baumannii localizes to the mitochondria and induces apoptosis of epithelial cells. Cell Microbiol. 2005;7(8):1127-38. [ Links ]
67. Gaddy JA, Actis LA. Regulation of Acinetobacter baumannii biofilm formation. Future Microbiol. 2009;4(3):273-8. [ Links ]
68. Kim SW, Choi CH, Moon DC, Jin JS, Lee JH, Shin JH, et al. Serum resistance of Acinetobacter baumannii through the binding of factor H to outer membrane proteins. FEMS Microbiol Lett. 2009;301:224-31. [ Links ]
69. Luke N, Sauberan S, Russo T, et al. Identification and characterization of a glycosyltransferase involved in Acinetobacter baumannii lipopolysaccharide core biosynthesis. Infect Immun. 2010;78(5):2017-23. [ Links ]
70. Knapp S, Wieland CW, Florquin S, Pantophlet R, Dijkshoorn L, Tshimbalanga N, et al. Differential roles of CD14 and toll-like receptors 4 and 2 in murine Acinetobacter pneumonia. Am J Respir Crit Care Med. 2006;173(1):122-29. [ Links ]
71. Fregolino E, Gargiulo V, Lanzetta R, Parrilli M, Holst O, Castro C. Identification and structural determination of the capsular polysaccharides from two Acinetobacter baumannii clinical isolates, MG1 and SMAL. Carbohydr Res. 2011;346(7):973-77. [ Links ]
72. Russo TA, Luke NR, Beanan JM, Olson R, Sauberan SL, MacDonald U, et al. The K1 capsular polysaccharide of Acinetobacter baumannii strain 307-0294 is a major virulence factor. Infect Immun. 2011;78(9):3993-4000. [ Links ]
73. Ellis TN, Kuehn MJ. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol Mol Biol Rev. 2010;74(1):81-94. [ Links ]
74. Kwon SO, Gho YS, Lee JC, Kim SI. Proteome analysis of outer membrane vesicles from a clinical Acinetobacter baumannii isolate. FEMS Microbiol Lett. 2009;297(2):150-6. [ Links ]
75. Jin JS, Kwon SO, Moon DC, Gurung M, Lee JH, Kim SI, Lee JC. Acinetobacter baumannii secretes cytotoxic outer membrane protein A via outer membrane vesicles. PLoS ONE. 2011;6(2):e17027. [ Links ]
76. Jacobs AC, Hood I, Boyd KL, Olson PD, Morrison JM, Carson S, et al. Inactivation of phospholipase D diminishes Acinetobacter baumannii pathogenesis. Infect Immun. 2010;78(5):1952-62. [ Links ]
77. Camarena L, Bruno V, Euskirchen G, Poggio S, Snyder M. Molecular mechanisms of ethanol-induced pathogenesis revealed by RNA-sequencing. PLoS Pathog. 2010;6(4):e1000834. [ Links ]
78. Sauvage E, Kerff F, Terrak M, Ayala JA, Charlier P. The penicillin-binding proteins: structure and role in peptidoglycan biosynthesis. FEMS Microbiol Rev. 2008;32(2):234-58. [ Links ]
79. Garnacho-Montero J, Ortiz-Leyba C, Fernández-Hinojosa E, Aldabó-Pallás T, Cayuela A, Marquez-Vácaro JA, et al. Acinetobacter baumannii ventilator-associated pneumonia: epidemiological and clinical findings. Intensive Care Med. 2005;31(5):649-55. [ Links ]
80. Luna CM, Aruj PK. Nosocomial Acinetobacter pneumonia. Respirology. 2007;12(6):787-91. [ Links ]
81. Gaynes R., Edwards JR, National Nosocomial Infections Surveillance System. Overview of nosocomial infections caused by gram-negative bacilli. Clin Infect Dis. 2005;41(6):848-54. [ Links ]
82. Anstey NM, Currie BJ, Hassell M, Palmer D, Dwyer B, Seifert H. Community-acquired bacteremic Acinetobacter pneumonia in tropical Australia is caused by diverse strains of Acinetobacter baumannii, with carriage in the throat in at-risk groups. J Clin Microbiol. 2002;40(2):685-6. [ Links ]
83. Leung WS, Chu CM, Tsang KY, Lo FH, Lo KF, Ho PL. Fulminant community-acquired Acinetobacter baumannii pneumonia as a distinct clinical syndrome. Chest. 2006;129(1):102-9. [ Links ]
84. Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis. 2004;39:309-17. [ Links ]
85. Trottier V, Segura PG, Namias N, King D, Pizano LR, Schulman CI. Outcomes of Acinetobacter baumannii infection in critically ill burned patients. J Burn Care Res. 2007;28(2):248-54. [ Links ]
86. Metan G, Alp E, Aygen B, Sumerkan B. Carbapenem-resistant Acinetobacter baumannii: an emerging threat for patients with post-neurosurgical meningitis. Int J Antimicrob Agents. 2007;29(1):112-3. [ Links ]
87. Nunez ML, Martinez-Toldos MC, Bru M, Simarro E, Segovia M, Ruiz J. Appearance of resistance to meropenem during the treatment of a patient with meningitis by Acinetobacter. Scand J Infect Dis. 1998;30(40):421-3. [ Links ]
88. O'Neill E, Humphreys H, Phillips J, Smyth EG. Third-generation cephalosporin resistance among Gram-negative bacilli causing meningitis in neurosurgical patients: significant challenges in ensuring effective antibiotic therapy. J Antimicrob Chemother. 2006;57(2):356-9. [ Links ]
89. Menon T, Shanmugasundaram S, Nandhakumar B, Nalina K, Balasubramaniam S. Infective endocarditis due to Acinetobacte baumannii complex a case report. Indian J Pathol Microbiol. 2006;49(4):576-8. [ Links ]
90. Olut A, Erkek E. Early prosthetic valve endocarditis due to Acinetobacter baumannii: a case report and brief review of the literature. Scand J Infect Dis. 2005;37(11-12):919-21. [ Links ]
91. Rizos I, Papathanasiou S, Rigopoulos A, Barbetseas J, Stefanadis C, Tsiodras S. Prosthetic valve endocarditis due to Acinetobacter spp: a rare case and literature review. Am J Med Sci. 2007;333(3):197-9. [ Links ]
92. Starakis I, Blikas A, Siagris D, Marangos M, Karatza C, Bassaris H. Prosthetic valve endocarditis caused by Acinetobacter lwoffi: a case report and review. Cardiol Rev. 2006;14:45-9. [ Links ]
93. Corrigan KM, Harmis NY, Willcox MD. Association of Acinetobacter species with contact lens-induced adverse responses. Cornea. 2001;20(5):463-6. [ Links ]
94. Kau HC, Tsai CC, Kao SC, Hsu WM, Liu JH. Corneal ulcer of the side port after phacoemulsification induced by Acinetobacter baumannii. J Cataract Refract Surg. 2002;28(5):895-7. [ Links ]
95. Levy J, Oshry T, Rabinowitz R, Lifshitz T. Acinetobacter corneal graft ulcer and endophthalmitis: report of two cases. Can J Ophthalmol. 2005;40(1):79-82. [ Links ]
96. Lockhart SR, Abramson MA, Beekmann SE, Gallagher G, Riedel S, Diekema DJ, et al. Antimicrobial resistance among gram-negative bacilli causing infections in intensive care unit patients in the United States between 1993 and 2004. J Clin Microbiol. 2007;45(10):3352-9. [ Links ]
97. Seifert H, Baginski R, Schulze A, Pulverer G. Antimicrobial susceptibility of Acinetobacter species. Antimicrob Agents Chemother. 1993;37(4):750-3. [ Links ]
98. Afzal-Shah M, Woodford N, Livermore DM. Characterization of OXA-25, OXA-26, and OXA-27, molecular class D beta-lactamases associated with carbapenem resistance in clinical isolates of Acinetobacter baumannii. Antimicrob Agents Chemother. 2001;45(2):583-8. [ Links ]
99. Rice L. Challenges in indentifying new antimicrobial agents effective for treating infections with Acinetobacter baumanii and Pseudomonas aeruginosa. Clin Infect Dis. 2006;43(2):S100-5. [ Links ]
100. Bou G, Cerveró G, Domínguez MA, Quereda C, Martínez- Beltrán J. Characterization of a nosocomial outbreak caused by a multiresistant Acinetobacter baumannii strain with a carbapenem-hydrolyzing enzyme: high-level carbapenem resistance in A. baumannii is not due solely to the presence of beta-lactamases. J Clin Microbiol. 2000;38(9):3299-305. [ Links ]
101. Fernandez-Cuenca F, Martínez-Martínez L, Conejo MC, Ayala JA, Perea EJ, Pascual A. Relationship between beta-lactamase production, outer membrane protein and penicillin-binding protein profiles on the activity of carbapenems against clinical isolates of Acinetobacter baumannii. J Antimicrob Chemother. 2003;51(3):565-74. [ Links ]
102. Nordmann P, Poirel L. Emerging carbapenemases in gram-negative aerobes. Clin Microbiol Infect. 2002;8:321-31. [ Links ]
103. Weldhagen G, Poirel L, Nordmann P. Ambler class A extended-spectrum beta-lactamases in Pseudomonas aeruginosa: novel developments and clinical impact. Antimicrob Agents Chemother. 2003;47(8):2385-92. [ Links ]
104. Poirel L, Menuteau O, Agoli N, Catton C, Nordmann P. Outbreak of extended-spectrum β -lactamase VEB-1-producing isolates of Acinetobacter baumannii in a French hospital. J Clin Microbiol. 2003;41:3542-7. [ Links ]
105. Danes C, Navia M, Ruiz J, Marco F, Jurado A, Jimenez de Anta M, Vila J. Distribution of beta-lactamases in Acinetobacter baumannii clinical isolates and the effect of Syn 2190 (AmpC inhibitor) on the MICs of different beta-lactam antibiotics. J Antimicrob Chemother. 2002;50(2):261-4. [ Links ]
106. Vila J, Marcos A, Marco F, Abdalla S, Vergara Y, Reig R, Gomez R, Jimenez de Anta T. In vitro antimicrobial production of beta-lactamases, aminoglycoside-modifying enzymes, and chloramphenicol acetyltransferase by and susceptibility of clinical isolates of Acinetobacter baumannii. Antimicrob. Agents Chemother. 1993;37(1):138-41. [ Links ]
107. Poirel L, Nordmann P. Carbapenem resistance in Acinetobacter baumannii: mechanisms and epidemiology. Clin Microbiol Infect. 2006;12(9):826-36. [ Links ]
108. Cornaglia G, Riccio M, Mazzariol A, Lauretti L, Fontana R, Rossolini G. Appearance of IMP-1 metallo-beta-lactamase in Europe. Lancet. 1999;353(9156):899-900. [ Links ]
109. Da Silva G, Correia M, Vital C, Ribeiro G, Sousa J, Leitao R, Peixe L, Duarte A. Molecular characterization of bla(IMP-5), a new integron-borne metallo-beta-lactamase gene from an Acinetobacterbaumannii nosocomial isolate in Portugal. FEMS Microbiol Lett. 2002;215(1):33-9. [ Links ]
110. Lee K, Lee W, Uh Y, Ha G, Cho J, Chong Y. VIM- and IMP-type metallo-beta-lactamase-producing Pseudomonas sp. and Acinetobacter sp. in Korean hospitals. Emerg Infect Dis. 2003;9(7):868-71. [ Links ]
111. Lim Y, Shin K, Kim J. Distinct antimicrobial resistance patterns and antimicrobial resistance-harboring genes according to genomic species of Acinetobacter isolates. J Clin Microbiol. 2007;45(3):902-5. [ Links ]
112. Tsakris A, Ikonomidis A, Pournaras S, Tzouvelekis L, Sofianou D, Legakis N, Maniatis A. VIM-1 metallo-beta-lactamase in Acinetobacter baumannii. Emerg Infect Dis. 2006;12(6):981-3. [ Links ]
113. Yum J, Yi K, Lee H, Yong D, Lee K, Kim J, Rossolini G, Chong Y. Molecular characterization of metallo-beta-lactamase- producing Acinetobacter baumannii and Acinetobacter genomospecies 3 from Korea: identification of two new integrons carrying the blaVIM-2 gene cassettes. J Antimicrob Chemother. 2002;49(5):837-40. [ Links ]
114. Lee K, Yum J, Yong D, Lee H, Kim H, Docquier J, Rossolini G, Chong Y. Novel acquired metallo-beta-lactamase gene, bla(SIM-1), in a class 1 integron from Acinetobacter baumannii clinical isolates from Korea. Antimicrob Agents Chemother. 2005;49(11):4485- 91. [ Links ]
115. Hujer K, Hamza N, Hujer A, Perez F, Helfand M, Bethel C, Thomson J, Anderson V, Barlow M, Rice L, Tenover F, Bonomo R. Identification of a new allelic variant of the Acinetobacter baumannii cephalosporinase, ADC-7 beta-lactamase: defining a unique family of class C enzymes. Antimicrob Agents Chemother. 2005;49(7):2941-8. [ Links ]
116. Bou G, Martinez J. Cloning, nucleotide sequencing, and analysis of the gene encoding an AmpC beta-lactamase in Acinetobacter baumannii. Antimicrob Agents Chemother. 2000;44:428-32. [ Links ]
117. Corvec S, Caroff N, Espaze E, Giraudeau C, Drugeon H, Reynaud A. AmpC cephalosporinase hyperproduction in Acinetobacter baumannii clinical strains. J Antimicrob Chemother. 2003;52(4):629-35. [ Links ]
118. Paton R, Miles R, Hood J, Amyes S. ARI-1: β-lactamase-mediated imipenem resistance in Acinetobacter baumannii. Int J Antimicrob Agents. 1993;2(2):81-8. [ Links ]
119. Donald H, Scaife W, Amyes S, Young H. Sequence analysis of ARI-1, a novel OXA beta-lactamase, responsible for imipenem resistance in Acinetobacter baumannii 6B92. Antimicrob Agents Chemother. 2000;44(1):196-9. [ Links ]
120. Scaife W, Young H, Paton R, Amyes S. Transferable imipenem-resistance in Acinetobacter species from a clinical source. J Antimicrob Chemother. 1995;36(3):585-6. [ Links ]
121. Afzal-Shah M, Woodford N, Livermore D. Characterization of OXA-25, OXA-26, and OXA-27, molecular class D beta-lactamases associated with carbapenem resistance in clinical isolates of Acinetobacter baumannii. Antimicrob Agents Chemother. 2001;45(2):583-8. [ Links ]
122. Brown S, Amyes S. OXA (beta)-lactamases in Acinetobacter:the story so far. J Antimicrob Chemother. 2006;57(1):1-3. [ Links ]
123. Bou G, Oliver A, Martinez J. OXA-24, a novel class D beta-lactamase with carbapenemase activity in an Acinetobacter baumannii clinical strain. Antimicrob. Agents Chemother. 2000;44(6):1556-61. [ Links ]
124. Da Silva G, Quinteira S, Bertolo E, Sousa J, Gallego L, Duarte A, Peixe L. Long-term dissemination of an OXA-40 carbapenemase producing Acinetobacter baumannii clone in the Iberian Peninsula. J Antimicrob Chemother. 2004;54:255-8. [ Links ]
125. Bertini A, Giordano A, Varesi P, Villa L, Mancini C, Carattoli A. First report of the carbapenem-hydrolyzing oxacillinase OXA-58 in Acinetobacter baumannii isolates in Italy. Antimicrob Agents Chemother. 2006;50:2268-9. [ Links ]
126. Bogaerts P, Naas T, Wybo I, Bauraing C, Soetens O, Pierard D, Nordmann P, Glupczynski Y. Outbreak of infection by carbapenem-resistant Acinetobacter baumannii producing the carbapenemase OXA-58 in Belgium. J Clin Microbiol. 2006;44(11):4189-92. [ Links ]
127. Poirel L, Marque S, Heritier C, Segonds C, Chabanon G, Nordmann P. OXA-58, a novel class D β-lactamase involved in resistance to carbapenems in Acinetobacter baumannii. Antimicrob Agents Chemother. 2005;49(1):202-8. [ Links ]
128. Marque S, Poirel L, Heritier C, Brisse S, Blasco M, Filip R, Coman G, Naas T, Nordmann P. Regional occurrence of plasmidmediated carbapenem-hydrolyzing oxacillinase OXA-58 in Acinetobacter spp. in Europe. J Clin Microbiol. 2005;43:4885-8. [ Links ]
129. Brown S, Young H, Amyes S. Characterisation of OXA-51, a novel class D carbapenemase found in genetically unrelated clinical strains of Acinetobacter baumannii from Argentina. Clin Microbiol Infect. 2005;11(1):15-23. [ Links ]
130. Heritier C, Poirel L, Fournier P, Claverie J, Raoult D, Nordmann P. Characterization of the naturally occurring oxacillinase of Acinetobacter baumannii. Antimicrob Agents Chemother. 2005;49(10):4174-9. [ Links ]
131. Turton J, Woodford N, Glover J, Yarde S, Kaufmann M, Pitt T. Identification of Acinetobacter baumannii by detection of the bla- 0xa-51-like carbapenemase gene intrinsic to this species. J Clin Microbiol. 2006;44(8):2974-6. [ Links ]
132. Costa S, Woodcock J, Gill M, Wise R, Barone A, Caiaffa H, Levin A. Outer-membrane proteins pattern and detection of betalactamases in clinical isolates of imipenem-resistant Acinetobacter baumannii from Brazil. Int J Antimicrob Agents. 2000;13(3):175-82. [ Links ]
133. Mussi M, Limansky A, Viale A. Acquisition of resistance to carbapenems in multidrug-resistant clinical strains of Acinetobacter baumannii: natural insertional inactivation of a gene encoding a member of a novel family of beta-barrel outer membrane proteins. Antimicrob Agents Chemother. 2005;49(4):1432-40. [ Links ]
134. Heritier C, Poirel L, Lambert T, Nordmann P. Contribution of acquired carbapenem-hydrolyzing oxacillinases to carbapenem resistance in Acinetobacter baumannii. Antimicrob Agents Chemother. 2005;49(12):3198-202. [ Links ]
135. Gehrlein M, Leying H, Cullmann W, Wendt S, Opferkuch W. Imipenem resistance in Acinetobacter baumanii is due to altered penicillinbinding proteins. Chemotherapy. 1991;37(6):405-12. [ Links ]
136. Limansky A, Mussi M, Viale A. Loss of a 29-kilodalton outer membrane protein in Acinetobacter baumannii is associated with imipenem resistance. J Clin Microbiol. 2002;40(12):4776-8. [ Links ]
137. Siroy A, Molle V, Lemaitre C, Vallenet D, Pestel M, Cozzone A, Jouenne T. Channel formation by CarO, the carbapenem resistance-associated outer membrane protein of Acinetobacter baumannii. Antimicrob Agents Chemother. 2005;49(12):4876- 83. [ Links ]
138. Quale J, Bratu S, Landman D, Heddurshetti R. Molecular epidemiology and mechanisms of carbapenem resistance in Acinetobacter baumannii endemic in New York City. Clin Infect Dis. 2003;37(2):214-20. [ Links ]
139. Bou G, Cervero G, Dominguez M, Quereda C, Martinez J. Characterization of a nosocomial outbreak caused by a multiresistant Acinetobacter baumannii strain with a carbapenem-hydrolyzing enzyme: high-level carbapenem resistance in A. baumannii is not due solely to the presence of beta-lactamases. J Clin Microbiol. 2000;38(8):3299-305. [ Links ]
140. Gribun A, Nitzan Y, Pechatnikov I, Hershkovits G, Katcoff D. Molecular and structural characterization of the HMP-AB gene encoding a pore-forming protein from a clinical isolate of Acinetobacter baumannii. Curr Microbiol. 2003;47(5):434-43. [ Links ]
141. Clark R. Imipenem resistance among Acinetobacter baumannii: association with reduced expression of a 33-36 kDa outer membrane protein. J Antimicrob Chemother. 1996;38(2):245-51. [ Links ]
142. Vila J, Marti S, Sanchez J. Porins, efflux pumps and multidrug resistance in Acinetobacter baumannii. J Antimicrob Chemother. 2007;59(6):1210-5. [ Links ]
143. Fournier PE, Vallenet D, Barbe V, Audic S, Ogata H, Poirel L, et al. Comparative genomics of multidrug resistance in Acinetobacter baumannii. PLoS Genet. 2006;2(1):7. [ Links ]
144. Higgins P, Wisplinghoff H, Stefanik D, Seifert H. Selection of topoisomerase mutations and overexpression of adeB mRNA transcripts during an outbreak of Acinetobacter baumannii. J Antimicrob Chemother. 2004;54(4):821-23. [ Links ]
145. Magnet S, Courvalin P, Lambert T. Resistance-nodulation-cell division-type efflux pump involved in aminoglycoside resistance in Acinetobacter baumannii strain BM4454. Antimicrob Agents Chemother. 2001;45(12):3375-380. [ Links ]
146. Marchand I, Damier L, Courvalin P, Lambert T. Expression of the RND-type efflux pump AdeABC in Acinetobacter baumannii is regulated by the AdeRS two-component system. Antimicrob Agents Chemother. 2004;48(9):3298-304. [ Links ]
147. Nemec A, Maixnerova M, Van der Reijden TJ, Van den Broek PJ, Dijkshoorn L. Relationship between the AdeABC efflux system gene content, netilmicin susceptibility and multidrug resistance in a genotypically diverse collection of Acinetobacter baumannii strains. J Antimicrob Chemother. 2007;60(3):483-9. [ Links ]
148. Towner K. Clinical importance and antibiotic resistance of Acinetobacter spp. Proceedings of a symposium held on 4 - 5 November 1996 at Eilat, Israel. J Med Microbiol. 1997;46(9):721- 46. [ Links ]
149. Doi Y, Adams J, Yamane K, Paterson D. Identification of 16S rRNA methylase-producing Acinetobacter baumannii clinical strains in North America. Antimicrob Agents Chemother. 2007;51(11):4209-10. [ Links ]
150. Lee H, Yong D, Yum JH, Roh KH, Lee K, Yamane K, et al. Dissemination of 16S rRNA methylase-mediated highly amikacin-resistant isolates of Klebsiella pneumoniae and Acinetobacter baumannii in Korea. Diagn. Microbiol Infect Dis. 2006;56(3):305- 12. [ Links ]
151. Yamane K, Wachino J, Doi Y, Kurokawa H, Arakawa Y. Global spread of multiple aminoglycoside resistance genes. Emerg Infect Dis. 2005;11(6):951-3. [ Links ]
152. Doi Y, Arakawa Y. 16S ribosomal RNA methylation: emerging resistance mechanism against aminoglycosides. Clin Infect Dis. 2007;45:88-94. [ Links ]
153. Su X, Chen J, Mizushima T, Kuroda T, Tsuchiya T. AbeM, an H+-coupled Acinetobacter baumannii multidrug efflux pump belonging to the MATE family of transporters. Antimicrob Agents Chemother. 2005;49(10):4362-64. [ Links ]
154. Seward R, Owner T. Molecular epidemiology of quinolone resistance in Acinetobacter spp. Clin Microbiol Infect. 1998;4:248-54. [ Links ]
155. Ribera A, Ruiz J, Jiminez de Anta MT, Vila J. Effect of an efflux pump inhibitor on the MIC of nalidixic acid for Acinetobacter baumannii and Stenotrophomonas maltophilia clinical isolates. J Antimicrob Chemother. 2002;49(4):697-8. [ Links ]
156. Fluit AC, Florijn A, Verhoef J, Milatovic D. Presence of tetracycline resistance determinants and susceptibility to tigecycline and minocycline. Antimicrob Agents Chemother. 2005;49(4):1636- 1638. [ Links ]
157. Guardabassi L, Dijkshoorn L, Collard JM, Olsen JE, Dalsgaard A. Distribution and in-vitro transfer of tetracycline resistance determinants in clinical and aquatic Acinetobacter strains. J Med Microbiol. 2000;49(10):929-36. [ Links ]
158. Ribera A, Roca I, Ruiz J, Gibert I, Vila J. Partial characterization of a transposon containing the tet(A) determinant in a clinical isolate of Acinetobacter baumannii. J Antimicrob Chemother. 2003;52(3):477-80. [ Links ]
159. Ribera A, Ruiz J, Vila J. Presence of the Tet M determinant in a clinical isolate of Acinetobacter baumannii. Antimicrob Agents Chemother. 2003;47(7):2310-12. [ Links ]
160. Peleg A, Adams J, Paterson D. Tigecycline efflux as a mechanism for nonsusceptibility in Acinetobacter baumannii. Antimicrob Agents Chemother. 2007;51(6):2065-69. [ Links ]
161. Ruzin A, Keeney D, Bradford PA. AdeABC multidrug efflux pump is associated with decreased susceptibility to tigecycline in Acinetobacter calcoaceticus-Acinetobacter baumannii complex. J Antimicrob Chemother. 2007;59(5):1001-4. [ Links ]
162. Reis A, Luz D, Tognim M, Sader H, Gales A. Polymyxin-Resistant Acinetobacter spp. isolates: What is Next? Emerg Infect Dis. 2003;9(8):1025-7. [ Links ]
163. Gales AC, Jones RN, Sader HS. Global assessment of the antimicrobial activity of polymyxin B against 54,731 clinical isolates of gram-negative bacilli: report from the SENTRY antimicrobial surveillance programme (2001-2004). Clin Microbiol Infect. 2006;12(4):315-321. [ Links ]
164. Conrad RS, Galanos C. Fatty acid alterations and polymyxin B binding by lipopolysaccharides from Pseudomonas aeruginosa adapted to polymyxin B resistance. Antimicrob Agents Chemother. 1989;33(10):1724-8. [ Links ]
165. Peterson AA, Fesik SW, McGroarty EJ. Decreased binding of antibiotics to lipopolysaccharides from polymyxin-resistant strains of Escherichia coli and Salmonella typhimurium. Antimicrob Agents Chemother. 1987;31:230-7. [ Links ]
166. Nicas TI, Hancock RE. Outer membrane protein H1 of Pseudomonas aeruginosa: involvement in adaptive and mutational resistance to ethylenediaminetetraacetate, polymyxin B, and gentamicin. J Bacteriol. 1980;143(2):872-8. [ Links ]
167. Young ML, Bains M, Bell A, Hancock RE. Role of Pseudomonas aeruginosa outer membrane protein OprH in polymyxin and gentamicin resistance: isolation of an OprH-deficient mutant by gene replacement techniques. Antimicrob Agents Chemother. 1992;36(11):2566-2568. [ Links ]
168. Young LS, Sabel AL, Price CS. Epidemiologic, clinical, and economic evaluation of an outbreak of clonal multidrug-resistant Acinetobacter baumanii infection in a surgical intensive care unit. Infect Control Hosp Epidemiol. 2007;28(11):1247-54. [ Links ]
169. Hsueh PR, Teng LJ, Chen CY, Chen WH, Yu CJ, Ho SW, et al. Pandrug-resistant Acinetobacter baumannii causing nosocomial infections in a university hospital, Taiwan. Emerg Infect Dis. 2002;8(8):827-32. [ Links ]
170. Lee CM, Lim HK, Liu CP, Tseng HK. Treatment of pan-drug resistant Acinetobacter baumannii. Scand J Infect Dis. 2005;37(3):195-9. [ Links ]
171. Urban C, Go E, Mariano N, Rahal J. Interaction of sulbactam, clavulanic acid and tazobactam with penicillin-binding proteins of imipenem-resistant and -susceptible Acinetobacter baumannii. FEMS Microb Lett. 1995;125:193-7. [ Links ]
172. Brauers J, Frank U, Kresken M, Rodloff AC, Seifert H. Activities of various beta-lactams and beta-lactam/beta-lactamase inhibitor combinations against Acinetobacter baumannii and Acinetobacter DNA group 3 strains. Clin Microbiol Infect. 2005;11(1):24-30. [ Links ]
173. Higgins PG, Wisplinghoff H, Stefanik D, Seifert H. In vitro activities of the beta-lactamase inhibitors clavulanic acid, sulbactam, and tazobactam alone or in combination with beta-lactams against epide miologically characterized multidrug-resistant Acinetobacter baumannii strains. Antimicrob Agents Chemother. 2004;48(5):1586-92. [ Links ]
174. Urban C, Go E, Mariano N, Berger BJ, Avraham I, Rubin D, et al. Effect of sulbactam on infections caused by imipenem-resistant Acinetobacter calcoaceticus biotype anitratus. J Infect Dis. 1993;167(2):448-51. [ Links ]
175. Smolyakov R, Borer A, Riesenberg K, Schlaeffer F , Alkan M, Porath A, et al. Nosocomial multi-drug resistant Acinetobacter baumannii bloodstream infection: risk factors and outcome with ampicillin-sulbactam treatment. J Hosp Infect. 2003;54(1):2-8. [ Links ]
176. Jiménez-Mejías ME, Pachón J, Becerril B, Palomino-Nicás J, Rodríguez-Cobacho A, Revuelta M. Treatment of multidrug-resistant Acinetobacter baumannii meningitis with ampicillin/ sulbactam. Clin Infect Dis. 1997;24(5):932-35. [ Links ]
177. Levin AS, Levy CE, Manrique AE, Medeiros EA, Costa SF. Severe nosocomial infections with imipenem-resistant Acinetobacter baumannii treated with ampicillin/sulbactam. Int J Antimicrob Agents. 2003;21(1):58-62. [ Links ]
178. Betrosian AP, Frantzeskaki F, Xanthaki A, Georgiadis G. High-dose ampicillin-sulbactam as an alternative treatment of late-onset VAP from multidrug-resistant Acinetobacter baumannii. Scand J Infect Dis. 2007;39(1):38-43. [ Links ]
179. Wood GC, Hanes SD, Croce MA, Fabian TC, Boucher BA. Comparison of ampicillin-sulbactam and imipenem-cilastatin for the treatment of acinetobacter ventilator-associated pneumonia. Clin Infect Dis. 2002;34(11):1425-30. [ Links ]
180. Fraenkel CJ, Ullberg M, Bernander S, Ericson E, Larsson P, Rydberg J, et al. In vitro activities of three carbapenems against recent bacterial isolates from severely ill patients at Swedish hospitals. Scand J Infect Dis. 2006;38(10):853-9. [ Links ]
181. Ikonomidis A, Pournaras S, Maniatis A, Legakis N, Tsakris A. Discordance of meropenem versus imipenem activity against Acinetobacter baumannii. Int J Antimicrob Agents. 2006;28(4):376-7. [ Links ]
182. Jones RN, Deshpande L, Fritsche TR, Sader HS. Determination of epidemic clonality among multidrug-resistant strains of Acinetobacter sp. and Pseudomonas aeruginosa in the MYSTIC Programme (USA, 1999-2003). Diagn Microbiol Infect Dis. 2004;49(3):211-6. [ Links ]
183. Lesho E, Wortmann G, Moran K, Craft D. Fatal Acinetobacter baumanniiinfection with discordant carbapenem susceptibility. Clin Infect Dis. 2005;41:758-9. [ Links ]
184. Paterson D, Depestel D. Doripenem. Clin Infect Dis. 2009;49:291- 298. [ Links ]
185. Murray CK, Hospenthal DR. Treatment of multidrug resistant Acinetobacter. Curr Opin Infect Dis. 2005;18(6):502-6. [ Links ]
186. Gounden R, Bamford C, van Zyl-Smit R, Cohen K, Maartens G. Safety and effectiveness of colistin compared with tobramycin for multidrug resistant Acinetobacter baumannii infections. BMC Infect Dis. 2009;9:26. [ Links ]
187. Bishburg E, Bishburg K. Minocycline an old drug for a new century: emphasis on methicillin-resistant Staphylococcus aureus (MRSA) and Acinetobacter baumannii. Int J Antimicrob Agents. 2009;34(5):395-401. [ Links ]
188. Wood G, Hanes S, Boucher B, Croce M, Fabian T. Tetracyclines for treating multidrugresistant Acinetobacter baumannii ventilatorassociated pneumonia. Intensive Care Med. 2003;29:2072-6. [ Links ]
189. Fluit A, Florijn A, Verhoef J, Milatovic D. Presence of tetracycline resistance determinants and susceptibility to tigecycline and minocycline. Antimicrob Agents Chemother. 2005;49:1636-8. [ Links ]
190. Fritsche T, Strabala P, Sader H, Jones R. Activity of tigecycline tested against non-fermentative gram-negative bacilli other than P. aeruginosa. 42nd Annual Meeting of IDSA; 2004; Boston, USA. Abstract 323. [ Links ]
191. Poulakou G, Kontopidou F, Paramythiotou E, Kompoti M, Katsiari M, Manias E, et al. Tigecycline in the treatment of infections from multi-drug resistant gram-negative pathogens. J Infect. 2009;58(4):273-84. [ Links ]
192. Peleg A, Potoski B, Rea R, Adams J, Sethi J, Capitano B, et al. Acinetobacter baumannii bloodstream infection while receiving tigecycline: a cautionary report. J Antimicrob Chemother. 2007;59(1):128-31. [ Links ]
193. Livermore D. Tigecycline: what is it, and where should it be used?. J Antimicrob Chemother. 2005;56:611-4. [ Links ]
194. Anthony K, Fishman N, Linkin D, Gasink L, Edelstein P, Lautenbach E. Clinical and microbiological outcomes of serious infections with multidrug-resistant gram-negative organisms treated with tigecicline. Clin Infect Dis. 2008;46:567-70. [ Links ]
195. Li J, Nation R, Milne R, Turnidge J, Coulthard K. Evaluation of colistin as an agent against multi-resistant Gram-negative bacteria. Int J Antimicrob Agents. 2005;25:11-25. [ Links ]
196. Falagas M, Kasiakou S. Colistin: The revival of polymyxins for the management of multidrugresistant gram-negative bacterial infections. Clin Infect Dis. 2005;40:1333-41. [ Links ]
197. Evans M, Feola D, Rapp R. Polymyxin B sulfate and colistin: old antibiotics for emerging multiresistant gram-negative bacteria. Ann Pharmacother. 1999;33:960-7. [ Links ]
198. Levin A, Barone A, Penco J, Santos M, Marinho I, Arruda E, et al. Intravenous colistin as therapy for nosocomial infections caused by multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii. Clin Infect Dis. 1999;28:1008-11. [ Links ]
199. Kallel H, Bahloul M, Hergafi L, Akrout M, Ketata W, Chelly H, et al. Colistin as a salvage therapy for nosocomial infections caused by multidrug-resistant bacteria in the ICU. Int J Antimicrob Agents. 2006;28:366-9. [ Links ]
200. Shirawi N, Memish Z, Cherfan A, Shimemeri A. Post-neurosurgical meningitis due to multidrug resistant Acinetobacter treated with intratecal colistina: case report and review of the literature. J Chemother. 2006;18:554-558. [ Links ]
201. Garnacho J, Ortiz C, Jimenez F, Barrero A, García J, Bernabeu M, et al. Treatment of multidrug-resistant Acinetobacter baumannii ventilator-associated pneumonia (VAP) with intravenous colistin: a comparison with imipenem-susceptible VAP. Clin Infect Dis. 2003;36:1111-8. [ Links ]
202. Linden P, Paterson D. Parenteral and inhaled colistin for treatment of ventilator-associated pneumonia. Clin Infect Dis. 2006;43(Suppl 2):89-94. [ Links ]
203. Kasiakou S, Michalopoulos A, Soteriades E, Samonis G, Sermaides G, Falagas M. Combination therapy with intravenous colistin for management of infections due to multidrug-resistant gram-negative bacteria in patients without cystic fibrosis. Antimicrob Agents Chemother. 2005;49:3136-46. [ Links ]
204. Katragkou A, Roilides E. Successful treatment of multidrug-resistant Acinetobacter baumannii central nervous system infections with colistin. J Clin Microbiol. 2005;43:4916-7. [ Links ]
205. Fulnecky E, Wright D, Scheld W, Kanawati L, Shoham S. Amikacin and colistin for treatment of Acinetobacter baumannii meningitis. J Infect. 2005;51:249-51. [ Links ]
206. Benifla M, Zucker G, Cohen A, Alkan M. Successful treatment of Acinetobacter meningitis with intrathecal polymyxin E. J Antimicrob Chemother. 2004;54:290-2. [ Links ]
207. Al S, Memish Z, Cherfan A, Al S. Post-neurosurgical meningitis due to multidrug-resistant Acinetobacter baumanii treated with intrathecal colistin: case report and review of the literature. J Chemother. 2006;18:554-8. [ Links ]
208. Ng J, Gosbell I, Kelly J, Boyle M, Ferguson J. Cure of multiresistant Acinetobacter baumannii central nervous system infections with intraventricular or intrathecal colistin: case series and literature review. J Antimicrob Chemother. 2006;58:1078-81. [ Links ]
209. Falagas M, Bliziotis I, Tam V. Intraventricular or intrathecal use of polymyxins in patients with gram-negative meningitis: a systematic review of the available evidence. Int J Antimicrob Agents. 2007;29:9-25. [ Links ]
210. Alvarez C, Cortes J, Ovalle M. Boletin GREBO 2015. GREBO [Internet]. 2015. Disponible en: http://www.grebo.org/grebo_site/jgrebo/documentos/Boletin_Grebo_2015. [ Links ]pdf
211. Rahal J. Novel antibiotic combinations against infections with almost completely resistant Pseudomonas aeruginosa and Acinetobacter species. Clin Infect Dis. 2006;43(Suppl 2):S95-9. [ Links ]
212. Chait R, Craney A, Kishony R. Antibiotic interactions that select against resistance. Nature. 2007;446:668-71. [ Links ]
213. Montero A, Ariza J, Corbella X, Doménech A, Cabellos C, Ayats J, et al. Antibiotic combinations for serious infections caused by carbapenem- resistant Acinetobacter baumanii in a mouse pneumonia model. J Antimicrob Chemother. 2004;54:1085-91. [ Links ]
214. Saballs M, Pujol M, Tubau F, Peña C, Montero A, Domínguez M, et al. Rifampicin/imipenem combination in the treatment of carbapenem-resistant Acinetobacter baumanii infections. J Antimicrob Chemother. 2006;58:697-700. [ Links ]
215. Bernabeu M, Pichardo C, García A, Pachón M, Ibáñez J, Jiménez M, et al. Pharmacokinetic/ pharmacodynamic assessment of the in-vivo efficacy of Imipenem alone or in combination with amikacina for the treatment of experimental multiresistant Acinetobacter baumanii pneumonia. Clin Microbiol Infect. 2005;11:319-25. [ Links ]
216. Ermertcan S, Hosgor M, Tunger O, Cosar G. Investigation of synergism of meropenem and ciprofloxacin against Pseudomonas aeruginosa and Acinetobacter strains isolated from intensive care unit infections. Scand J Infect Dis. 2001;33:818-21. [ Links ]
217. Joly-Guillou M, Wolff M, Farinotti R, Bryskier A, Carbon C. In vivo activity of levofloxacin alone or in combination with imipenem or amikacin in a mouse model of Acinetobacter baumannii pneumonia. J Antimicrob Chemother. 2000;46:827-30. [ Links ]
218. Sader H, Rhomberg P, Jones R. In vitro activity of beta-lactam antimicrobial agents in combination with aztreonam tested against metallo-beta-lactamase-producing Pseudomonas aeruginosa and Acinetobacter baumannii. J Chemother. 2005;17:622-7. [ Links ]
219. Howard A, O'Donoghue M, Feeney A. Acinetobacter baumannii: an emerging opportunistic pathogen. Virulence. 2012;3:243-50. [ Links ]
220. Mihu M, Martinez L. Novel therapies for treatment of multi-drug resistant Acinetobacter baumannii skin infections. Virulence. 2011;2:97-102. [ Links ]
221. Coates A, Hu Y. Novel approaches to developing new antibiotics for bacterial infections. Br J Pharmacol. 2007;152:1147-54. [ Links ]
222. Poole K. Overcoming multidrug resistance in gramnegative bacteria. Curr Opin Investig Drugs. 2003;4:128-39. [ Links ]
223. Wang J, Hu B, Xu M, Yan Q, Liu S, Zhu X, et al. Use of bacteriophage in the treatment of experimental animal bacteremia from imipenem-resistant Pseudomonasaeruginosa. Int J Mol Med. 2006;17:309-17. [ Links ]
224. Yang H, Liang L, Lin S, Jia S. Isolation and characterization of a virulent bacteriophage AB1 of Acinetobacter baumannii. BMC Microbiol. 2010;10:131. [ Links ]
225. Shankar R, He L, Szilagyi A, Muthu K, Gamelli R, Filutowicz M, et al. A novel antibacterial gene transfer treatment for multidrug-resistant Acinetobacter baumannii-induced burn sepsis. J Burn Care Res. 2007;28:6-12. [ Links ]
226. Dadachova E, Burns T, Bryan R, Apostolidis C, Brechbiel M, Nosanchuk J, et al. Feasibility of radioimmunotherapy of experimental pneumococcal infection. Antimicrob Agents Chemother. 2004;48:1624-9. [ Links ]
227. Dadachova E, Nakouzi A, Bryan R, Casadevall A. Ionizing radiation delivered by specific antibody is therapeutic against a fungal infection. Proc Natl Acad Sci U S A. 2003;100:10942-7. [ Links ]
228. Dadachova E, Patel M, Toussi S, Apostolidis C, Morgenstern A, Brechbiel M, et al. Targeted killing of virally infected cells by radiolabeled antibodies to viral proteins. PLoS Med. 2006;3:427. [ Links ]
229. McConnell M, Domínguez J, Smani Y, López R, Docobo F, Pachón J. Vaccination with outer membrane complexes elicits rapid protective immunity to multidrug-resistant Acinetobacter baumannii. Infect Immun. 2011;79:518-26. [ Links ]
230. Islam A, Singh K, Ismail A. Demonstration of an outer membrane protein that is antigenically specific for Acinetobacter baumannii. Diagn Microbiol Infect Dis. 2011;69:38-44. [ Links ]
231. Castano A, Mroz P, Wu M, Hamblin M. Photodynamic therapy plus low-dose cyclophosphamide generates antitumor immunity in a mouse model. Proc Natl Acad Sci U S A. 2008;105:5495-500. [ Links ]
232. Demidova T, Hamblin M. Photodynamic therapy targeted to pathogens. Int J Immunopathol Pharmacol. 2004;17:245-54. [ Links ]
233. Dai T, Tegos G, Lu Z, Huang L, Zhiyentayev T, Franklin M, et al. Photodynamic therapy for Acinetobacter baumannii burn infections in mice. Antimicrob Agents Chemother. 2009;53:3929- 34. [ Links ]
234. Friedman A, Han G, Navati M, Chacko M, Gunther L, Alfieri A, et al. Sustained release nitric oxide releasing nanoparticles: characterization of a novel delivery platform based on nitrite containing hydrogel/glass composites. Nitric Oxide. 2008;19:12-20. [ Links ]
235. Mihu M, Sandkovsky U, Han G, Friedman J, Nosanchuk J, Martinez L. The use of nitric oxide releasing nanoparticles as a treatment against Acinetobacter baumannii in wound infections. Virulence. 2010;1(2):62-7. [ Links ]
236. Siegel J, Rhinehart E, Jackson M, Chiarello L, Healthcare Infection Control Practices Advisory Committee. Management of multidrug-resistant organisms in health care settings, 2006. Am J Infect Control. 2007;35(10 Suppl 2):S165-93. [ Links ]
237. Dijkshoorn L, Nemec A, Seifert H. An increasing threat in hospitals: multidrug-resistant Acinetobacter baumanii. Nat Rev Microbiol. 2007;5(12):939-51. [ Links ]
238. Wilks M, Wilson A, Warwick S, Price E, Kennedy D, Ely A, et al. Control of an outbreak of multidrug-resistant Acinetobacter baumannii-calcoaceticus colonization and infection in an intensive care unit (ICU) without closing the ICU or placing patients in isolation. Infect Control Hosp Epidemiol. 2006;27(7):654-8. [ Links ]
239. Zarrilli R, Casillo R, Di Popolo A, Tripodi MF, Bagattini M, Cuccurullo S, et al. Molecular epidemiology of a clonal outbreak of multidrug-resistant Acinetobacter baumannii in a university hospital in Italy. Clin Microbiol Infect. 2007;13(5):481-9. [ Links ]
240. Kraniotaki E, Manganelli R, Platsouka E, Grossato A, Paniara O, Palú G. Molecular investigation of an outbreak of multidrug-resistant Acinetobacter baumannii, with characterisation of class 1 integrons. Int J Antimicrob Agents. 2006;28(3):193-9. [ Links ]
241. Podnos Y, Cinat M, Wilson S, Cooke J, Gornick W, Thrupp L. Eradication of multi-drug resistant Acinetobacter from an intensive care unit. Surg Infect (Larchmt). 2001;2(4):297-301. [ Links ]
242. Aygün G, Demirkiran O, Utku T, Mete B, Urkmez S, Yilmaz M, et al. Environmental contamination during a carbapenem-resistant Acinetobacter baumannii outbreak in an intensive care unit. J Hosp Infect. 2002;52(4):259-62. [ Links ]
243. Lee S, Kim N, Choi S, Hyong Kim T, Chung J, Woo J, et al. Risk factors for acquisition of imipenem-resistant Acinetobacter baumannii: a case-control study. Antimicrob Agents Chemother. 2004;48(1):224-8. [ Links ]
244. Kim YA, Choi JY, Kim CK, Kim CO, Kim MS, Choi SH, et al. Risk factors and outcomes of bloodstream infections with metallo- beta-lactamase-producing Acinetobacter. Scand J Infect Dis. 2008;40(3):234-40. [ Links ]
245. Villers D, Espaze E, Coste M, Giauffret F, Ninin E, Nicolas F, et al. Nosocomial Acinetobacter baumannii infections: microbiological and clinical epidemiology. Ann Intern Med. 1998;129(3):182-9. [ Links ]
246. Abbo A, Navon S, Hammer O, Krichali T, Siegman Y, Carmeli Y. Multidrug-resistant Acinetobacter baumannii. Emerg Infect Dis. 2005;11(1):22-9. [ Links ]
247. Cornaglia G, Akova M, Amicosante G, Cantón R, Cauda R, Docquier J, et al. Metallo-beta-lactamases as emerging resistance determinants in Gram-negative pathogens: open issues. Int J Antimicrob Agents. 2007;29(4):380-8. [ Links ]
248. Nemec A, Dijkshoorn L, van der Reijden T. Long-term predominance of two pan-European clones among multi-resistant Acinetobacter baumannii strains in the Czech Republic. J Med Microbiol. 2004;53(2):147-53. [ Links ]
249. Van den Broek P, Arends J, Bernards A, De Brauwer E, Mascini E, van der Reijden T, et al. Epidemiology of multiple Acinetobacter outbreaks in the Netherlands during the period 1999-2001. Clin Microbiol Infect. 2006;12(9):837-43. [ Links ]
250. Suller M, Russell A. Antibiotic and biocide resistance in methicillin-resistant Staphylococcus aureus and vancomycin-resistant enterococcus. J Hosp Infect. 1999;43(4):281-91. [ Links ]
251. Thomas L, Maillard J, Lambert R, Russell A. Development of resistance to chlorhexidine diacetate in Pseudomonas aeruginosa and the effect of a "residual" concentration. J Hosp Infect. 2000;46(4):297-303. [ Links ]
252. Wisplinghoff H, Schmitt R, Wöhrmann A, Stefanik D, Seifert H. Resistance to disinfectants in epidemiologically defined clinical isolates of Acinetobacter baumannii. J Hosp Infect. 2007;66(2):174-81. [ Links ]
253. Kaye K, Harris A, Samore M, Carmeli Y. The case-case-control study design: addressing the limitations of risk factor studies for antimicrobial resistance. Infect Control Hosp Epidemiol. 2005;26(4):346-51. [ Links ]