INTRODUCCIÓN
La Enfermedad de Membrana Hialina (EMH) fue descrita por primera vez por Avery y Mead en 1959, caracterizándose como una patología por deficiencia de agente tensoactivo1. Desde 1989, son ya varios los surfactantes derivados de animales que se han desarrollado (poractan alfa, beractant, bovactant), con diferencias en sus concentraciones, inicio y duración de acción (reducción de la tensión superficial) y su contenido de proteínas B y C.
The EuroNeoNet describió la incidencia de EMH en diferentes rangos de edad; entre 24 a 25 semanas fue del 92%, entre 26 a 27 del 88%, entre 28 a 29 del 76% y entre 30 a 31 del 57%2. De esta manera, se ha convertido en una causa importante de morbilidad y mortalidad infantil en los Estados Unidos de América y todo el mundo3,4,5,6,7,8, a pesar de que se ha tratado de reducir con tratamientos9-11, que han resultado efectivos pues han disminuido la incidencia de complicaciones como la Displasia Broncopulmonar (DBP) y neumotórax9,12,13,14.
Son varios los surfactantes de origen animal que existen comercialmente disponibles y la controversia sobre cuál emplear y cómo hacerlo se mantiene sin resolver, por lo cual se han realizado múltiples trabajos que comparan a dos o más surfactantes entre sí9,11,15. Sin embargo, son pocos los que existen que comparan Alveofact® (A) y Curosurf® (C).
El objetivo de este trabajo fue evaluar la efectividad en términos de tiempo de ventilación mecánica y de suministro de oxígeno como datos primarios y de necesidad de segunda dosis de surfactante, terapia posnatal con esteroides para tratamiento de DBP, estancia hospitalaria en días, efectos colaterales inmediatos durante la administración y complicaciones neonatales, como datos secundarios, evaluándose adicionalmente la incidencia de DBP, mortalidad neonatal y comparando los costos de administración de A versus C, en neonatos prematuros de 32 semanas o menos con EMH en una unidad neonatal.
MATERIALES Y MÉTODO
DISEÑO
Mediante una cohorte retrospectiva, se realizó un análisis de los datos de prematuros entre 24 y 32 semanas de gestación al nacer, que recibieron surfactante entre el 1 de enero de 2006 y el 31 de diciembre de 2013 en la Unidad de Cuidados Intensivos de la Fundación Hospital San José de Buga, Colombia.
PACIENTES
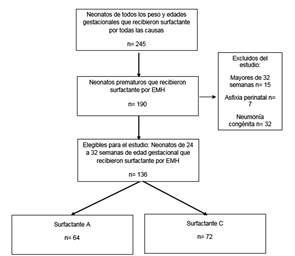
En el estudio se incluyeron neonatos de 24 a 32 semanas de edad gestacional quienes por peso ( menor a 1000 g) o por diagnóstico de EMH con criterios de dificultad respiratoria y radiografía tórax, es decir, con infiltrados bilaterales en vidrio esmerilado, broncograma aéreo y pérdida de volumen pulmonar, a quienes se les suministró surfactante profiláctico, es decir, en los primeros 15 a 30 minutos de vida, o terapéutico, después de 30 minutos hasta 24 horas de vida. De este grupo se excluyeron aquellos neonatos que presentaron asfixia, trisomías y malformaciones congénitas mayores, neumonía y sepsis de origen vertical, con ausencia de clínica infecciosa, laboratorios normales y cultivos negativos. La muestra fue extraída de una base de datos de la Unidad de Cuidados Intensivos, de la Fundación Hospital San José de Buga, con 245 neonatos de todos los pesos y edades gestacionales que recibieron surfactante, tanto por presentar EMH, como por otras causas. De estos se excluyeron 15 por tener más de 32 semanas de edad gestacional al nacer, siete por asfixia perinatal y 32 por neumonía congénita. En total, se incluyeron todos los neonatos que cumplieran los criterios de inclusión y carecieron de al menos uno de exclusión, siendo en total 136 neonatos, entre los cuales 64 recibieron A y 72 recibieron C (Ver Figura 1).
La recolección de la información que se encontró en la base de datos, se obtuvo mediante interrogatorios por parte del personal a la madre, evaluación del neonato y los datos de laboratorio o radiología directamente de los informes. Las historias clínicas materna y neonatal fueron una fuente secundaria de información.
SURFACTANTE
El método de administración del surfactante fue mediante bolo rápido en infusión por tubo orotraqueal o por sonda orotraqueal 6-Fr en salas de cirugía, parto o Unidad de Cuidados Intensivos Neonatales (UCIN). Las dosis y métodos de administración se realizaron acordando las recomendaciones de los manufacturadores, esto es, 100 mg/kg/dosis total de fosfolípido de Alveofact de Boehringer in-gelheim Ltd, Germany, y 25 mg/kg/dosis o 200 mg/kg/dosis total de Curosurf de Chiesi farmaceutici, Italy.
Para este estudio, se obtuvieron dos grupos de comparación: grupo de A y grupo de C, a quienes se les suministró el surfactante a dosis de 100 mg/Kg y 200 mg/Kg para la primera dosis respectivamente y 100 mg/Kg para la dosis subsecuente de ambos surfactantes. A pacientes con hallazgos clínicos y radiológicos de EMH, se les suministró un tratamiento profiláctico, si se correspondían al grupo cuyo peso era menor a 1000 g, mientras que aquellos que se encontraban por encima de este dato, se les dio uno terapéutico. El tiempo de administración de surfactante profiláctico fue en los primeros 30 minutos de vida en sala de partos, cirugía y UCIN, mientras el tiempo de administración de surfactante terapéutico, fue el de rescate precoz entre 30 minutos a dos horas y rescate tardío entre dos a 24 horas.
Si el neonato requería intubación orotraqueal para la administración del surfactante, este era extubado inmediatamente, si reunía criterios, conectándose a presión positiva continua en la vía aérea nasal (CPAP, por sus siglas en ingles).
CRITERIOS PARA ADMINISTRAR LA SEGUNDA DOSIS
La administración de una segunda dosis se realizó entre 6 a 24 horas después de aplicada la primera y el máximo número de dosis fue de dos. Los criterios para su aplicación fueron: Fracción Inspirada de Oxígeno (FIO2) mayor al 40% por más de 6 horas, Presión Media de la Vía Aérea (Paw) mayor a 7 cmH2O para mantener una adecuada Saturación Arterial de Oxígeno (SaO2) o Presión Arterial de Oxígeno (PaO2), PaO2 menor a 50 mmHg, radiografía de tórax con hallazgos compatibles con EMH tomado entre las primeras 6 y 12 horas de aplicada la primera dosis de surfactante.
TERAPIA VENTILATORIA
La terapia ventilatoria convencional fue empleada mediante modalidad asistido-controlado o sincrónica o mediante la aplicación de CPAP nasal. Estas técnicas se encuentran estandarizadas, al igual que los criterios de destete para ambos.
Después de la instilación del surfactante exógeno, los neonatos fueron extubados si tenían adecuado esfuerzo respiratorio espontáneo, aplicando con oxígeno por flujo libre o en CPAP nasal. Aquellos sin esfuerzo respiratorio o cuando este era inadecuado, fueron ventilados con Neopuff con presiones máximas de 20 cmH2O durante 5 a 10 minutos, para ser llevado a CPAP nasal. Si un patrón respiratorio no se establecía adecuadamente después de 10 minutos de la instilación del surfactante o si el neonato cumplía con alguno de los criterios de intubación y ventilación mecánica, la extubación no se realizaba y la ventilación era continuada.
Los criterios para continuar o re-intubar y conectar a ventilación mecánica después del tratamiento con surfactante incluyeron alguno de los siguientes: razón entre tensión de oxigeno arterial y tensión de oxígeno alveolar inferior a 0,22; FIO2 mayor a 50% y en aumento para mantener SaO2 mayor o igual a 88% hasta 92% por 1 hora o PaO2 menor o igual a 50 mmHg; acidosis respiratoria con pH menor a 7,20; PaCO2 mayor a 65 mmHg una hora antes de la intubación; apnea persistente mayor a 20 segundos con más de tres episodios por una hora asociados a bradicardia o un solo episodio de apnea que requiera ventilación a presión positiva; la insuficiencia respiratoria (Silverman de 7 y más) y la inestabilidad hemodinámica, por que se define como “presión sanguínea baja para la edad gestacional, pobre perfusión o ambos”, requiriendo volumen o soporte inotrópico por un periodo de cuatro horas o más.
Por otro lado, los criterios de extubación fueron: PaO2 entre 50 y 80 mmHg; PaCO2 mayor a 65 mmHg; pH mayor a 7,20; FIO2 menor a 40%, SaO2 mayor o igual a 88% (88 a 92% idealmente); Paw menor o igual a 7 cmH2O en neonatos con peso inferior a 1000 g y Paw menor o igual a 8 cmH2O en un peso mayor o igual a 1000 g; frecuencia ventilatoria inferior a 20 respiraciones por minuto; paciente hemodinámicamente estable sin evidencia de Ductus Arterioso Permeable (DAP) clínicamente significativo.
Los criterios para CPAP nasal fueron: neonato con peso inferior a 1000 g después de aplicado el surfactante con FiO2 mayor a 35%, neonato prematuro que haya recibido surfactante profiláctico y rescate temprano, neonato hemodinámicamente estable, respiraciones espontáneas regulares, apneas menores a tres en una hora o ausencia de un episodio de apnea que requiera ventilación a presión positiva. Ahora bien, los criterios para retiro de CPAP nasal fueron: neonato sin signos de dificultad respiratoria, que no requiriera incremento de oxígeno luego de 3 a 6 horas, que tolerara una reducción de Presión al Final de la Espiración (PEEP, por sus siglas en ingles) de 4 cmH2O y persistiera estable durante una hora. Adicionalmente, los neonatos con dificultad respiratoria y FIO2 menor a 30% que requerían PEEP de 5 a 6 cmH2O, fueron dejados en CPAP al menos 24 horas. Si la evolución era favorable, se disminuía PEEP hasta 4 cmH2O y el aporte de oxígeno se disminuía manteniendo saturaciones entre 88 y 92%. Se retiró de CPAP nasal cuando los requerimientos de oxígeno con FIO2 fueron menores al 25% luego de una hora y el neonato se encontraba clínicamente estable, es decir, sin dificultad respiratoria y sin apnea importante, esto es, sin la persistencia de más de tres episodios en una hora o con requerimiento de CPAP.
Los criterios de fracaso de CPAP nasal fueron la presencia de al menos uno de los siguientes: pH menor a 7,20; PCO2 mayor a 65 mmHg, apnea recurrente mayor a tres episodios por una hora asociados a bradicardia o un episodio de apnea que requiriera ventilación con presión positiva; PaO2 menor o igual que 50 mmHg o saturación menor a 85 % con FIO2 mayor a 50%.
VARIABLES EN ESTUDIO
Los datos que se registraron para cada neonato incluyeron: nombre, entidad de salud, número de historia clínica, fecha de nacimiento y de ingreso, peso y edad gestacional al nacer, medido por fecha de última menstruación, ecografía obstétrica más temprana y calificación de Ballard, sexo, gestación múltiple, administración prenatal de surfactante, vía de nacimiento, valoración de APGAR a los 1, 5 y 10 minutos, diagnósticos, reanimación cardiorrespiratoria, calificación de Silverman, causa de prematuridad, edad de aplicación de primera y segunda dosis de surfactante, tiempo entre última dosis de surfactante y extubación, presión ventilatoria inspiratoria pico, PEEP, Paw, FIO2, PaO2, índice de oxigenación (Fio2 x Paw x 100/PaO2), índice de Kirby (PaO2/FiO2) al momento de la administración del surfactante y a las 2 y 6 horas después de administrado, modo ventilatorio, tipo de surfactante administrado, tiempo de suministro de oxígeno, dosis de surfactante en centímetros cúbicos y miligramos, aplicación prenatal de betametasona y número de dosis, así como el tiempo entre la última dosis de betametasona y el nacimiento, complicaciones por prematuridad y por la administración del surfactante y la mortalidad.
Los datos primarios incluyeron tiempo de ventilación mecánica y tiempo de suministro de oxígeno medido en horas, mientras que como datos secundarios se recolectaron la necesidad de segunda dosis de surfactante, terapia postnatal con esteroides para tratamiento de DBP, estancia hospitalaria en días, efectos colaterales inmediatos durante la administración del surfactante, desaturación menor a 85%, taquicardia mayor a 160 por minuto, bradicardia menor a 100 por minuto, hipotensión o hipertensión arterial según edad gestacional y postnatal, complicaciones como retinopatía de la prematuridad, hemorragia intraventricular severa grado III o IV, sepsis, enterocolitis necrosante, estadios mayor o igual a IIA, DAP que requiera terapia farmacológica o quirúrgica, hemorragia pulmonar, síndromes de escape en los primeros 14 días, presencia de neumotórax u otro síndrome de escape en tórax o pulmones. Adicionalmente, se evaluó la incidencia de DBP y mortalidad.
ANÁLISIS ESTADÍSTICO
Los análisis estadísticos se realizaron con Stata® 11.0. Las variables categóricas, nominales u ordinales se presentan en tablas de frecuencias con sus respectivos porcentajes y fueron comparadas mediante Chi2 o Prueba Exacta de Fisher, mientras que las variables cuantitativas se expresaron como promedios y su Desviación Estándar (±DE) o medianas con su Rango Intercuartil (RI); se evaluaron empleando la prueba t-test no pareado o Wilcoxon rank-sum, acordando su distribución para comparar diferencias. La significancia estadística fue definida como un valor p <0,05.
RESULTADOS
CARACTERÍSTICAS GENERALES
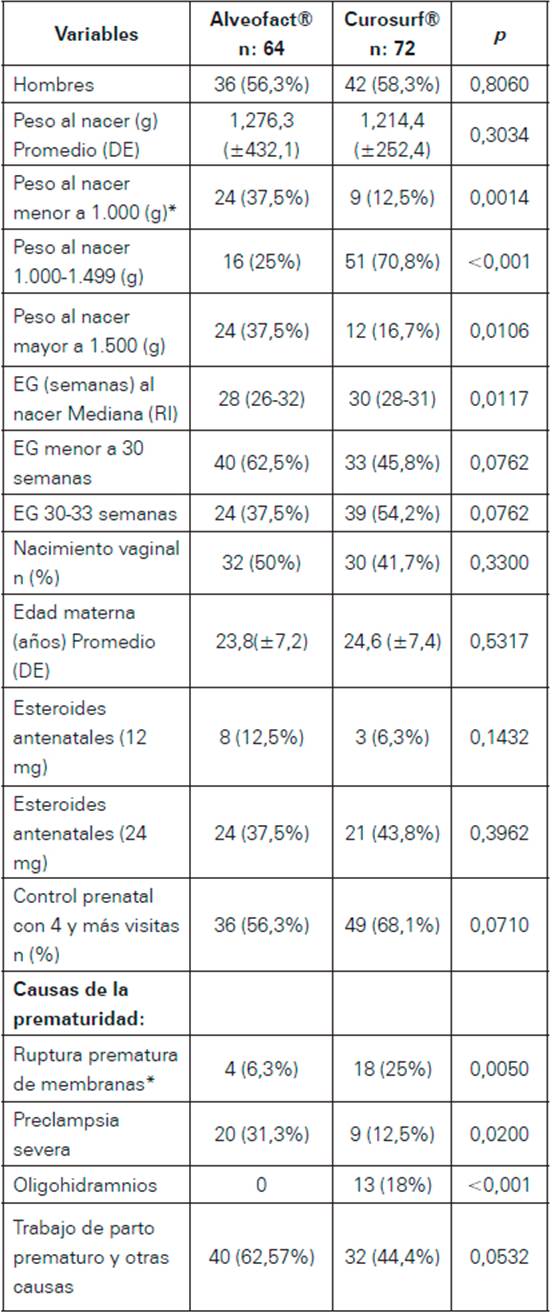
Un total de 136 neonatos fueron incluidos en el estudio. Los varones fueron 56,3% para A y 58,3% para C, sin diferencia entre los grupos (p = 0,8060). El promedio de peso al nacer fue para A 1276,3 g (±432,1 g) y para C 1214,4 g (±252,4 g), (p: 3034). Hubo una mayor proporción de neonatos con un peso inferior a 1000 g de peso al nacer en el grupo de A, diferencia estadísticamente significativa (p = 0,0014). La mediana de la edad gestacional fue para A 28 semanas (RI: 26 a 32 semanas) y para C 30 semanas (RI: 28 a 31 semanas), (p = 0,0117). No se halló diferencia estadísticamente significativa para edad gestacional al nacer menor a 30 semanas, vía de nacimiento, edad materna, administración de betametasona antenatal, ni control prenatal. Las causas principales de nacimientos prematuros fueron parto prematuro espontáneo y otras causas (63,5%), preclampsia severa (21,3%) y ruptura prematura de membranas ovulares (16,2%). (Ver Tabla 1).
SOPORTE VENTILATORIO Y SUMINISTRO DE OXÍGENO
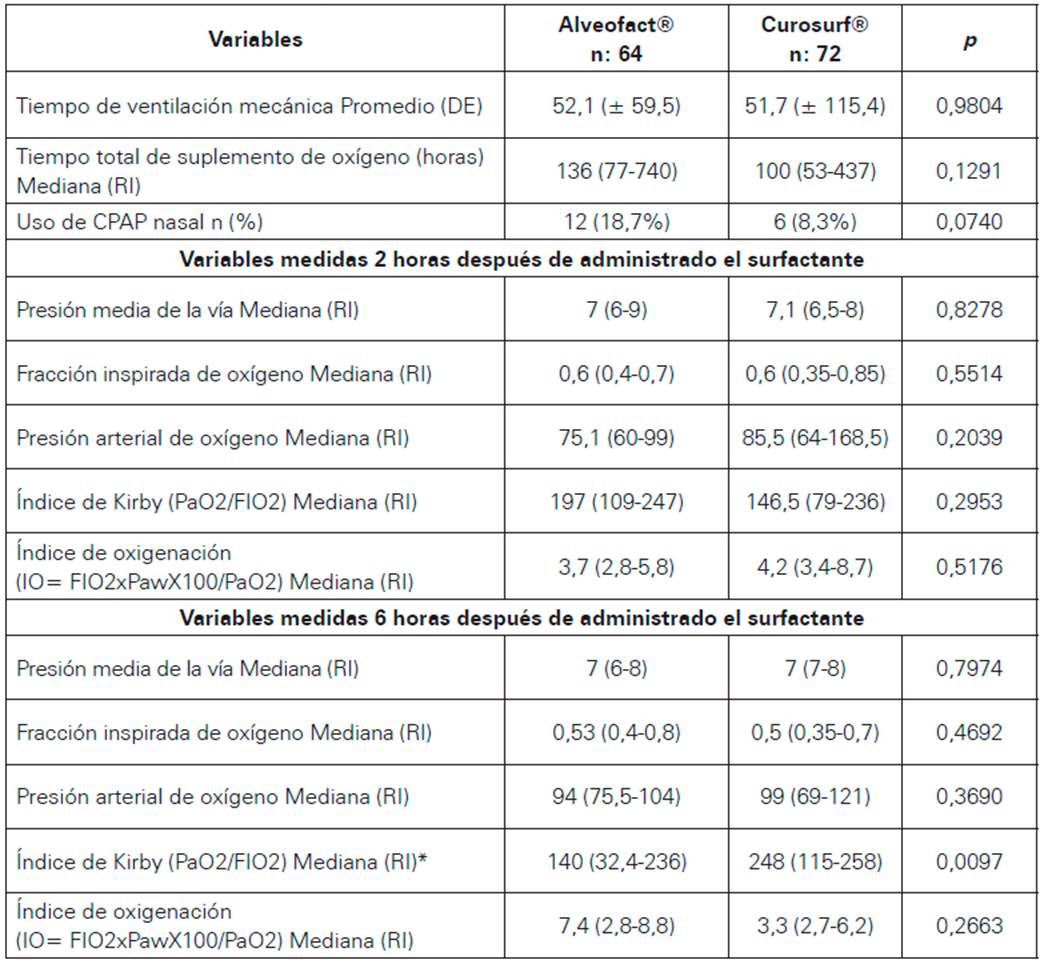
Para este grupo de neonatos tratados con A y C, no se hallaron diferencias estadísticamente significativas para el tiempo de ventilación mecánica, tiempo total de suplemento de oxígeno, uso de CPAP nasal posterior a la terapia con surfactante, Paw de la vía aérea, PaO2, FIO2, índice de Kirby e índice de oxigenación a dos y seis horas después de la primera dosis de surfactante, a excepción del índice de Kirby medido seis horas después de la primera dosis, en el que se encontraron diferencias estadísticamente significativas a favor del tratamiento C (Ver Tabla 2).
ADMINISTRACIÓN DE PRIMERA Y SEGUNDA DOSIS DE SURFACTANTE
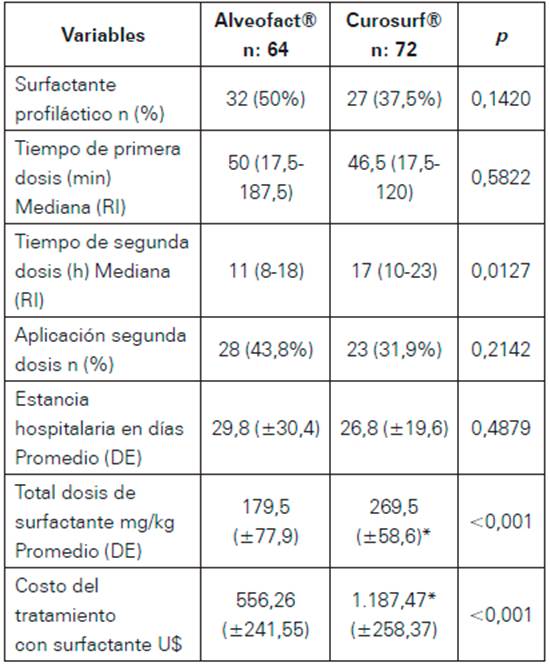
La administración profiláctica se realizó en 59 neonatos (43,4%) sin diferencia significativa entre los dos surfactantes. No se halló diferencia estadísticamente significativa en el tiempo de administración de la primera dosis, pero la segunda dosis de surfactante se aplicó más tardíamente en los neonatos que recibieron C (17 horas; RI: 10-23 horas versus 11 horas; RI 8-18 horas; p = 0,0127). El 44,9% de los prematuros requirieron una segunda dosis del medicamento, sin hallar diferencias estadísticamente significativas entre los dos surfactantes (p = 0,2142) (Ver Tabla 3).
ESTANCIA HOSPITALARIA
El promedio de la estancia para los neonatos que recibieron A fue de 29,8 días (±30,4 días) y 26,8 días (±19,6 días) para los que recibieron C, sin encontrar diferencia significativa, (p = 0,4879). (Ver Tabla 3).
DOSIS TOTAL Y COSTOS DE LA ADMINISTRACIÓN DEL SURFACTANTE
Los costos del tratamiento con surfactante resultaron significativamente mayores para C que para A, y esto estuvo asociado a que el C es más costoso por mg, ya que este tiene un valor de U$ 4,4/mg y A U$ 3,1/mg y adicionalmente su primera dosis es dos veces mayor a la de A.
La dosis total de surfactante administrado fue significativamente menor para A con promedio de 179,5 mg/kg (±77,9 mg/kg), en comparación con el grupo C que fue de 269,5 mg/kg (±58,6 mg/ kg) (p<0,001), lo que a su vez se tradujo en que el costo para A fuera considerablemente más bajo comparado con C, U$ 556,26 (±241,55) para A y U$ 1.187,47 (±258,37) para C; p<0,001 (Ver Tabla 3).
EFECTOS COLATERALES ASOCIADAS A LA ADMINISTRACIÓN DEL SURFACTANTE Y COMPLICACIONES SECUNDARIAS A LA PREMATURIDAD
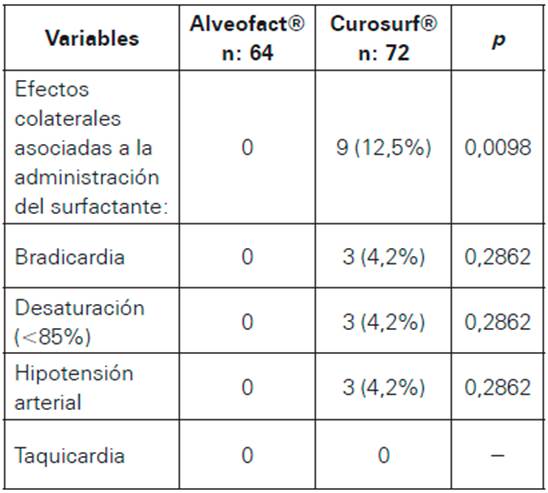
En cuanto a los efectos colaterales durante la administración de surfactante como reducción de la SaO2, bradicardia e hipotensión arterial, ocurrieron nueve casos (12,5%), todos para neonatos con C (Ver Tabla 4).
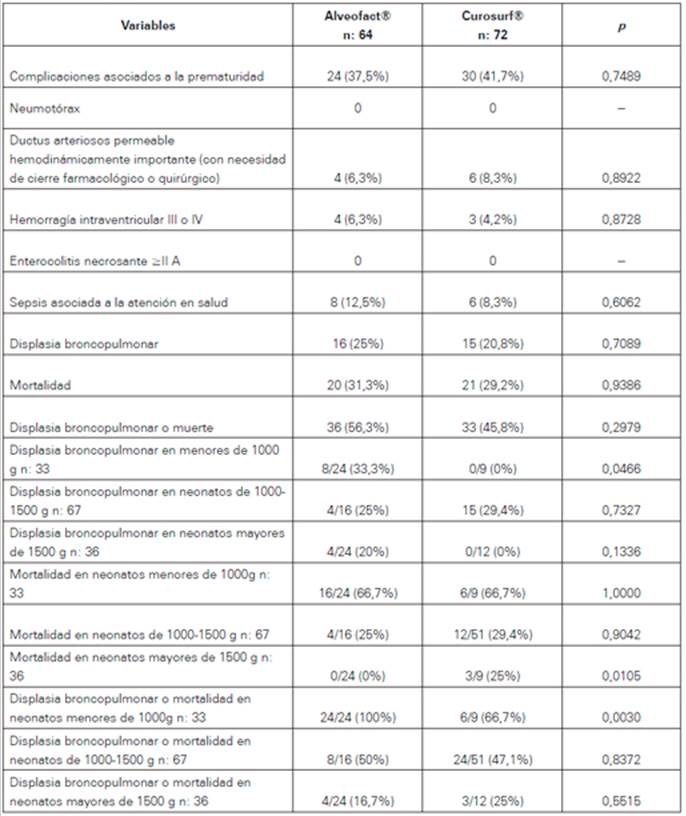
Hubo 54 (46,1%) complicaciones, siendo la principal la DBP presentada en 31 de los casos (22,8%), sepsis asociada a la atención en salud en 14 casos (10,3%), DAP; importante desde el punto de vista hemodinámico, con necesidad de cierre farmacológico o quirúrgico en 10 casos (7,4%) y hemorragia intraventricular grado III o IV en 7 casos (5,1%), sin existir diferencia significativa relacionada a estas entre ambos surfactantes (p>0,05) ( Ver Tabla 5).
DBP Y MORTALIDAD
La DBP ocurrió en 31 casos (22,8%) y la mortalidad en 41 (30,1%) neonatos, sin hallar diferencias estadísticamente significativas desde el punto de vista estadístico para aquellos que recibieron cualquiera de los surfactantes (p>0,05). Tampoco se halló diferencias estadísticamente significativas para la combinación DBP y muerte entre los dos surfactantes, presentándose en 69 (50,7%) neonatos.
Cuando se hizo un análisis por grupos de peso al nacer, se encontró una significativa de mayor proporción de DBP o mortalidad en los neonatos menores de 1000 g que recibieron A (p: 0,0030) y una significativa mayor mortalidad entre los neonatos con más de 1500 g de peso al nacer que recibieron C (p: 0,0105). Por grupos de peso, no se halló diferencia estadísticamente significativa para DBP entre neonatos de 10001500 g y mayores de 1500 g, ni para mortalidad en menores de 1000 g y 1000-1500 g, o para DBP o mortalidad en neonatos de 1000-1500 g y en tres de 1500 g (Ver Tabla 5).
DISCUSIÓN
El surfactante propio y el exógeno afecta la mecánica pulmonar y el intercambio de gases. En general, se encargan de mantener la interfase alvéolo-capilar, disminuyen la tensión superficial del alvéolo, estabilizan el volumen pulmonar y disminuyen la presión trans-pulmonar. El surfactante mantiene una enorme superficie de los pulmones necesaria para el intercambio de gases, lo cual favorece un mejor funcionamiento de la fisiología pulmonar. La respuesta a la oxigenación aparece a los minutos después de su administración, reduciendo las necesidades de soporte ventilatorio con la hora, junto con la reducción de la presión media de la vía aérea16. La administración de surfactante en prematuros con EMH establecida, reduce la mortalidad, disminuye los síndromes de escape aéreo, como neumotórax y enfisema pulmonar intersticial, y disminuye el riesgo de enfermedad pulmonar crónica a los 28 días de edad17.
Los hallazgos de este trabajo muestran, dado que el muestreo no fue aleatorio, que los prematuros que recibieron A tuvieron una mayor proporción de recién nacidos menores a 30 semanas, así como una significativa mayor proporción de prematuros con peso al nacer menor a 1000 g, sin hallar diferencias entre los promedios de peso al nacer entre los dos grupos. En cuanto al soporte ventilatorio y resultados gasométricos, no se hallaron diferencias estadísticamente significativas entre A y C, excepto para el índice de Kirby a las seis horas después de administrado el surfactante, siendo significativamente mayor para C.
En este trabajo no se encontró ventaja de un surfactante sobre el otro, diferencia que fue mostrada en un trabajo previo por Mendoza y cols. (18, donde el tiempo de ventilación mecánica fue mayor para A 63,1 horas (± 68,7 horas), comparado con C 26,7 horas (± 26,1 horas), diferencia que fue significativa (p: 0,004), pero con la diferencia que A fue administrado a 50 mg/kg/dosis, mientras que en este trabajo A se administró a 100 mg/kg dosis. Hay trabajos in vitro que han mostrado que tanto A como C requieren dosis más altas para alcanzar su objetivo terapéutico, concentraciones necesarias para reducir tensión superficial menor a 5 nM/n 6-12 veces mayores 19. Es por ello quizás que la primera dosis de A deba ser de 100 mg/kg y para C de 200 mg/kg, diferente a como lo menciona European Consensus Guidelines on the Managenemt of Neonatal Respiratory Distress Syndrome in Preterm Infants - 2013, (20 donde dan como dosis para A 50 mg/kg/dosis y para C 100-200 mg/kg/dosis.
Cloete y cols. (21, compararon de manera retrospectiva dos dosis de C, 100 mg/kg versus 200 mg/kg en la primera dosis del surfactante, en 118 y 138 neonatos prematuros, encontrando para el grupo de 200 mg/kg una significativa reducción en los requerimientos de oxígeno después de la administración del surfactante (p<0,0003) y una reducción en la necesidad de una segunda dosis (33,9% para 100 mg/kg versus 15,9% para 200 mg/kg; p: 0,0008). No hubo diferencias para duración de ventilación mecánica, neumotórax, muerte, ni estancia hospitalaria. Un dato interesante es que A contiene 83,7 ± 3,9 mol% de fosfatidil colina en comparación con C que contiene 73,0 ± 2,7 mol% (p<0,01), mientras que las concentraciones de SP-B (µg/µmol de fosfolípido) son significativamente mayores para A 5,2 ± 0,6 que para C 3,2 ± 0,5 (p<0,05) y SP-C (µg/µmol de fosfolípido) 12,9 ± 1,7 para A y 10,1 ± 1,5 para C (p<0,01). Esto ha mostrado en estudios experimentales que A tiene mejores tasas de adsorción estática y dinámica20.
Adicionalmente, existen dos trabajos que han comparado A con C; Proquitté H y cols. (22, compararon el tratamiento con 100 mg/kg de A y C en prematuros menores a 32 semanas, sin demostrar diferencias estadísticamente significativas para tiempo de oxigenoterapia, tiempo de ventilación mecánica, como tampoco para número de dosis administradas, dosis acumulada, complicaciones tales como, síndromes de escape aéreo, hemorragia pulmonar, leucomalacia periventricular, hemorragia grado II o IV, DAP, DBP, estancia hospitalaria. Así mismo, Baroutis G y cols. (11, no hallaron diferencias significativas entre Alveofact®, Curosurf® y Survanta® a dosis de 100 mg/kg para administración de oxigenoterapia, como tiempo de administración y FIO2, Paw y duración en días de ventilación mecánica.
La administración precoz en la primera media hora de vida del neonato, estuvo indicada en condiciones de extremado bajo peso al nacer (menor a 1000 g), en proporciones estadísticas similares para ambos surfactantes (A 50% versus C 37,5%; p:0,1420). En este servicio, los neonatos con peso menor a 1000 g al momento de este análisis recibieron precozmente, es decir en los primeros 30 minutos de vida, surfactante, a través de sonda o tubo orotraqueal, siendo la indicación extubar y llevarlos a CPAP nasal en caso de cumplir con los criterios. Para este trabajo, seis neonatos recibieron surfactante por sonda 6-Fr y el resto por tubo orotraqueal, donde 18 terminaron después de la administración del medicamento con CPAP nasal. La administración de surfactante con sonda ha sido descrita en publicaciones recientes y sus beneficios son la reducción de la ventilación mecánica invasiva y la enfermedad pulmonar crónica23.
Kanmaz y cols. (24, compararon dos grupos cada uno con 100 neonatos menores de 32 semanas, con la administración de 100 mg/kg de C mediante la técnica Intube-Surfactante-Extube, un primer grupo recibió C con catéter 5-F y CPAP nasal y un segundo grupo con intubación, ventilación a presión positiva durante 30 segundos después de la instilación de C y CPAP nasal posteriormente. Encontraron para el primer grupo, menos ventilación mecánica en las primeras 72 horas (30% versus 45%; p: 0,02), menos CPAP nasal y ventilación mecánica (p: 0,006 y 0,002 respectivamente) y menos DBP (riesgo relativo -0,27; IC 95%: -0,1 a -0,72). Dos estudios recientes describen que la administración temprana en las primeras dos horas de vida, disminuye la necesidad de ventilación mecánica en la primera semana de vida en neonatos de 28 a 32 semanas de edad gestacional25 y disminuye las tasas de hemorragia intraventricular grave (mayor igual a grado III) y neumotórax, sin embargo, no encontraron efecto sobre DBP, comparado con la administración tardía de surfactante26.
Chung y cols. (27, describieron que, en comparación con la terapia de rescate, la administración temprana de surfactante puede reducir el requerimiento y el periodo de ventilación mecánica, así como la presencia de DAP y colestasis asociado a nutrición parenteral. El problema de este trabajo fue el pequeño tamaño de la muestra, 19 neonatos para grupo profiláctico y 27 para grupo de rescate. Un metaanálisis, encontró que la administración profiláctica de surfactante frente a un tratamiento de rescate, demostró una reducción significativa de la mortalidad neonatal con Riesgo Relativo típico (RRt) de 0,84 (IC 95%: 0,740,95); Diferencia de Riesgo típico (DR) -0,04 (IC 95%: -0,06 a -0,01); reducción de enfermedad pulmonar crónica con RRt de 0,69 (IC 95%: 0,55-0,86; DR -0,04 (IC 95%: -0,06 a -0,01)); y reducción de enfermedad pulmonar crónica o muerte a las 36 semanas de edad gestacional con RRt de 0,83 (IC 95%: 0,,75-0,91; DR -0,06 (IC 95%: -0,09 a -0,03)). Se halló también reducción de riesgo de neumotórax con RRt de 0,69 (IC 95%: 0,59-0,82; DR -0,05 (IC 95%: -0,08 a -0,03)); reducción de riesgo de enfisema pulmonar intersticial con RRt de 0,60 (IC 95%: 0,41-0,89; DR -0,06 (IC 95%: -0,10 a -0,02)); y reducción de riesgo de síndromes de escape aéreo en general con RRt de 0,61 (IC 95%: 0,48-0,78; DR -0,18 (IC 95%: -0,26 a -0,09)). También, se evidenció una tendencia a la reducción de riesgo de DBP o muerte a los 28 días de vida con RRt de 0,94 (IC 95%: 0,88-1,00; DR -0,04 (IC 95%: -0,07 a -0,00)). No encontraron diferencias estadísticamente significativas para otras complicaciones asociadas a la EMH o a la prematuridad28.
Se ha demostrado en ensayos clínicos recientes que el inicio de CPAP temprano, acompañado de una administración selectiva de surfactante, en lugar de una aplicación profiláctica de rutina, puede ser mejor, ya que se reducen las intubaciones, con tasas de mortalidad o enfermedad pulmonar crónica bajas en el grupo de CPAP29,30,31. Sin embargo, hay que tener en cuenta que en estos ensayos clínicos las condiciones de nacimiento son las ideales u óptimas, incluso con las mejores tasas de administración de betametasona prenatal, por lo cual estos resultados pueden no ser generalizados a todos los neonatos dentro de otras instituciones individuales32. Son varios los países como Reino Unido, Canadá, Estados Unidos y Europa que han empleado el tratamiento profiláctico en neonatos menores de 29 semanas de edad gestacional20,33,34,35.
En 45% de neonatos se hizo necesario una segunda dosis de surfactante, sin diferencias significativas entre A y C, como tampoco hubo diferencias entre los tiempos de la administración de la primera y segunda dosis de surfactante. En los ensayos clínicos con asignación al azar de dos dosis, han encontrado que dos e incluso tres dosis son mejores que una única dosis, en reducción de la mortalidad (13% versus 21%) y síndrome de escape aéreo (9% versus 18%)14,36. No se encontraron para A y C diferencias estadísticamente significativas para tiempo de aplicación de primera dosis de surfactante, pero si para la aplicación de la segunda (p:0,0127), siendo seis horas más tardías para C. Esto es similar a lo expuesto por Proquitté H y cols. (22, quienes informaron una segunda dosis para A, a las 18 horas (≥21,9 horas) y C 27 horas (±25,7 horas). Hay autores que describen que es práctico usar un horario flexible de las dosis repetidas de acuerdo a la condición clínica, a las necesidades de oxígeno y a la farmacocinética del surfactante37.
La estancia hospitalaria para A fue 29,8 días (±30,4 días) y de C 26,8 días (±19,6 días), sin ser diferentes estadísticamente (p=0,4879). Esta estancia es inferior a la informada por Proquitté H y cols. (22, para quienes la estancia en los neonatos que recibieron A fue de 80 días (RI: 1-258 días) y de C 78 días (RI: 1-136 días; p = 0,740).
Por otro lado, la dosis de C recomendada en la literatura es superior a la de A23,38,39,40. En este estudio se administró 200 mg/kg en la primera dosis y 100 mg/ kg de peso en la segunda dosis para C y 100 mg/kg en la primera y segunda dosis para A, que es superior a la recomendada por European Consensus Guidelines on the Managenemt of Neonatal Respiratory Distress Syndrome in Preterm Infants - 201320, para quienes A debe ser administrado 50 mg/kg dosis. Se decidió utilizar esta dosis más elevada de A, basados en resultados de trabajos previos como el de Mendoza y cols. (18, donde hallaron algunas diferencias cuando se comparó a Alveofact®, con Curosurf® y Survanta®, que estuvieron posiblemente asociadas a una dosis baja de A. Sin embargo, Proquitté H y cols. (22, no encontraron diferencias para ambos (A y C). En un trabajo in vitro se sugirió que A debe ser suministrado a una dosis superior a la recomendada19. Por estas razones, naturalmente la dosis de C fue superior a la de A, y con un costo 1,5 veces superior a C comparado con A, es decir, U$179,5 ±77,9 para A y U$269,5 ±58,6, con una diferencia significativa (p<0,001).
Varios trabajos han mostrado los efectos colaterales durante la administración de los diferentes surfactantes18,41,42. En este trabajo se presentaron nueve efectos colaterales asociados al tratamiento C: bradicardia, desaturación e hipotensión en tres pacientes para cada caso. Son varios los estudios que han mostrado los cambios hemodinámicos durante la administración de surfactante, en variables como incremento y disminución del flujo sanguíneo cerebral43,44,45 y reducción de la presión de la arteria pulmonar46,47. Katheria y cols. (42, mostraron incremento del flujo sanguíneo sistémico, con mejoría de la respuesta hemodinámica sistémica después de terapia de rescate con surfactante. Cuando el surfactante es administrado, ocurre una rápida mejoría de la elasticidad pulmonar resultando en una hiperventilación transitoria, hipocapnia y en una disminución en el flujo sanguíneo cerebral41. Estos cambios pueden persistir durante una hora. También hay mejoría en la oxigenación inducida por el surfactante, al reducir la resistencia vascular pulmonar, incrementando el flujo a través del ductus arterioso48.
El 39,7% de los pacientes presentaron alguna complicación, sin embargo, en esta revisión, no se encontraron diferencias en cuanto al número de complicaciones como DAP con repercusión hemodinámica, hemorragia intraventricular III o IV, enterocolitis necrosante IIA o mayor, ni sepsis. Por otro lado, en el trabajo de Proquitté H y cols. 22, se presentaron 208 complicaciones entre los 187 neonatos del estudio, con cifras de complicaciones graves como hemorragia intraventricular III o IV (16%), neumotórax (7%), enterocolitis (6,4%) y DAP (19,1 %) superiores a las informadas en este trabajo.
La DBP varía de acuerdo a la edad gestacional, presentándose en 67,3% en neonatos de 22-25 semanas de edad gestacional al nacer y 36,6% en los de 26-30 semanas 49. En este trabajo, se presentó en 69 (50,7%) de los neonatos sin diferencias significativas para A y C (p: 0,2979), coincidiendo con otros estudios (11,22), sin embargo, en este la prevalencia de DBP es inferior a la informada por Proquitté y cols. (22 (22,8% versus 42,2%; p<0,001). Por otra parte, en este trabajo 41 (30,1%) neonatos fallecieron; 20 (31,3%) para A y 21 (29,2%) para C, sin diferencia entre los dos (p=0,9286), siendo estas cifras muy similares a las informadas por otros 11,18,50. Este trabajo mostró una mayor proporción de DBP o mortalidad en los neonatos que al nacer pesaron menos de 1000 g y recibieron A y mayor mortalidad en neonatos mayores de 1500 g que recibieron C.
LIMITACIONES DEL TRABAJO
La principal limitación metodológica fue que la administración de los dos surfactantes no fue aleatoria ni cegada. Sin embargo, en esta unidad neonatal, la guía de EMH y los procedimientos de administración de surfactante, ventilación mecánica y uso de CPAP nasal están estandarizados.
CONCLUSIONES
Tanto poractan alfa (Curosurf®), como bovactant (Alveofact®) tienen resultados similares en términos de ventilación mecánica, estancia hospitalaria y complicaciones neonatales, sin embargo, C resulta ser más costoso que A. La DBP o mortalidad fue mayor para neonatos de menos de 1000 g de peso al nacer que recibieron A, mientras la mortalidad en neonatos mayores de 1500 g fue mayor en C.
Se considera que el tratamiento del neonato con EMH puede hacerse de manera segura y eficiente con cualquiera de estos dos surfactantes, ya que estos tienen similares beneficios clínicos a pesar de las diferencias en la composición y las propiedades biofísicas.
Sin embargo, para comparar los resultados de estos dos surfactantes en neonatos, se hace necesario realizar un ensayo clínico, aleatorizado y cegado.