Introducción
La Enfermedad Trofoblástica Gestacional (ETG) agrupa un conjunto de anormalidades que tienen en común la proliferación excesiva de tejido trofoblástico1,2 siendo la Mola Hidatiforme (MH) la condición más frecuente y que se caracteriza por hipertrofia trofoblástica y edema de las vellosidades coriónicas. Esta a su vez se divide en MH completa y MH parcial según el grado de extensión de la hipertrofia y la afectación de las vellosidades3 . La primera es más frecuente y presenta mayor riesgo de enfermedad persistente y malignización1,2, mientras que la MH parcial frecuentemente pasa desapercibida como otras causas de hemorragia en primer trimestre sin recibir tratamiento o seguimiento apropiados.
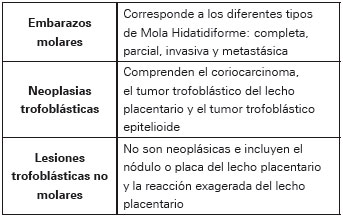
En Colombia, la estimación disponible acerca de la incidencia de ETG es de base hospitalaria y arroja un valor de 3,73 casos por cada 1000 embarazos4 . Se considera que las estimaciones poblacionales probablemente sean similares a las reportadas en los Estados Unidos, con una cifra aproximada de 1 por cada 1000 embarazos5 . En cuanto a la información epidemiológica de la ETG en el departamento de Santander, es escasa y no involucra la cuantificación de la beta-hCG6 . En el 2003 la Organización Mundial de la Salud clasifica la ETG teniendo en cuenta sus características histológicas en tres categorías7 como se observa en la tabla 1.
Existe un riesgo aumentado de padecer ETG en mujeres menores y mayores de 20 y 40 años respectivamente, con antecedente de ETG o de abortos espontáneos2,5. Otros factores no confirmados pero mencionados en la literatura incluyen el grupo sanguíneo A o AB8,9, el uso de anticonceptivos orales5 , el tabaquismo10 , el nivel socioeconómico5 y la dieta deficiente en betacarotenos11 .
Los valores altos de beta-hCG, en particular superiores a 100 000 UI/L están asociados a abundante proliferación de tejido trofoblástico y suelen tener con mayor frecuencia síntomas2,3,12. Por el contrario, los casos de MH parcial se manifiestan más frecuentemente con clínica similar a un aborto incompleto y las mediciones cuantitativas de betahCG suelen estar ausentes. Además, éstas producen beta-hCG en menor cantidad respecto a las MH completas pese a que producen cantidades similares de hCG13 .
Pese a que se necesita una confirmación histológica posterior2,3, la aplicación del tratamiento de evacuación solo requiere la presencia de hallazgos clínicos y la cuantificación de la subunidad beta de la gonadotropina coriónica humana (beta-hCG)2,12. Aun así, existe la posibilidad de enfermedad residual persistente con probabilidad de invadir o metastatizar, en cuya presencia la quimioterapia debe complementar el manejo. Es probable, que los valores mayores previos al tratamiento condicionen en el médico tratante la decisión de aplicar quimioterapia profiláctica independiente de la reducción posterior de concentraciones de betahCG12 .
La capacidad de la cuantificación de las concentraciones de beta-hCG de discriminar el tipo de MH, no ha sido establecida en la región1,6 al igual que los factores que determinan su comportamiento. La presente investigación estudia el comportamiento de las concentraciones de beta-hCG previas al tratamiento evacuador en relación al tipo histológico de MH y factores de riesgo para el desarrollo de ETG.
Materiales y métodos
Clasificación de los casos
Se realizó un estudio transversal observacional en el que se utilizó la base de datos de las muestras del departamento de Patología de la Universidad Industrial de Santander correspondientes al periodo comprendido entre enero de 2005 a diciembre de 2014. El criterio de inclusión fue el diagnóstico histopatológico de MH, mientras que se excluyeron los casos donde la cuantificación de las concentraciones de beta-hCG no estuvo disponible o no resultara informativa y los casos donde el diagnóstico del tipo de MH no fuera establecido. El diagnóstico histopatológico de los especímenes fue corroborado en todos los casos por un médico patólogo con experiencia. A partir de los informes de histopatología se registró la información relacionada con la fecha de toma de la muestra, el tipo de la misma (legrado, histerectomía, placenta, etc.) y el diagnóstico histológico (MH parcial o completa).
Recolección de la información
La búsqueda de los datos se realizó obteniendo las historias clínicas de los casos previamente identificados con diagnóstico de ETG en el archivo del Hospital Universitario de Santander (HUS). Se ubicaron los registros de notas médicas y resultados de laboratorio en fechas próximas a las del informe de histopatología y se tomó la información registrada de acuerdo al instrumento de recolección diseñado para tal fin. Se incluyeron variables como edad, lugar de nacimiento, antecedentes (ginecológicos, tóxicos, diagnóstico previo de ETG, grupo sanguíneo, factor Rh, edad gestacional al momento del tratamiento), indicación posterior de EMA-CO (etopósido, metotrexato, dactinomicina, ciclofosfamida y vincristina) y valores de beta-hCG séricos previos al tratamiento evacuador que originó la muestra de patología.
Es necesario apuntar la existencia de acotamiento en los valores reportados, es decir, casos en los que el registro de laboratorio no reportaba el valor exacto de la medición de beta-hCG, sino un número con la anotación que el valor real de beta-hCG era superior al mismo, por ejemplo: “Mayor a 5000 UI/L”. Para el análisis estadístico se asumió que el valor real fue equivalente a la cota reportada en los 16 casos restantes con MH completa y valores acotados.
Análisis estadístico
A partir de los registros físicos se tabuló en una hoja de cálculo de Microsoft Excel 2013 la información de las variables para cada caso con posterior verificación cruzada de su fiabilidad. Se describieron las distribuciones de frecuencias de las variables discretas y continuas y se calcularon los estadísticos de resumen. Los intervalos de confianza no simétricos para la mediana se hallaron mediante el método binomial exacto. Se probó la asociación entre la clase de mola y los valores de beta-hCG a través de la demostración de diferencias significativas en las distribuciones de valores de beta-hCG según el tipo de mola mediante la prueba U de Mann-Whitney.
La exploración de las asociaciones entre las demás variables se llevó a cabo realizando pruebas chi cuadrado de independencia, prueba U de Mann- Whitney, análisis de varianza no paramétrico de Kruskall-Wallis y coeficiente de correlación Rho de Spearman. La elección de los métodos estadísticos se realizó según la adecuación del supuesto de normalidad para el cual se utilizó la prueba de Shapiro-Wilk y el análisis de la curva de distribución. Además, se hizo un análisis de curva ROC para evaluar la capacidad de la concentración de beta-hCG con el fin de discriminar la MH completa y determinar la sensibilidad y especificidad de cada punto de corte. El nivel de significancia elegido a priori fue de 10%, aunque los valores de p fueron reportados. El análisis estadístico se llevó a cabo con Microsoft Excel 2013, Stata 12 y SPSS 21.
Resultados
En total 74 casos fueron diagnosticados como MH de los cuales 51 correspondían a completa, 22 a parcial y 1 caso fue indeterminado. En 63 casos se obtuvo de la historia clínica el registro de medición de beta-hCG previo al tratamiento evacuador, luego de excluir tres casos con cotas sin valor informativo, entre los cuales 47 (75%) tenían diagnóstico de MH completa y 16 (25%) de MH parcial. El ordenamiento temporal de los casos no mostró patrones ni tendencias en relación con los valores de beta-hCG, el tipo de MH, la presencia de acotamiento en los niveles de beta-hCG ni la indicación posterior de EMA-CO. La presencia de acotamiento en el reporte de la concentración de la beta-hCG afectó a 18 casos (37%) con MH completa y a un caso (5%) con MH parcial. Se descartaron los valores de tres casos (2 MH completa y 1 MH parcial) con valores de beta-hCG acotados como mayores a 1500 UI/L los cuales no aportaron información alguna.
Se detectó un valor atípico de beta-hCG reportado como superior a 24 000 000 UI/L, el cual fue descartado para las pruebas de normalidad debido a su desproporcionada influencia. Los valores de beta-hCG presentaron una distribución con marcada asimetría positiva condicionada por la presencia de valores superiores a 600 000 UI/L. La hipótesis nula de normalidad para los valores de beta-hCG (Shapiro- Wilk: 0,693, p<0,0001) fue rechazada, incluso tras la transformación logarítmica (Shapiro-Wilk: 0,917, p<0,0001), al igual que la de normalidad para las demás variables continuas excepto para la edad gestacional. Estos valores fueron mayores en los casos de MH completa comparados con los de MH parcial (Ver Tabla 2).
Tabla 2 Medidas de resumen para variables cuantitativas.
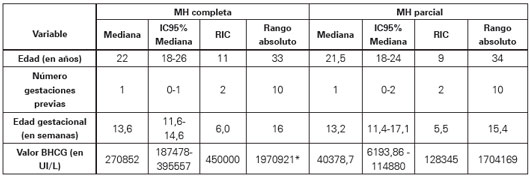
* Excluyendo como valor máximo 24000000 UI/L; RIC: Rango intercuartílico.
Fuente: autores.
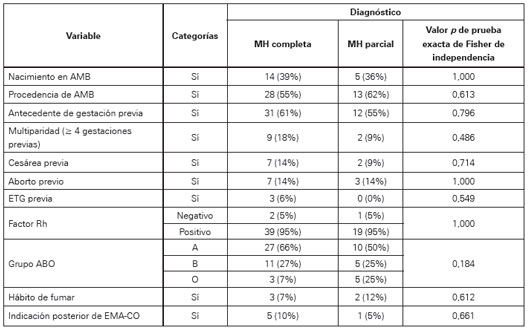
Se encontró una asociación significativa entre acotamiento de valores y el diagnóstico histopatológico (chi cuadrado=5,86, p=0,27). Dentro del grupo con MH completa, al comparar las distribuciones de valores exactos de beta- HCG reportados con los acotados no se hallaron diferencias significativas (U de Mann-Whitney: 284, p=0,418).
Al comparar las curvas de valores beta-hCG, tanto exactos como acotados, para los casos de MH parcial y completa, se encontró una diferencia significativa (U de Mann-Whitney: 144, p<0,0001) (Ver Figura 1).
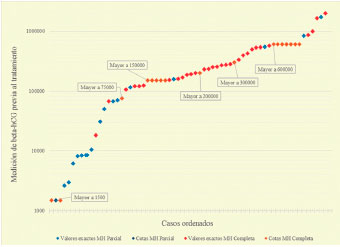
Fuente: autores.
Figura 1 Medición de beta-hCG previa al tratamientoSe muestran los valores exactos y acotados de beta-hCG previos al tratamiento en casos con diagnóstico de mola hidatidiforme completa y parcial.
La Figura 2 muestra la curva ROC para la discriminación de los casos de MH completa y parcial según los valores de beta-hCG, detallando el rendimiento diagnóstico de diversos puntos de corte (los valores fueron aproximados al múltiplo de 2000 UI/L inferior más cercano con idéntico rendimiento). Un punto de corte en 100 000 UI/L (el más utilizado en la literatura) ofreció una sensibilidad del 91,5% y una especificidad del 68,8%.
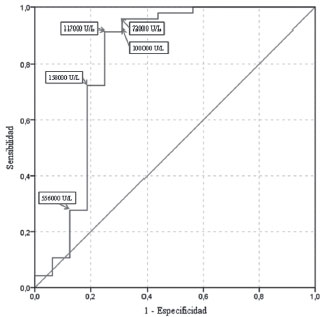
Fuente: autores.
Figura 2 Curva ROC de la medición de beta-hCGSe muestra el rendimiento diagnóstico para la discriminación de casos de MH completa y parcial según valores de beta-hCG previos al tratamiento.
La probabilidad de que un caso con valor de beta-hCG mayor a 100 000 UI/L tuviese un diagnóstico de MH completa fue alta (valor predictivo positivo = 90%) comparado con la de MH parcial, en la cual dicha situación se presentó en cerca de la tercera parte de los casos (Ver Tabla 3).
Tabla 3 Relación de casos según valores de beta-hCG para cada diagnóstico histopatológico.
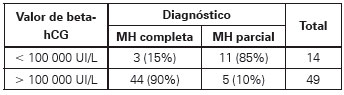
Fuente: autores.
Las distribuciones de valores de edad (U de Mann- Whitney: 559, p=0,981) y semanas de gestación (U de Mann-Whitney: 506, p=0,591) no fueron significativamente diferentes según el tipo de MH, al igual que la asociación entre el número de gestaciones y el tipo de MH (d de Somers: -0,35, p=0,659). Esta última, porque presentó un elevado número de valores empatados en la prueba U de Mann-Whitney. Respecto al valor de beta hCG, no hubo una asociación significativa con la edad gestacional (Rho de Spearmann: -0,195, p=0,126) (Ver Tabla 4).
Tabla 4 Asociación entre valores de beta-hCG y factores de riesgo para ETG.
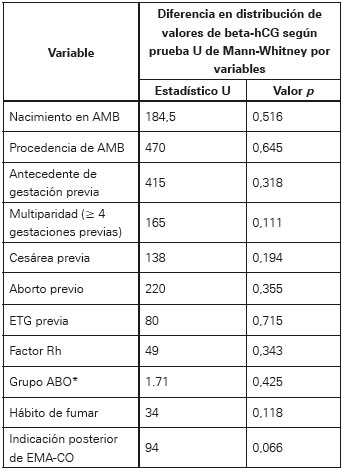
*Resultados reportados corresponden a prueba de Kruskal-Wallis por tratarse de una variable politómica.
Fuente: autores.
Respecto a las variables cualitativas y su relación con los valores de beta-hCG, fue significativa para la indicación posterior de EMA-CO (p=0,066) y no alcanzó significancia con el hábito de fumar (p=0,118) y multiparidad (p=0,111) (Ver Tabla 5). Cabe resaltar que ningún caso con medición de beta-hCG previa al tratamiento menor a 190 000 UI/L tuvo indicación posterior de dicho régimen por parte de los médicos tratantes según lo reportado en la historia clínica; no se halló ninguna asociación significativa entre estas variables y el tipo de MH según prueba de independencia mediante el método exacto.
Discusión
Los casos reportados en el presente estudio corresponden a todos los informes del departamento de patología de material referido desde el HUS. Se considera muy poco probable que algún caso de enfermedad trofoblástica del HUS que haya sido sometido a tratamiento evacuador (legrado, aspiración o histerectomía) no esté representado en la base de datos del departamento, pues la institución es el centro público de referencia de tercer nivel de atención en la región nororiente del país, y en particular del departamento de Santander.
Las características demográficas y las frecuencias relativas de cada tipo histológico de MH en la muestra estudiada son cercanas a las reportadas en otros estudios; sin embargo, la edad gestacional fue ligeramente mayor en este trabajo11,14,15,16,17,18,19. De igual manera la mediana y el rango de las concentraciones de beta-hCG previos al tratamiento fueron similares a los observados en la literatura14,15,16,17,18,19,20. Sin embargo, en los estudios consultados no se describe la presencia o ausencia de datos acotados para las concentraciones de beta-hCG siendo probable que hayan asumido el valor reportado como si fuera exacto o este hubiese sido excluido o inexistente debido a que el laboratorio no las reporta.
El rendimiento diagnóstico de la concentración de beta-hCG para clasificar entre MH completa y parcial es aceptable aunque modesto (AUC=0,809, IC 95%: 0,644-0,973), coincidiendo con los hallazgos de Van Trommel et al. quien con 109 casos de MH completa y 26 de MH parcial reporta un área bajo la curva de 0,797 en el análisis de curva ROC, siendo significativamente mejor que el azar para distinguir entre las dos entidades21 .
En el presente estudio se encontró que el punto de corte de 117 000 UI/L ofreció mejor precisión diagnóstica (sensibilidad 91,5%, especificidad 75%) en comparación con el de 100 000 UI/L, utilizado habitualmente como referencia. Es importante resaltar que un alto porcentaje (93,7%) de las pacientes con MH completa presentaron niveles superiores a 100 000 UI/L en contraste con lo referido en otros estudios15,16,17.
En cuanto a los de MH completa, una revisión de 153 pacientes reporta que cerca del 50% tuvieron concentraciones mayores a 100 000 UI/L16 . La revisión de Berkowitz y Goldstein de 858 mujeres con MH completa revela que aproximadamente el 40% presentan valores de beta-hCG mayores a 100 000 UI/L al momento de la consulta15 , adicionalmente un 7% de los casos manifestaron síntomas de hipertiroidismo como resultado de los niveles elevados de beta-hCG, no obstante una posterior revisión entre los años 1988 y 1993 no encontró ningún caso con hipertiroidismo atribuido al diagnóstico más precoz22 .
En otro de los trabajos en base a 77 pacientes con MH se reporta, para la medición previa al tratamiento evacuador, una mediana superior a los 100 000 UI/L y una alta heterogeneidad en las concentraciones medidas comparable con la encontrada en el presente estudio17 .
Respecto a los casos con MH parcial, el presente estudio halló que el 31% tuvieron concentraciones iguales o mayores a 100 000 UI/L. Un trabajo con 81 casos con diagnóstico de MH parcial revela que solo el 37% (30 casos) tuvo mediciones de beta-hCG previos al tratamiento, y solo dos casos tuvieron valores superiores a 100 000 UI/L. Adicionalmente, se anota que solo en cinco existió la impresión diagnóstica inicial de enfermedad trofoblástica, siendo en la gran mayoría aborto diferido o incompleto18 . En otro estudio que incluía 201 mujeres con diagnóstico de MH parcial, solamente el 7% había recibido diagnóstico preoperatorio correcto19 .
Factores como la edad gestacional, el tabaquismo, el índice de masa corporal, la paridad, el peso placentario y la presencia de síntomas de hiperémesis gravídica han sido asociados significativamente con las concentraciones de beta-hCG en mujeres con embarazos no complicados23 . En la literatura no se encuentran reportes de asociaciones significativas entre valores iniciales de beta-hCG en casos de MH y factores de riesgo para ETG5,9,24. En el presente estudio tanto el hábito de fumar como la multiparidad presentaron asociaciones no significativas con las concentraciones de beta-hCG.
Un estudio en Brasil describe que el riesgo de enfermedad persistente en los casos con niveles de beta-hCG superiores a 100 000 UI/L, aumenta 2,9 veces respecto a aquellos con niveles inferiores24 e igualmente resalta su asociación significativa con la ausencia de factor Rh. En contraste, el antecedente de aborto recurrente y el grupo sanguíneo ABO no están asociados. Los autores no relatan ningún hallazgo relevante entre factores de riesgo de ETG y niveles de beta-hCG24 .
Los valores mayores de beta-hCG previos al tratamiento evacuador estuvieron asociados a la posterior indicación reportada en la historia de EMA-CO. Estos hallazgos coinciden con el valor pronóstico atribuido a las altas concentraciones de beta-hCG previas al tratamiento2,11. Sin embargo la indicación del régimen EMA-CO, probablemente se encuentra muy condicionada por el juicio clínico que involucra dichos niveles, por lo tanto, el presente estudio no puede confirmar dicha utilidad pronostica.
Existe la posibilidad de un subregistro de casos, en particular de MH parcial, basado en casos con diagnóstico inicial de aborto incompleto sin recepción de muestra para confirmación histopatológica pese a que es habitual en la institución. Un estudio de 3 846 legrados obstétricos entre los años 1995 y 1998 realizados en Bucaramanga en la misma institución del presente estudio, encontró 51 casos con diagnóstico de MH confirmado por histopatología de los cuales el 62,7% fue detectado mediante el estudio clínico pese a su alta especificidad13 . En el actual trabajo se documentaron siete casos en los que no se reportaron niveles beta-hCG previos al tratamiento, dos de ellos tuvieron diagnóstico histopatológico de MH completa y cinco de parcial. Los primeros fueron diagnosticados clínicamente como aborto incompleto mientras que los otros recibieron diagnóstico clínico de huevo anembrionado (dos casos), aborto incompleto (dos casos) y en un caso se realizó el diagnóstico sobre los restos placentarios que acompañaban un feto con múltiples malformaciones de 25 semanas de gestación.
Igualmente, existe la probabilidad de cambios en el método de procesamiento y análisis de las muestras séricas de beta-hCG reportadas, no obstante se asume la comparabilidad directa de todas las mediciones independiente de cambios menores en el método. No se apreció ningún efecto importante del ordenamiento temporal de los casos en los valores de beta-hCG ni en las demás covariables.
Se recomienda continuar con el estudio de casos con MH para lograr un mayor tamaño de muestra pese a que el obtenido se basó en todos los disponibles en un periodo de casi una década. Un mejoramiento en los sistemas de registro y análisis de las historias clínicas en las instituciones permitiría estudiar un intervalo de tiempo más amplio con mayor facilidad. Además, es necesario diseñar estrategias metodológicas que permitan abordar el problema de los valores acotados con el fin de reducir el posible sesgo introducido al tomarlos; no obstante, se resalta que no se hallaron diferencias significativas entre los niveles obtenidos con y sin acotamiento. Igualmente, continuar con el seguimiento de los casos de ETG y estandarizar la metodología de su cuantificación de forma que al solicitarla por sospecha de ETG se pueda determinar el valor exacto.
Conclusiones
El presente estudio muestra que las concentraciones de beta-hCG permiten discriminar el tipo histológico de MH significativamente mejor que el azar aunque con un rendimiento diagnóstico modesto, al igual que la asociación significativa de sus niveles altos con la indicación posterior de EMA-CO. Por otro lado, indica que no existe relación significativa con los factores de riesgo para ETG y entre los valores reales acotados. Sin embargo, es cuestionable la utilidad clínica de una cota cuando su valor reportado es bajo y no ayuda a distinguir entre los tipos histológicos.
Consideraciones Éticas
De acuerdo con los principios establecidos en el Reporte Belmont y en la Resolución 008430 de octubre 4 de 1993 (Capítulo VI del Título II) esta investigación se consideró como una investigación sin riesgo (Artículo 11 de la Resolución No. 008430/93) y se realizó en cumplimiento con los aspectos mencionados en el Artículo 6 de dicha Resolución.