Introducción
La sepsis neonatal (SN) es una infección sistémica de etiología bacteriana, viral, parasitaria o fúngica 1), (2, asociada a disfunción orgánica que pone en riesgo la vida de los recién nacidos (RN)3.
En 2016, El Tercer Consenso Internacional para la Definición de Sepsis y Choque Séptico (Sepsis-3) 4, definió la sepsis como una disfunción orgánica que amenaza la vida, causada por una desregulación de la respuesta del hospedero frente a una infección. En los neonatos, la sepsis se clasifica dependiendo del momento de su inicio: SN temprana es la que inicia durante las primeras 72 h de vida, caso en el que la infección, como una infección placentaria o del tracto genital materno, es transmitida de manera vertical al RN 5. Si la infección inicia desde las 72 h hasta los 28 días de vida, se clasifica como SN tardía 6; la infección en este último grupo de pacientes es transmitida desde el ambiente hospitalario o la comunidad 5. Esta clasificación implica entonces diferencias en el modo de trasmisión posible de la infección, así como los posibles agentes etiológicos, por lo cual es de utilidad para decidir el tratamiento antibiótico inicial 7.
El riesgo de SN y la mortalidad tienen una relación inversa con la edad gestacional y el peso al nacer, ya que en estas condiciones se encuentra un sistema inmune inmaduro, los pacientes están más expuestos a medidas como ventilación mecánica, hospitalización prolongada, inserción de línea central y otras medidas invasivas 5. Factores maternos como corioamnionitis, la ruptura prematura de membranas y niveles elevados de Proteína C reactiva (PCR) maternos también son factores de riesgo conocidos para SN temprana 8), (9.
La SN es la causa más importante de morbilidad y mortalidad en el RN, tanto pretérmino como a término 5. Según la Organización Mundial de la Salud, cerca de cinco millones de muertes anuales se deben a la SN 10. A pesar de la importancia a nivel mundial, el interés público en la sepsis es pobre aún 4. La mayoría de casos de SN a nivel mundial tienen su origen en infecciones respiratorias o gastrointestinales 11. El S. agalactiae o Streptococcus del grupo B (SGB) de Lancefield es el principal microorganismo asociado a SN temprana en el mundo 12. Cerca del 70% de casos de SN tardía son por microorganismos grampositivos 7. En los Estados Unidos predominan las cepas de SBG y los microorganismos gramnegativos 13. Allí, la incidencia de SN temprana está alrededor de 0.30.98 por 1000 nacidos vivos 14), (15, con una mortalidad cerca del 24.4% 16. Actualmente, existe tendencia al aislamiento de Staphylococcus spp. en SN tardía y neonatos sometidos a procedimientos invasivos 13. En el Reino Unido, la incidencia de SN temprana es de 0.9 casos por 1000 nacidos vivos 17. En los países en vía de desarrollo, la incidencia de SN varía entre 1-4 eventos por 1000 nacidos vivos 18. En Egipto se ha reportado que hasta el 50% de los pacientes de UCIN presentan SN 19. En Sudáfrica, se han reportado tasas de fatalidad para la SN temprana y tardía de hasta 40% y 19.7%, respectivamente, cifras similares a las de otros países en desarrollo 10. La incidencia de SN reportada en México es de 160.9 casos por cada 1000 nacidos vivos 13, en América del Sur y el Caribe las cifras estuvieron entre 3.59-8.91 casos por cada 1000 nacidos vivos para el 2005 13. En Colombia en el año 2014, se registraron 7.24 muertes neonatales por 1000 nacidos vivos 20. Un estudio realizado en la ciudad de Medellín, en el año 2008, evidenció que cerca de 7% de los pacientes hospitalizados en UCIN correspondían a pacientes con SN 21. Los principales gérmenes aislados fueron los Staphylococcus coagulasa negativa y los bacilos gramnegativos 21.
Las manifestaciones clínicas de la SN no son específicas e incluyen rechazo al alimento, distrés respiratorio, neumonía, apnea, retraso del llenado capilar, frialdad de extremidades, intolerancia a la alimentación, inestabilidad térmica, hipotonía, convulsiones, abultamiento de la fontanela e ictericia prolongada 7. Las manifestaciones más severas son el choque, la coagulación intravascular diseminada, falla multiorgánica, entre otras 5), (22. Estos hallazgos se pueden encontrar en muchas otras condiciones patológicas lo que dificulta el diagnóstico 5, sumado a que también pueden presentarse de manera tardía, empeorando el pronóstico para el RN 5.
El diagnóstico final de SN se hace por hemocultivo, considerado como el estándar de oro, del que se pueden obtener resultados en un periodo de 36 h 17 hasta los 6 días 14 de cultivo. Aunque regularmente sólo son positivos en 30-70% de los casos 14), (17, por lo que no se puede descartar SN al obtener un resultado negativo. En parte, el bajo rendimiento de los hemocultivos se debe a un volumen insuficiente de muestra, variaciones en los niveles de bacteremia, uso de antibióticos en la madre o previo a la toma de la muestra en el neonato, entre otros 23. Recientemente se ha demostrado la utilidad de sistemas multiplex basados en reacción en cadena de polimerasa para la detección rápida de infecciones nosocomiales en RN pretérmino, con buena sensibilidad y especificidad, lo que podría servir como prueba diagnóstica adjunta al estándar de oro 24. La iniciación de terapia antibiótica antes de obtener los resultados del cultivo se recomienda para los neonatos con signos clínicos o factores epidemiológicos asociados con sepsis 10.
El tratamiento antibiótico resulta en muchas ocasiones como consecuencia del temor a una infección neonatal 17, sus graves complicaciones y secuelas a largo plazo 14, se ha reportado que en el 80-95% 14 de RN tratados con antibióticos por sospecha de infección, no requerían su uso 17.
Teniendo en cuenta que dentro de la fisiopatología de la SN, después del reconocimiento de una señal que puede provenir de un agente patógeno o señales de daño endógenas, se presenta un aumento en la producción de varias clases de mediadores inflamatorios y anti-inflamatorios 25, como los reactantes de fase aguda, interleucinas y otras moléculas. Se ha planteado que estos mediadores podrían servir como biomarcadores de SN y que podrían ser de ayuda para establecer su diagnóstico, ayudando así con la disminución del uso innecesario de antibióticos. Así mismo, se ha planteado que los biomarcadores podrían ayudar a predecir la severidad de la SN y a guiar el tratamiento antibiótico 25), (26.
En estudios previos se ha analizado el uso de diversos parámetros como ayuda en el diagnóstico de SN como índices hematológicos 10), (27), (28, biomarcadores como la PCR, la procalcitonina (PCT), citocinas como la interleucina (IL)-1β, IL-8, IL-6, interferón (IFN)-γ, factor de necrosis tumoral (TNF)-α, quimiocinas como CXCR4 y CXCL12 6, marcadores de superficie celular, niveles de ácidos nucleicos en suero o plasma 29.
En esta revisión se describen los principios fisiopatológicos de la sepsis neonatal y las características de los biomarcadores más usados para su diagnóstico. Además, se mencionan detalles de otros marcadores que también han sido recientemente estudiados.
Metodología de búsqueda
Desde junio de 2017 hasta diciembre de 2018, por medio del motor de búsqueda PUBMED se buscaron y revisaron artículos científicos, usando las palabras clave “neonatal sepsis”, “biomarkers”, “c reactive protein”, “procalcitonin”, “interleukin 6”, “immunology” y “pathogenesis”. Se incluyeron los artículos publicados en los últimos cinco años y de investigación en humanos. En esta búsqueda fueron identificados 38 artículos, con base en el título y el resumen. De estos, fueron excluidos cinco por ser duplicados. También se usó como referencia el Tercer Consenso Internacional para la Definición de Sepsis y Choque Séptico (Sepsis-3) 4 como fuente de la definición de sepsis, dos artículos acerca de la inmunopatogenia de SN y cuatro artículos sobre epidemiología de SN que no fueron identificados durante la búsqueda, pero que los autores consideraron que, por su relevancia en el tema, era pertinente incluirlos en la presente revisión. Se revisaron en total 40 artículos para esta revisión.
Resultados
Principios fisiopatogénicos de la sepsis neonatal
Gran parte de la susceptibilidad, frecuencia y severidad de la sepsis neonatal se debe a las características del sistema inmune propias de la edad, explicado por importantes diferencias entre la inmunidad en neonatos y personas adultas 11), (30. Debido al tiempo que necesita la maduración del sistema inmune adaptativo, los mecanismos de defensa en los neonatos se fundamentan en el sistema inmune innato 30. Sin embargo, los RN pretérmino con menos de 32 semanas de edad gestacional tienen su sistema inmune innato también inmaduro 11, lo que los hace aún más vulnerables frente a procesos infecciosos 11. De hecho, hasta el 25% de los RN prematuros con menos de 32 semanas de gestación desarrollan una infección sistémica severa dentro de su periodo neonatal 11.
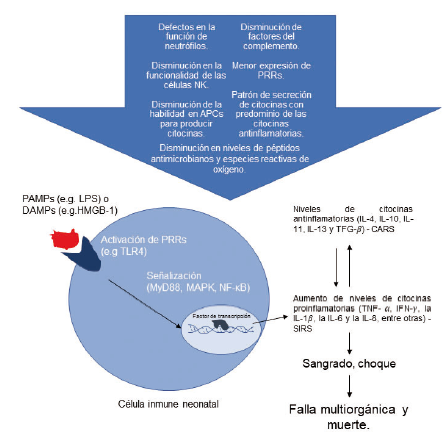
El sistema inmune inmaduro de los RN muestra una serie de diferencias cuantitativas y cualitativas en comparación con los individuos de mayor edad 31, que van a determinar las respuestas frente a estímulos patógenos (Ver Figura 1).
Fuente: autores
Figura 1 Particularidades del sistema inmune que afectan la inmunopatogénesis de la sepsis neonatal
La frecuencia de linfocitos T y B circulantes diferenciados a células de memoria y efectoras solo alcanzan hasta el 10% del total de linfocitos del RN 11. Los neutrófilos representan una cifra mínima de los leucocitos circulantes antes de las 32 semanas de gestación, además, tienen defectos en el reclutamiento, la actividad fagocítica, la expresión de moléculas de adhesión 2 y liberación de péptidos antimicrobianos y especies reactivas de oxígeno (ROS). Adicionalmente, los RN pretérmino carecen de la habilidad de formar redes extracelulares y péptidos antimicrobianos que eliminan microorganismos mediante las especies reactivas de oxígeno 11), (31; limitaciones en el aclaramiento de estos componentes facilita la diseminación sistémica y el agravamiento del proceso séptico 29. Los factores del sistema del complemento como C3a, Factor H, Factor I también están disminuidos en los RN pretérmino, lo que limita el reconocimiento, opsonización y aclaramiento de patógenos 11. El plasma neonatal tiene una disminución importante en la actividad opsonizadora, comparada con los adultos, lo que incrementa el riesgo de sepsis 2. Hay tres subtipos descritos de monocitos, según la expresión de CD14 y CD16 en su superficie; antes de las 29 semanas de gestación, la expresión de CD14 es baja 11, lo que limita la función de reconocimiento inmune y presentación antigénica de estas células 11. También, por debajo de las 24 semanas de gestación, poca actividad de los receptores de reconocimiento de patrones (PRR, en inglés) es detectada. La actividad de los PRR incrementa significativamente hasta la semana 33 de gestación, cuando alcanza un nivel similar al del RN a término 11. Inicialmente se produce la activación de los PRR endosomales, como los receptores Toll-Like (TLR, en inglés) 7, 8, y 9, luego los intracitoplasmáticos, como los receptores de dominio de oligomerización por unión de nucleótidos (NOD, en inglés), y los receptores NOD-like (NLR, en inglés), seguidos de los PRR extracelulares, como los TLR 1, 2, 4, y 5 11. La actividad del TLR 2, con un rol importante en el reconocimiento de Staphylococcus coagulasa negativa, se desarrolla tarde en la gestación 11. La respuesta de Th mediada por IL-17 parece ser importante en prevenir la invasión de microorganismos a través de las mucosas y por microorganismos intracelulares 11), (31. Con el fin de promover esta respuesta, las células presentadoras de antígenos neonatales producen grandes cantidades de IL-1β, IL-6, y de IL-23, no obstante, son producidas en bajos niveles en los RN pretérmino de menos de 29 semanas de gestación. En los neonatos, las funciones de las células NK, tales como la desgranulación, la liberación de IFN-γ y factores citolíticos están disminuidas en comparación con las respuestas que se producen en individuos mayores 31. También se conoce que las poblaciones de células dendríticas neonatales, tanto convencionales como plasmocitoides, muestran una disminución en la habilidad de producir múltiples citocinas asociado a la activación por medio de los TLR 31.
La flora microbiana del útero, la placenta, el canal vaginal y la piel cercana se modifica cerca al nacimiento. En el caso de los RN a término, hay factores que promueven la colonización por microorganismos benéficos 11. Este microbioma tiene un papel importante en la protección del RN contra infecciones 11. Los RN a término que nacen por vía vaginal son colonizados por la flora cutánea, intestinal y vaginal de la madre 11. En el caso de los RN pretérmino, más de la mitad nacen por cesárea, lo que probablemente altera la colonización normal, además, frecuentemente presentan algún déficit nutricional o están expuestos a tratamientos antibióticos prolongados, lo que puede alterar aún más la colonización normal y aumenta el riesgo de SN 11. Estas alteraciones de la flora normal favorecen el crecimiento de su contraparte patógena 11.
Los gérmenes aislados en la SN temprana están relacionados con la flora presente en la madre, adquirida al momento del parto o durante la gestación 7. La SN tardía puede ser causada por la entrada sistémica de bacterias ambientales vía catéter o por traslocación a través del intestino inmaduro, especialmente cuando ha sido comprometido, como en el caso de enterocolitis necrotizante 29. El reconocimiento de los patógenos por células inmunes locales es el primer paso para el desarrollo de una respuesta inmune una vez que se ha comprometido la barrera epitelial 2.
Las células inmunes reconocen patógenos intra y extracelulares por medio de estructuras microbianas características, o patrones moleculares asociados a patógenos (PAMP, en inglés), mediante los PRR. Los PRR más estudiados han sido los TLR. Hay 10 tipos de TLR en humanos, cada uno con ligandos específicos 2. El lipopolisacárido (LPS, o endotoxina) de las bacterias gramnegativas es el PAMP más estudiado, y es reconocido principalmente por el TLR 4 y su vía de señalización 31, de la que hacen parte las proteínas de membrana CD14 y MD2 2. Otro PAMP bien conocido es el ácido lipoteicoico, de las bacterias grampositivas, el cual es reconocido por medio del TLR 2 2. Los RNA virales de doble cadena hacen su señalización por medio del TLR 3, un receptor intracelular2. Frecuentemente, un microrganismo estimula más de un tipo de TLR simultáneamente 2.
Otros PRR intracelulares son los receptores NOD y los receptores NOD-like, que detectan peptidoglicanos de las bacterias grampositivas en el citosol, los receptores de lectinas tipo C, los receptores del Gen I inducible por ácido retinoico (RIG-I, en inglés) y los receptores RIG-like (RIR, en inglés), los cuales detectan RNA viral de doble cadena e inducen la producción de IFN-1 2), (11. La activación de los PRR activa una cascada de señalización, en la que intervienen múltiples factores como el factor de diferenciación mieloide 88 (MyD88), el factor regulador de interferones 5 (IRF5, más relacionado con la vía de producción de interferones), que llevan finalmente a la activación de las proteínas quinasas activadas por mitógenos (MAPK) y del regulador de transcripción maestro NF-κB, lo que a su vez lleva a la expresión genética y producción de citocinas proinflamatorias 2), (11), (16), (32. La señalización por medio de STAT6 lleva a la estimulación de la producción de citocinas antinflamatorias 11. Las citocinas son moléculas pequeñas con una corta vida media, que va desde minutos hasta algunas horas, y tienen un papel central en la migración y activación de las células inmunes 25.
Recientemente, se ha señalado la importancia de los patrones moleculares asociados a daño (DAMP, en inglés), que son proteínas intracelulares que se liberan como respuesta a un estímulo nocivo, pueden también estimular los TLR, y además amplifican la respuesta de receptores como el receptor para los productos finales de la glicación (RAGE, en inglés), lo que perpetúa la respuesta inflamatoria debido a una traslocación de DAMP de la madre al feto en el contexto de SN 25. Las proteínas de alta movilidad del grupo de caja 1 (en inglés, HMGB-1) son DAMP importantes que señalizan por medio de los TLR 2, TLR 4 y por RAGE, y se han relacionado con la progresión de la sepsis a choque séptico 2. La sepsis se asocia con disregulación en la muerte celular, incluyendo autofagia, apoptosis y piroptosis 1, llevando a la liberación de DAMP que estimulan aún más la respuesta inflamatoria 3. Las proteínas de choque térmico, otros DAMP conocidos, también señalizan a través de algunos TLR 2.
Actualmente es aceptado que la patogénesis de la SN se caracteriza por una respuesta inmune bimodal excesiva o suprimida, cuyas dos fases pueden ocurrir simultáneamente 30. El inicio de este proceso se da entonces como respuesta al reconocimiento por los PRR de los componentes de los organismos invasores, lo cual estimula la liberación de una variedad de citosinas 25. El TNF-α, IFN-γ, la IL-1β, la IL-6 y la IL-8 son citocinas proinflamatorias, abundantes en la primera fase de la SN, conocida como síndrome de respuesta inflamatoria sistémica (SIRS, en inglés)2. La estimulación de los neutrófilos, plaquetas, células endoteliales y otras células inmunes llevan a la producción de mediadores biológicamente activos como el factor de activación plaquetaria, metabolitos del ácido araquidónico, histamina, bradicinina, proteínas del complemento, péptidos vasoactivos y óxido nitroso, mediadores proinflamatorios que contribuyen con la respuesta inflamatoria sistémica característica del SIRS 25. Se cree que el incremento moderado de estas citocinas proinflamatorias tiene un rol protector al promover las respuestas antimicrobianas, mientras que una elevación excesiva se asocia con lo que se conoce como tormenta de citocinas, se asocia con un desenlace fatal debido a fallas multiorgánicas 30. La IL-10, IL-11, IL-13 y el factor de crecimiento transformante (TFG)-β son citocinas anti-inflamatorias2, producidas en la segunda fase de la respuesta inmune, conocida como síndrome de respuesta anti-inflamatoria compensadora (CARS, en inglés), especialmente en los pacientes con sepsis severa 25. Estas citocinas antinflamatorias bloquean la activación de los fagocitos, la fiebre, alteran la coagulación y disminuyen los niveles de mediadores vasoactivos. Los diferentes patrones de incremento de las citocinas pueden ayudar en la identificación del factor etiológico 30.
La disfunción inmune se relaciona con la progresión de la sepsis, debido a la disfunción de subpoblaciones de células T, incluyendo las células T reguladoras, cuya activación puede inhibir el exceso en la respuesta inflamatoria del huésped debido a la activación de las vías del TCR 22. Otras células con funciones inmunosupresoras son las células B reguladoras y las células dendríticas reguladoras 22. Las células B reguladoras ejercen su función inmunosupresora por la secreción de IL-10, mientras que las células T reguladoras pueden hacerlo también mediante inhibición por contacto al unir moléculas expresadas en su membrana, como el CTLA-4, TIM-3, y GITR, a su receptor en las células efectoras 22.
El estrés oxidativo que resulta de la respuesta del huésped frente a las endotoxinas de los microorganismos gramnegativos y a las exotoxinas de los grampositivos es responsable de la activación de radicales libres y citocinas proinflamatorias 33. Aunque los neonatos en el contexto de una infección tienen mayor actividad de enzimas antioxidantes como la superóxido dismutasa y la glutatión peroxidasa, en comparación con los adultos, los neonatos tienen menores niveles de agentes antioxidantes como vitamina E, β-carotenos y grupos sulfihidrilo, por lo cual, frente a un desbalance oxidativo y proinflamatorio, ocurre un significativo aumento en los niveles de PCR 33.
Las alteraciones en la coagulación ocurren en casi todos los pacientes sépticos 28. Durante un proceso infeccioso, la cascada de la coagulación empieza con el aumento de la expresión de factor tisular en los neutrófilos, monocitos o el endotelio, lo que lleva a un aumento de proteínas de la coagulación incluyendo el complejo trombina antitrombina, el inhibidor del activador del plasminógeno y el complejo plasmina-α2 antiplasmina 2. Además, también hay una inactivación de la proteína S y otras proteínas anticoagulantes, como la antitrombina III 2. Estos desórdenes de la coagulación que se presentan en la sepsis pueden ir desde hipercoagulabilidad localizada, lo que es en realidad un mecanismo de defensa que tiene como fin limitar la infección, pero que puede llevar a tromboembolismo y hasta coagulación intravascular diseminada (CID), caracterizada por la presencia de trombosis microvascular 2. En el caso de sepsis por gramnegativos, es el LPS lo que induce la activación de tromboplastina tisular que promueve el desarrollo de CID 3. Luego de la aparición de CID, los desórdenes hemorrágicos se presentan debido al agotamiento de plaquetas y factores de la coagulación 28. Los componentes del sistema de la coagulación tienen un papel en la modulación de la respuesta inflamatoria por lo cual la CID se asocia con mal pronóstico 28. La sepsis también es una causa importante de trombocitopenia en los neonatos 6 y una reducción importante en el recuento de plaquetas (<50x109/L) está asociado con incremento en el riesgo de sangrado 28. La disminución en la función de las plaquetas en los RN pretérmino aumenta aún más el riesgo de sangrado 2.
Durante la infección, la mielopoyesis en la médula ósea neonatal se disminuye rápidamente, lo que conduce a neutropenia, especialmente común en la SN por gramnegativos, lo que afecta negativamente la inmunidad antimicrobiana 2. Los neutrófilos neonatales tienen reducida elasticidad en comparación con los neutrófilos en los adultos, lo que asociado a una presión arterial baja aumenta el riesgo de oclusión microvascular 2. En los neonatos ocurre una agregación irreversible de los neutrófilos en el espacio vascular, lo que lleva a disminución en la diapédesis, depleción de las reservas medulares e incremento del riesgo de problemas de perfusión tisular, llevando finalmente a disfunción orgánica 2.
Sustancias producidas por otras células inmunes como factores del complemento, citocinas, factores de coagulación y otras, también contribuyen con el desarrollo de SN 2), (3. La producción de histamina por los mastocitos como respuesta a la infección probablemente también esté asociada con el choque séptico 2. Se ha visto que los mastocitos neonatales producen cantidades significativamente mayores de histamina en comparación con los mastocitos de adultos, lo que puede estar asociado con la vasodilatación y el desarrollo de choque 2.
La activación excesiva en respuesta a la infección por medio de los TLR del endotelio puede llevar a dilatación y fuga vascular de líquidos y proteínas, por la acción de varias sustancias como citocinas, quimiocinas, moléculas de adhesión, péptidos vasoactivos como el factor de activación plaquetaria, tromboxanos, leucotrienos, óxido nítrico, histamina, bradicinina, prostaglandinas, puede contribuir también con el desarrollo de hipovolemia y por último del choque séptico 2), (25.
Otros factores que contribuyen con el establecimiento del choque son la limitación del corazón del neonato para incrementar el volumen latido y la contractilidad, la vaso-regulación periférica anormal, alteraciones metabólicas y nutricionales, que incluyen aumento del gasto energético y el consumo de oxígeno, con una disminución en la función mitocondrial, ocasionada por la hipoxia y la presencia de ROS 2), (33.
El choque séptico termina llevando a una falla multiorgánica3, lo que se relaciona con un pronóstico ominoso, el bajo gasto cardiaco, la falla en la microcirculación, la formación de microtrombos y CID, puede llevar a compromiso de prácticamente todos los órganos, lo que termina por cobrar la vida del RN 2.
Biomarcadores en el diagnóstico de sepsis neonatal
El reto de la identificación de un biomarcador para SN se refleja en el hecho que más de 3000 moléculas han sido propuestas, con cerca de 200 candidatos evaluados 34. Un biomarcador ideal para SN debe identificar tempranamente y con precisión la enfermedad; la posibilidad de medir el indicador diariamente aumenta la probabilidad de detección temprana, además, un mínimo requerimiento de sangre (se ha sugerido <0,1 mL) es también una característica importante, así como la concordancia en su medición cuando se use sangre capilar o venosa 24. Debe tener ciertas propiedades como un punto de corte óptimo y estandarizado 5, alta sensibilidad y valor predictivo negativo25, y una especificidad y valor predictivo positivo > 0,85 26. Los niveles de los biomarcadores se alteran durante el curso de la enfermedad, razón por la que son útiles en el diagnóstico etiológico 5 y en el seguimiento 7, además de ser útiles en el monitoreo de la respuesta al tratamiento 24. Otras características que se buscan en el marcador ideal son la rapidez en la obtención de los resultados, poder ser medido automáticamente, que se realice una medida cuantitativa, que sea accesible y de bajo costo 16. Los biomarcadores usados se han clasificado en 3 grupos, clásicamente: reactantes de fase aguda, citocinas - quimiocinas y antígenos de superficie; para la presente revisión se incluyó el grupo de “otros marcadores”, donde se incluyen algunos marcadores con uso no difundido ampliamente y que han sido estudiados recientemente (Ver Tabla 1). Los biomarcadores en SN también se han clasificado dependiendo en tiempo en que ocurre su expresión en marcadores tempranos (e.g. CD64 o interleucinas) y tardíos (e.g. PCR, PCT) 24.
Reactantes de fase aguda
Proteína C reactiva
La Proteína C Reactiva (PCR) es el reactante de fase aguda más ampliamente estudiado y utilizado en SN, particularmente en SN temprana 26. Es una proteína de estructura pentamérica5 que pertenece a la familia de las pentraxinas 19, sintetizada en el hígado 32; se eleva como respuesta a un proceso inflamatorio por el aumento en los niveles de IL-6 23, IL-1β y TNF-α 5. Es medida por técnicas de inmunoturbidimetría y nefelometría 18. Sus niveles se elevan dentro de 6-1217 h desde iniciada la infección, con su pico máximo a las 48 h 16. Su vida media es de 19-48 h y puede aumentar hasta 1000 veces durante una infección 7), (35. Se considera que es eficiente para confirmar o descartar la presencia de infección después de 24 h de sospechado el proceso infeccioso 10. El punto de corte más preciso y consistente en los reportes es 10 mg/L 11), (18), (26, aunque otros autores proponen >6 mg/L como el valor aceptado para el punto de corte5. Adicionalmente, se están haciendo estudios para comprobar la utilidad de PCR de alta precisión, la cual se considera normal cuando el valor es <1mg/L, punto de corte que ha demostrado poder ser más sensible que la prueba convencional en el diagnóstico de SN 5. Las mediciones seriales durante las primeras 24-48 h tienen mejor sensibilidad (74-98%) y especificidad (71-94%); estas mediciones se usan también para evaluar la respuesta a la terapia antibiótica14,26. El valor predictivo positivo varía entre 77-100% y el valor predictivo negativo varía entre 73-98% 18. Los valores normales seriados tienen un 99% 5 de valor predictivo negativo para el diagnóstico de infección, por lo que puede ayudar en la decisión de suspender la terapia antibiótica 7), (17. Se han realizado estudios que muestran que los niveles de PCR medidos en saliva tienen buen rendimiento para el diagnóstico de SN con punto de corte 3,48ng/L, la PCR en saliva tuvo una sensibilidad de 94,3% y especificidad del 80%; en un punto de corte de 3,4ng/L, tuvo una sensibilidad de 94% y especificidad de 91,3% en la predicción de PCR ≥10mg/ L 19. Los niveles persistentemente elevados de PCR deben hacer sospechar la presencia una infección por hongos 32, tratamiento inadecuado debido a resistencia farmacológica o surgimiento de complicaciones 24. Diferentes valores para la sensibilidad y especificidad se han publicado con respecto a este marcador, lo que puede explicarse por las variaciones en los estudios en cuanto a la definición de sepsis, metodología de las mediciones, valores de referencia, características de los pacientes, entre otros 26.
Dentro de las limitaciones de la PCR como biomarcador para infección se encuentran la elevación por procesos inflamatorios no infecciosos como el estrés del parto 26, exposición a glucocorticoides, RPM, asfixia perinatal o choque, administración de surfactante, hemorragia interventricular, neumotórax, convulsiones y otros 5. La no disponibilidad de rangos de referencia específicos por edad, el desconocimiento de los cambios en la cinética dependiente del peso al nacer y la edad gestacional 7, son algunas de sus limitaciones. La PCR tiene una baja sensibilidad para detectar sepsis temprana debido a la demora en la inducción de su síntesis hepática 18.
Procalcitonina
La Procalcitonina (PCT) es la pre-hormona de la calcitonina, secretada normalmente por las células C tiroideas 27. Es una proteína de 116 aminoácidos con un peso molecular de 14 kDa 5 con un rol importante en el metabolismo del calcio y como reactante de fase aguda en respuesta a estímulos inflamatorios, especialmente bacterias 27 y se mide por inmunoturbidimetría generalmente 18. La PCT en el contexto de un proceso infeccioso de origen bacteriano, también se produce en otros órganos como el hígado 27, células neuroendocrinas del pulmón y los intestinos y en las células polimorfonucleares de sangre periférica 27, sustentado en que se ha observado que la PCT también se incrementa en pacientes que han sido sometidos a tiroidectomía 36. Esta se empieza a sintetizar desde 2-4 h desde el inicio de la infección bacteriana, lo que se refleja en un aumento de sus niveles entre 6-8 h desde el inicio del proceso infeccioso 7. Tiene su pico máximo a las 18-24 h y su vida media es de 24 5-30 h 7), (35. Los niveles de PCT incrementan hasta las 24 h de vida y se mantienen estables durante 2 días 36. La PCT se eleva y regresa antes a la normalidad comparado con la PCR 23 y también es más sensible y específica para identificar infecciones bacterianas en los neonatos 9), (17. Un valor de 0,05 ng/mL de PCT en suero, prácticamente descarta la presencia de sepsis 36. En un estudio realizado por Chiesa et al., en el cual se incluyeron 83 neonatos sanos, el valor de PCT más alto al nacimiento fue de 0,7 ng/mL 37. Los rangos de referencia para los niveles normales están establecidos por hora de vida, tanto para RN a término y pretérmino 36. Los niveles de PCT son independientes de la edad gestacional7, pero se ha demostrado que en RN con 32 o menos semanas de edad gestacional se afecta por la edad post-natal 5, el punto de corte más usado es >2,0 ng/mL 27. Su sensibilidad ha sido reportada entre 72-79% y su especificidad entre 7290% al momento del inicio de los síntomas 18, aunque otros valores también se han reportado debido a las diferencias metodológicas de los estudios 7), (26), (37. Los niveles persistentes o en ascenso sugieren un mal pronóstico de la enfermedad 25.
Los niveles de PCT pueden elevarse en condiciones no infecciosas como asfixia neonatal, hipoxemia y hemorragia intracraneal 7. También existe evidencia que sugiere que la edad gestacional menor a 37 semanas, el muy bajo peso al nacer, un puntaje de APGAR de 4 a los 5 minutos, administración prenatal de antibióticos y el uso de surfactante pulmonar puede aumentar los niveles de PCT en la primera semana de vida 36.
La precisión de esta prueba varía según si se trata de SN temprana o tardía, aún quedan por establecer umbrales distintos según estas condiciones 36. Varios investigadores han sugerido que el mejor rendimiento de esta prueba se obtiene al medirla a las 24 h de vida, además, la toma de 2 muestras, una al momento del nacimiento y otra a las 24 h de vida, tiene más utilidad clínica que una sola muestra aislada 36. También se ha demostrado un mejor rendimiento de la prueba en combinación con la PCR 16. Últimamente se han realizado estudios evaluando también el uso de una relación PCT/PCR, que ha mostrado ser útil 38.
Amiloide Sérico A
El amiloide Sérico A (ASA) pertenece al grupo de las apo-lipoproteínas, la cual es sintetizada en el hígado, células endoteliales, monocitos y leiomiocitos 5. Esta se secreta en respuesta al trauma o infección 5. Se le atribuyen funciones como quimiotaxis, inmunomodulación y regeneración tisular 26. Los niveles de ASA dependen de la IL-1, la IL-6 y el TNF-α16 y varían con la edad5. Diferencias metodológicas asociadas al establecimiento de puntos de corte que van desde 1-68 mg/L hace que los estudios sean heterogéneos 18. Se ha visto que sus niveles incrementan desde 8-24 h después de la infección y hasta 1000 veces durante una infección 18. En general, tiene una especificidad del 92% y una sensibilidad del 78% 26. Los niveles de ASA tienen una relación inversa con la mortalidad 7.
Proteína de unión a lipopolisacárido
La proteína de unión a LPS (PUL) es un tipo de molécula de reconocimiento de patrón soluble, sintetizada por los hepatocitos y miocitos, principalmente 26. Cumple dos funciones, unirse y transportar endotoxinas a las células CD14+ (monocitos) y el reconocimiento de PAMPs de espiroquetas, micobacterias, micoplasmas y bacterias grampositivas26. Sus niveles se elevan de 6-8 horas de iniciado el proceso infeccioso 5. Tiene una sensibilidad de 94,1% y una especificidad de 77,8% 7, un valor predictivo positivo de 88,9% y un valor predictivo negativo de 87,5% en un punto de corte de 17,5 mg/L 26.
Hepcidina
La hepcidina es un péptido de 25 aminoácidos sintetizado principalmente en el hígado, con un rol crítico en la homeostasis del hierro y los procesos inflamatorios 3. Esta hace parte de un grupo de moléculas con carga positiva, conocidas como péptidos antimicrobianos, con funciones como regular la respuesta inmune y la apoptosis; además, recientemente se han documentado funciones bactericidas, al insertarse en la membrana de fosfolípidos y causar disrupción, lo que provoca salida del contenido citoplasmático 3. En el contexto de una infección, la circulación de LPS e IL-6 inducen la expresión de hepcidina por los neutrófilos y macrófagos 3. Los rangos normales en suero reportados han sido 33-71,3 ng/mL para los neonatos pretérmino y 55,3- 86,8 ng/mL para los recién nacidos a término 26. Con un punto de corte de 92,2 ng/mL, la sensibilidad y especificidad fueron de 76% and 100%, respectivamente26. Otros péptidos antimicrobianos como la catelicidina y las defensinas también han sido propuestos como potenciales biomarcadores en sepsis neontal 3.
Otro reactante de fase aguda que ha sido estudiado como biomarcador de sepsis, aunque en menor medida, es la lectina de unión a manosa 26.
Citocinas y quimiocinas
Son pequeñas moléculas con una vida media corta, con un papel central en la respuesta inmune 25. Las concentraciones de las citocinas varían desde ρg/mL hasta µg/mL 25. En el contexto de SN, los cambios en los niveles de las citocinas pueden verse reflejados antes que los cambios en los niveles de los reactantes de fase aguda, sin embargo, los costos de las pruebas manuales y la disponibilidad de los equipos para su medición 16 representan una barrera en la implementación rutinaria en la práctica clínica de estas pruebas 26. Las más evaluadas en sepsis neonatal han sido la IL-6, IL-8, IL-10 y TNF-α con resultados aceptables.
Interleucina-6
La IL-6 es la citocina más estudiada en los neonatos 25. Es una citocina inducida por el LPS y otros componentes bacterianos, que es producida particularmente por monocitos, células dendríticas, linfocitos B, T, células endoteliales y fribroblastos 5. Esta induce la activación de células B y la secreción de anticuerpos, además de estimular la diferenciación de células T citotóxicas25. Sus niveles se elevan antes de que se presenten signos o síntomas de infección. Esta elevación de IL-6 induce el aumento en los niveles de PCR 32. Los niveles de IL-6 aumentan dentro de las 2-6 h de iniciada la infección 16), (25, tiene una vida media más corta que la PCR y la PCT27, además, su concentración disminuye hasta volverse indetectable en la mayoría de pacientes con infección dentro de las 24-48 h 32, siendo aún más rápida esta disminución cuando se administra tratamiento antibiótico 16, razones por las que se considera que puede ser de utilidad como marcador temprano de la enfermedad 18), (25. Se ha demostrado que en la SN por hongos hay una elevación sustancial de IL-6 y TNF-α, cuando se compara con SN de etiología bacteriana 30, aunque se ha reportado también que la IL-6 se eleva más en la SN por gérmenes gramnegativos 32. Se han propuesto varios puntos de corte con un rango que va desde 1870 ρg/mL 26 en plasma. Tiene una sensibilidad de 79%, una especificidad del 84% 39 y un valor predictivo negativo de 93-100%7. Se mide por ensayo de inmunoadsorción ligado a enzima 18. Recientemente se han hecho ensayos con una prueba rápida de IL-6, que tarda una hora, y los resultados fueron similares a la prueba de laboratorio usual en cuanto al rendimiento de detección de SN tardía, pero fue menos sensible para los casos de SN temprana 24. Al combinar la IL-6 con la PCR aumenta su rendimiento de manera importante 7), (26.
Interleucina-8
La cinética de la IL-8 es similar a la de la IL-6 16. Es producida por monocitos, macrófagos, fibroblastos y células endoteliales5. Se eleva dentro de las 2-4 h de iniciada la infección, con un pico a las 2 h 25) y luego una rápida declinación a las 4 h 5). A las 48 h ya ha disminuido considerablemente 25. Se relaciona con la activación y quimiotaxis de los neutrófilos. La sensibilidad y la especificidad de la IL-8 para el diagnóstico de SN varía entre 81-92% y 70-94%, respectivamente, cuando se usan puntos de cortes de 70-90 ρg/mL 16. En los RN con menos de 32 semanas de gestación pueden encontrarse niveles más altos 25. En combinación con la PCR, PCT o IL-6 su rendimiento aumenta 40. La desventaja de la medición de la IL-8 en comparación con la IL-6 es su límite de detección, ya que para la IL-6 es >0,7 ρg/mL, mientras que para la IL-8 es >10 ρg/mL 25.
Factor de necrosis tumoral-alfa
El TNF-α es una citocina proinflamatoria de 17 kDa que resulta del clivaje de una proteína transmembrana homotrímera de 26 kDa 26, producida principalmente por macrófagos, monocitos y células dendríticas 25. Frente a la exposición de LPS tiene una rápida elevación desde 30 minutos después del estímulo 25 y alcanza su pico a los 90 minutos 25. Tiene una vida media estimada de cerca de 70 minutos 25. Tiene efectos sobre los vasos produciendo dilatación y aumento de la permeabilidad lo que lleva a que se desarrolle edema, disminución del volumen sanguíneo e hipoproteinemia lo que puede progresar a choque 25, además junto con la IL-1β pertenecen al grupo de citocinas pirógenas, involucradas en el desarrollo de la fiebre 25. El estímulo del TNF-α induce la producción de otras citocinas como la IL-6 e IL8 25. Los niveles de TNF-α no se afectan por la edad gestacional o posnatal 5. Se han estudiado varios puntos de corte para el diagnóstico de SN, desde 0,18-20 000 ρg/L. La sensibilidad y la especificidad han sido de 66-68% y 76-89%, respectivamente 26.
Interleucina-10
La IL-10 es una citocina con un rol anti-inflamatorio importante en la sepsis, regulando la producción de citocinas proinflamatorias, especialmente los niveles de TNF-α, IL-1, IL-6, IFN-γ, y GM-CSF, por lo cual tiene un papel importante en la fase del CARS, junto con el TFG-β 25. Es producida por monocitos, macrófagos, células T, células B y células NK 25. Se ha reportado que una alta relación de IL-10/TNF se asocia con SN tardía severa 25. En un punto de corte de 17,3 ρg/mL, se ha reportado que la IL-10 tiene una sensibilidad del 92% y una especificidad del 84% para el diagnóstico de SN confirmada por cultivo 26. Se ha demostrado que altos niveles de estas citocinas se asocian con choque séptico en niños 25. También, se ha observado que en los pacientes con sepsis de origen micótico son los que tienen niveles de IL-10 más altos 30.
Quimiocinas
Las quimiocinas son citocinas quimiotácticas que direccionan la migración leucocitaria. Estas se clasifican en subgrupos dependiendo la posición de los dos primeros residuos conservados de cisteína cerca del extremo amino-terminal 6.
El receptor tipo 4 de α-quimiocina (CXCR-4, también conocido como CD184) es específico para el factor-1 derivado del estroma (SDF-1, también llamado CXCL12), y es una molécula con alta actividad quimiotáctica para los linfocitos. Su expresión se ha visto aumentada en la superficie de los linfocitos circulantes durante un proceso séptico o la estimulación con LPS 6. El CXCL12 pertenece al grupo de quimiocinas CXC, está involucrada en procesos de angiogénesis, migración leucocitaria y otros 6. La utilidad de estos 2 marcadores, especialmente en combinación con la PCR, ha sido demostrada en el diagnóstico de SN tardía 6. El CCL5 (más comúnmente conocida como RANTES, por su sigla en inglés), es una proteína de 8 kDa, con función quimiotáctica en basófilos, eosinófilos y células T. Se ha visto que sus niveles normales disminuyen en los procesos sépticos y que puede ser útil como biomarcador 26; además, hay datos que sugieren que los niveles disminuidos de CCL5 pueden ayudar a predecir el desarrollo de CID 2.
Otras quimiocinas que podrían ser usadas para el diagnóstico de SN son MCP-1 y IP-10 7. Hay estudios que muestran que el IP-10 es un biomarcador temprano de infección sensible 2.
Antígenos de superficie celular
Al presentarse una respuesta inflamatoria a causa de una infección, se presenta un aumento en la expresión de antígenos leucocitarios 7. Estos antígenos pueden ser medidos con bastante precisión mediante citometría de flujo, pudiéndose obtener resultados en menos de 1 h y usando un volumen de sangre mínimo, de hasta aproximadamente 50 µL de sangre total 26. Algunas moléculas que se expresan en las membranas celulares pueden ser usadas como biomarcadores de infección. Entre estas se encuentran el receptor de la fracción C3 del complemento (CD11β/CD18) 7, presepsina o CD14 subtipo soluble (CD14ss) 26, CD16, CD32, E-selectina (CD62), L-selectina (CD62L), CD64 16, CD69 7, CD163 soluble, el receptor del activador del plasminógeno tipo uroquinasa soluble (suPAR), receptor de activación expresado en células mielomonocíticas soluble-1 (sTREM-1) 18, moléculas de adhesión intercelular-1 (ICAM-1) y moléculas de adhesión de células vasculares-1 (VCAM-1) 26. El más estudiado ha sido el CD64 7.
CD64
También llamado Receptor Fcγ I, es un receptor de alta afinidad para las inmunoglobulinas IgG1 e IgG3 expresado en las membranas de los neutrófilos inactivos, en número de aproximadamente 1000 por célula 25 esta molécula actúa promoviendo la fagocitosis y es expresado frente a una infección bacteriana, los neutrófilos se activan y la expresión de CD64 se puede incrementar hasta 10 veces en un lapso de 4-6 h 25. Se ha reportado una sensibilidad entre 75-95% y una sensibilidad entre 77-88% al inicio de los síntomas de la SN tardía, requiriendo solo 50 μl de sangre y siendo medido usualmente por citometría de flujo.
Presepsina o CD14 subtipo soluble
La presepsina es una forma soluble truncada del CD14 26. Sus niveles están aumentados en los neonatos con sepsis, aunque no se evidencian grandes diferencias comparado con los pacientes con SIRS de origen no infeccioso. Se ha reportado un punto de corte >1.39 μg/mL con sensibilidad de 83% y especificidad de 65%, para neonatos con menos de 48 h de vida, mientras que, para los neonatos con mayor edad, el punto de corte reportado es >0.59 μg/mL, con sensibilidad y especificidad de 67% y 88%, respectivamente 26.
Otros biomarcadores
Resistina
La resistina es una hormona descubierta recientemente cuya función está relacionada con la adipogénesis y el desarrollo de resistencia a la insulina 23. Esta hormona es secretada en los humanos por las células mononucleares, los macrófagos y los neutrófilos 23. Hay estudios que soportan que la resistina tiene un rol como agente proinflamatorio 23. Mas aún, se ha reportado que los niveles de resistina se encuentran elevados en los pacientes con SN comparado con controles sin RPM prolongada ni SN y que este aumento también se correlaciona con un incremento en los niveles de IL-6 23. Sus niveles disminuyen si la madre ha recibido esteroides 23.
Fibronectina, haptoglobulina y neopterina
La fibronectina con una especificidad de 96% y sensibilidad de 63%, la haptoglobulina con especificidad de 95% y sensibilidad de 67%, y la neopterina con especificidad de 85% y sensibilidad de 78% son biomarcadores proteicos que han sido evaluados para ser usados para el diagnóstico de sepsis neonatal7.
Otros biomarcadores que están siendo estudiados como potenciales biomarcadores de infección son: pentraxina 3 (PTX3), lipoproteína Apo-A, calprotectina y proadrenomedulina, entre otros26. Recientemente la proteómica, genómica, el análisis post-genómico 1 y metabolómica se han perfilado como ramas que pueden proveer herramientas útiles en el estudio de la SN 26, pero aún están en sus fases iniciales 25. Por ejemplo, en el caso de los GBS y la E. coli, los principales agentes etiológicos de SN, se ha evaluado la caracterización de genes que codifiquen factores de virulencia de estos gérmenes relacionados con el desarrollo de SN. Así mismo, se puede evaluar la presencia de los factores de virulencia en estos microorganismos7.
Conclusiones
La SN aún representa un problema de salud importante alrededor del mundo ya que su diagnóstico sigue siendo problemático, así como tomar la decisión de iniciar o no un tratamiento antibiótico. Se han venido realizando esfuerzos buscando un biomarcador que pueda ayudar a tomar estas decisiones con más seguridad. En el estudio de su fisiopatología se han descrito múltiples factores que se producen dentro del proceso infeccioso que podrían servir como biomarcadores de la enfermedad. Debido al enfoque de la presente revisión, se dejaron de lado los parámetros hematológicos que han sido ampliamente estudiados también como herramientas en el diagnóstico de SN. A pesar de que son múltiples los biomarcadores que se han estudiado en SN, aún no hay disponibilidad de un biomarcador ideal que se pueda usar de manera individual. El mejor rendimiento de los biomarcadores disponibles se obtiene cuando se usan en combinación; hasta ahora se ha recomendado el uso conjunto de un marcador temprano con uno tardío para mejor rendimiento y en mediciones seriadas. Las diferencias en la metodología entre los diferentes estudios hacen difícil establecer un solo punto de corte y rangos de normalidad para ser tomados como referencia en la práctica clínica, por lo que estudios en cada una de las poblaciones son pertinentes para hallar estos valores. Para las definiciones es pertinente adoptar las directrices de las recomendaciones internacionales con el fin de poder comparar los estudios realizados en los distintos escenarios. Las ramas de las ciencias “-ómicas” incipientes podrían en un futuro ayudar con el diagnóstico más eficiente de la SN.














