Introducción
La hemorragia digestiva alta (HDA) o superior, es una situación clínica que se presenta cuando existe una estructura sangrante que tiene como lugar el esófago, estómago o la primera porción del duodeno, teniendo como límites anatómicos el esfínter esofágico superior y el ligamento de Treitz1-3. Dicho sangrado puede proceder de estructuras contiguas que vierten el contenido hemorrágico en el tubo gastrointestinal o ser directamente originado en el tracto digestivo1,4. La hemorragia digestiva se divide en superior e inferior, siendo la primera hasta cinco veces más frecuente que la segunda.. Actualmente esta patología es una causa importante de admisión hospitalaria y, a pesar de los avances médicos para su determinación y tratamiento, no se ha logrado mejorar la tasa de mortalidad (alrededor del 10%) en los pacientes.
La HDA ha sido catalogada como la principal emergencia gastroenterológica por su alta prevalencia, siendo en Estados Unidos de 50 a 172/100000 personas por año. La incidencia de esta condición clínica está reportada entre 34, 72 y 100/100 000 personas en España, Reino Unido y Malasia respectivamente7,8. La mortalidad de las personas que presentan la HDA es más alta en China donde oscila entre 4 y 14%; en latinoamérica, específicamente en Perú y México la mortalidad es cercana al 9 y 4% respectivamente; en Colombia, por su parte, hay pocos estudios que documenten los aspectos epidemiológicos de esta entidad, sin embargo, se puede afirmar que la mortalidad ha permanecido entre el 5 y el 10% en los últimos 20 años; por otro lado, en un estudio realizado en Bogotá, capital del país, el 5.7% de las endoscopias realizadas fueron por hemorragia digestiva y en Barranquilla la HDA fue la indicación del 20% de las esofago-gastroscopias8-12.
La HDA se presenta mayoritariamente en personas de sexo masculino con una edad media de 60 años, y se estima que el 13,9% de pacientes que la presentan, resangran en los primeros siete días, pero dicha cifra asciende al 30% según la bibliografía estadounidense y británica; además, el impacto económico que conlleva alcanza los 2000 millones de dólares anuales en Estados Unidos8,13-18.
La presentación clínica de la HDA difiere de la inferior en que generalmente no se encuentra contenido hemático en el recto, pero sí cursa con hematemesis y melenas; en ocasiones se presenta con signos sistémicos propios de una pérdida de sangre como lo son debilidad, mareo y síncope. Diferentes hallazgos como epistaxis, gingivorragia, sangrado tonsilar e incluso alimentos de color rojo y diversos medicamentos que contienen bismuto pueden semejar una falsa hemorragia digestiva alta19.
Los antiinflamatorios no esteroideos (AINES) son considerados un factor de riesgo importante para presentar sangrado digestivo alto al debilitar los mecanismos protectores de la mucosa gastrointestinal20. Un estudio en Turquía demostró que el 16,3% de pacientes con hemorragia digestiva superior estaban medicados con AINES21. Respecto al alcoholismo se determinó que el 23,7% de pacientes que resangraron presentaban este antecedente16. También han sido documentados otros factores de riesgo como el sexo masculino, cirrosis, inhibidores COX-2 selectivos e infección por Helicobacterpylori 22.
El pronóstico de la HDA puede variar entre leve y mortal: pacientes con sangrado leve podrían recuperarse completamente sin tratamiento clínico específico, mientras que aquellos con sangrado severo pueden experimentar una complicación severa e incluso la muerte si no reciben el tratamiento para su condición2,9.
La identificación temprana de factores de riesgo y la predicción del pronóstico pueden inducir una intervención apropiada, reduciendo así la mortalidad, la morbilidad, la estancia hospitalaria y los costos. En este sentido, se han desarrollado varios sistemas de puntuación para predecir la gravedad en pacientes con HDA23.
Durante la última década, el manejo de la HDA y la comprensión del riesgo de estratificación siguen siendo un tema frecuente de investigación y publicación, puesto que el diagnóstico precoz, así como la estratificación precisa de pacientes con mayor riesgo de mortalidad y resangrado, pueden impactar en las decisiones clínicas y ayudar al momento de tomar decisiones finales pertinentes. Existen múltiples sistemas de puntuación que estratifican a los pacientes en aquellos con alto y bajo riesgo, sin embargo, continúan las controversias relacionadas con la estratificación del riesgo, papel de la endoscopia, el tratamiento específico, la necesidad de cirugía adicional, la intervención endoscópica y la muerte en aquellos pacientes clasificados. En consecuencia, hay diferentes perspectivas entre los autores sobre cómo usar adecuadamente estas escalas en los pacientes ya que la mayoría de los estudios se han centrado en la mortalidad y estancias hospitalarias, dejando rezagados otros desenlaces..
Las escalas de evaluación para HDA han surgido desde el siglo pasado debido a la necesidad de diagnosticar y clasificar rápidamente a los pacientes para así establecer los desenlaces más y menos probables de acuerdo al resultado obtenido; en este artículo se plantean cuatro de ellas: Forrest, Rockall, Glasgow Blatchford y AIMS65, cada una evalúa diferentes variables tales como hallazgos de laboratorio, examen físico, hallazgos endoscópicos, comorbilidades y edad, las cuales se relacionan con el resangrado, mortalidad, necesidad de intervención, estancia hospitalaria y costo del tratamiento. En los últimos años se han llevado a cabo numerosos estudios con poblaciones que presentan HDA para evaluar la capacidad predictiva de dichas escalas; sin embargo, estas publicaciones difieren en los resultados obtenidos y evidencian la inexistencia de una escala de evaluación única con excelente desempeño, lo que presenta actualmente una limitante en la estratificación de los pacientes y abre nuevas posibilidades orientadas hacia el mejoramiento o la creación de nuevas escalas que destaquen entre las demás.
Este artículo tiene como objetivo exponer una descripción clara sobre aspectos clave relacionados con la etiología, diagnóstico, factores de riesgo y, particularmente, escalas de evaluación que se han usado en pacientes con HDA alrededor del mundo.
Metodología de búsqueda
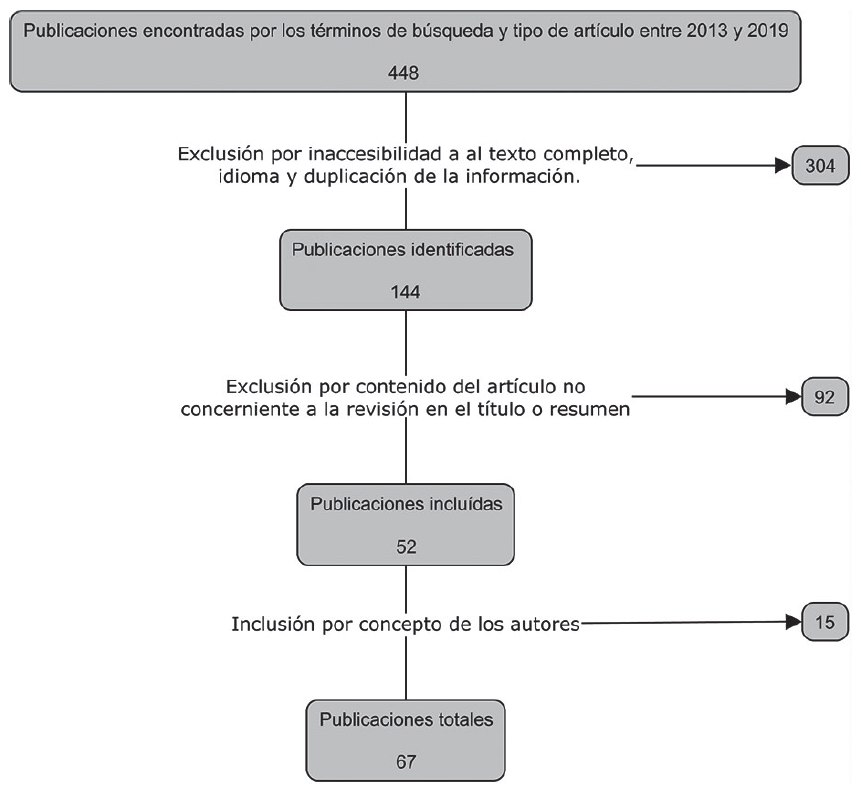
La consulta se realizó entre los meses de junio y noviembre de 2019 en la que se seleccionaron artículos originales, reportes y series de casos, revisiones sistemáticas y narrativas en las bases de datos PubMed y ClinicalKey. Los términos de búsqueda en español fueron hemorragia digestiva superior, hemorragia gastrointestinal por separado y estas dos combinadas con el booleano [AND] con escalas de evaluación; las principales palabras de búsqueda en inglés fueron upper gastrointestinal bleeding, gastrointestinal hemorrhage . evaluationscales. Se excluyeron artículos que estaban disponibles en un idioma diferente al inglés o español, se hizo lo propio con los artículos que según criterio de los autores basándose en la revisión del título y del resumen de los artículos, no contasen con la información necesaria para dar respuesta al objetivo, sea porque no ahondaban en aspectos epidemiológicos, etiológicos, diagnósticos o terapéuticos relevantes para la revisión de tema o porque no poseían información en cuanto a las escalas de evaluación; también se excluyeron publicaciones por duplicación de la información y por falta de acceso al texto completo según las licencias otorgadas por la Universidad Pontificia Bolivariana. Se priorizaron artículos publicados entre 2013 y 2019, se incluyeron los artículos que en el título o resumen evidenciaran un abordaje integral de la hemorragia digestiva alta y aquellas publicaciones concernientes a las escalas de evaluación. Los autores añadieron artículos que consideraron pertinentes para enriquecer el proceso de introducción y discusión de la presente revisión de tema y algunos más antiguos para contextualizar el desarrollo de las diferentes escalas de evaluación. (Ver figura 1)
Etiologías
Los autores dividen la HDA en dos grupos: no varicosa y varicosa, teniendo cada una presentación diferente24-27. (Ver Tabla 1)
La hemorragia no varicosa engloba las úlceras esofágicas bajas, gástricas y duodenales, erosiones gastroesofágicas, reflujo gastroesofágico, gastropatía hipertensiva portal y tumor gástrico, por su parte, el sangrado de origen varicoso se presenta principalmente mediante las várices esofágicas. El síndrome de Mallory Weiss también es considerada una causa importante28. Las patologías más prevalentes son la úlcera péptica (duodenal y gástrica) y las várices esofágicas8,16,27-29.
Úlcera péptica
Es una lesión del tracto digestivo generada por el ácido peptídico el cual ocasiona una rotura epitelial que alcanza la submucosa, generalmente localizada en el estómago o la porción proximal del duodeno4,30. Las dos principales causas de esta patología son la colonización por Helicobacterpylori y el uso de AINES: la bacteria posee varios mecanismos para dañar la mucosa: el primero es una inhibición de las células D que son productoras de somatostatina, lo que finalmente genera una hipersecreción de gastrina que produce una carga acida en el duodeno, el segundo es la disminución en la secreción de bicarbonato y el tercero es el bloqueo de la liberación de secretina en el duodeno, además induce la liberación de sustancias proinflamatorias que empeoran el cuadro. Los AINES generan una disminución de las prostaglandinas por inhibición de la vía de la ciclooxigenasa 1, lo que lleva a una alteración de la capacidad que tienen las células para repararse debido a una disminución del flujo sanguíneo31. Esta patología puede llevar a una complicación grave: la úlcera péptica perforada, la cual confiere el riesgo de una exposición del peritoneo al contenido gástrico32.
Las ulceras también se encuentran asociadas a estrés fisiológico, hipersecreción ácida (gastrinoma) y malignidad. La ulceración inducida por estrés se observa en pacientes gravemente enfermos en unidad de cuidados intensivos, con ventilación mecánica a largo plazo y coagulopatía..
La presentación clínica varía de acuerdo a la localización de la lesión, los pacientes con una úlcera ubicada en la porción gástrica presentan dolor abdominal postprandial, emesis, náuseas y pérdida de peso; mientras que las ubicadas en el duodeno generan síntomas como deseo de alimentarse constantemente y dolor abdominal nocturno el cual está asociado a la secreción gástrica33. En caso de una perforación, el paciente presenta dolor de ubicación epigástrica y rigidez abdominal debida a la afección peritoneal32. La mortalidad de las úlceras pépticas se encuentra alrededor del 10%, sin embargo, puede aumentar al 30% cuando se perfora34.
Várices esofágicas
Son consideradas una complicación de la hipertensión portal. La ruptura de las várices suele ocurrir en aquellos pacientes que presentan una presión portal superior a los 12 mmHg, que se evidencia en aproximadamente el 50% de los pacientes diagnosticados con cirrosis; cabe aclarar que dicha ruptura también puede presentarse con valores de presión portal menores al planteado4,35-37.
La formación de estas várices está relacionada con un aumento de la resistencia al flujo portal lo cual genera un incremento de presión que lleva a la apertura de canales vasculares embrionarios que se dilatan progresivamente y que además, ven su crecimiento favorecido por la expresión de factores de crecimiento derivados del endotelio vascular (VEGF)38.
El aspecto clínico de estos pacientes es producto del aumento de presiones que tienen como consecuencia el sangrado de origen varicoso, el cual, cuando se presenta en conjunto con ascitis en pacientes con cirrosis, implica una mortalidad del 57% según una revisión sistemática con 118 estudios y 23 797 pacientes38,39.
Esofagitis
Representa aproximadamente el 10% de los casos de HDA, el reflujo gastroesofágico grave y el abuso de alcohol son los dos factores de riesgo más comunes para la esofagitis erosiva. Otras causas de esofagitis asociada con sangrado son la esofagitis infecciosa y la asociada a fármacos..
La isquemia puede conducir a necrosis esofágica, aunque es poco frecuente. En pacientes con HDA secundaria a esofagitis, la hematemesis es más común que la melena, la presencia de odinofagia y disfagia dependerá de la cronicidad y gravedad de la condición subyacente..
Síndrome de Mallory Weiss
Es una causa de HDA que en la mayoría de los casos es autolimitada40. Esta patología consta de laceraciones longitudinales que no perforan la unión gastroesofágica, origina del 3 al 15% de los sangrados y su mecanismo es la generación de un aumento de presiones en la cavidad abdominal y gástrica que se refleja a nivel de la unión entre el estómago y el esófago41.
Los factores de riesgo documentados son el hipo, la tos, convulsiones y traumas torácicos; el consumo de alcohol está presente en un 30-60% de los pacientes mientras que la hernia hiatal en un 40-80%. Su causa también puede ser iatrogénica por procedimientos de estudios ecocardiográficos a nivel de la unión gastroesofágica o cardias42.
La presentación clínica generalmente está precedida por vómito, náuseas o tos y los pacientes presentan de manera frecuente hematemesis, aunque también puede cursar con otras manifestaciones de menor incidencia como dolor epigástrico o de espalda, melena y hematoquecia. Debido a la hemorragia también puede comprometerse la hemodinamia lo que se verá reflejado mediante taquicardia e hipotensión43. La mortalidad del síndrome de Mallory Weiss en pacientes con HDA es del 5,3%42.
Diagnóstico e intervención
Antes de cualquier diagnóstico, se presta un abordaje que asegure la estabilidad hemodinámica del paciente mediante administración de oxígeno, reposición del volumen intravascular y transfusiones sanguíneas que mantengan la hemoglobina entre 7 y 9 g/dl según la Guía de la Sociedad Europea de Endoscopia Gastrointestinal (ESGE); también recomiendan el inicio inmediato de inhibidores de bomba de protones vía intravenosa4,44,45.
Los pacientes son clasificados según aspectos clínicos como su estado hemodinámico, antecedentes patológicos, resultados de laboratorio recientes y edad, para esto se emplean algunas escalas como el índice de Rockall, la escala de Glasgow Blatchford y el AIM65 que determinan si el paciente debe ser ingresado al hospital, recibir transfusiones sanguíneas o tratamiento endoscópico46.
El diagnóstico se lleva a cabo determinando si el origen de la hemorragia intestinal es alto o bajo: hallazgos como hematemesis y melenas son indicadores más frecuentes en sangrado digestivo superior que inferior; en el lavado por sonda nasogástrica se encuentra contenido hemático o de aspecto similar al café, otro hallazgo sugestivo es la relación entre el nitrógeno uréico sanguíneo (BUN) y la creatinina mayor a 3047.
Si el paciente presenta antecedentes de alcoholismo, cirrosis o cualquier alteración hepática, debe inclinarse el diagnóstico hacia un sangrado alto de origen varicoso; por el contrario, se debe sospechar de un sangrado alto de origen no varicoso cuando el paciente tiene antecedente de consumo de AINES o Ácido Acetilsalicílico (ASA)47,48.
Si el origen de la hemorragia se sitúa bajo el ángulo de Treizz, el diagnóstico imagenológico se basa en los hallazgos a la colonoscopia debido a que se estaría frente a un sangrado digestivo inferior49.
A continuación se describen algunas de las ayudas diagnósticas y terapéuticas utilizadas en el abordaje de un sangrado digestivo:
Endoscopia superior
Esta ayuda diagnóstica es considerada como primera opción en pacientes con sangrado digestivo superior, permite identificar la causa del sangrado digestivo superior en el 95% de los casos, además de la causa se debe describir el tipo, localización y cantidad de lesiones, también debe dar constancia de si el sangrado es activo o si posee hallazgos que sugieran una hemorragia reciente44,49.
Según la ESGE, la endoscopia debe ser llevada a cabo durante las 24 horas siguientes al episodio hemorrágico en los pacientes que no tienen un diagnóstico confirmado para disminuir el tiempo de estancia hospitalaria, resangrado y evaluar la necesidad de una intervención quirúrgica; también se puede considerar un uso muy temprano de esta ayuda diagnóstica (primeras 12 horas) en pacientes con inestabilidad hemodinámica que persiste a pesar de reanimación con líquidos; otros de sus usos son la evacuación de hematomas y el hallazgo de otras lesiones relacionadas con el cuadro clínico45,49. Su sensibilidad alcanza entre el 92 y 98% mientras que su porcentaje de especificidad está entre el 30 y 100%49. Este método diagnóstico puede presentar complicaciones para el paciente tales como perforaciones del tubo digestivo, aspiración y aumento del sangrado durante el procedimiento49.
La ESGE recomienda la terapia endoscópica, la cual puede realizarse mediante tres modalidades45:
Inyección de medicamentos como epinefrina, agentes esclerosantes y fibrina. Se ha evidenciado una disminución en el resangrado y en la cirugía de emergencia cuando se combina epinefrina con otro agente, pero no se ha disminuído la mortalidad comparada con la monoterapia con epinefrina.
La terapia térmica por electrocoagulación ha demostrado ser efectiva en alcanzar la hemostasia primaria, reducir la recurrencia del sangrado, la necesidad de cirugía urgente y la mortalidad.
La terapia mecánica con clips también ha demostrado reducir el resangrado, pero no se ha evidenciado una mejoría en la hemostasia de los pacientes. Importar lista
En pacientes con sangrado activo, la Asociación Europea recomienda combinar la inyección de epinefrina con terapia térmica, mecánica o inyección de un agente esclerosante45.
Angiografía por tomografía computarizada
Es utilizada en los casos en que la endoscopia no permite localizar el origen del sangrado; permite visualizar el contraste entre la mucosa intestinal y el contenido hemorrágico cuando el sangrado es mayor a 0,5ml/min49. Posee una sensibilidad y especificidad del 86 y 95% respectivamente49. Es un método mínimamente invasivo que también permite diagnosticar neoplasias y demostrar tanto la existencia de un sangrado activo como los estigmas de sangrado reciente. Este examen diagnóstico tiene riesgo en pacientes con nefropatías debido al contraste aplicado49.
Angiografía por catéter
Es más usado en sospecha de sangrado inferior que superior, sin embargo, tiene utilidad en ambos; presenta una especificidad alrededor del 100% y una sensibilidad entre el 42 y 86%, teniendo en cuenta que la pérdida hemorrágica debe ser de 0,5 a 1,5ml/min para que este método diagnóstico detecte el sangrado49. Un grupo australiano de gastroenterología recomienda realizarlo en pacientes en los que la endoscopia esté contraindicada o arroje resultados no concluyentes y en algunos pacientes hemodinámicamente inestables; por su parte, la ESGE la recomienda en pacientes con resangrado y en los cuales la endoscopia no haya sido efectiva45,49.
Su principal ventaja radica en que es una herramienta diagnóstica y terapéutica, pues pueden infundirse medicamentos vasoconstrictores o hacer embolización mediante este. Puede generar algunas complicaciones como hematomas, pseudoaneruismas, y disminución del flujo sanguíneo intestinal, pero estas se presentan en menos del 10% de los pacientes49.
Las siguientes son indicaciones quirúrgicas para los pacientes con HDA según la ESGE45:
Escalas de clasificación
Existen escalas para clasificar las diferentes características de los pacientes que presentan una hemorragia digestiva alta, entre ellas se encuentran la clasificación de Forrest, el índice de Rockall (Ver Tabla 3), la escala de Glasgow Blatchford (Ver Tabla 4) y el AIMS 659 (Ver Tabla 5).
Clasificación de Forrest
Se basa en las características endoscópicas de las úlceras gastrointestinales, tiene como objetivo clasificar la severidad de la hemorragia de acuerdo a los hallazgos de los estudios imagenológicos; es usada como predictor del riesgo de resangrado y mortalidad, estratificando a los pacientes en 6 grupos como se aprecia en la Tabla 250,51.
Tabla 2 Clasificación de Forrest
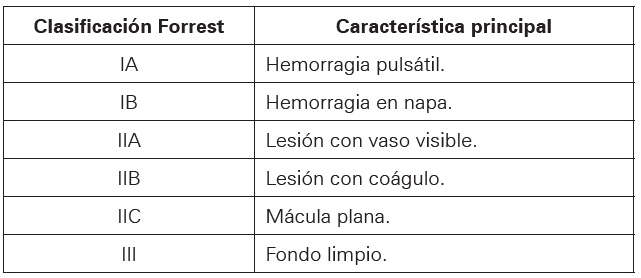
Fuente: Forrest JA, Finlayson ND, Shearman DJ. Endoscopy in gastrointestinal bleeding. Lancet. 1974;304(7877):394–397.
Se estima que el 90% de los pacientes clasificados en IA presentan recidiva en el sangrado, por su parte, sólo el 5% de los pacientes clasificados en III la presentan. Su utilidad no está limitada únicamente a la predicción, sino que a partir de la misma clasificación pueden arrojarse alternativas clínicas relevantes para el manejo médico41.
Índice de Rockall (RS)
Propuesto a razón de un estudio que contó con alrededor de 7000 pacientes por T.A Rockall et al. En 1996; presenta dos componentes: uno clínico de donde surge el índice de Rockall pre-endoscópico o inicial, el otro componente se basa en los hallazgos encontrados en la endoscopia originando de esta manera el índice de Rockall completo; es usado como predictor de mortalidad y resangrado52. Presenta las variables de edad, shock, comorbilidades y diagnóstico endoscópico, a las cuales se les asigna una clasificación que se obtiene de la suma del puntaje que obtuvo el paciente en cada una. Desde su creación en Inglaterra ha sido bastante usado53.
Entre más alto sea el puntaje obtenido, mayor es el riesgo de muerte y resangrado para el paciente, así53:
Menos del 5% de los pacientes con una puntuación menor o igual a 2 resangró y su mortalidad fue prácticamente nula, esto se contrasta con las personas que obtuvieron un puntaje mayor a 2 quienes resangraron y murieron en mayor cuantía52.
Escala de Glasgow-Blatchford (GBS)
Desarrollada a inicios del siglo XXI, es usada en pacientes que presentan sangrado digestivo alto para predecir si requieren o no un tratamiento inmediato, para ello se tiene en cuenta una serie de parámetros serológicos y clínicos, en los primeros se encuentran la úrea y la hemoglobina dividida según el sexo mientras en los segundos se incluyen el pulso y la presentación del episodio acompañada de unas posibles comorbilidades, a estas variables se les asigna una puntuación la cual se aprecia en la Tabla 454.
El estudio en el que se publicó por primera vez esta clasificación contó con 1748 pacientes, en los cuales se identificaron de manera apropiada (sensibilidad) el 99% de los pacientes con un sangrado que requería intervención médica y el 32% de los que no lo necesitaban (especificidad)54.
Tabla 4 Escala de Glasgow Blatchford

Fuente: Blatchford O, Murray WR, Blatchford M. A risk score to predict need for treatment for upper-gastrointestinal haemorrhage. Lancet. 2000;356(9238):1318-21.
Los pacientes que obtienen un puntaje mayor a 0 son clasificados como de alto riesgo. Esta escala, al no poseer un componente endoscópico, presenta una mayor facilidad para ser usada en la primera instancia de la atención53.
Clasificación AIMS65
Esta clasificación fue publicada en 2011 en un estudio de más de 60 000 pacientes; es frecuentemente usada como predictor de mortalidad, aunque no es su única finalidad pues puede hacer lo propio con la duración de la estancia hospitalaria y el costo del tratamiento de los pacientes55. Su nombre (AIMS65) surge de las iniciales en el idioma inglés de los cinco factores de riesgo que se usan para obtener el puntaje: albúmina, INR (International Normalized Ratio), alteración del estado mental, presión arterial sistólica y edad; cada factor arroja un puntaje que posteriormente se suma para obtener la calificación definitiva, de tal manera que 0 es el menor y 5 el mayor resultado posible55.
La inclusión de la albúmina en los criterios presenta verdadera importancia debido a que, además de no pertenecer a las demás clasificaciones, sus bajos niveles séricos están directamente relacionados con la mortalidad de pacientes55.
Discusión sobre las escalas de evaluación
Diferentes autores realizan apreciaciones sobre las escalas de evaluación ya planteadas anteriormente. En un estudio español, Martínez et al.50 afirman que la clasificación AIMS65 no sufrió un aumento significativo (1,85±0,4) en comparación con la escala de Glasgow Blatchford (12,7±0,7) y el índice de Rockall (6,8±0,5) al evaluar el resangrado. En cuanto a la mortalidad no se encontraron diferencias entre las tres en las curvas ROC: AIMS 0.76, GBS 0.78, RS 0.7856. En los resultados arrojados se evidenció que las tres escalas ya mencionadas fueron útiles para prever la necesidad de transfusión sanguínea: AIMS 0.71, GBS 0.85, RS 0.73, siendo la de escala de Glasgow Blatchford la de mejor desempeño56. La AIMS65 destaca sobre las otras escalas debido a que presenta una menor complejidad, lo que le permite ser más usada en la práctica clínica diaria57.
Contrastando la capacidad para predecir qué pacientes son de alto y bajo riesgo entre la escala de Glasgow Blatchford y el índice de Rockall, en un estudio realizado en Taiwán, se obtuvo un 100% (IC95: 98.3-100) de sensibilidad (S), 3.41% (IC95: 0.75- 9.65) de especificidad (E), valor predictivo positivo (VPP) del 71.67% (IC95: 65.4-76) y negativo (VPN) del 100% (IC95: 30.5-100) con un GBS > 0, mientras que las del RS>2 fueron: S: 96.7% (IC95: 93.4-98.7) E: 11.4% (IC95: 5.6-19.9), VPP: 72.7% (IC95: 67.2-77.8) y VPN: 58.8% (IC95: 33-81.5). El área bajo la curva (AUC) fue de 0.808 (IC95: 0.756-0.86) para GBS y 0.767 (IC95: 0.713-0.821) para RS, lo que indica que la GBS puede ser más útil para estratificar el riesgo que el RS, pues presenta mayor sensibilidad. En cuanto a la predicción de resangrado, el GBS>0 presento S: 100% (IC95: 91.1-100) y E: 1.1% (IC95: 0.25-3.3), el RS>2 obtuvo S: 100% (IC95: 84.4-100) y E: 6.46% (IC95: 3.81- 10.15), por lo que, debido a su baja especificidad, no son buenos predictores de resangrado58. Lo expuesto anteriormente discrepa de lo publicado por Tuncer et al. en Turquía, quienes sugieren que el RS>2 tuvo un mejor desempeño con S: 96.4% (IC95: 81.7-99.9), E: 20% (IC95: 13.4-28.1), VPP: 21.3% (IC95: 14.5-29.4), VPN: 96.2% (IC95: 80.4-99.9) que el GBS>0 que tuvo S: 100% (IC95: 87.7-100), E: 0% (IC95: 0-2.9) y VPP: 18.3% (IC95: 12.5-25.4) para predecir la recurrencia de sangrado, en un estudio que contó con 153 pacientes21.
En un estudio multicéntrico que contó con 3012 pacientes residentes en Europa, Norteamérica, Asia y Oceanía, la escala más eficiente para predecir la necesidad de intervención asistencial fue la de Glasgow Blatchford <1 (S:98.6%, E:34.6%, VPP: 96.6% y VPN: 56%) frente a AIMS65= (S: 81.6%, E:49.9%, VPP: 74.7% y VPN: 59.9) y un RS de 0 (S: 95.6%, E: 23.4%, VPP: 86.5% y VPN: 50.9%); mientras que en la predicción de mortalidad a 30 días, las clasificaciones AIMS65 (S: 65.8%, E: 76.2%, VPP: 18% y VPN: 96.6%) y RS (S: 74%, E: 61.7.%, VPP: 11.1% y VPN: 97.3%) tuvieron un mejor rendimiento que las presentadas por GBS (S: 88.7%, E: 40.2%, VPP: 9.9 y VPN: 97.9%)59. Otro estudio publicado por Yaka et al. en una población de 254 personas encontró que GBS (AUC 0.809 [IC95: 0.756-0.856]) y la clasificación AIMS65 (AUC 0.809 [IC95: 0.756-0.856]) tuvieron similar capacidad de predicción de mortalidad a 30 días, en este mismo estudio se evidenció que la GBS (AUC 0.904 [IC95: 0.861-0.937]) tuvo un mejor desempeño para prever la necesidad de transfusión sanguínea que AIMS65 (AUC 0.796 [IC95: 0.742-0.844])60. Dichos hallazgos coinciden con una investigación realizada, en Portugal donde también encontraron que la escala que mayor eficiencia tiene para predecir la necesidad de transfusión de glóbulos rojos era la GBS (AUC 0.826 [IC95: 0.773-0.880]), en contraparte, en un estudio con 278 pacientes estadounidenses, la AIMS65 presentó un mejor rendimiento en predecir mortalidad que la GBS y esta última tuvo un mejor desempeño en predecir la necesidad de transfusión sanguínea61,62.
En un estudio iraní de 182 pacientes se comparó la escala de Glasgow Blatchford y el índice de Rockall, la GBS presentó un mayor rendimiento para predecir resangrado (AUC 0.722 vs 0.520), mientras el RS hizo lo propio con la mortalidad (AUC 0.648 vs 0.582)63.
También se han realizado estudios como el publicado por Budimir et al. en Croacia, en el que ninguna de las tres escalas evaluadas (GBS, AIMS65 y RS) tuvieron un buen desempeño para predecir mortalidad y resangrado64. Contrario a lo ocurrido en el estudio de Gu et al., en el que compararon las mismas escalas en pacientes hospitalizados por HDA y las tres presentaron resultados aceptables para predecir mortalidad, siendo la de mejores resultados la AIMS659.
Hay pocas publicaciones que comparen la clasificación de Forrest con otras. En un estudio con 371 pacientes de un centro de atención coreano, los cuales fueron sometidos a dos endoscopias con una semana de diferencia entre una y otra, se obtuvo como resultado que en la primera imagen el 72,2% de los pacientes fueron clasificados en el grupo de alto riesgo, es decir, presentaron una úlcera entre el tipo IA y el IIC, entre tanto, la segunda imagen arrojó resultados contrarios en los que el 70,6% de los pacientes presentó una úlcera correspondiente a la clasificación de bajo riesgo, lo que indica que el riesgo de sangrado y mortalidad son mayores en la primera semana donde se altera la mucosa del tracto digestivo65.
El consenso para el manejo de la hemorragia gastrointestinal alta de la Sociedad Británica de Gastroenterología recomienda clasificar a los pacientes a su ingreso al servicio de urgencias según la escala de Glasgow Blatchford, la cual ha demostrado tener el mejor rendimiento en predecir los desenlaces clínicamente importantes como necesidad de transfusión, tratamiento endoscópico, cirugía y muerte, también se usa la AIMS65 y el Índice de Rockall para predecir mortalidad66. Históricamente se ha usado la GBS de 0 para clasificar a los pacientes de muy bajo riesgo y determinar si se benefician de manejo extrahospitalario, pero actualmente es controversial si ese punto de corte debe ser igual o menor a 1, incluso el Grupo de Consenso Internacional para el manejo de hemorragia digestiva alta no variceal recomienda tomar el 1 como punto de corte en el GBS, pero no recomiendan usar otra escala como RS o AIMS65 para clasificar los pacientes en la categoría de muy bajo riesgo. Este grupo de expertos también recomienda usar la GBS, RS y AIMS65 de manera individual en todos los pacientes con hemorragia digestiva alta66,67.
Conclusiones
La HDA es la principal emergencia gastroenterológica y continúa siendo una patología de distribución e importancia global por su prevalencia, mortalidad y amplios gastos en salud que debe intervenirse. Su etiología es variable, siendo más frecuentes las úlceras pépticas en las causas no varicosas y las várices esofágicas en las varicosas. El manejo de estos pacientes se basa en un abordaje dirigido a la estabilización y reanimación inicial y diagnóstico temprano en el cual se emplean técnicas endoscópicas, angiográficas y quirúrgicas que pueden usarse también como tratamiento según el tipo de paciente al que se enfrente el clínico, aunque esto depende de los recursos con los que cuente el personal de salud al momento de la atención. Las escalas de evaluación o predicción son recomendadas por diferentes grupos de expertos y guías de práctica clínica alrededor del mundo en la evaluación rutinaria de los pacientes con HDA, siendo la Escala de Glasgow Blatchford la que cuenta con mayores recomendaciones iniciales, sin dejar de lado el Índice de Rockal y la clasificación AIMS65, sin embargo, las diferentes investigaciones realizadas alrededor del mundo plantean diferencias entre los resultados de los estudios que evalúan las actuales escalas de evaluación, lo que sugiere una nueva posibilidad de investigación orientada hacia una eficaz estratificación de los pacientes, buscando que la predicción sea un pilar fundamental en el manejo de las personas que presenten una HDA e impactar de esta manera en los desenlaces de los pacientes.