Introducción
El síndrome de ovario Poliquístico (SOP) es el trastorno endocrino más frecuente en las mujeres en edad fértil y es conocido como factor de riesgo para múltiples enfermedades metabólicas y cardiovasculares1. En 1935 fue descrito por primera vez por los médicos Irving Stein y Michael Leventhal, a través de la publicación de siete casos de mujeres con ovarios aumentados de tamaño asociado a cambios menstruales, infertilidad, dolor e hiperandrogenismo2. A partir de este momento, se ha conocido como un desorden de amplia presentación clínica, en donde factores genéticos, endocrinos y ambientales juegan un papel importante. Su prevalencia es diversa, reportándose datos desde el 6% al 21%, dependiendo de la población y los criterios aplicados para su diagnóstico3,4.
La causa exacta del SOP es desconocida, se sugiere que hay una fuerte influencia genética, al existir mayor riesgo de padecer el síndrome en aquellas familias que tengan mujeres que lo presenten5; además, se ha encontrado que situaciones como la restricción del crecimiento intrauterino, la pubertad precoz y la exposición prenatal a andrógenos, se encuentran asociados con el aumento del mismo6. Hasta el momento se ha planteado que la resistencia a la insulina, presente en el 80% de las pacientes, corresponde a una de las principales responsables del origen del trastorno, debido a que genera una hiperinsulinemia compensatoria que influye directamente en la disminución de la globulina transportadora de hormonas sexuales(SHGB), aumentando la actividad y la fracción libre de andrógenos, al igual que ejerce un efecto estimulante en la producción de hormona luteinizante (LH) y en la secreción ovárica y suprarrenal de andrógenos 7,8.
Actualmente, existe poco consenso sobre el hallazgo del SOP, lo que ha influido directamente en la detección excesiva del síndrome y sus efectos adversos asociados9. El presente artículo tiene como objetivo hacer una revisión amplia de la información más actualizada para la valoración y diagnóstico del trastorno, y la problemática de su sobrediagnóstico.
Metodologia de búsqueda
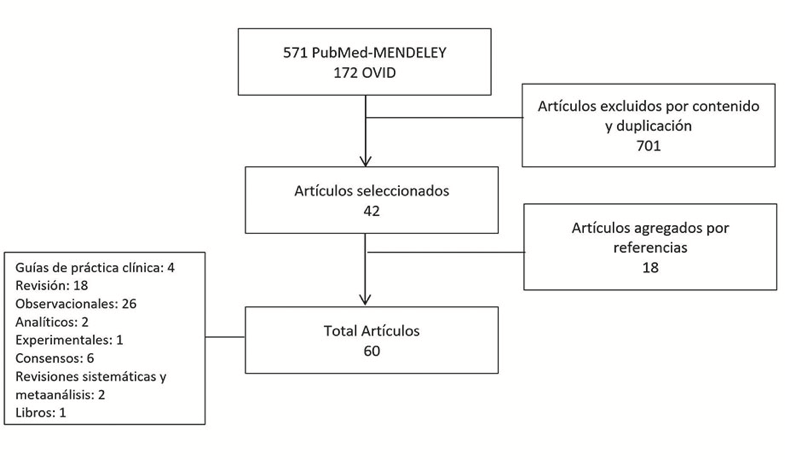
Se realizó una búsqueda bibliográfica durante el periodo de Febrero a Abril del 2020 en las bases de datos de PubMed-MENDELEY y OVID sobre estudios observacionales, analíticos, artículos de revisión, capítulos de libro, guías de práctica clínica, revisiones sistemáticas y metaanálisis publicados en los últimos 10 años en los idiomas de español e inglés, usando los términos MeSH: Polycystic ovary síndrome, Hyperandrogenism, Overdiagnosis, Phenotype y Anovulation y los términos DeCS Síndrome del ovario poliquístico, Hiperandrogenismo, Sobrediagnóstico, Fenotipo y Anovulación. Los criterios de inclusión fueron que los artículos debían discutir el síndrome de ovario poliquístico y su diagnóstico de una forma completa o reflejar el impacto en las pacientes falsamente diagnosticadas con el mismo ya sea en el título o resumen, siendo excluidos aquellos textos por contenido y duplicidad. Se obtuvieron 743 artículos, de los cuales se seleccionaron 43; finalmente se adicionaron 18 artículos más, encontrados en las referencias de los textos incluidos, que cumplieron con los criterios previamente establecidos (Ver Figura 1).
Resultados
Criterios diagnósticos
Han existido diferentes consensos sobre los criterios diagnósticos para el hallazgo de SOP, siendo el primero hecho por el National Institute of Health (NIH) en abril de 1990, donde se propuso al hiperandrogenismo clínico o bioquímico y la oligo- anovulación crónica, como signos elementales para el diagnóstico, posteriormente de la exclusión de otras causas10. Luego, en mayo del 2003, en una reunión de expertos en Rotterdam de la European Society for Human Reproduction and Embryology (ESHRE) y la American Society for Reproductive Medicine (ASRM), se tuvo en cuenta como criterios, los signos clínicos o bioquímicos de hiperandrogenismo, la disfunción ovárica y la presencia de ovarios poliquísticos por ecografía, siendo diagnóstico el cumplimiento de dos de los mismos, permitiendo clasificar a las pacientes en cuatro fenotipos (Ver Tabla 1)11.
Tabla 1 Criterios diagnósticos y fenotipos del síndrome de ovario poliquístico.Para el diagnóstico se necesita el cumplimiento, en NIH dos de los dos criterios; ESHRE/ASRM dos de los tres criterios; AE-PCOS hiperandrogenismo con cualquiera de los otros dos criterios; NIH 2012 dos de los tres criterios.
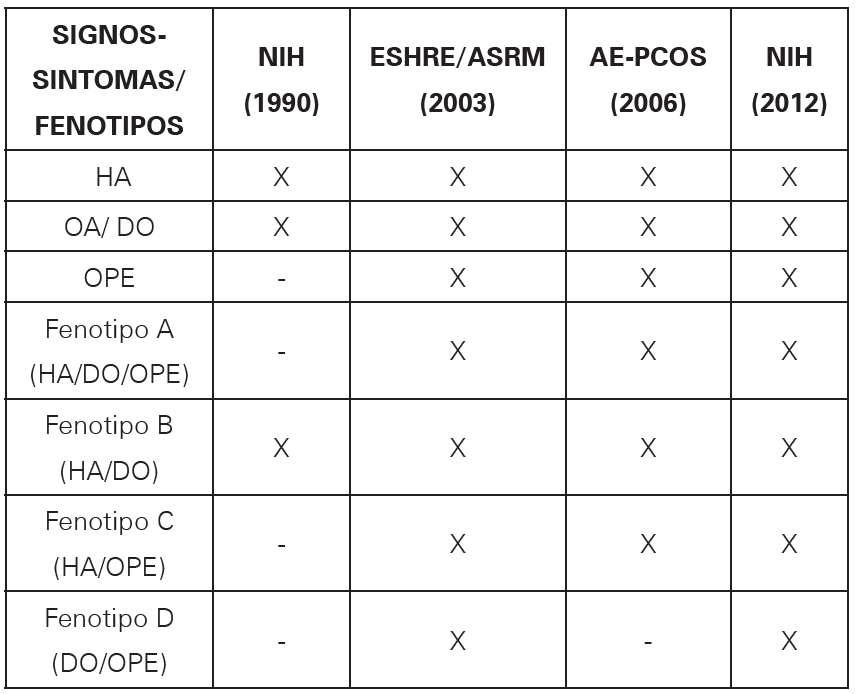
HA:Hiperandrogenismo
DO:Disfunción ovárica
OPE:Ovarios poliquísticos por ecografía
Fuente: autores.
En 2006, en el debate sobre la inclusión del criterio ecográfico, la Sociedad de Exceso de Andrógenos (AE-PCOS), emprendió una revisión sistemática en la que se definió como piedra fundamental al hiperandrogenismo para el diagnóstico del SOP, excluyendo al fenotipo no hiperandrogénico propuesto por Rotterdam12.
Finalmente, en el 2012, el NIH realizó una reevaluación de la literatura, llegando al consenso en el que se reconocieron los criterios de Rotterdam 2003 como los más claros hasta el momento, recomendando su uso junto con la clasificación fenotípica de SOP, según la combinación de signos del paciente, propuesta por ellos.13 Es importante destacar que la Endocrine Society Clinical Practice Guidelines, en el 2013, descartó la aplicación del criterio ecográfico para el diagnóstico de SOP en adolescentes, por lo que dictaminó que para el hallazgo en estas pacientes se requiere la presencia de hiperandrogenismo clínico y/o bioquímico, al igual que la persistencia de trastornos menstruales infrecuentes, definido en algunos estudios por un periodo de por lo menos dos años posterior de la menarquia, sumado o no a la presencia de amenorrea primaria a los 16 años14,15,16.
Abordando los distintos fenotipos, estos son afrontados según los riesgos a largo plazo a los que están propensas las mujeres con el síndrome a desarrollar, siendo los fenotipos A y B, o “clásicos”, los que se caracterizan por tener una mayor presencia y pronunciamiento de los signos y síntomas, como la disfunción menstrual, resistencia a la insulina, índice de masa corporal aumentado, obesidad, riesgo de síndrome metabólico y formas más severas de dislipidemias aterogénicas en comparación con los fenotipos C y D17.
El fenotipo C, llamado “SOP ovulatorio”, es un intermedio entre los clásicos y el no hiperandrogénico, también conocido como fenotipo D; en este último, se evidencia una menor prevalencia de disfunción endocrina y metabólica, sumado a que se encuentra más cercano al grupo de pacientes sanos; asimismo, se diferencia de los fenotipos clásicos por presentar niveles más bajos de la relación hormona luteinizante- hormona folículo estimulante, testosterona libre y total; además, se considera que puede tener una fisiopatología diferente a los otros tres, asociándolo a una baja presentación de complicaciones, tales como hipertensión, diabetes gestacional, obesidad, enfermedades cardiovasculares, entre otros17.
Se han definido en diversos estudios la distribución de los fenotipos en las pacientes diagnosticadas con SOP18-22. En 2015, Zhao Y. et al, evaluaron a 647 mujeres diagnosticadas según los criterios de Rotterdam 2003, en la población Han, China, encontrando 409 casos (63.21%) pertenecientes al subtipo A, 58 casos (9%) subtipo B, 101 casos (15,6%) subtipo C y 79 casos (12.9%) subtipo D18, siendo concordante con lo encontrado por Guastatella E. et al, en donde el fenotipo A correspondió a la mayoría de los casos con un 53.9%, seguido por el C con un 28.8%19. Diamanti E. et al, hallaron que los fenotipos clásicos son más frecuentes, comparados con los no clásicos, con una frecuencia de 85.96% y 14.04%, respectivamente20. Es importante aclarar que hay una gran controversia respecto a esto, debido a que no existen suficientes trabajos basados en poblaciones no seleccionadas, en los que se puedan observar la distribución de los fenotipos en las pacientes con SOP; sin embargo, en los estudios en que se han realizado, se refiere que la mayoría de los casos corresponden a los fenotipos B y C, mientras que los A y D tienen prevalencias semejantes y más bajas1,23,24.
Definición de los criterios
Disfunción ovarica
Aunque no está bien descrito, se estima que la disfunción ovárica es una alteración cuya prevalencia en mujeres sin SOP se encuentra desde el 4.5% hasta el 8%.22,24 En contraste con el 70-80% de las pacientes con el síndrome, de las cuales alrededor del 40% pueden llegar a desarrollar subfertilidad o esterilidad, que en muchos casos supone uno de los principales motivos de consulta25,26. Este término tiene un abordaje más amplio que el de oligoanovulación, debido a que vincula otras formas de disfunción como los ciclos menstruales frecuentes1.
En definitiva, la disfunción ovárica corresponde a ciclos menstruales ≥35 o ≤21 días, siendo estudiado en pacientes eumenorreicas con ovarios poliquísticos y/o hirsutismo, correspondientes a cerca del 30% de los casos, a través de las mediciones de progesterona en los días 22 a 24 del ciclo, siendo indicativo de anovulación valores menores a 5ng/ml22,27. Por otra parte, se estima que alrededor de 85-90% de las mujeres con sangrado menstrual infrecuente y el 30-40% con amenorrea, pueden llegar a ser diagnosticadas con SOP28.
Hiperandrogenismo
Cerca del 82% de las mujeres con SOP presentan síntomas de exceso de andrógenos, siendo el hirsutismo el más frecuente, presentándose en hasta el 70% de las pacientes, el cual se encuentra en sus formas más severas en aquellas con ciclo menstrual ausente29,30.
Es importante aclarar que el hirsutismo es conocido como el exceso de vello terminal con distribución androide.31 Su evaluación es muy subjetiva, por lo que se debe realizar a través de la escala visual Ferriman- Gallwey modificada, que se aplica en nueve áreas del cuerpo (labio superior, mentón, cuello, parte superior del pecho, abdomen, espalda, brazos, muslos y parte inferior del dorso) utilizando una puntuación de 0 a 4, según el grado y características del vello, siendo reportado como positivo a partir del percentil 95 en las diferentes razas y etnias, teniendo como puntos de corte, en algunos estudios, valores superiores o iguales a 6, considerándose patológico inclusive con puntajes de 3; de la misma manera, teniendo en cuenta que se ha reportado que más del 50% de las pacientes con calificaciones de 1-5 presentan exceso de andrógenos, se recomienda que tanto en grados mínimos como en severos, sea determinada la existencia o no de hiperandrogenismo31,12,25. Asimismo, se ha encontrado una relación directamente proporcional con la progresión del hirsutismo y la resistencia a la insulina32.
Además, es de gran importancia distinguir el hirsutismo de la hipertricosis, definida como un crecimiento excesivo de vello de una distribución no androgénica, principalmente en zonas de los antebrazos y las antepiernas33. Su aparición no se debe a exceso de andrógenos, sino a causas hereditarias o adquiridas como las nutricionales, o por el consumo de medicamentos como fenitoina, acetazolamida, estreptomicina, ciclosporina, entre otros34.
El acné y la alopecia son otros signos clínicos de hiperandrogenismo, los cuales son menos frecuentes y específicos que el hirsutismo; se ha encontrado al acné en alrededor del 15- 30% y la alopecia en no más del 5% de las pacientes con SOP29,32,35,36.
En cuanto a la demostración bioquímica, la calidad de los estudios y la elaboración de rangos normativos para su hallazgo, son fundamentales para diagnosticar hiperandrogenemia, siendo necesario la alteración de por lo menos un valor de andrógenos.31 La American College of Obstetrics and Gynecology, recomienda siempre realizar las mediciones de testosterona total (TT) y testosterona libre (TL), teniendo en cuenta que la TT se debe analizar a través de radioinmunoanálisis, cromatografía de columna o espectrometría de masas después de la toma de muestra, mientras que la TL se evalúa utilizando diálisis de equilibrio, ultrafiltrado o precipitación de sulfato de amonio o el cálculo del índice de andrógenos libres (FAI), que se basa en la proporción de TT entre SHBG, siendo lo normal un valor <4.52,31,36. La cuantificación de dehidroepiandrosterona sulfato (DHEAS) y la androstenodiona (AA), son opcionales en los casos de duda diagnóstica, su valor puede encontrarse alterados en el 40% de las mujeres con SOP a la vez que la AA puede ser el único andrógeno elevado en alrededor del 7% de las pacientes.9,25,31,32
Ovarios poliquisticos
La morfología de ovarios poliquísticos por ecografía se puede encontrar en más del 90% de las mujeres con SOP37; inicialmente, se definió como la existencia de al menos un volumen mayor de 10cc y/o la presencia de 12 o más folículos antrales entre 2 a 9 mm de tamaño, en por lo menos uno de los ovarios;12,45 se han realizado estudios que discuten el número de folículos, considerándose positivo cuando se visualizan 20 o más a través de un transductor de alta frecuencia >8MHz, el cual si está ausente se debe tener en cuenta el volumen ovárico para el cumplimiento de este criterio, siendo igual a lo recomendado ante las situaciones en que la ultrasonografía no puede llevarse a cabo por vía transvaginal12,14,32,38.
Diagnóstico diferencial
Es conocido que la exclusión de la mayoría de los trastornos que simulan SOP se hace a través de la clínica; sin embargo, la forma ineludible y responsable de hacerlo es por medio de pruebas hormonales; los diagnósticos diferenciales principales de esta alteración son aquellos que cursan con exceso de andrógenos y/o disfunción ovulatoria, lo que incluye alteraciones endocrinas y de etiología maligna39. La Endocrine Society Clinical Practice Guideline recomienda en todas las pacientes, la realización de exámenes para descartar la presencia de enfermedades tiroideas, hiperprolactinemia y la hiperplasia suprarrenal congénita no clásica, con la medición sérica de hormona Tiroidea estimulante, prolactina y 17-hidroxiprogesterona, respectivamente40. En aquellas pacientes con cuadro clínico sugerente,se debe realizar la evaluación de otras situaciones como la amenorrea hipotalámica, insuficiencia ovárica y el embarazo; o si la presentación de la sintomatología es rápida o manifiesta una virilización severa como engrosamiento de la voz, clitoromegalia, alopecia androgénica, se debe sospechar la existencia de tumores secretores de andrógenos; de igual forma, el estudio de otras alteraciones como el síndrome de Cushing y la acromegalia, debe pensarse cuando hayan características físicas concordantes con los mismos39,40. Adicionalmente de las anteriores, hay más causas de hiperandrogenismo cuya presentación es rara, entre estos se encuentran otras formas de hiperplasia adrenal congénita, trastornos congénitos del metabolismo o acción de los esteroides suprarrenales, síndromes de resistencia insulínica extrema, el shunt portosistémico, trastornos del desarrollo sexual e inclusive el uso de medicamentos como los esteroides androgénicos anabólicos, la progestinas sintéticas y el ácido valproico, también podrían explicar la aparición de estos síntomas39,40.
Problemática del sobrediagnóstico
Es claramente notable que las complicaciones que trae consigo el SOP, están relacionadas con cáncer endometrial, síndrome metabólico, enfermedades cardiovasculares y complicaciones del embarazo (diabetes gestacional, pre-eclampsia)41-43. La aplicación de los criterios de Rotterdam 2003, promovió el aumento de los casos diagnosticados con el trastorno, incluyendo a mujeres con características propias del síndrome no tan severas, logrando superar hasta cerca de tres veces la prevalencia encontrada con los otros criterios; en el momento, no está bien documentado cuales son los fenotipos en los cuales se ha incrementado el sobrediagnóstico, ni tampoco hay evidencia que clarifique el beneficio que trae el tratamiento en aquellas pacientes con las presentaciones menos graves del SOP2,3,44.
Es importante comprender que muchos de los hallazgos del SOP se encuentran normalmente en las poblaciones adolescentes debido a los procesos fisiológicos correspondientes a la edad; es así como en este grupo etario, se pueden observar comúnmente trastornos menstruales y acné; además, alrededor del 30-40% de las mismas presentan morfología de ovarios poliquísticos sin algún hallazgo adicional, siendo considerado difícil esclarecer el diagnóstico del síndrome46. Por lo que, conociendo la definición del sobrediagnóstico como la calificación de una enfermedad cuyo tratamiento y seguimiento puede ser perjudicial para las pacientes, trayendo efectos negativos en su calidad de vida debido a la innecesaria etiqueta clínica, así como la utilización de terapias y consumo de recursos inadecuados, algunos investigadores han sugerido abstenerse de determinar a las pacientes adolescentes con la enfermedad, y mejor establecer como “en riesgo” a aquellas que cumplen los criterios47,48.
Asimismo, se ha estudiado que un rango de 13-22% de las mujeres adultas jóvenes sanas con ciclos regulares y sin clínica de hiperandrogenismo, pueden tener ovarios poliquísticos49,50. De igual forma, hay varios trabajos que demuestran que la prevalencia del SOP desciende de una forma importante luego de los 25 años de edad, sugiriendo la posibilidad de transitoriedad del trastorno y la resolución del mismo, sin necesidad de intervención en muchos de los casos51,52.
Los efectos desencadenantes del sobrediagnóstico del SOP, están relacionados con el aumento de la ansiedad, depresión, baja autoestima, mala imagen corporal, disfunción sexual, así como lo consideración del trastorno como una condición estigmatizante en las mujeres diagnosticadas, sin ser asociado con la presentación de los síntomas sino más bien a un componente psicosocial.53-58 En un estudio realizado en una comunidad universitaria, a través de un escenario hipotético en el que se les diagnosticaba SOP a un grupo de ellas, encontraron que en las mujeres en las que se les dijo que tenían el síndrome, presentaron una mayor percepción de una condición más grave, baja autoestima y la intención de realizarse una ecografía en comparación con aquellas en las que no recibieron el diagnóstico59.
Adicionalmente, se debe tener muy presente que el SOP es un diagnóstico de exclusión, por lo tanto se hace necesario tener precaución al asumirlo en mujeres en las cuales no sea muy evidente, debido a que la adopción del trastorno puede significar la falta de estudio y tratamiento de otras enfermedades que se estén cursando y que usualmente pueden confundirse con el mismo, tal como ocurre en los casos de amenorrea hipotalámica, cuya falta de manejo puede llevar a importantes complicaciones como el desarrollo de osteoporosis prematura60,61.
Finalmente, se sugiere que hasta que no se cuente con información adecuada, se debería ofrecer un tratamiento enfocado en los síntomas en mujeres adolescentes y en aquellas con fenotipo no hiperandrogénico, evitando asignar el diagnóstico de SOP con el fin de disminuir los efectos adversos psicológicos derivados de este, sumado el argumento que la mención del trastorno no es necesario para garantizar la efectividad del manejo2.
Conclusiones
El síndrome de ovario poliquístico es una alteración cuya presentación es heterogénea y constituye un factor de riesgo importante para múltiples alteraciones tanto biológicas como psicosociales. Actualmente, no existe claridad en el diagnóstico en la población adolescente, ni tampoco del evidente beneficio terapéutico en aquellas pacientes clasificadas dentro de los fenotipos menos severos, por lo que se recomienda estudiar de la mejor forma cada caso, sopesando los riesgos y beneficios de cada mujer, teniendo en cuenta que el estudio de este trastorno y la correcta aplicación de los criterios diagnósticos junto con la exclusión de otras enfermedades, configura un pilar fundamental para evitar su sobrediagnóstico y los efectos negativos en el bienestar y calidad de vida desencadenados por este.