Introducción
El cáncer de mama es la patología neoplásica que se presenta más frecuentemente en las mujeres1. En 2018 GLOBOCAN estimó 2'o88 449 nuevos casos de cáncer de seno en el mundo2, y en Colombia para el mismo año el Instituto Nacional de Salud reportó 2278 nuevos casos3.
La macromastia o hipertrofia mamaria no se considera factor de riesgo para desarrollar cáncer de seno, pero puede estar presente hasta en el 30% de las pacientes con cáncer de seno que son llevadas a manejo quirúrgico4, es una condición relativamente frecuente en la población femenina que se define como el aumento excesivo del volumen mamario, el diagnóstico se realiza de manera clínica y tiene un espectro variable de presentación, el peso promedio de una mama normal es de 150gr a 300gr, se considera hipertrofia leve cuando pesa de 350 a 500gr por cada seno, moderada entre 500gr y looogr, e hipertrofia severa o gigantomastia más de 1000gr5,6. Cuando el tamaño de las mamas genera síntomas que interfieren con la calidad de vida de la paciente se denomina macromastia sintomática7, estos síntomas son; cervicalgia tipo punzante de intensidad variable y duración continua; dolor lumbar secundario a alteraciones posturales; marcas en los hombros por el sostén secundarias al gran peso que ejercen las mamas, produciendo dolor constante y en ocasiones neuropatía periférica de miembros superiores; intertrigo a repetición en el pliegue infra mamario; y síntomas psicológicos como disminución en la satisfacción con su autoimagen que pueden afectar negativamente su dimensión afectiva o sexual y disminuir su calidad de vida8. No hay datos globales de prevalencia, sin embargo, según la Sociedad Americana de Cirugía Plástica, en el año 2o18 se realizaron 43 591 procedimientos de mamoplastia de reducción en Estados Unidos9.
El cáncer de seno se puede clasificar histológicamente en varios tipos, esta clasificación ha tenido varios cambios a lo largo del tiempo10 y se describe a profundidad en la quinta edición de la clasificación de tumores del seno realizada por la organización mundial de la salud11. Generalmente se denomina a los carcinomas no invasivos (in situ), cuando las células tumorales no han penetrado la membrana basal del epitelio, estos cuales pueden originarse de las células epiteliales que revisten los conductos galactóforos (Carcinoma ductal in situ) o de los lóbulos (Carcinoma lobulillar in situ); se denominan carcinomas invasivos o infiltrantes cuando han las células tumorales han sobrepasado la membrana basal. El carcinoma ductal infiltrante es el más frecuente de todos y corresponde al 75% de todos los tumores invasores, el carcinoma lobulillar infiltrante es el segundo en frecuencia, presente hasta en el 10% de las pacientes. Los carcinomas invasivos de tipo especial comprenden los subtipos papilar, medular, apocrino, mucinoso, de células claras, cribiforme, tubular y a la enfermedad de Paget; los misceláneos son tumores infrecuentes y hacen referencia al sarcoma pleomórfico, tumor filodes, carcinosarcoma metaplásico y al carcinoma anaplásico, entre otros11,12.
Existen múltiples marcadores moleculares asociados al cáncer de seno que determinan su comportamiento, el pronóstico de la enfermedad y su respuesta a los tratamientos actuales, los más frecuentemente identificados son los receptores hormonales estrogénicos y progestágenos, el antígeno Ki 67, antígeno carcinoembrionario, el receptor del factor de crecimiento epidérmico humano HER2 y los genes de susceptibilidad de cáncer de seno BRCA 1 Y BRCA 2. Según la expresión de estos marcadores inmunohistoquímicos, el carcinoma invasivo se clasifica en cuatro subtipos moleculares principales: Luminal A, Luminal B, HER2 y basal o triple negativo13.
El subtipo molecular Luminal A tiene el mejor pronóstico, presenta expresión de receptores para estrógenos (RE) y receptores para progesterona (RP), es el tipo más común de cáncer de mama, representa más del 40% de todos los cánceres de mama y responde generalmente a tratamiento sistémico con terapia endocrina. El Luminal B es el segundo en frecuencia, responsable del 20% de los casos, se caracteriza por tener expresión de receptores estrogénicos, expresión variable de receptores HER2 o un índice de proliferación tumoral Ki-67 alto, lo cual le confiere un peor pronóstico, suele recibir tratamiento sistémico con terapia endocrina y quimioterapia, el subtipo HER2 es responsable del 1o-15% de los casos, se caracteriza por una expresión aumentada de receptores HER2, los cuales se asocian a angiogénesis y proteólisis, dando un peor pronóstico, puede recibir tratamiento sistémico con quimioterapia asociado a inmunoterapia (Trastuzumab) y en algunos casos terapia endocrina14. Finalmente, el subtipo basal o triple negativo debe su nombre a la ausencia de expresión de RE, RP y HER2, pero se asocia a la mutación BRCA1. Es el subtipo más agresivo de todos, se presenta en un 10 a 15% de los casos, suele tener respuesta favorable a tratamiento con quimioterapia, pero con alto riesgo de recaída de 3 a 5 años después del tratamiento13-16.
Cuando el diagnóstico del cáncer de seno se realiza en estadios avanzados de la enfermedad (T3-T2, N2-N3), o existe evidencia de invasión loco-regional por compromiso de ganglios linfáticos, el tratamiento quirúrgico consiste en realizar mastectomía radical modificada, generando un defecto total del seno, que para ser reconstruido generalmente requiere de técnicas avanzadas como colgajos libres microquirúrgicos, colgajos regionales o la utilización de implantes mamarios o expansores17.
En contraste, cuando el diagnóstico se realiza en un estadio oncológico temprano, es posible realizar terapia conservadora de seno como cuadrantectomía, mastectomía con ahorro de piel o mastectomía con preservación de complejo areola pezón, en conjunto con radioterapia o terapia adyuvante: el defecto resultante en el seno es pequeño y la reconstrucción puede ser realizada de manera inmediata utilizando los tejidos remanentes del seno con técnicas de colgajos locales, lo que se conoce actualmente con el término de Cirugía Oncoplástica de Seno, que permiten recrear la forma del seno de manera inmediata, con resultados estéticos aceptables en pacientes con senos de pequeño volumen18,19.
Cuando se realiza cirugía conservadora de seno con cuadrantectomía en pacientes con cáncer de seno y macromastia, hasta en el 20% de los casos puede haber márgenes positivos del tumor después de la resección4 y se ha visto una incidencia de hasta 30% de secuelas estéticas dadas por malos resultados cosméticos y deformidades posoperatorias debido al gran volumen de tejido que se manipula y a la dificultad de obtener simetría con el seno contralateral, las cuales suelen requerir de corrección quirúrgica posteriormente20. Adicionalmente existen dificultades en el seguimiento radiológico con mamografías y ecografías secundarias a la difícil evaluación de estructuras y posibles hallazgos tempranos de recurrencia tumoral debido el gran volumen mamario residual, así como una distribución heterogénea de la radiación durante la radioterapia adyuvante en comparación a un seno de menor volumen21.
Considerando el impacto en la calidad de vida, debemos recordar que la mama hace parte fundamental de la figura femenina como símbolo de sexualidad y de la labor materna, la cual se ha representado ampliamente en el arte, la filosofía y la religión. Por lo anterior la pérdida parcial o total de la mama por el cáncer de seno y la mastectomía, tiene implicaciones físicas, emocionales, psicosociales, culturales y sexuales8 que se pueden manifestar en diversos síntomas como ansiedad, insomnio, sentimientos de inutilidad y auto desvaloración, lo cual sumado a los síntomas físicos y psicológicos secundarios de padecer de hipertrofia mamaria, puede disminuir aún más su calidad de vida8.
La mayor parte del esfuerzo terapéutico en pacientes con patología maligna de mama inicialmente se centró en aspectos como la supervivencia, mortalidad, periodo libre de enfermedad y morbilidad asociada al cáncer de mama, sin embargo, recientemente ha existido un aumento en la cobertura de los servicios de salud, el cáncer de seno se diagnóstica cada vez más en pacientes más jóvenes y existe mayor disponibilidad de tratamientos que ayudan a prolongar la supervivencia, las cuales alcanzan a ser del 89.5% y del 90.2% a 5 años en Australia y Estados Unidos respectivamente, es por eso que recientemente se ha dado importancia cada vez más creciente a la calidad de vida como un desenlace fundamental en la evaluación y seguimiento de pacientes oncológicas y en pacientes con cirugía de seno. Se han realizado esfuerzos significativos en el desarrollo de procedimientos reconstructivos que permitan mejorarla, así como el diseño de instrumentos validados que permitan medir el éxito de las intervenciones desde una perspectiva integral, teniendo en cuenta el pronóstico oncológico y las implicaciones en la calidad de vida global de las pacientes22,23.
La cirugía oncoplástica combinada con mamoplastia de reducción en pacientes con cáncer de seno y macromastia es una técnica efectiva que proporciona cambios significativamente positivos en las pacientes que lo reciben. Ha demostrado tener menor incidencia de recurrencia local en comparación a cirugía conservadora de seno únicamente debido a que se logran márgenes mayores de resección y adicionalmente se obtiene mejoría de los síntomas propios de la macromastia y un mejor resultado estético por la simetría4.
A continuación, se presenta el caso clínico de paciente con carcinoma lobulillar infiltrante de seno asociado a macromastia bilateral sintomática, en quien se realizó mamoplastia de reducción oncoplastica para dar tratamiento integral de ambas patologías en un solo procedimiento quirúrgico, obteniendo un adecuado control oncológico y una mejoría significativa en su calidad de vida evidenciada por el instrumento BREAST-Q, (Modulo de Terapia Conservadora de seno, versión 1.0), el cual es un cuestionario auto aplicado con validación internacional y adaptación lingüística al idioma español, que se usa para medir de manera objetiva la calidad de vida preoperatoria y posoperatoria con el fin de encontrar cambios en ella asociados a procedimientos quirúrgicos en seno24.
Caso clinico
Se describe el caso de una paciente de sexo femenino, de 41 años, afiliada al régimen subsidiado y procedente del municipio de Floridablanca, G2P2A0C0, con primer parto a los 30 años de edad, menarquia a los 16 años de edad, antecedente de terapia de reemplazo hormonal durante 13 años, y sin antecedente familiar de cáncer de seno. Consultó inicialmente a primer nivel de complejidad por masa en mama derecha de 6 meses de evolución, con dolor tipo picada ocasional y telorrea ipsilateral color amarillo, sin cambios en piel. A la revisión por sistemas refirió dolor cervical punzante y dolor interescapular ocasional de moderada intensidad de 3 años de evolución, asociado a cuadros recurrentes de intertrigo en el pliegue inframamario. Al examen físico se encontró paciente con sobrepeso (índice de masa corporal de 29kg/m2), glándulas mamarias de gran volumen asociado a ptosis mamaria grado III y aumento en la lordosis cervical, el seno derecho presenta lesión de 25x30 mm en límite de cuadrantes internos en cuadrante superior e interno, de consistencia dura, adherida a planos profundos, no dolorosa a la palpación, con telorrea amarilla en seno derecho, no asociado a adenopatías axilares. Glándula mamaria izquierda sin masas, se encuentra lordosis de columna cervical, cardiopulmonar sin hallazgos patológicos, abdomen sin masas , tacto vaginal normal, se le realizó ecografía mamaria que reportó lesión espiculada en el radial ubicada en cuadrante superior e interno de la glándula mamaria derecha de 24 x 11 x 14 mm (BIRADS V), en el mismo momento realizan mamografía con reporte de lesión espiculada BIRADS V a nivel de la interlinea de cuadrantes internos de mama derecha y lesión lobulada de características benignas en glándula mamaria izquierda de localización central (BIRADS III).
Se remitió a mastología oncológica donde se realizó biopsia por aspiración con aguja fina que reporta tumor maligno pobremente diferenciado, desmoplásico, posiblemente carcinoma, receptores estrogénicos positivos 70%, progestágenos positivos 90%, HER 2 negativo, Ki 67: 1%, E-Cadherin positivo, el cual se considera con pronóstico favorable por ser susceptible de terapia hormonal y encontrarse en estadio temprano, con una tasa de supervivencia estimada del 73% a 10 años25.
Fue llevada a junta oncológica con los resultados anteriormente descritos y estudios de extensión: Radiografía de tórax normal, ecografía abdominal normal, colonoscopia con hemorroides grado II y esofagogastroduodenoscopia con gastritis crónica antral leve, citología cérvico vaginal negativa, tomografía computarizada de cráneo normal, ecocardiograma con fracción de eyección 62% sin valvulopatías o lesiones. La junta oncológica consideró diagnóstico de carcinoma de mama derecha T2N0M0 estadio IIA ; se consideró candidata a terapia neoadyuvante debido al tamaño tumoral (mayor de 3cm) y la intención de ser llevada a cirugía conservadora de seno según lo recomendado en las guías norteamericanas de cáncer de seno26, se aplicó terapia sistémica con protocolo AC (Doxirubicina y Ciclofosfamida) por 4 ciclos y posteriormente 3 ciclos de Paclitaxel por 12 semanas, se valoró paciente al finalizar la terapia neoadyuvante encontrando disminución de tamaño de masa en mama derecha al examen físico y se realizó una nueva ecografía que reportó lesión espiculada de 14 X 9 X 15 mm con retracción de tejidos adyacentes en planos profundos del cuadrante interno. La respuesta a la terapia neoadyuvante se clasifica según los criterios RECIST y OMS de valoración clínico radiológica27,28, como completa cuando hay ausencia de la lesión en el nuevo estudio, parcial con reducción de al menos un 30% de las dimensiones, progresión cuando hay un aumento de más del 20% en las dimensiones del tumor y estabilidad cuando no cumple criterios para catalogarla dentro de las demás categorías, en este caso, se consideró respuesta parcial a neoadyudancia, fue valorada por cirugía plástica y mastología, en donde se propuso cirugía conservadora de seno mediante manejo con cuadrantectomía derecha y mamoplastia de reducción bilateral de manera simultánea. (Figura 1)
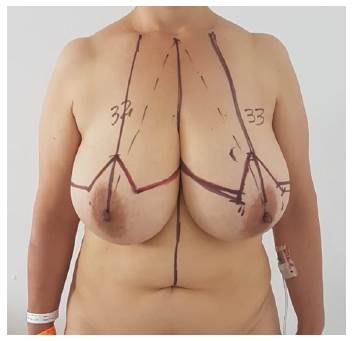
Figura 1 A) Paciente en estado Preperatorio, Macromastia Bilateral, con mayor volumen en seno derecho y mayor ptosis en seno izquierdo, marcación de mamoplastia de reducción - Pedículo inferior.
En el procedimiento quirúrgico se realizó cuadrantectomía derecha (tejido resecado 200gr) más vaciamiento ganglionar y realización de mamoplastia de reducción bilateral, para escoger la técnica de reducción se debe seleccionar un pedículo que se encuentre en una localización diferente al cuadrante del tumor, en este caso se utilizó la técnica de pedículo inferior debido a que el tumor estaba localizado en el cuadrante medial; se resecó 900gr de tejido mamario en la mama derecha y 790gr en la mama izquierda (Figura 2), logrando simetría entre ambos senos y un adecuado resultado estético posoperatorio (Figura 3). Se obtuvo resultado de patología que indicó tamaño tumoral de 19 x 14 x 13 mm, márgenes negativos y con score de Bloom Richardson modificado de 6 puntos (formación de túbulos 3, pleomorfismo nuclear 1, recuento mitótico 2 con invasión linfovascular y perineural), resultado de vaciamiento ganglionar con ganglios linfáticos comprometidos por lesión tumoral, por lo que se indicó radioterapia adyuvante (6600 cGy) y hormonoterapia con Tamoxifeno.
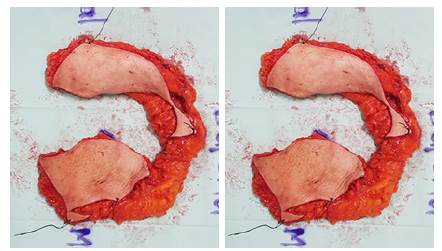
Figura 2 Producto de Resección mamoplastia de reducción, A) 900 gr mama derecha B) 790 gr mama izquierda.
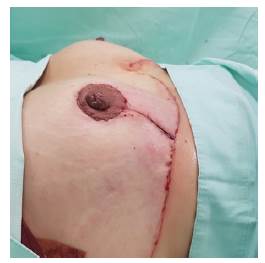
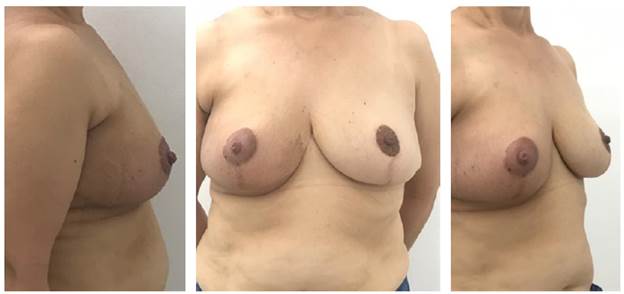
Durante seguimiento a los 6 meses (Figura 4) se encuentra paciente sin recurrencia local o regional y con mejoría de síntomas derivados de macromastia, con resultado estético satisfactorio a pesar de haber recibido radioterapia adyuvante en seno derecho. Se evidencia adecuada simetría mamaria y adecuada proyección de complejo areola pezón, con disminución considerable del volumen mamario en comparación con preoperatorio, se aplicó cuestionario BREAST Q a los 6 meses del post operatorio encontrando mejoría en bienestar físico (prequirúrgico 58/100, postquirúrgico 75/100), psicosocial (prequirúrgico 46/100 postquirúrgico 92/100) y satisfacción con el aspecto de las mamas (prequirúrgico 50/100, post quirúrgico 90 /100).
Discusión
En pacientes con cáncer de seno en estadio temprano es posible ofrecer tratamiento de manera segura con cirugía conservadora de seno. Verpnessi y cols realizaron un analisis de los resultados a largo plazo de 3 ensayos clinicos realizados en 1973 pacientes, en los que se comparó diferentes modalidades de tratamiento local en cáncer de seno, encontrando tasas de recurrencia similares entre los pacientes que recibieron tratamiento con mastectomía radical (2.3%) y los pacientes que recibieron cuadrantectomía y radioterapia posoperatoria (3.3%), con la ventaja de preservar el seno29. En otro trabajo de Veronessi y Cols30 donde se analiza el seguimiento a 20 años de uno de estos estudios, se encuentra que la sobrevida a largo plazo en pacientes con cáncer de seno tratadas con cirugía conservadora de seno es idéntica al grupo de pacientes tratadas con mastectomía radical a pesar de tener una ligera mayor tasa de recurrencia locorregional.
Desde entonces, se ha descrito ampliamente en la literatura la seguridad de la cirugía conservadora de seno en estadios tempranos con resultados variables en términos de márgenes libres de resección y de recaída locorregional. Tanis y cols reportan tasas de recurrencia loco regionales del 11% a 10 años para cancer de mama en estadios I-III tratados con cirugia conservadora de seno31.
Clough y cols reportan tasas de recurrencia local de 8.8% para tamaño tumoral mayor a 30 mm y encuentran que el riesgo de metastasis en pacientes con cirugia conservadora se relacionó con el estado triple negativo y afeccion ganglionar linfatica32. El Instituto Nacional de Cancerologia Americano report una tasa de recurrencia de 18% a 10 años en pacientes con cancer de seno estadio I y II operadas con cirugia conservadora de seno.
En pacientes con cáncer de seno en estadio temprano asociado a hipertrofia mamaria, es posible realizar cirugia conservadora de seno (cuadrantectomía y radioterapia posoperatoria) asociado a un procedimiento de mamoplastia de reducción bilateral, lo que se conoce con el término de mamoplastia de reducción oncoplastica o mamoplastia de reducción oncoterapéutica33, la primera descripción de este procedimiento fue realizada por Clough y cols. en 1992, tratando a 16 mujeres con tumores en el cuadrante inferior del seno34 y posteriormente por Shestah y cols en 199335, desde entonces ha incrementado su utilización y los reportes en la literatura33.
Ettinger y cols investigaron unaa serie de casos de 24 mujeres a quienes se les realizó mamoplastia de reducción oncoplastica, reportando margenes histologicos libres de tumor en la totalidad de sus pacientes36. Asi mismo, Emiroglu y cols en una serie de casos de 82 pacientes con cáncer de seno y macromastia, reportan márgenes positivos en el 3,7% de los casos, recurrencia local del 4,9% y recurrencia loco regional del 6,1%, encontrando mejor control oncológico en comparación a otros estudios donde utilizan cirugía conservadora de seno únicamente4.
En una revisión sistemática realizada por Piper y cols. se analizaron 17 artículos con un total de 1312 pacientes a quienes se realizó mamoplastia de reducción oncoplastica y de recurrencia a distancia de 3%; adicionalmente, tasas de re excisión por márgenes positivos de 0-16,4%, con un promedio de 3,5% 3737.
Se presume que estas tasas bajas de recurrencia y márgenes positivos en una mamoplastia de reducción oncoplastica probablemente se asocien a la amplia escisión de nervios y parénquima mamario en bloque, permitiendo la resección tumoral con márgenes más amplios y tratar simultáneamente la macromastia y el cáncer de seno4.
Como ventajas adicionales de realizar la mamoplastia de reducción oncoplastica en pacientes con mamas hipertróficas, se optimiza el tratamiento con radioterapia adyuvante al aplicarlo de manera más localizada en una zona de menor volumen, el seguimiento imagenológico se facilita por la reducción del volumen mamario y se mejoran los síntomas físicos derivados de la hipertrofia mamaria33,37,38.
Con respecto a la dimensión estética, a pesar de que la mayoría de pacientes tratadas con cirugía conservadora de seno se encuentran satisfechas con el resultado, hasta el 30% puede presentar secuelas cosméticas, de las cuales, la asimetría mamaria es la más frecuente, siendo esta mucho más evidente en pacientes con hipertrofia mamaria39. Estas secuelas estéticas son difíciles de corregir en un segundo procedimiento quirúrgico, debido a los cambios que se producen en la calidad de la piel y de los tejidos blandos después de la radioterapia adyuvante33.
Cuandose realiza lareseccióntumoraly lamamoplastia de reducción en el mismo procedimiento quirúrgico inicial, se tiene mayor control sobre la simetría posoperatoria de ambos senos, y la intervención es realizada en tejido que no ha presentado daño por radiación20,40.
En una revisión sistemática realizada por Lonie y cols. analizaron 58 estudios con 5.867 pacientes de mujeres con macromastia a quienes se realizó mamoplastia de reducción, encontrando una tasa de satisfacción promedio de 90,26% y mejoría en los síntomas físicos y mentales41. Emiroglu y cols en un estudio retrospectivo de pacientes con cáncer de seno y macromastia, a quienes se realizó tratamiento con la técnica utilizada en nuestra paciente, encontraron tasas de satisfacción buenas o excelentes hasta del 84%, viéndose reflejado esto en mejoría de la calidad de vida, medida por instrumentos validados4.
En cuanto a las complicaciones, Imahiyerobo y cols. encuentran que las complicaciones más frecuentemente relacionadas con MRO son necrosis en la piel del seno, necrosis parcial o total del complejo areola pezón, dehiscencia de la herida, infección, seromas y hematomas, que se presentaron hasta en un 21 % y encontraron que el factor de riesgo que más se relaciona con la incidencia de complicaciones es el índice de masa corporal aumentado42. A pesar de que nuestra paciente tratada presentaba sobrepeso, no tuvo ninguna complicación posoperatoria.
Conclusión
El manejo simultaneo del cáncer de seno y macromastia con mamoplastia de reducción oncoplastica ofrece beneficios en el control oncológico de la enfermedad, facilita el seguimiento clínico, genera un resultado estético satisfactorio e impacta de manera positiva la calidad de vida global de las pacientes, viéndose mejoría significativa en la autoestima, autoaceptación corporal y en los síntomas físicos23,37,38,43,44-46. En el caso presentado, se obtuvo márgenes de resección tumoral libres, una disminución en el volumen mamario y una adecuada simetría posoperatoria, logrando un tratamiento completo de la patología neoplásica y una mejoría en la calidad de vida de la paciente medida por el BREAST-Q, recomendamos fuertemente la realización de este procedimiento en pacientes con diagnóstico de cáncer de seno en estadios tempranos que sean candidatas a terapia conservadora de seno y que presenten macromastia de manera concomitante.