Introducción
La neumonía intersticial aguda, también conocida como síndrome de Hamman - Rich, es una patología idiopática pulmonar rápidamente progresiva que se caracteriza por daño alveolar difuso de etiología desconocida asociado a infiltrados pulmonares bilaterales y falla ventilatoria inminente en pacientes previamente sanos1-3. Es un diagnóstico de exclusión por lo que requiere de un estudio exhaustivo para descartar otras causas de daño alveolar infecciones, enfermedades de tejido conectivo y elementos farmacológicos1,3,4.
La información que se conoce de esta entidad, desde su descripción por Hamman y Rich en 193 55, se ha reunido a través de reportes de caso dada su baja prevalencia y su difícil diagnóstico. Se sabe que la mayoría de los pacientes requieren ventilación mecánica y que la mortalidad asociada a esta patología es alta5, pero no ha sido posible establecer un manejo más allá del manejo sintomático. Aunque hay reportes de algunos datos de mejoría con el uso de esteroides, hay otros en los cuales no, por lo que aún no se puede dar una recomendación fuerte para su uso en esta patología6-8.
Se identificaron un caso de un paciente masculino de 56 años quien se presentó inicialmente con síntomas respiratorios inespecíficos, en quien se documentan cambios imagenologicos del parénquima pulmonar rápidamente progresivos asociados a deterioro de la ventilación del paciente por lo que requirió ventilación mecánica invasiva. Se documentó daño alveolar difuso en fase fibroproliferativa en biopsia pulmonar, se descartó infección, autoinmunidad y toxicidad medicamentosa.
Caso clínico
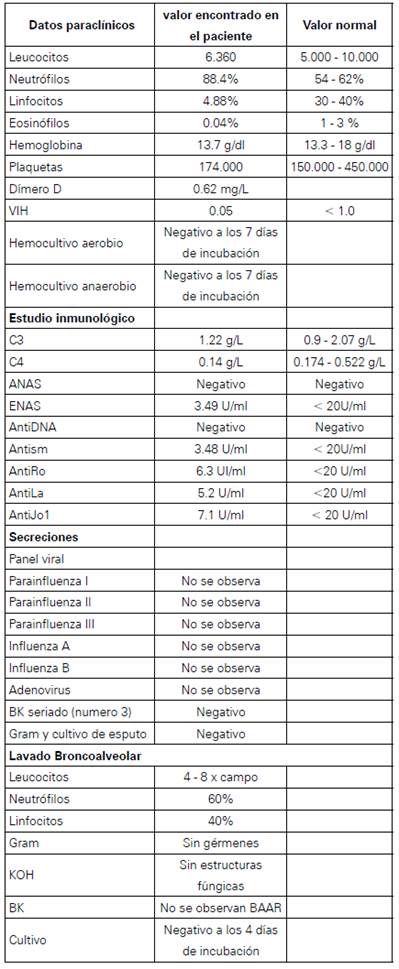
Se trata de un paciente masculino de 56 años con antecedente de diabetes mellitus tipo 2 y obesidad grado I, que consulta por cuadro clínico de 3 días de evolución consistente en tos inicialmente seca con posterior expectoración mucoide asociado a disnea. Se realiza radiografía de tórax sin alteraciones del parénquima pulmonar por lo que se da egreso con manejo sintomático (Ver figura 1). Reingresa por persistencia de sintomatología respiratoria, documentándose al examen físico, taquicardia, fiebre en 38,5° C, y a la auscultación pulmonar, sibilancias espiratorias bilaterales. No se evidenciaron previas úlceras orales, sinovitis ni ningún otro signo que indicara enfermedad autoinmune. En los paraclínicos iniciales se evidencia gases arteriales con trastorno leve de la oxigenación e hiperlactatemia, requiriendo oxígeno a bajo flujo.
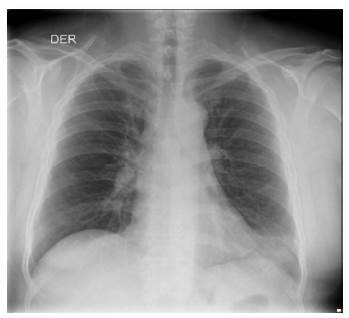
Figura 1 Radiografía de tórax ingreso: Opacidad triangular en la língula, que puede corresponder a atelectasia. No se observan otras alteraciones en la transparencia pleuropulmonar. Ángulos costofrénicos libres sin signos de derrame pleural.
En su abordaje inicial en el servicio de urgencias se calcula escala de Wells con probabilidad baja para tromboembolismo pulmonar (TEP), dímero D positivo y, mediante una tomografía de tórax, TEP descartado (Ver figura 2). Sin embargo, se identificaron trayectos fibrosos subsegmentarios con múltiples áreas de vidrio esmerilado en parches subpleurales indeterminadas. Se considera neumonía adquirida en la comunidad y se inicia manejo antibiótico con ampicilina/sulbactam más claritromicina. Se toman hemocultivos los cuales son negativos, panel viral negativo, baciloscopia seriada de esputo negativa y gram y cultivo de esputo negativos (Ver Tabla 1).
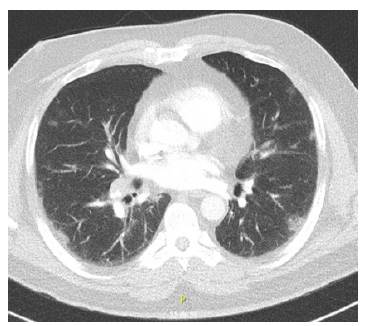
Figura 2 Angiotomografía de tórax: Negativo para tromboembolismo pulmonar. Trayectos fibrosos subsegmentarios con múltiples áreas de vidrio esmerilado en parches subpleurales indeterminadas más aparentes en lóbulos inferiores.
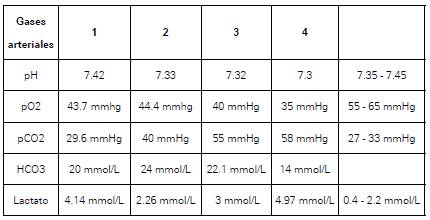
Dado el deterioro gasométrico con trastorno moderado - severo de la oxigenación (Ver tabla 2) y deterioro del patrón ventilatorio, el paciente es trasladado a unidad de cuidado intensivo 3 días después de su ingreso, donde se le realizó intubación orotraqueal para asegurar vía aérea (Ver figura 3).
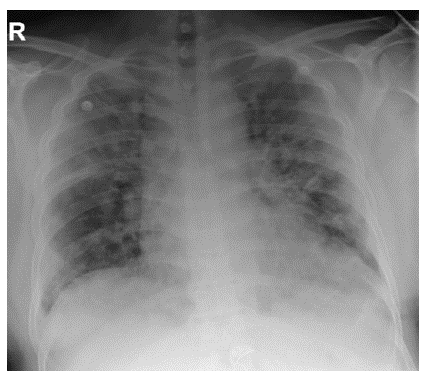
Figura 3 Radiografía de tórax control día 3: Opacidades alveolares en el lóbulo superior derecho y en el pulmón izquierdo.
Realizan tomografía de tórax de alta resolución control con extensa alteración parenquimatosa por compromiso por vidrio esmerilado central y subpleural multilobar rápidamente progresivo comparado con el estudio previo (Ver figura 4). Se escalonó manejo antibiótico a meropenem y se inició manejo con corticoide (tres bolos de metilprednisolona para continuar a 40mg día) por sospecha de neumonitis por hipersensibilidad versus neumonía intersticial aguda. Se solicitó perfil autoinmune con ANAS, ENAS, antiDNA, antism, antiJo, antiLa, antiRo negativos y complemento en rangos de normalidad. Es llevado a fibrobroncoscopia y lavado broncoalveolar en LB9, tomando biopsias transbronquiales de RB8 y RB9, sin presencia de microorganismos, BK, KOH y cultivo de hongos negativo (Ver tabla 1) y biopsia transbronquial, con hallazgo de daño alveolar difuso en fase fibroproliferativa. Presenta mejoría clínica progresiva logrando destete de ventilación mecánica invasiva 12 días después de su ingreso a unidad de cuidados intensivos, siendo trasladado a hospitalización donde se da egreso hospitalario para continuar tratamiento con corticoide 40 mg día realizando el correcto destete del mismo.
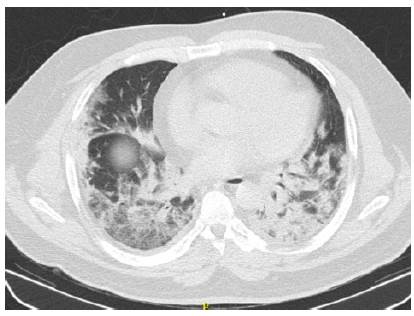
Figura 4 Tomografia de tórax de alta resolución día 4: extensas consolidaciones de morfología parcheada en ambos lóbulos superiores e inferiores, con gradiente anterior/posterior, con imágenes de broncograma aéreo en su interior y opacidades en vidrio esmerilado asociadas, tanto en lóbulos superiores como inferiores, con derrame pleural bilateral asociado de predominio izquierdo.
Discusión
La neumonía intersticial aguda fue inicialmente descrita por Hamman y Rich en 1935 basados en 4 casos de pacientes quienes presentaban un cuadro rápidamente progresivo de síntomas respiratorios inespecíficos, disnea y cianosis. Dicha sintomatología asociada a consolidaciones bilaterales en la radiografía de tórax. Los 4 pacientes fallecen y en los hallazgos histológicos del tejido pulmonar se visualiza engrosamiento de las células epiteliales alveolares, proliferación del tejido fibroso y ausencia de bacterias, que sugieren una misma patología que no había sido descrita con anterioridad9.
Desde entonces se hacía el diagnóstico de fibrosis pulmonar de etiología desconocida y síndrome de Hamman - Rich, usándose como sinónimo fibrosis pulmonar idiopática. En 1986, Katzenstein y Myers introducen el concepto de neumonía intersticial aguda, al reportar una serie de 8 casos de pacientes con falla respiratoria aguda asociado a daño alveolar difuso en la biopsia pulmonar y relacionándose con aquellos pacientes reportados por Hamman y Rich10.
Posteriormente, en el 2000 la sociedad americana de tórax pública el consenso sobre fibrosis idiopática pulmonar y reconoce la neumonía intersticial aguda como una patología diferente a esta11.
Hasta el momento se conoce que hay más de 200 tipos de enfermedades pulmonares intersticiales, separadas en enfermedades de causa conocida, como las de origen ocupacional, toxicidad por medicamentos o secundario a enfermedades sistémicas y por otro lado las de causa no conocida, como la neumonía intersticial aguda que hace parte de los 7 subgrupos de la neumonía intersticial idiopática12. De los reportes de caso revisados desde 1986, los pacientes que presentaron esta entidad tienen una media de edad de 54 años y acudieron al servicio de urgencias dentro de los primeros 18 días de síntomas2. En estado unidos, se estima una prevalencia alrededor de 81 y 67 por cada 100 000 hombres y mujeres, respectivamente y 1.8% de casos sin diagnosticar según reportes de autopsias13.
La neumonía intersticial aguda se define por presentar los siguientes criterios: síntomas respiratorios agudos que resultan en hipoxia severa, infiltrados bilaterales del parénquima pulmonar en radiografía de tórax, ausencia de etiología identificable o condición predisponente y hallazgo histológico de daño alveolar difuso1,2,14. La etiología de mayor importancia a descartar primero es la infecciosa, por lo que es necesario un análisis microscópico completo que incluya cultivos de esputo, hemocultivos, lavado broncoalveolar y análisis histológico de las muestras de tejido pulmonar, que permite identificar microorganismos difíciles de cultivar como pneumocystis y CMV1,15. Otra de las causas de daño alveolar difuso son las enfermedades del tejido conectivo, principalmente la polimiositis, dermatomiositis, esclerosis sistémica, lupus eritematoso sistémico y síndrome de sjogren; muchas de estas enfermedades reumatológicas debutan con DAD por lo que es necesario descartarlas para establecer el diagnóstico de NIA1,16. El DAD también puede ser consecuencia de toxicidad medicamentosa, principalmente de agentes quimioterapéuticos, amiodarona y nitrofurantoína1.
La neumonía intersticial aguda comparte muchas características con el síndrome de distress respiratorio agudo del adulto, como los infiltrados bilaterales del parénquima pulmonar, la hipoxia severa y el hallazgo histológico de DAD. Se diferencian por la ausencia de etiología de la NIA y el compromiso multiorgánico que presenta el SDRA1,6. La mortalidad del SDRA alcanza hasta un 31%, disminuyendo en los últimos años, siendo las causas de este, principalmente la neumonía, aspiración o inhalación de humo y trauma severo16. Pero por otro lado, no se conoce una tasa de mortalidad exacta en la neumonía intersticial aguda reportándose > 50% en diferentes series17.
En cuanto a la presentación clínica, inicia con síntomas respiratorios inespecíficos, según los reportes de caso publicados el más común es la tos (71 - 100%), la disnea (82 - 94%) y la fiebre (35 -90%), lo que puede demorar la consulta inicial y la mayoría de los pacientes presentan hipoxia al ingreso a urgencias8,10 La NIA se clasifica como una neumonía intersticial idiopática que se caracteriza por ser rápidamente progresiva, y la mayoría de los pacientes cursan con falla ventilatoria aguda10,18.
Debido a su baja prevalencia la información sobre hallazgos paraclínicos se ha obtenido a través de series de casos. Dentro de los hallazgos radiológicos, en la radiografía de tórax inicial predominan las opacidades pulmonares en la mayoría de pacientes. En el TACAR las imágenes predominantes fueron, vidrio esmerilado difusas bilaterales hasta en el 52% de los casos, consolidaciones con broncograma aéreo hasta en el 20% de los pacientes y menos frecuentes el derrame pleural, nódulos y engrosamiento de septos interlobulillares4,8. Existen algunas diferencias radiológicas entre la neumonía intersticial aguda y el SDRA. En la primera de estas, las opacidades en el TACAR suelen ser más simétricas, bilaterales y de predominio en bases pulmonares. Y dentro de los diagnósticos diferenciales, está la infección por pneumocystis jiroveci, edema hidrostático, neumonía eosinofílica aguda, proteinosis alveolar, hemorragia alveolar, entre otros3.
El lavado broncoalveolar tiene especial utilidad, descartando otras causas DAD, como lo son la neumonía eosinofílica, procesos infecciosos a nivel pulmonar y sistémicos y toxicidad pulmonar inducida por medicamentos. En la mayoría de casos el reporte es inespecífico con aumento del conteo de neutrófilos e hipertrofia de los neumocitos tipo II19. El diagnóstico histológico se realiza por biopsia pulmonar, pudiendo ser transbronquial o biopsia pulmonar abierta. Los hallazgos dependen de la fase en la que se encuentre el DAD, la fase inicial es la exudativa en la que se visualizan estructuras lineales eosinofílicas compuestas por tejido epitelial necrótico y proteínas del suero denominadas membranas hialinas con edema intersticial y alveolar. En la fase tardía o de organización, migran los fibroblastos a los septos alveolares y hay hiperplasia de los neumocitos tipo II. Dentro de las complicaciones más frecuentes relacionadas con la biopsia transbronquial, se encuentran la hemorragia, inestabilidad hemodinámica, no tolerancia a la extubación o empeoramiento de la falla ventilatoria19. La biopsia pulmonar abierta es una opción que brinda mayor información e incluso diagnósticos insospechados en pacientes con neumonía intersticial aguda sin causa clara, conduciendo al inicio de terapia dirigida y suspensión de tratamientos que conlleven a una alta morbilidad. Indicada en SDRA sin causa hallada a pesar de estudios exhaustivos y en el que se cree que presente un SDRA "like"16. Dentro de las complicaciones más frecuentes, la fuga de aire prolongada y hemotórax, ninguna de ellas resultando en muerte, según estudios realizados20,22 La mayoría de estudios demuestran que es el diagnóstico etiológico más frecuente en la biopsia pulmonar abierta en la DAD, presentándose hasta en el 56% de los casos22.
En nuestro caso paciente en edad promedio de presentación, siendo un hombre sano con los síntomas inespecíficos componente de evolución en menos de 18 dias según la literatura, con hallazgos del componente multilobar asociado broncograma aéreo, rápido deterioro con requerimiento de ventilación mecánica, todo los diagnosticos diferenciales se excluyeron (Etiologia infecciosa, medicamentosa e inmunológica) y un lavado broncoalveolar dentro de límites normales.
En cuanto al tratamiento se basa en medidas de soporte y ventilación mecánica invasiva o no invasiva, siendo la primera necesaria en la mayoría de los casos reportados. El uso de corticoides sistémicos aun es contradictorio, un estudio retrospectivo no mostró beneficio con respecto a mortalidad en pacientes tratados con corticoide con una mortalidad del 100%7 y en estudios aislados se encontró que el uso de metilprednisolona mejoró la sobrevida de los pacientes de SDRA con 45% sobrevida comparado con 33% con no uso de esteroide, por lo anterior hasta el momento no se puede dar recomendaciones fuerte para su uso6,11,13. En nuestro paciente se usó dosis de corticoides con una resolución completa de síntomas.
El pronóstico de los pacientes que cursan con neumonía intersticial aguda es pobre, la mortalidad de esta patología es superior al 50% como consecuencia de la falla ventilatoria aguda a pesar del manejo con ventilación mecánica y corticoides sistémicos en algunos casos, lo que le confiere especial importancia a los reportes de caso de esta patología23. Son pocos los reportes pero se ha relacionado en pequeñas series a resolución completa de síntomas en algunos pacientes24. Se presenta el caso de un hombre de 56 años que ingresa por un cuadro respiratorio, deterioro clínico y radiológico progresivo requiriendo intubación orotraqueal y manejo en unidad de cuidado intensivo, con estudios exhaustivos descartando las causas de daño alveolar difuso y finalmente llegando al diagnóstico de neumonía intersticial aguda. Finalmente, se aclara que el caso se documentó en el 2019, previo a la pandemia por Sars Cov2.
Conclusión
La neumonitis intersticial aguda es una patología rápidamente progresiva con alta mortalidad, se manifiesta inicialmente con síntomas respiratorios inespecíficos lo que puede demorar la consulta inicial. Para su diagnóstico requiere una biopsia pulmonar y hallazgo histológico de daño alveolar difuso, descartando todas las causas de SDRA. El tratamiento es de soporte y el uso de corticoides no se puede recomendar como evidencia fuerte a falta de estudios. En el caso reportado se inició tempranamente el manejo con corticoides sistémicos y el paciente recibió ventilación mecánica invasiva con una recuperación completa.