Introducción
A nivel mundial, el consumo de tabaco es una de las causas de mortalidad prevenibles1; sin embargo, más de ocho millones de muertes son atribuidas a este hábito anualmente, de las cuales, cerca del 90% corresponden a fumadores activos, y las restantes a fumadores pasivos2. En México, 43 000 personas fallecen al año por enfermedades atribuibles al tabaquismo. De hecho, en la última Encuesta Nacional de Consumo de Drogas, Alcohol y Tabaco, realizada en 2017, se estimó que 14,9 millones de mexicanos fuman tabaco, esto es, el 17,6 % de la población del país3. La alta mortalidad debida al tabaquismo, tanto global como nacional, se debe a la diversidad de padecimientos, ampliamente documentados, de los sistemas respiratorio, reproductor, integumentario, inmunológico, cardiovascular y digestivo4-10. De igual manera, se ha relacionado con el desarrollo de enfermedad isquémica cardíaca, tumores malignos en diversos órganos y, actualmente, con la progresión severa de síntomas de SARS-CoV-211-13.
Los esfuerzos para controlar el consumo del tabaco a nivel mundial promueven la generación del Convenio Marco de la Organización Mundial de la Salud para el Control del Tabaco (CMCT), el cual es un tratado internacional que incluye medidas eficaces en forma de artículos para el control del tabaquismo en cada país participante. Del CMCT surgen las medidas MPOWER, por sus siglas en inglés, que incluyen seis artículos altamente eficientes en el control del tabaquismo; M: vigilar el consumo de tabaco y las políticas de prevención; P: proteger a la población del humo de tabaco; O: ofrecer ayuda para dejar el tabaco; W: advertir de los peligros del tabaco; E: hacer cumplir las prohibiciones sobre publicidad, promoción y patrocinio del tabaco, y R: aumentar los impuestos al tabaco. Con estos esfuerzos se ha logrado que el número de países que adoptan las medidas MPOWER aumente año tras año. En el 2020, el 69 % de la población mundial aplica como mínimo una medida en su más alto nivel, según lo establecido por la Organización Mundial de la Salud (OMS). Aunque muchos países de la región de las Américas implementan dichas medidas, su nivel de aplicación es heterogéneo: México y Colombia solo aplican dos medidas en su nivel más alto, Canadá aplica cuatro medidas en su nivel más alto y Brasil aplica cinco medidas en su nivel más alto; a pesar de este avance, aún falta un largo camino por recorrer para lograr eliminar el tabaquismo como un problema de salud pública14,15.
Bajo la hipótesis de que las repercusiones en la salud por el consumo de tabaco provenían de la combustión de la hoja de tabaco, surgieron en China los cigarrillos electrónicos (CE) en 2003, los cuales no contenían esta hoja16. Dichos cigarrillos son dispositivos que contienen en un cartucho una sustancia líquida (e-liquid), compuesta principalmente por propilenglicol (PG), glicerina, saborizantes y un nivel de nicotina graduable. Durante su uso, la inhalación del consumidor activa un circuito que calienta el atomizador, lo cual convierte el e-liquid en aerosol que se exhala a manera de neblina17. El PG es un alcohol que se considera como "sustancia segura" ya que se utiliza en cosméticos y alimentos, sin embargo, se ha reportado que ante su inhalación produce irritación ocular y respiratoria. Por su parte, la glicerina, también es considerada segura en su forma tópica, pero se desconocen sus efectos al ser inhalada18.
Otro componente de los CE es la nicotina, la cual viaja por medio de partículas de humo hacia los pulmones, donde es absorbida hasta la circulación y finaliza en el cerebro, donde actúa a nivel neuronal al unirse a receptores colinérgicos, provocando así la liberación de numerosos transmisores; destacándose entre estos la dopamina, que regula, efectos de placer e intensifica los efectos de la nicotina al ser liberada en zonas destinadas al placer y a la recompensa19.
El uso a nivel global de los CE ha ido creciendo rápidamente con el paso de los años20, aumentando de 7 millones a 41 millones de usuarios entre 2011 y 201821. En México, los CE han tenido un gran impacto, ya que más de 5 millones de mexicanos entre 12 y 65 años mencionaron haber probado alguna vez el CE, y casi un millón de mexicanos refirió utilizarlo de manera constante3. A pesar de la creciente popularidad de los CE, estos entraron al mercado como alternativas al cigarrillo convencional (CC), sin mayores pruebas toxicológicas preclínicas o ensayos de seguridad a nivel mundial. Aunado a esto, no parece existir un consenso global en el aspecto legal, pues hay países en donde está prohibido y otros en los cuales no existe regulación alguna19,22,23.
La OMS menciona que muchas industrias tabacaleras han anunciado el CE como una opción menos dañina comparada con el CC. A pesar de esto, sus efectos en la salud se desconocen, pero resaltan mayores riesgos tanto a nivel sistémico como celular. Sin embargo, el riesgo es muy heterogéneo, dependiendo de factores como el tipo de CE, su uso, la cantidad, el patrón de consumo y de sus componentes14.
A nivel mundial existen múltiples organizaciones que han adoptado una postura en contra del uso y distribución de los sistemas electrónicos de administración de nicotina (SEAN) y los sistemas similares sin nicotina (SSSN). Las sociedades científicas respiratorias como la Asociación Argentina de Medicina Respiratoria (AAMR), la Asociación Latinoamericana de Tórax (ALAT), la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), la Sociedad Mexicana de Neumología y Cirugía del Tórax (SMNyCT) y la European Respiratory Society, se congregaron en el año 2018 en el Foro de Sociedades Científicas frente al CE, en el cual se constató que no hay pruebas suficientes que indiquen que los CE son útiles para dejar de fumar tabaco, que los CE no son dispositivos seguros para la salud de los consumidores y, por último, que los CE promueven un mayor consumo tabáquico24.
En los últimos años, el Centro para el Control y Prevención de Enfermedades de los Estados Unidos (CDC por sus siglas en inglés) reportó numerosas hospitalizaciones por enfermedades relacionadas con el uso de CE25,26. Al respecto, en México, en el 2019, el Instituto Nacional de Enfermedades Respiratorias (INER) impartió un comunicado en el cual se une a la postura del CDC, alertando sobre el posible daño grave pulmonar a corto plazo27. Por otro lado, los consumidores de CE pueden clasificarse como activos y pasivos28,29; los primeros inhalan directamente el aire del CE, y los segundos inhalan el aerosol exhalado por los activos30. En los consumidores activos las partículas ultrafinas de los CE podrían tener efectos a nivel respiratorio y cardiovascular; a nivel respiratorio se han observado cambios en la expresión génica de la mucosa nasal, aumento del riesgo de presentar síntomas de bronquitis crónica y afectación pulmonar directa en forma de inflamación y estrés oxidativo. A nivel cardiovascular se activan procesos inflamatorios implicados en el desarrollo de enfermedad cardiovascular, eventos cardiovasculares agudos y deterioro de la función vascular. Igualmente, los CE liberan sustancias carcinógenas que, a pesar de encontrarse en concentraciones leves, podrían tener efectos tras la exposición repetida23.
A pesar de que los riesgos para la salud de los consumidores activos de CE han sido reportados en la literatura16,22,31,32, la información todavía es escasa respecto a las personas expuestas al aerosol de estos dispositivos, por lo tanto, el objetivo de esta revisión es identificar los efectos de la exposición pasiva al aerosol de los CE en estudios realizados in vivo e in vitro.
Metodología de búsqueda
Se realizó una revisión de la literatura sobre los riesgos para la salud de los fumadores pasivos de CE siguiendo la guía PRISMA (por sus siglas en inglés: Preferred Reporting Items for Systematic reviews and Meta-Analyses)33. Para cumplir con el objetivo propuesto, se realizó la búsqueda en las bases de datos PubMed, Scielo y EBSCO. Para la estrategia de búsqueda se utilizaron las palabras clave "Electronic Nicotine Delivery Systems", "Electronic Cigarettes", cada uno en conjunto con (operador booleano AND) "Vaping", "Secondhand Smoking", "Tobacco Smoke Pollution", entre los últimos el operador booleano OR; las palabras se identificaron tanto en el título como en el abstract de los documentos.
A partir de esta búsqueda se obtuvo un total de 323 artículos de las bases de datos y 5 artículos mediante búsqueda manual en publicaciones relacionadas con el tema. Posterior a la eliminación de los duplicados (46) restaron 282 artículos, de los cuales fueron seleccionados 52 tras la lectura del título y resumen. Posteriormente, se procedió a la lectura completa de estos 52 artículos, para lo cual se emplearon los siguientes criterios de inclusión: i) artículos contenidos en revistas indexadas y revisadas por pares, ii) publicados entre el 1 de enero de 2003 (año de aparición del cigarrillo electrónico) y el 15 de junio de 2020, iii) contar con los términos de búsqueda en el título y resumen, iv) disponibilidad del documento completo, v) idioma de la publicación (inglés o español), vi) diseño del estudio observacional y experimental, y vii) estudios en seres humanos, animales e in vitro. Los estudios observacionales incluidos fueron reportes de caso, estudios transversales y de cohorte; mientras que los experimentales fueron cuasiexperimentales y estudios controlados aleatorizados.
Posteriormente, tras la lectura completa y el análisis de los documentos, cada autor capturó mediante el uso del programa Microsoft Office Excel® los criterios encontrados, así como la información más relevante de cada documento (tipo de estudio, año de publicación, lugar de publicación, tamaño de muestra, resultado principal, entre otros) para su posterior cotejo. Se consideraron como criterios de exclusión la ausencia de una versión digital del artículo, ausencia de información acerca de los efectos nocivos en la salud, redacción del cuerpo del artículo en un idioma distinto al español e inglés, así como artículos de revisión, editoriales o cartas al editor; se eliminaron así 35 artículos (Figura 1).
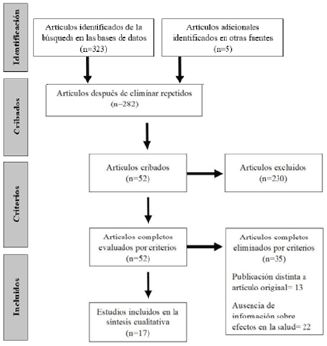
Fuente: elaboración propia.
Figura 1 Diagrama de flujo de las publicaciones incluidas en la revisión.
Se encontraron 17 artículos que cumplían con todos los criterios requeridos y que contenían información alusiva a los efectos de la exposición al aerosol de segunda mano de CE. Toda la literatura incluida fue publicada a partir del año 2013, en el idioma inglés, y fueron realizados en los Estados Unidos (60 %) y países europeos como Grecia, Italia, Reino Unido y Francia (40 %). Para su análisis, los artículos fueron agrupados en tres categorías: i) estudios realizados en seres humanos, ii) estudios realizados en animales y iii) estudios realizados in vitro. Dos artículos contaron con dos muestras de distintos grupos, clasificándose tanto en estudios realizados en animales como in vitro. Una de las limitantes fue la diversidad en la terminología utilizada en los documentos para referirse a los CE.
Resultados
Estudios realizados en seres humanos
Fueron siete estudios, de los cuales cuatro tuvieron un diseño experimental y tres un diseño observacional (Tabla 1).
Tabla 1 Estudios realizados en seres humanos.
| Año | Autores | Muestra | País | Diseño | Valores de pruebas | Efecto en la salud |
|---|---|---|---|---|---|---|
| 2013 | Flouris et al. | 30 | Grecia | Experimental | p > 0,001 | Niveles de cotinina sérica no interfieren con la función pulmonar normal. |
| 2016 | Poulianiti et al. | 30 | Grecia | Experimental | p > 0,05 | No produce perturbaciones inmediatas en el sistema antioxidante de la sangre. |
| 2018 | Bayly et al. | 11 830 | EUA | Observacional | p < 0,01 OR 1,27 IC 95 % | Exacerbaciones de asma en jóvenes asmáticos. |
| 2018 | Avino et al. | 10 | Italia | Experimental | Se utilizaron fórmulas para analizar la materia de partículas exhaladas | El riesgo para cáncer de pulmón en personas expuestas al aerosol de CE es cinco veces menor que en fumadores pasivos de CC. |
| 2018 | Willis et al. | 8087 | EUA | Observacional | p < 0,01 OR 2,58 IC 1,36-4,89 | Enfermedad pulmonar obstructiva crónica. |
| 2019 | Johnson et al. | 28 | EUA | Experimental | 15 % de los participantes (n=5) | Dolor de cabeza, boca seca, tos e irritación de los ojos. |
| 2020 | Galiatsatos et al. | 1 | EUA _ | Observacional (reporte de caso) | NA | Neumonitis por hipersensibilidad en individuos susceptibles. |
OR: odds ratio. IC: intervalo de confianza. NA: no aplica. n: muestra.
Fuente: elaboración propia.
Entre los estudios observacionales, dos fueron transversales y el otro correspondió a un reporte de caso. En los transversales se determinó una asociación entre el aerosol de segunda mano de CE y las exacerbaciones de asma y enfermedad pulmonar obstructiva crónica (EPOC)34,35. Ambos estudios emplearon muestras representativas: el primero incluyó estudiantes con diagnóstico de asma entre 11 y 17 años expuestos al aerosol de segunda mano de CE y con ataques de asma en los 12 meses previos a la encuesta34; mientras que el otro estudio incluyó personas mayores de 18 años que formaron parte de una encuesta nacional vía telefónica35. El reporte de caso trató de una paciente de 37 años con neumonitis por hipersensibilidad, donde el único factor de riesgo relevante fue la exposición al aerosol de segunda mano de CE en su hogar un año previo al inicio de los síntomas36.
En los estudios experimentales se obtuvieron para las mediciones muestras de sangre, de orina y de saliva; los grupos que conformaron las muestras fueron de diez a quince sujetos, y el método de muestreo no fue aleatorizado. Todos los protocolos fueron aprobados por un comité de ética y los participantes firmaron el consentimiento informado. Dos estudios fueron realizados por un solo grupo de investigadores, quienes estudiaron las elevaciones de cotinina, el principal metabolito de la nicotina, que es considerado el mejor biomarcador en fumadores activos y pasivos37. El primero reportó que los niveles de cotinina en sangre no interfieren en la función pulmonar normal a corto plazo38. El segundo reportó que la exposición pasiva al aerosol de CE no produce perturbaciones inmediatas en el sistema antioxidante de la sangre39. En contraste, la cefalea, boca seca, tos e irritación de los ojos se asociaron con una elevación de los niveles de cotinina sérica y salival y de acroleína en participantes de un evento público expuestos al aerosol de segunda mano por un promedio de seis horas40.
En un estudio elaborado por Avino et al.41, en 2018, se midieron las concentraciones de partículas del aerosol exhalado por fumadores de CE en un medio controlado, y determinaron que el riesgo de cáncer pulmonar es más elevado en fumadores pasivos de CC que en personas expuestas al aerosol de CE, dadas las concentraciones de químicos presentes.
Estudios realizados en animales
Se encontraron seis estudios experimentales y un estudio observacional, todas las muestras de animales fueron ratones (Tabla 2).
Tabla 2 Estudios realizados en animales.
| Año | Autores | Muestra | País | Diseño | Valores de pruebas | Efecto en la salud |
|---|---|---|---|---|---|---|
| 2015 | Lerner et al. | Ratones | EUA | Experimental | Estrés oxidativo: p < 0,001 | Inflamación pulmonar y estrés oxidativo. |
| 2015 | McGrath et al. | Ratones recién nacidos | EUA | Experimental | Peso: intento 1 (p <0,054), intento 2 (p <0,006) Disminución de proliferación celular: p <0,004 | Disminución de la proliferación celular alveolar, deficiencia en el desarrollo pulmonar. Afecta de manera adversa la ganancia de peso. |
| 2015 | Ponzoni et al. | 180 ratones | Italia | Experimental | Cotinina y nicotina cerebral: p < 0,01 Cotinina urinaria: p <0,05 Comportamiento compulsivo: p <0,01 Regulación positiva de nAChR: p < 0,01 | Alteraciones neuroquímicas, fisiológicas y conductuales relacionadas con la adicción. Regulación positiva de nAChR y elevación de la cotinina y nicotina a nivel cerebral y cotinina urinaria. La abstinencia espontánea provoca mayor ansiedad y comportamiento compulsivo. |
| 2017 | Rau et al. | 58 ratones | EUA | Experimental | p <0,05 | Necrosis del colgajo e hipoxia. Los niveles de nicotina y cotinina en suero mayores en los expuestos al CC que al CE. |
| 2018 | Troiano et al. | 45 ratones | EUA | Observacional | p < 0,001 IC 95 %, 59,9-71,8 | Perjudiciales para la cicatrización de heridas. Aumento de la necrosis del colgajo. |
| 2019 | Wang et al. | Ratones machos y hembras | EUA | Experimental | Células inflamatorias y MPO: p < 0,01 Regulación positiva de nAChR: p <0,05 Marcadores: p < 0,001 | Actividad baja de MPO y aumento de células inflamatorias en el grupo expuesto con PG y nicotina. Alteración selectiva de marcadores lipogénicos y miogénicos. Regulación positiva de nAChR. |
| 2020 | Mayyas et al. | 52 ratones | EUA | Experimental | Inflamación: p < 0,01 Estrés oxidativo: p < 0,05 Fibrosis: p < 0,05 | Aumenta la expresión de químicos, promoviendo alteraciones cardíacas. fibrosis, inflamación y estrés oxidativo. |
IC: intervalo de confianza. MPO: mieloperoxidasa. nAChR: receptor nicotínico de acetilcolina. IL: interleucina
Fuente: elaboración propia.
El colgajo de piel de ratones fue evaluado en dos estudios, un observacional de tipo cohorte42 y un experimental43, ambos con muestras mayores a 40 ratones y una duración de 1 mes y 5 semanas, respectivamente. En estos, se reportó una severa necrosis e hipoxia en el tejido del colgajo tras la exposición al aerosol del CE y al humo del CC, sin una diferencia significativa entre estos. Además, se reportaron niveles de cotinina en sangre mayores en el grupo expuesto al humo CC que en su contraparte electrónica43; en cambio, en el estudio realizado por Ponzoni et al.44, en el 2015, se reportaron niveles de cotinina y nicotina cerebrales y cotinina urinaria similares en ambos grupos expuestos. Además, en este último estudio, en donde se expusieron 180 ratones por 7 semanas, los efectos resultantes se presentaron durante y después de la abstinencia espontánea, tales como ansiedad severa y comportamiento compulsivo en el grupo expuesto al aerosol del CE.
La exposición al aerosol de CE durante el período neonatal puede afectar negativamente el peso, incrementar los niveles sistémicos de cotinina y disminuir la proliferación celular alveolar, así como generar una deficiencia en el desarrollo pulmonar45,46. Mayyas et al.46, en 2020, realizaron un experimento con ratones, divididos aleatoriamente en cuatro grupos: expuestos al aire (control), aerosol de CE, humo de CC y humo de pipas de agua. La exposición durante una hora al día por cuatro semanas demostró que en los ratones expuestos al aerosol de CE hubo una elevación de endotelina-1, mieloperoxidasa (MPO), proteína C reactiva, súper óxido dismutasa y glutatión, comparado con el control. Lo anterior promueve alteraciones cardíacas como fibrosis, inflamación y estrés oxidativo.
Dos experimentos utilizaron tanto ratones como células epiteliales bronquiales humanas. En el primero, al exponer a los ratones al aerosol del CE con y sin nicotina por dos horas durante tres días, se encontró un aumento de células y proteínas inflamatorias (neutrófilos, linfocitos T CD8, IL-6, IL-1a e IL-13, entre otros) en el grupo expuesto a PG y nicotina47. En el segundo estudio, la exposición de los ratones al aerosol del CE durante tres días reveló una respuesta inflamatoria pulmonar con elevación de MCP-1, IL-6, IL-1a e IL-13; otro hallazgo fue la generación de estrés oxidativo48.
Estudios realizados in vitro
Se incluyeron cinco estudios experimentales in vitro, dos realizados en Inglaterra, uno en Francia y dos en Estados Unidos (Tabla 3).
Tabla 3 Estudios realizados in vitro.
| Año | Autores | Muestra | País | Diseño | Valores de la prueba | Efecto en la salud |
|---|---|---|---|---|---|---|
| 2015 | Lerner et al. | Células epiteliales bronquiales humanas y fibroblastos pulmonares fetales humanos | EUA | Experimental | IL 8: p <0,05 IL 6: p < 0,01 | Incremento en la secreción de IL6 e IL8 en células epiteliales bronquiales humanas. |
| 2016 | Higham et al. | Neutrófilos | UK | Experimental | p < 0,05 | Respuesta proinflamatoria de los neutrófilos humanos. Productos químicos nocivos y carcinógenos. |
| 2017 | Thorne et al. | Células epiteliales bronquiales | UK | Experimental | p = 0,05 | No genotoxicidad o citotoxicidad. |
| 2017 | Anthérieu et al. | Células epiteliales bronquiales | Francia | Experimental | p <0,05 | Aumento de citocinas proinflamatorias. No genotoxicidad. Menores efectos adversos que el humo de CC en viabilidad celular y el estrés oxidativo. |
| 2019 | Wang et al. | Células epiteliales bronquiales humanas | EUA | Experimental | Aumento IL 6: p <0,05 Aumento de prostaglandina E2: p <0,05 | Aumento de citocinas proinflamatorias en pacientes con EPOC. |
IL: interleucina. EPOC: enfermedad pulmonar obstructiva crónica.
Fuente: elaboración propia.
En el primer estudio, realizado por Lerner et al., se expusieron células epiteliales bronquiales humanas al aerosol del CE durante 5, 10 y 15 minutos, tras lo cual se demostró un incremento en la secreción de citocinas proinflamatorias (IL-6 e IL-8)48.
Higham et al.49, en 2016, aislaron y expusieron al aerosol de CE y al humo del CC los neutrófilos de la sangre de diez personas sanas no fumadoras. Tras la exposición, se observaron respuestas proinflamatorias en forma de cambios morfológicos, un aumento de CD11b, CD66b (activadores de neutrófilos), CXCL-8 (reclutamiento de neutrófilos) y MMP-9 (proteasas), además, se identificaron varios productos químicos nocivos como acroleína, propanal y estireno y los carcinógenos 2, 3-benzofurano y aliltiourea.
Anthérieu et al.50, en 2017, expusieron células epiteliales bronquiales humanas al humo de CC y al aerosol del CE. La exposición aguda consistió de 8 a 48 minutos, mientras que la exposición repetida consistió de 8 minutos por hora, durante 6 horas. El aerosol de los CE provocó una elevación de IL-6, sin embargo, no provocó efectos genotóxicos. Por otra parte, el humo de CC elevó la IL-6 e IL-8 y produjo regulaciones negativas y positivas del genoma.
En el estudio realizado por Wang et al.47, al utilizar las células epiteliales bronquiales de pacientes sanos y con EPOC como muestra, se encontró un aumento de citocinas proinflamatorias en los últimos; esto puede afectar la reparación de las células potenciando su remodelación. Por último, en un estudio realizado por Thorne et al.51, en 2017, se expusieron las células epiteliales bronquiales humanas al aerosol de CE por 120 minutos, lo cual no resultó en efectos al ADN o de citotoxicidad.
Discusión
Se revisaron 17 artículos para determinar los efectos adversos en la salud a partir de la exposición pasiva al aerosol de los CE. La mayoría de los documentos reportaron efectos adversos particularmente del aparato respiratorio.
A pesar de que el surgimiento de los CE data del año 2003, el primer artículo encontrado sobre los efectos de los CE en la salud de personas expuestas al aerosol de los CE fue publicado en el 2013. De los estudios revisados, todos fueron publicados en el idioma inglés y no se encontraron artículos sobre el tema en español.
Los principales efectos de la exposición pasiva al aerosol del CE en estudios realizados en seres humanos fueron las exacerbaciones del asma y EPOC34,35. Las exacerbaciones del asma ya habían sido descritas desde hace casi 30 años, relacionadas con la exposición pasiva al humo del CC en infantes y en niños entre 7 y 12 años mediante el análisis de cotinina urinaria52,53.
Johnson et al.40, en 2019, congregaron a jóvenes de entre 19 y 30 años previamente sanos, sin antecedentes de consumo de CC o CE, para que fueran a convenciones de CE para así reportar los efectos de la exposición pasiva, los cuales fueron dolor de cabeza, boca seca, tos, irritación de los ojos, elevación de niveles de cotinina y de acroleína. Respecto a esta última sustancia, dos estudios determinaron que es un agente etiológico del cáncer de pulmón a través del daño en el ADN o por inhibición de su reparación54,55.
En contraste, Flouris et al.38, en 2013, comentaron que, a pesar de encontrar niveles de cotinina en sangre, estos no producen alteraciones en la función pulmonar en humanos; y Poulianiti et al.39, en 2013, afirmaron que la misma exposición no produce cambios significativos en los biomarcadores de estrés oxidativo. Las principales diferencias reportadas en estos estudios pueden atribuirse a la utilización de diferentes marcas de CE, que varían desde la composición del propio CE, la concentración de nicotina, los componentes en los e-liquids, el tamaño de la cámara eléctrica, si son desechables o no y la empresa que los distribuye56. Por lo tanto, en países en los que su venta está permitida se deben regular las especificaciones en el contenido de cada elemento, para así permitir un mejor estudio de los efectos ocasionados en la salud57,58.
En los estudios realizados en animales e in vitro, se encontraron efectos proinflamatorios y de estrés oxidativo46-50; en los estudios que analizaron los cambios proinflamatorios, uno de los hallazgos en común fue el aumento de la IL-647,48,50. El aumento de IL-6, junto con el de su receptor soluble (sIL-6R), actúa como mediador de la respuesta inflamatoria y es capaz de provocar la transición de inflamación aguda a crónica59. Otro hallazgo interesante fue la detección de un aumento de MCP-148, una proteína quimioatrayente de neutrófilos que se ha asociado con la progresión y metástasis de diversos tumores, entre ellos, el cáncer de pulmón60.
La necrosis del colgajo, en estudios en animales, tras la exposición pasiva al aerosol de los CE fue reportada por Rau et al.42, en 2017, y por Troiano et al.43, en 2018. Este hallazgo es similar al encontrado en los fumadores de CC, debido a que la necrosis del colgajo se ha asociado al tabaquismo en diversas ocasiones, en donde se establece que la prevalencia en fumadores de CC es más del doble que en no fumadores61.
En los estudios revisados en seres humanos no se encontró información respecto a los efectos neurológicos causados por la exposición pasiva al aerosol de los CE. Sin embargo, en ratones se reportó una activación de los receptores nicotínicos que producen una regulación positiva de α4ß2; otros efectos neurológicos como la ansiedad y comportamientos compulsivos fueron encontrados tras la abstinencia espontánea al aerosol de CE44.
Considerando los hallazgos reportados en la literatura revisada sobre los efectos nocivos a la salud, es importante el abordaje de las actitudes de los consumidores de CE y las legislaciones al respecto. Los consumidores activos de CE acostumbran a hacerlo en lugares "libres de humo", con la premisa de que los CE son menos dañinos que los CC, ante la creencia de que el aerosol contiene solamente vapor de agua y que este no afecta a las personas expuestas al aerosol. Los lugares más comunes en donde se rompen las restricciones "libres de humo" son bares, restaurantes o discotecas, por lo que la población más propensa a violar estas restricciones son los jóvenes de entre 18 y 29 años62-64. Aunado a esto, las personas expuestas al aerosol de los CE de manera pasiva no suelen confrontar a los consumidores activos de CE dentro de lugares cerrados, en zonas "libres de humo" o cercanos a ellos64, debido a que los CE no emiten un olor desagradable, pues existen diversos sabores y olores que los vuelven menos molestos que los CC, por lo cual un mayor número de personas se expone a la inhalación pasiva de estos aerosoles62,63,65.
Otro aspecto que debería abordarse es que los sitios "libres de humo" suelen tener señalizaciones que no son específicas para los CE, ya que la mayoría de las imágenes hacen alusión a un CC en combustión. Ante esta situación, los consumidores de CE ignoran estos letreros al no identificar los CE en la imagen. Además, al encontrar puntos de venta cercanos a áreas "libres de humo", se genera mayor confusión en el consumidor66.
Desde el 2008 se prohibió la comercialización de los CE en México, en virtud de la interpretación que la Comisión Federal para la Protección contra Riesgos Sanitarios realizó del artículo 16, fracción VI, de la Ley General para el control del Tabaco67, en el cual se prohíbe: "Comerciar, vender, distribuir, exhibir, promocionar o producir cualquier objeto que no sea un producto del tabaco, que contenga alguno de los elementos de la marca o cualquier tipo de diseño o señal auditiva que lo identifique con productos del tabaco", puesto que los CE, a pesar de no ser "productos del tabaco", contienen elementos que los identifican como tal68.
En el 2014, se propuso una modificación al mismo artículo y fracción, con el objeto de, por una parte, señalar la importación como una conducta prohibida, y, por otra, hacer alusión expresamente a los CE dentro de dicha fracción. No obstante, las Comisiones Unidas de Salud y Asuntos Legislativos rechazaron dicha propuesta, al considerar que los CE no son productos del tabaco y, por ende, no forman parte del objeto de la ley en comento69. Recientemente, mediante decreto publicado el 19 de febrero de 2020 en el Diario Oficial de la Federación (DOF), se crearon diversas fracciones arancelarias a la tarifa de la Ley de los Impuestos Generales de Importación y Exportación, a partir de las cuales se estableció expresamente la prohibición de la importación y exportación de los CE y de las soluciones y mezclas utilizadas para su elaboración70.
A pesar de la prohibición general existente en torno a la comercialización y venta de los CE en México, se ha reportado un incremento de su conocimiento y uso en estudiantes entre 12 y 13 años; además, el uso de los CE se ha relacionado con el uso del CC, y quienes han probado ambos son más propensos a probar la marihuana71.
Conclusión
Se encontró evidencia en la literatura sobre los efectos en la salud de la exposición pasiva al aerosol de los CE, sin embargo, en los estudios predominó un tamaño de muestra pequeño, y en cuanto a la duración de los estudios, estos fueron en su mayoría de corto plazo. Por tanto, resulta importante la realización de más estudios que midan los efectos, tanto en humanos como en animales, en el mediano y largo plazo para la toma de decisiones en materia de prevención y legislación de los CE en los países que aún permiten su distribución y comercialización.














