Introducción
La enfermedad ósea metabólica (EOM) del prematuro, antes conocida como raquitismo u osteopenia del prematuro, se define como una reducción en el contenido mineral óseo en relación con el nivel esperado de mineralización para un bebé de tamaño o edad gestacional comparable, asociado a cambios radiográficos o bioquímicos1.
La etiología de la EOM es multifactorial, con numerosos factores de riesgo asociados, en gran parte, a la falta de transferencia normal de calcio y fósforo de la madre al feto, un proceso que ocurre de manera más significativa en el último trimestre de gestación, y que es exacerbado por la ingesta inadecuada y el alto grado de crecimiento esquelético que se produce en las semanas después del nacimiento1. Esta entidad es más común entre los neonatos prematuros menores de 30 semanas de gestación y, en particular, con un peso al nacer extremadamente bajo (<1000 g)1-3. La suplementación de minerales en prematuros a los niveles necesarios para igualar la acumulación transplacentaria en el último trimestre ha resultado ser un desafío, especialmente en los recién nacidos que no toleran la alimentación enteral y requieren nutrición parenteral total prolongada4.
La EOM usualmente ocurre de 6 a 16 semanas después del nacimiento y por lo general es clínicamente aparente en estadios avanzados de la enfermedad, cuando ocurre desmineralización severa, que se manifiesta a través de diferentes anormalidades anatómicas óseas en cráneo, huesos faciales, uniones costocondrales, costillas y huesos largos1,5. En la mayoría de los casos, la bioquímica anormal, que incluye hipofosfatemia, hiperfosfatasia e hiperparatiroidismo secundario, es evidente antes de la aparición de signos radiológicos como osteopenia, evidencia de raquitismo y fracturas6.
Establecer la prevalencia de esta enfermedad no ha sido posible, dada la falta de consenso en su definición, los diferentes métodos para su tamizaje y diagnóstico y la dificultad para la interpretación de los resultados1,6-8. Sin embargo, se ha identificado una tendencia a su aumento, probablemente debida a la mayor supervivencia de los neonatos prematuros7, en quienes sigue siendo una causa importante de morbilidad, a pesar de las mejoras en el manejo nutricional8.
Se estima una prevalencia de 16-60 % en los recién nacidos de bajo y muy bajo peso1, la cual varía de forma inversamente proporcional según la edad gestacional y el peso al nacer; se encontró que hasta un 40 a 50 % de los prematuros extremos pueden presentar EOM7,9,10. Esta también varía de acuerdo con el régimen nutricional brindado, con una prevalencia de 40 % en los prematuros alimentados con alimento materno sin fortificar; mientras que, en los que reciben leche materna con fortificadores que contengan calcio y fosfato y/o fórmulas de prematuros, la prevalencia disminuye al 16 %4. Otros factores que influyen sobre su prevalencia son el área corporal y la longitud del neonato, que también guardan una relación inversamente proporcional8.
Su diagnóstico implica una serie de criterios bioquímicos, radiológicos y clínicos, incluidos la medición de PHT, fosfato y fosfatasa alcalina séricos, la excreción urinaria de calcio y fósforo; una radiografía de puño o rodilla; y un examen físico completo en busca de manifestaciones anatómicas. Una vez establecido, se inicia de forma oportuna tratamiento optimizando la nutrición del prematuro y suplementando con calcio y vitamina D o fósforo, de acuerdo con los niveles de PTH; esto permite prevenir las complicaciones de la entidad, entre las que se encuentra un mayor riesgo de fracturas, deterioro de la función respiratoria y miopía del prematuro5. La comprensión de la EOM ha crecido en los países desarrollados, donde su prevalencia es aún desconocida, por lo que se ha mejorado la estrategia de manejo de nutrientes, los métodos de intervención clínica y el monitoreo en pacientes de alto riesgo, lo que ayuda a disminuir gradualmente su incidencia y a mejorar la calidad de vida de los neonatos prematuros. Sin embargo, sigue faltando investigación en profundidad y una comprensión sistemática de la EOM del prematuro en los países en desarrollo, lo que se asocia con una prevención insuficiente de la misma y con una mayor incidencia de complicaciones10.
El objetivo del presente artículo es realizar una revisión de los aspectos más relevantes de la EOM, permitiendo un abordaje integral y oportuno del recién nacido, con énfasis en la prevención y tratamiento precoz para evitar potenciales complicaciones.
Metodología de búsqueda
La información consignada en la presente revisión fue extraída luego de la búsqueda, entre enero y mayo de 2021, en las bases de datos Pubmed, ClinicalKey, ScienceDirect, SciELO y LILACS; se utilizaron como palabras clave términos MeSH "Bone Diseases, Metabolic"; "Infant, Premature"; "Infant, Very Low Birth Weight"; "Hypocalcemia"; "Hypophosphatemia"; "Alkaline Phosphatase". Se incluyeron los artículos publicados en inglés y español, sin fecha límite de publicación, con diseño metodológico de serie de casos, ensayo clínico controlado, metaanálisis, revisión sistemática y estudios observacionales, cuya población de estudio fueran recién nacidos con enfermedad ósea metabólica del prematuro. Se tuvieron como criterios de exclusión la no disponibilidad del texto completo e idioma diferente a inglés y español. Se obtuvieron 107 artículos en la búsqueda inicial. La revisión de los títulos y resúmenes de los resultados de la búsqueda fue llevada a cabo por tres evaluadores (SJGB, LMDB, AVG). Posteriormente, se excluyeron 68 artículos cuyo texto completo no se encontraba disponible, se encontraban en otros idiomas diferentes a los seleccionados, eran duplicados o con diseño metodológico diferente a los mencionados. Se obtuvieron un total de 39 artículos para su análisis.
Fisiopatología
Desarrollo del esqueleto fetal
La mineralización ósea comienza durante la fase embrionaria del desarrollo humano, y la mayor parte del proceso ocurre durante el tercer trimestre de gestación11. Los osteoblastos producen la matriz ósea orgánica para la deposición de calcio y fosfato, con una expansión progresiva del volumen óseo a través de un aumento en el grosor trabecular. La función y actividad de los osteoblastos y osteoclastos están influenciadas por la disponibilidad de minerales antes del nacimiento. La placenta proporciona calcio, fosfato y magnesio mediante transporte activo desde la circulación materna, incluso en presencia de bajos niveles de estos minerales, mientras que los ríñones y el intestino no juegan un papel importante para el feto11.
Durante el embarazo, el calcio y el fósforo se transfieren activamente de la madre al feto, alcanzando una tasa de acreción máxima entre las 32 y 36 semanas de gestación12, con una tasa de acumulación de calcio de aproximadamente 100-130 mg/kg de peso corporal fetal por día y de fosfato de 60 a 70 mg/kg de peso corporal fetal por día, lo que da lugar a un período de rápido crecimiento óseo13. El tercer trimestre es el período de crecimiento más activo, representa aproximadamente el 80 % de la acumulación de minerales óseos fetales en respuesta a las mayores necesidades fetales del esqueleto en desarrollo13. Como resultado, los requerimientos de Ca y P aumentan con la disminución de la edad gestacional, para compensar la pérdida de acumulación de estos minerales, y los bebés que nacen prematuros se ven privados de esta acumulación11,13.
La placenta tiene un papel central en la mineralización ósea. El calcio se transporta activamente a través de la placenta mediante bombas de calcio en la membrana basal, que dan como resultado un gradiente de calcio materno-fetal transplacentario de 1:46. Esta "hipercalcemia" fetal es necesaria para una adecuada formación esquelética14. El alto gradiente fetal-materno de minerales está asociado con bajos niveles fetales de hormona paratiroidea (PTH), calcitriol y esteroides sexuales, así como altos niveles de calcitonina y proteína relacionada con PTH (PTHrP). Los receptores sensores de calcio (CaSR) mantienen la PTH suprimida en respuesta a los altos niveles de calcio en el suero fetal. Es probable que los bajos niveles de calcitriol fetal se deban a la supresión de la ia-hidroxilasa renal fetal, debido a los bajos niveles de PTH, los altos niveles de calcio, fosfato y el aumento de la actividad placentaria de la enzima catabólica 24-hidroxilasa que provoca la conversión de 25-hidroxivitamina D en 24,25-dihidroxivitamina D que no se puede convertir en calcitriol15. La calcitonina se produce en la tiroides fetal y la placenta, y sus niveles en el feto son aproximadamente el doble de los de la circulación materna. Los altos niveles de calcitonina favorecen el depósito mineral. La PTHrP es producida por los condrocitos y las células pericondrales, y tiene un papel aditivo con la PTH en la regulación del calcio y fosfato fetales. También se produce en preosteoblastos y osteoblastos y estimula la formación de hueso11-14.
La 25-hidroxicolecalciferol, que desempeña un papel importante en el crecimiento del esqueleto fetal, se transfiere por vía transplacentaria y se activa al agregar un grupo hidroxilo adicional en los riñones del embrión para convertirse en 1,25 (OH) 2 vitamina D por: 1,25-dihidroxicolecalciferol. El último trimestre es el período en el que el esqueleto del embrión se osifica y posteriormente requiere una forma más activa de vitamina D de la madre3. Por lo tanto, hay un aumento de la movilización esquelética y la absorción gastrointestinal de minerales en las madres embarazadas para aumentar sus niveles de calcio sérico y posteriormente mejorar la transferencia transplacentaria de calcio al feto16; consecuentemente, los fetos con restricción de crecimiento debido a la disfunción placentaria crónica pueden ser osteopénicos debido a la interrupción del transporte de calcio o fosfato. La desmineralización también se observa en bebés nacidos de madres con infección placentaria y corioamnionitis6. Además, estudios han demostrado que la movilización fetal mejora el desarrollo del hueso cortical a través de su efecto de fuerza mecánica, por lo que los recién nacidos prematuros que se ven privados de estos movimientos tienen huesos corticales subdesarrollados y son más susceptibles a desarrollar EOM16.
Homeostasis mineral postnatal
Después del nacimiento, hay cambios rápidos en el suministro de minerales, el entorno hormonal y el estrés mecánico11 (Figura 1); la fuente placentaria de minerales se interrumpe, y el aumento en las necesidades de calcio de los huesos resulta en una reducción dramática de los niveles de calcio séricos, que alcanza su punto más bajo a las 18 horas de edad. Como resultado, la hormona paratiroidea (PTH) aumenta de manera transitoria en los primeros dos días después del parto, y el calcio sérico a menudo vuelve a su nivel normal incluso en prematuros, siempre y cuando estén sanos17. La hipocalcemia puede ser más intensa y duradera en neonatos prematuros enfermos, particularmente entre aquellos que sufren trastornos hipóxicos. Se ha encontrado que un compromiso en la oxigenación del tejido lleva a un aumento posterior en la entrada intracelular de calcio18. La reducción en el calcio sérico estimula la glándula paratiroidea para liberar PTH. La PTH actúa principalmente sobre los riñones al retener el calcio y destruir el fosfato. La PTH también facilita la formación de 1,25-dihidroxicolecalciferol en los riñones, lo que posteriormente mejora la absorción de calcio y fosfato del tracto gastrointestinal en el intestino delgado, tanto por transporte activo como por difusión pasiva12,16. La vitamina D suele ser esencial para la absorción activa de calcio; sin embargo, contribuye poco a la absorción de calcio en bebés prematuros en las primeras semanas de vida, ya que la mayor parte de la absorción parece ser pasiva12. La PTH aumenta el nivel sérico de calcio y fosfato al mejorar la resorción ósea. En última instancia, el hiperparatiroidismo produce un aumento en el calcio circulante y una reducción en el fosfato sérico1,16.
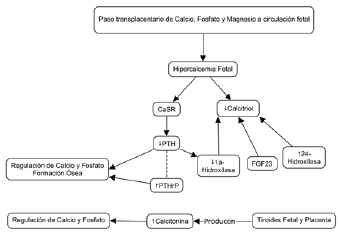
- CaSR: receptores sensores de calcio
- PTH: hormona paratiroidea
- PTHrP: proteína relacionada con PTH
Fuente: adaptado de Faienza MF et al.12
Figura 1 Mecanismos fisiopatológicos implicados en la regulación de minerales óseos fetales.
Factores de riesgo
La EOM es una enfermedad compleja y multifactorial, con diversos factores de riesgo asociados, en diferentes momentos del desarrollo del recién nacido. En términos generales, se conoce que el peso al nacer y la edad gestacional están inversamente relacionados con el desarrollo de EOM. El uso de medicamentos que afectan el metabolismo del hueso, la inmovilización y alimentación parenteral prolongadas, el retraso en la nutrición completa, sepsis, displasia broncopulmonar (DBP) y enterocolitis necrosante (ECN) también han sido descritos como factores de riesgo para EOM1,8.
En el periodo prenatal, el daño crónico a la placenta y su vascularización deficiente, observado en patologías como restricción del crecimiento intrauterino, preeclampsia y corioamnionitis, afecta el transporte mineral, contribuyendo a la desmineralización ósea. Asimismo, la deficiencia materna de vitamina D retrasa el crecimiento del esqueleto fetal6,7,19.
Se ha demostrado que fuerzas mecánicas ejercidas sobre los huesos y articulaciones promueven la formación y el crecimiento óseo, y que, por el contrario, la inmovilización lleva a la resorción ósea y excreción urinaria de calcio. Los estímulos para formación ósea ocurren principalmente en el tercer trimestre de gestación por medio de los movimientos fetales activos contra la resistencia de la pared uterina. Condiciones como la sepsis, patologías del sistema nervioso central, trastornos musculares y parálisis favorecen la falta de estimulación mecánica19.
En la etapa postnatal, condiciones crónicas asociadas a la prematurez como DBP, ECN, la colestasis asociada a la nutrición parenteral total (NPT) y la utilización de fármacos osteolíticos como esteroides, metilxantinas y diuréticos son otros factores de riesgo descritos para EOM5,20. Durante este periodo, es difícil suplir las necesidades minerales con la lactancia materna no fortificada o usando fórmulas estándar. Sistemas digestivos poco desarrollados como los de recién nacidos prematuros disminuyen la captación de dichos minerales esenciales para la formación ósea, por lo que la suplementación de calcio y fósforo es un desafío, principalmente en recién nacidos de muy bajo peso, en los que por su inmadurez gastrointestinal no es posible lograr la vía enteral plena al corto plazo y se hace necesario instaurar soporte de nutrición parenteral como estrategia para cubrir las necesidades de macro y micronutrientes. Esto sucede, asimismo, en prematuros con intolerancia gastrointestinal de difícil manejo que requieren nutrición parenteral de larga data5,8,19.
Cabe resaltar que la mayoría de los factores descritos están interrelacionados y no pueden ser disociados. Los factores de riesgo y su mecanismo patológico se resumen en la Tabla 1.
Tabla 1 Factores de riesgo para la enfermedad metabólica ósea del prematuro y sus mecanismos fisiopatológicos.
Fuente: Adaptado de Chinoy A, et al.14
Diagnóstico y tamización
El diagnóstico de la EOM del prematuro reúne una serie de criterios bioquímicos, radiológicos y, en etapas avanzadas de la enfermedad, clínicos.
Marcadores séricos
1. Calcio
La evaluación de los niveles de calcio no es una herramienta confiable debido a que los recién nacidos pueden mantener valores normales de calcio a pesar de presentar pérdida ósea de calcio, como resultado de la liberación de PTH. Además, la medición de calcio puede afectarse por otros trastornos como el agotamiento de fosfato y la hipofosfatemia6,11.
2. Fosfato y fosfatasa alcalina (FA)
La determinación del fosfato y FA es empleada rutinariamente para la evaluación de la mineralización ósea, donde la hipofosfatemia tiene aparición más temprana (en los primeros 7-14 días postparto)21. La hipofosfatemia con valores por debajo de 3,5-4,0 mg/dl (1,1-1,3 mmol/L), asociados a la elevación de FA más de 500 UI/L, son sugestivos de la enfermedad7. En recién nacidos pretérmino, dicha elevación de la FA ocurre hasta las 6-12 semanas de edad23. Es importante distinguir la elevación patológica de la FA, versus su aumento debido a la mineralización ósea rápida8; en estos casos sería útil la medición de la FA específica de hueso7. Cuando se evidencia un nivel de fósforo menor a 5,6 mg/dL (1,8 mmol/L) y FA mayor a 900 UI/L, se calcula una sensibilidad de 100 % y especificidad de 70 % para densidad mineral significativamente disminuida6,7,22. Los puntos de corte de los biomarcadores pueden variar dependiendo de la población estudiada7. Se recomienda la evaluación semanal o quincenal de fosfato sérico y FA7,11.
3. Otros
En recién nacidos con muy bajo peso al nacer, niveles séricos de PTH> 100 pg/ml podrían indicar riesgo de EOM. Además, los niveles altos de PTH, en asociación con la reabsorción tubular renal de fosfato (TRP), pueden diferenciar la causa de hipofosfatemia (ver biomarcadores urinarios). Adicionalmente, se ha demostrado que los niveles de PTH pueden predecir una disminución del contenido mineral óseo en los recién nacidos prematuros que han alcanzado la edad de término11.
Otros marcadores bioquímicos como la osteocalcina sérica (proteína de matriz ósea, marcador de actividad osteoclástica) y la concentración de calcio y fosfato urinario podrían ser útiles, pero requieren más estudios7,11. Se ha evidenciado que la excreción de fosfato urinario y osteocalcina sérica pueden ser marcadores útiles para predecir una baja mineralización ósea a los tres meses de edad corregida11.
4. Biomarcadores urinarios
La excreción urinaria de calcio y fósforo han sido usados como biomarcadores de mineralización ósea postnatal, con niveles superiores a 1,2 mmol/L y 0,4 mmol/L, respectivamente, asociados con una alta mineralización ósea. Asimismo, la reabsorción tubular de fósforo (RTF) >95 % sugiere inadecuada suplementación7; la RTF se calcula con la fórmula: [i- (fósforo urinario/creatinina urinaria x creatinina sérica/fósforo sérico)] x 10011. Este último parámetro en combinación con el valor de PTH permite diferenciar las deficiencias de calcio y fósforo6. Para aquellos recién nacidos con PTH elevada y RTF baja, se supone una deficiencia de calcio y/o vitamina D; mientras que los neonatos con PTH disminuida o dentro de límites normales y RTF >95 % deben recibir suplementación con calcio y fósforo3.
5. Imagenología
Para los recién nacidos con riesgo de EOM se recomienda solicitar una radiografía ósea (puño o rodilla) a las 4-8 semanas después del nacimiento, es decir, para aquellos bebés con niveles de fósforo disminuido por debajo de 5,6 mg/dL (<1,8 mmol /l) asociado a valores elevados de FA más de 5 veces del valor normal en adultos o >900 U/L. Asimismo, otras indicaciones de radiografía simple en recién nacidos pretérmino son: edema, movilidad reducida o sensibilidad de una extremidad; irritabilidad, llanto inexplicable; aumento del esfuerzo respiratorio con baja distensibilidad torácica, y dificultad para el destete del ventilador23.
Los principales hallazgos radiográficos en recién nacidos con EOM son: disminución de la densidad ósea, ensanchamiento de la placa de la epífisis de los huesos largos, metáfisis con deformación, adelgazamiento cortical, irregularidad en los bordes del cartílago de crecimiento y las metáfisis, reducción del hueso cortical, formación de hueso nuevo subperióstico, reacciones periósticas, fracturas (especialmente costales y de huesos largos, rara vez metafisarias)23. Las anormalidades óseas en la radiografía simple se pueden clasificar de acuerdo con el puntaje de Koo, que permite determinar la gravedad de los hallazgos y realizar un monitoreo de la EOM. El puntaje de Koo clasifica las alteraciones de la siguiente manera23,24:
Grado 0 (normal): densidad mineral normal.
Grado 1: disminución de la densidad de la línea blanca metafisaria, aumento de la hipotransparencia bajo el nivel metafisario, adelgazamiento cortical.
Grado 2: presencia de rarefacción ósea asociada con alteraciones metafisarias, sombras y formaciones óseas subperiósticas
Grado 3: asociado con la presencia de fracturas espontáneas.
Aunque la radiografía simple es una herramienta relativamente segura y de fácil acceso en las unidades de cuidado intensivo neonatal, los hallazgos característicos de EOM son evidentes hasta una pérdida entre el 30-40 % del contenido mineral, por cual no se constituye como el método de elección para el diagnóstico de EOM20,23.
Actualmente, la densitometría con rayos X de doble energía (DEXA) es el patrón de oro para la evaluación del contenido óseo mineral y la mineralización ósea8,20. La DEXA mide el contenido del calcio en el hueso expresado en gramo de hidroxiapatita por centímetro cuadrado, y requiere el uso de radiación ionizante (dosis efectiva, 0,001 mSv; <0,1 mrem). Usualmente, en los recién nacidos se valora la columna lumbar, antebrazo y calcáneo11. En el estudio de Figueras-Aloy et al., en el que evaluaron una cohorte de prematuros <31 semanas con peso <1.500 g, se encontró que una densidad mineral ósea >0,068 g/cm2 al alta se asoció con una probabilidad del 90,3 % de no desarrollar EOM del prematuro25.
Sin embargo, la DEXA presenta algunas limitaciones que han reducido su uso, entre estas: tiempo del examen y los artefactos de movimiento, ausencia de valores estandarizados que permitan una interpretación universal de los resultados, la ausencia de dispositivos portátiles, alto costo y la no disponibilidad en todas las instituciones de salud7,11.
Por otra parte, el ultrasonido cuantitativo (usualmente en tibia) es una alternativa no invasiva, más asequible en términos económicos, cuenta con valores de referencia establecidos y dispositivos portátiles que facilitan las valoraciones en recién nacidos en estado crítico21. Esta herramienta mide el contenido mineral óseo y la matriz orgánica mediante la evaluación de dos parámetros: velocidad del sonido y el tiempo de transmisión ósea11. A pesar de sus ventajas, el uso del ultrasonido requiere más investigación para determinar su utilidad6,7 20.
6. Criterios clínicos
Usualmente, las manifestaciones clínicas en pacientes con EOM son evidentes en fases tardías de la enfermedad6,7. La EOM se caracteriza por aumento del tamaño de la fontanela anterior con retraso en el cierre de estas, ensanchamiento de las suturas del cráneo, protuberancias frontales y parietales, craneotabes, engrosamiento de las uniones costocondrales, en articulaciones de la muñeca, fracturas de costillas y huesos largos e inclinación lateral progresiva de la tibia6,26.
No hay pautas establecidas para la tamización de la EOM del prematuro. Sin embargo, diferentes autores recomiendan que debe realizarse en recién nacidos con factores de riesgo, tales como: muy bajo peso al nacer (<1500g), edad gestacional menor a 28 semanas, nutrición parenteral por más de cuatro semanas, incapacidad para lograr la suplementación adecuada y administración de los fármacos anteriormente mencionados3,7,11. Los marcadores usualmente empleados son el calcio, fósforo y fosfatasa alcalina en sangre, indicados entre las 4 y 6 semanas de edad y posteriormente cada semana o cada dos semanas. Si estos resultados son anormales (fosfatasa alcalina >500 UI/L, fósforo <1,8 mmol/L), se diagnostica EOM del prematuro, y se solicita el nivel de PTH y el porcentaje de reabsorción tubular de fósforo13 (Figura 2).
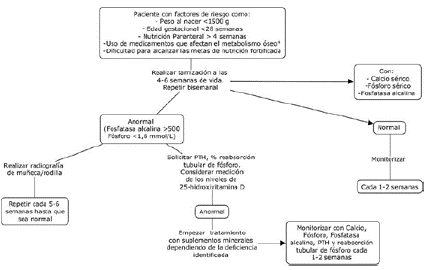
Fuente: Adaptado de Graça MI et al.20
Figura 2 Algoritmo propuesto para la detección y el tratamiento de la enfermedad ósea metabólica del prematuro.
Prevención y tratamiento
La principal estrategia para la prevención de la EOM consiste en optimizar la nutrición del prematuro, haciendo énfasis en los aportes de calcio, fósforo y vitamina D, con el objetivo de mantener sus niveles séricos normales y simular las tasas de almacenamiento in útero1. Los requerimientos, de acuerdo a las guías de consenso, son 120-200 mg/ kg/día de calcio y 60-140 mg/kg/día de fósforo (Tabla 2)3,27,28; de esta forma se mantiene una relación enteral de consumo de calcio: fósforo de 1,5:1 a 1,7:1 (mg a mg), la cual es necesaria para una óptima absorción y retención3.
Tabla 2 Requerimientos de calcio y fósforo para recién nacidos según guías de consenso.
| REFERENCIA | CALCIO (MG/KG/DÍA) | FÓSFORO (MG/KG/DÍA) |
|---|---|---|
| AAP (Abrams, 2013) | 150-220 | 75-140 |
| ESPGHAN (Agostoni, 2010) | 70-140 | 50-90 |
Por este motivo, se prefieren fórmulas para RNPT (LP) o leche materna fortificada (LMF), en casi todos los infantes con un peso menor a 1800-2000 g, independientemente de la EG. Cuando estas fórmulas se administran de manera exclusiva, proveen de 180 a 220 mg/kg/día de calcio y 100-130 mg/kg/día de fosforo1 3. Se hace necesaria la fortificación del alimento materno como estrategia nutricional para minimizar el riesgo de EOM, pues se ha descrito en la literatura que la no fortificación puede aumentar el riesgo de esta condición entre un 30 y 50 % en los RNPT de MBPN. Esta suplementación se continuará en todo RNPT hasta alcanzar un peso de 2000-2200 g, y en casos de restricción hídrica, FA sérica persistentemente aumentada o signos radiológicos de osteopenia8.
Adicionalmente, es necesario administrar suplementos minerales cuando la terapia nutricional sea insuficiente, o en circunstancias especiales sin respuesta a la LMF o LP, entre las que se encuentran el peso menor a 800 g, la estancia hospitalaria prolongada o un fósforo <4 mg/dl (1,29 mmol/L) de forma persistente. En estos casos, se añadirán a la dieta 40-80 mg/kg/día de Ca elemental. De igual forma, se requieren 200-400 UI/día de vitamina D en RNPT <1500g, aporte que aumenta a 400UI/día de vitamina D en los RNPT >1500g, de acuerdo con las recomendaciones de la American Academy of Pediatrics (AAP)3,7,8.
Es importante resaltar que no hay evidencia que soporte la suplementación oral con fosfato para la prevención de la EOM, pues su administración aumenta el riesgo de hiperparatiroidismo secundario, al reducir el calcio ionizado, por lo cual, puede promover o empeorar la EOM13.
La importancia de aplicar estrategias adecuadas para la prevención de esta entidad radica en que algunos estudios han postulado que si estas fallan, se pueden presentar consecuencias a corto y largo plazo, entre las que se encuentran dolicocefalia, fracturas, retraso en la velocidad de crecimiento e incluso osteopenia en la edad adulta28,29.
Si, a pesar del manejo profiláctico guiado por los factores de riesgo, se diagnostica EOM del prematuro, debe tenerse en cuenta el nivel de PTH. Recién nacidos con PTH elevada deben recibir calcio y vitamina D, iniciando con 200-400 UI/día de vitamina D y 20 mg/kg /día de calcio elemental que se aumenta según se tolere hasta una dosis máxima de 70 a 80 mg/kg/día. Estas dosis se refieren a dosis suplementarias y no incluyen el contenido de calcio de la leche materna o la fórmula13. En casos severos de EOM se indica el aumento progresivo de dosis de calcio, que puede ajustarse 1-2 veces por semana, y la monitorización de los niveles de PTH y FA hasta su normalización6,7 13,16. Por otra parte, prematuros con PTH disminuida o dentro de límites normales y RTF >95 % deben recibir suplementación de fósforo y garantizar un radio de absorción y retención de calcio: fósforo entre 1,5:1 a 1,7:1 en mg, para evitar la disminución de absorción de calcio y, en consecuencia, el hiperparatiroidismo6,7,13,16.
Dentro de las estrategias nutricionales para minimizar el riesgo de enfermedad óseo metabólica se encuentran las siguientes:
Nutrición enteral trófica temprana: existe suficiente nivel de evidencia sobre el estímulo enteral temprano en los recién nacidos prematuros. Los metaanálisis de ensayos aleatorizados indican que la alimentación trófica precoz dentro de las 48 horas postnatales y la introducción de la alimentación enteral progresiva antes de los 4 días de vida, con una tasa de avance superior a 24 ml/kg/día, se puede lograr en prematuros clínicamente estables y con muy bajo peso al nacer, sin que ello incremente la mortalidad o incidencia de ECN30. Esto se relaciona estrechamente con la salud ósea, ya que se logran mejorar los aportes de calcio, fósforo y vitamina D en menor tiempo y por la vía de preferencia que es enteral, adicionalmente, se logra mejor relación calcio-fósforo, lo que beneficia la disponibilidad de estos micronutrientes y favorece el desarrollo de la masa ósea31.
Uso de fortificadores de leche materna y fórmulas para prematuros: además de que a través de estas se mejora el aporte de macronutrientes, los fortificadores de leche materna y las fórmulas de prematuros tienen aportes de micronutrientes que responden a las demandas específicas del prematuro32.
Evitar la suspensión innecesaria de la nutrición enteral: la suspensión arbitraria de la nutrición enteral ante signos gastrointestinales inespecíficos es común en las unidades de cuidados intensivos neonatales. En muchos casos se presenta por la falta de conceptualización que hay frente al término de intolerancia gastrointestinal. Realizar algoritmos para evaluar de forma objetiva los signos y síntomas asociados con el riesgo de intolerancia es una estrategia para evitar la suspensión innecesaria de la nutrición enteral, pues esta práctica implica retorno a la nutrición parenteral y retrasa el logro de la nutrición enteral plena, conductas que aumentan el riesgo de EOM9,33.
Adecuada programación de la nutrición parenteral: es necesario el inicio temprano de calcio y fósforo en la nutrición parenteral, y asegurar aportes de calcio elemental de 40 a 120 mg/kg y de 30 y 60 mg de fósforo durante las dos primeras semanas de soporte nutricional; si es necesario continuar soporte parenteral después de la segunda semana, se recomienda asegurar aporte de calcio entre 75 y 90 mg/kg y 60 y 70 mg/kg de fósforo. Adicionalmente, utilizar multivitaminas pediátricas cuyo aporte de vitamina D oscile entre 160 y 280 UI desde el primer día de NPT34,35. Los insumos que se utilizan en la nutrición parenteral serán fundamentales para optimizar el aporte de calcio y fósforo; se recomienda el uso de glicerol fosfato de sodio, que ha demostrado tener una compatibilidad significativamente mejor con el gluconato de calcio que el fosfato de potasio. El uso de glicerofosfato de sodio en la NP neonatal previene la precipitación de calcio y fósforo, lo que favorece mejor suministro de estos micronutrientes para que se logren satisfacer sus necesidades30.
Terapia física asistida: el ejercicio físico asistido es una nueva modalidad preventiva que se suma al manejo nutricional en recién nacidos prematuros estables, se ha relacionado con mejoría en la fuerza ósea. Dentro de las opciones de terapia física temprana se describen: estimulación táctil con golpes de presión moderada o estimulación cinestésica con flexión pasiva y extensión de ambos miembros superiores e inferiores. Se reportan en la literatura beneficios relacionados con la ganancia de peso, la mineralización ósea y la osteogénesis36-39.
Finalmente, las terapias no farmacológicas también forman parte del tratamiento de la EOM del prematuro. Entre estas estrategias, la terapia física con ejercicios pasivos puede proveer la estimulación necesaria para el desarrollo muscular y mineral óseo; de esta forma, se ha demostrado que al practicarse durante 5-15 minutos diarios favorece la mineralización ósea, el aumento del peso y la talla, además del incremento en fuerza de la tibia1,7. De igual forma, se recomienda la revisión de medicamentos administrados al RN y la suspensión, si es necesaria, de diuréticos y/o esteroides8.
Conclusiones
La EOM es una enfermedad compleja y multifactorial con diversos factores de riesgo asociados en diferentes momentos del desarrollo del recién nacido. Se ha identificado una tendencia al aumento de la EOM, probablemente debido a la mayor sobrevida de los neonatos prematuros, en quienes es una causa importante de morbilidad, a pesar de las mejoras en el manejo nutricional.
No hay consenso en las pautas para el tamizaje, diagnóstico y tratamiento de la EOM. Sin embargo, la comprensión de esta patología permitirá mejorar las estrategias de tamización y diagnóstico precoz, evitando de esta forma el desarrollo de complicaciones. La principal estrategia es brindar un soporte nutricional individualizado que busque cubrir las demandas de calcio, fósforo y vitamina D del prematuro, asociado a los métodos de intervención clínica y el monitoreo de bebés de alto riesgo, ayudando a disminuir gradualmente su incidencia y a mejorar la calidad de vida de los recién nacidos prematuros.














