Introducción
Colombia es un país de localización tropical, con gran cantidad de enfermedades infectocontagiosas de interés en salud pública con comportamiento epidémico en más del 85% del territorio nacional. Dentro de estas patologías encontramos dengue, malaria, hepatitis virales, fiebre amarilla, fiebre tifoidea, infección por Rickettsia, Zika, Chinkungunya, toxoplasmosis y leptospirosis1. Esta última entidad, es una zoonosis generalizada y potencialmente mortal que tiene la capacidad de generar grandes epidemias, especialmente en épocas de fuertes lluvias e inundaciones, es causada por las especies patógenas de Leptospira spp, bacteria aerobia obligada de las cuales han sido descritas al menos 20 especies2. Esta bacteria habita principalmente en los túbulos renales de los animales portadores hasta ser eliminada por la orina luego de un promedio de cinco a catorce días, generando contagio en el ser humano cuando este consume agua o alimentos contaminados con ella3.
Según datos de la Organización Mundial de la Salud (OMS) se estima a nivel mundial una incidencia anual media de 5 casos por cada 100.000 habitantes. Las regiones con más incidencia son África, Pacífico Occidental y América, esta última con una incidencia de 12,5 casos por 100.000 habitantes4. Se han reportado hasta 500.000 muertes a nivel mundial5, con una mortalidad global de 2,2% y en América Latina cercana al 1%6.
En Colombia, se dio un primer registro de leptospirosis humana severa en 1966, mientras que la primera epidemia urbana ocurrió en Barranquilla en 19952. En este país presenta una incidencia de 1,6 por cada millón de habitantes7. Según el último boletín epidemiológico semanal para el 2021 del Institutito Nacional de Salud de Colombia, durante este año se notificaron 2.115 casos de leptospirosis a esta entidad. Los departamentos que más casos aportaron fueron Antioquia (501), Tolima (251) y Valle del Cauca (210)8. Algunos de los factores de riesgo para esta infección son la exposición a orina o ambientes contaminados por la bacteria, especialmente asociada a algunas ocupaciones como la ganadería, agricultura, jardinería; o también por bajo nivel socioeconómico y deficiencia sanitaria9.
En cuanto a presentación clínica, el período de incubación varía entre 2 y 3 días. Posteriormente, se da la aparición de fiebre, generalmente de manera súbita con temperaturas de 38 a 39°C; de forma concomitante aparecen otros síntomas como cefalea, malestar general y dolor muscular (especialmente a nivel lumbar y de pantorrillas), inyección conjuntival y erupción cutánea. Estos pueden permanecer alrededor de una semana, durante la cual es posible detectar leptospiras en sangre2. Durante su curso la enfermedad puede autolimitarse o evolucionar a un segundo pico febril asociado a diferentes complicaciones como dolor muscular severo, ictericia, miocarditis con arritmias, falla renal y hemorragias o Síndrome de Weil2.
Las hemorragias pueden ir desde petequias y púrpuras, hasta hemorragia pulmonar, siendo esta última una de las formas de enfermedad severa menos estudiadas de la leptospirosis. Corresponde a una hemorragia intraalveolar que puede llevar a falla respiratoria aguda, con una mortalidad que puede alcanzar el 50%10, siendo la segunda causa de fallecimiento luego de la miocarditis. La hemorragia alveolar puede darse por toxinas o respuesta inmune por la presencia de material antigénico y leptospiras en los capilares pulmonares junto con un fenómeno de activación endotelial con disfunción asociada11. El riñón es el principal órgano afectado teniendo como manifestación la lesión renal aguda. En segundo lugar se encuentra el compromiso pulmonar presentado en el 20 al 70 por ciento de los casos, con severidad variable, presentándose de forma leve en la mayoría de pacientes, siendo solo un bajo porcentaje el que se expresa con clínica grave12.
La prueba de oro en el diagnóstico corresponde a la microaglutinación, esta tiene una alta especificidad y sensibilidad cuando se usan baterías de laboratorio para serovariedades locales, sin embargo, tiene como defecto no ser serogrupo específica. Otras pruebas para realizar son; la reacción en cadena de la polimerasa (PCR); cultivo, el cual tiene poca disponibilidad; histopatología de tejidos comprometidos, usado ampliamente en diagnóstico post mortem; y los anticuerpos antileptospira IgM, detectados a partir del quinto día de enfermedad13,14. En la tabla 1 se resumen los métodos diagnósticos sugeridos por el Instituto Nacional de Salud de Colombia para la vigilancia de dicha patología. (Tabla 1)
Tabla 1 Diagnóstico por laboratorio de Leptospirosis.
| Método | Fase de la enfermedad | Muestras en estudio | |||
|---|---|---|---|---|---|
| Sangre | LCR | Orina | Biopsia | ||
| Cultivo en medio Fletcher | Después de 3 días y en sangre máximo hasta 10 días del inicio de los síntomas. En orina a partir de los 7 días. | + | + | + | + |
| Reacción en cadena de la polimerasa (PCR) | Después de 3 días de inicio de la enfermedad. | + | + | + | + |
| Titulación de anticuerpos por pruebas IgM | Después de 5 días de inicio de la enfermedad. | + | |||
| Titulación de anticuerpos por MAT | Primera muestra al inicio de los síntomas (fase aguda) y luego segunda muestra con intervalo de 10 a 15 días (fase convaleciente). | + | |||
| Estudio histopatológico | Post mortem | + | |||
Fuente: Instituto Nacional de Salud Pública - Colombia. Protocolo de Vigilancia en Salud Pública: Leptospirosis [Internet]. 2020. Disponible en: https://www.ins.gov.co/buscador-eventosLineamientos/Pro_Leptospirosis.pdf
El tratamiento se orienta hacia el inicio temprano de antibióticos, dentro de los cuales se encuentran penicilina, cefalosporinas y doxiciclina. Esta última tiene como ventaja tratar también infección por rickettsias, con régimen de tratamiento de 100 mg dos veces al día vía oral. Adicionalmente, el paciente con enfermedad severa o enfermedad de Weil debe ser manejado de manera hospitalaria con vigilancia continua, medidas generales para hidratación, monitoreo de signos vitales y seguimiento diario de funciones renal y hepática15.
Las estrategias de prevención frente a la leptospirosis están enfocadas en evitar la exposición. Esto se resume en hervir el agua antes del consumo, evitar baños en aguas contaminadas, realizar control de plagas (especialmente de ratas y ratones) y no consumir alimentos contaminados con orina de estos animales. Por otro lado, a los trabajadores expuestos se les debe proporcionar equipo de protección personal correspondiente16.
Los problemas con el diagnóstico generan que se tenga un subregistro en el número de casos, con altas tasas de mortalidad asociadas a fallas orgánicas, especialmente a nivel renal y pulmonar, por la no identificación de la patología a tiempo. A continuación, se presenta un caso de leptospirosis con complicaciones a nivel pulmonar caracterizadas por hemorragia alveolar grave, con el objetivo de recalcar la importancia de esta entidad como diagnóstico diferencial junto a otras patologías, como dengue, en el paciente que presenta síndrome febril ictero-hemorrágico.
Presentación del caso
Paciente masculino de 21 años, universitario, sin antecedentes de enfermedades previas, quien consulta por cuadro clínico de 5 días de evolución de cefalea holocraneana de predominio occipital sin irradiación, de intensidad leve a moderada, asociada a náuseas, dolor osteomuscular de predominio en la región de miembros inferiores, 3 episodios de emesis en los último 3 días, diarrea de 10 a 12 deposiciones por día e inyección conjuntival. Presentó fiebre desde el inicio de los síntomas hasta la noche anterior a la consulta. Fue valorado inicialmente en segundo nivel de atención con documentación de trombocitopenia en hemograma e hicieron remisión por sospecha de dengue con signos de alarma.
Al examen físico de ingreso se encontraba alerta y orientado, con tensión arterial de 95/65 mmHg, frecuencia cardiaca de 102 lpm, frecuencia respiratoria de 20 rpm, saturación de oxígeno de 94% y temperatura de 37,8°C. Presentaba mucosa oral seca y adenopatías retroauriculares predominantemente izquierdas, levemente dolorosas, de consistencia intermedia. La auscultación cardiopulmonar no mostró alteraciones, sin embargo, al examen abdominal se evidenció dolor a la palpación del cuadrante superior derecho y exantema, sin signos de irritación peritoneal ni masas o megalias. Fue hospitalizado inicialmente con hidratación endovenosa, manejo de soporte y Ampicilina-Sulbactam 3 gramos cada 6 horas.
Los paraclínicos de ingreso fueron negativos para malaria, antígenos febriles, virus de la inmunodeficiencia humana, dengue, hepatitis B, hepatitis A y el hemocultivo tomado previo al inicio de antibiótico. Se realizó una ecografía de abdomen total que no mostró alteraciones en los órganos evaluados.
Adicionalmente, presentaba hiperbilirrubinemia a expensas de la bilirrubina directa, con alteración de la función hepática y una proteína C reactiva (PCR) que se encontraba elevada (Tabla 2). Los tiempos de coagulación y los niveles séricos de electrolitos eran normales. El parcial de orina mostraba sangre en 250 Ul y bilirrubinas de 3 mg/dl, mientras que en el cuadro hemático se encontró anemia leve con hemoglobina de 12,3 g/dl, hematocrito de 35%, leucocitosis de 12 300/ul y trombocitopenia de 52 000/ul. Los gases arteriales evidenciaban alcalosis respiratoria no compensada al observarse pH de 7,45, PCO2 de 27,8 mmHg, PO2 de 70,5 mmHg, SO2 de 95,3% y CHCO3 de 19,10 mmol/L.
Tabla 2 Paraclínicos tomados al ingreso
| Bilirrubina total | 7,84 mg/dl |
| Fosfatasa alcalina | 115 U/L |
| Amilasa | 218 U/L |
| ALAT | 63,6 U/L |
| ASAT | 286 U/L |
| Lactato | 1,4 mmol/L |
| Nitrógeno ureico (BUN) | 41 mg/dl |
| Creatinina | 1,0 mg/dl |
| Proteína C reactiva | 192,9 mg/L |
Fuente: autores.
La radiografía de tórax realizada al ingreso mostraba infiltrados alveolares parahiliares bilaterales con aumento de volumen de las cavidades cardíacas en forma global, prominencia del pedículo vascular y mínimo borramiento del ángulo costofrénico derecho, cambios que sugerían la existencia de edema agudo de pulmón.
Al segundo día de hospitalización el paciente presentó epistaxis bilateral de moderada cantidad y dos deposiciones melénicas, considerándose hemorragia de vías digestivas altas. Luego, presentó desaturación hasta del 86% que requirió soporte de oxígeno a bajo flujo y taquicardia, sin alteración de la conciencia u otros síntomas. Por persistencia de la trombocitopenia se indicó la transfusión de 6 unidades de plaquetas, la cual se dio sin complicaciones. Al tercer día de hospitalización presentó taquipnea con disnea y gases arteriales con alcalosis respiratoria no compensada. Por su deterioro clínico se consideró suspender Ampicilina/ Sulbactam e iniciar nuevo esquema antibiótico de amplio espectro con Meropenem. Presentó una nueva deposición melénica abundante y se transfundieron 4 unidades de plasma fresco congelado. Posteriormente, con saturación de 92% con oxígeno por Ventury al 35%, sin embargo, con persistencia de disnea. Los paraclínicos de control mostraban hemoglobina en disminución (10,4 g/dl), plaquetas de 167 000 /ul, leucocitos de 17 900 u/l y enzimas hepáticas que continuaban elevadas. Al cuarto día de hospitalización presentó empeoramiento de los signos de dificultad respiratoria, por lo que se realizó intubación orotraqueal, observándose retorno de secreción hemática en el tubo, por lo que se agregó al plan de manejo Vancomicina. En este momento se reportaron IgM-dengue, IgM-CMV, IgM-Herpes, IgM-VEB y Chaga-test negativos.
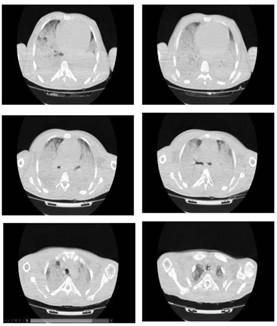
Se realizó una TAC de tórax que reportó en su ventana pulmonar un extenso infiltrado intersticial difuso en vidrio esmerilado, con extensas zonas de consolidación pulmonar y presencia de broncograma aéreo en relación con patología intersticial y alveolar aguda generalizada, con leves derrames pleurales bilaterales (Figura 1).
Se indagó a profundidad por antecedentes epidemiológicos encontrándose que un compañero de trabajo tenía diagnóstico reciente de leptospirosis. Ellos frecuentaban un trapiche de procesamiento de caña de azúcar en el que habitaban roedores y consumían procesados sin las medidas de higiene adecuadas. Al día 5 de hospitalización se adicionó al plan de manejo Doxiciclina para cubrimiento de gérmenes intracelulares tipo Leptospira. Dos días después, se realizó el retiro de la ventilación mecánica al tener una evolución favorable del proceso respiratorio y se recibió un informe de serología con IgM para leptospira positiva. Luego de dos semanas de hospitalización se indicó egreso hospitalario por buena evolución clínica, con continuación de antibiótico por otros 7 días de Doxiciclina 100 mg vía oral cada 12 horas. Se hizo seguimiento al paciente por consulta externa dos semanas después con nueva prueba IgM positiva, observándose notable mejoría sin complicaciones luego de su egreso hospitalario.
Discusión
Se ha presentado un caso de un paciente con síndrome febril ictero-hemorrágico. El primer diagnóstico que fue tenido en cuenta fue dengue ya que esta patología se presenta con síntomas tales como fiebre, malestar general, emesis, hemorragias y trombocitopenia1, los cuales coinciden con el cuadro clínico presentado en nuestro paciente. Sin embargo, al tener una evolución entorpecida se decide indagar sobre antecedentes epidemiológicos, encontrándose un nexo con una posible infección con Leptospirosis al estar el paciente expuesto a alimentos contaminados con orina de roedores. Las ratas han sido identificadas como huéspedes de mantenimiento de las serovariedades Icterohaeomorrhagiae y Copenhagen'! de Leptospira spp. Identificar estos huéspedes podría ser una buena estrategia para generar medidas de control a nivel local según corresponda17. Por otro lado, se ha visto que algunos de los hallazgos más comunes en pacientes con leptospirosis son ictericia y disnea, mientras que el dengue se ha asociado más dolor retroocular y petequias, siendo los dos primeros síntomas presentados en nuestro paciente, mientras los siguientes estaban ausentes18. En algunas ocasiones, puede existir coinfección, especialmente con dengue, de la cual se han reportado casos en diferentes regiones del mundo y algunas veces coincidiendo con desastres naturales como factor de riesgo19.
En un estudio realizado en Bogotá, Colombia, que reunió 14 casos de leptospirosis, fue más frecuente en la población entre 20 y 35 años, rango de edad en el que se encontraba el paciente del presente caso. El 71,4% de los pacientes tuvo factores de riesgo para adquirir la infección, tales como contacto directo con animales, realización de labores agrícolas o ganaderas, inundaciones y práctica de deportes como canotaje. La mayoría de las consultas a urgencias se presentaron siete días después de iniciados los síntomas. En todos los pacientes hubo fiebre, cefalea, mialgias, artralgias y, en menor proporción, dolor abdominal y diarrea20; todos estos síntomas estuvieron presentes en el cuadro clínico de nuestro paciente.
Ante la alta sospecha de leptospirosis existen varias pruebas que ayudan a confirmar el diagnóstico. El cultivo no es una herramienta muy usada teniendo en cuenta el crecimiento lento de la bacteria que puede ir de cinco a seis semanas, además, se realiza solo en ciertos laboratorios con cultivos semisólidos como el medio de Fletcher, por lo que se usa más en contexto de investigación. Las muestras deben ser múltiples y tomadas según el día de enfermedad, siendo en sangre o LCR la primera semana y, a partir de la segunda, en orina21. Por otro lado, las pruebas serológicas tienen utilidad en la segunda fase de la enfermedad, cuando aparecen anticuerpos contra la bacteria. En el caso presentado se encontró positiva la prueba de anticuerpos IgM. Los dos sistemas tradicionales usados son la aglutinación macroscópica y la aglutinación microscópica (MAT), esta última tiene mayor sensibilidad y especificidad, y es aceptado como método de referencia para el diagnóstico según la Organización Mundial de la Salud (OMS). Tiene la capacidad de confirmar anticuerpos IgM e IgG contra Leptospira. Para su interpretación se deben tomar dos muestras de suero con intervalo de dos semanas, como se hizo en el proceso diagnóstico del caso presentado22.
La enfermedad de Weil corresponde a la fase severa de la enfermedad, también conocida como fiebre icterohemorrágica. Es la forma de peor pronóstico que puede darse desde el comienzo de la enfermedad o en una segunda fase, afectando diversos órganos, principalmente riñón, hígado y pulmón15. El cuadro típico se representa con la triada de hemorragia, ictericia y nefropatía aguda. A nivel pulmonar la afectación se puede presentar con hemorragia alveolar, como es el caso del paciente expuesto. Esta puede evidenciarse por una clínica de tos, dolor torácico, dificultad respiratoria y hemoptisis que puede no ser evidente hasta el momento de realizar intubación, como se relató en este paciente23. Adicionalmente, la enfermedad de Weil se puede presentar con otras manifestaciones hemorrágicas como hemorragia gastrointestinal y epistaxis15 que fueron evidenciadas en este caso y precedieron el empeoramiento del curso de la patología.
Al consultar en la literatura, se encontró el caso de un adolescente de 16 años en Pira, Perú, quien presentó un cuadro de fiebre, mialgias, disnea y expectoración hemoptoica asociado a infección por leptospirosis, este último síntoma hizo pensar en una posible complicación a nivel pulmonar. En nuestro paciente la sospecha aumentó luego de la presentación de secreción serohemática asociada a la vía respiratoria. En la radiografía de tórax se evidenció infiltrado alveolar reticulonodular bilateral y difuso, más acentuado en el sector periférico e inferior24. Otro caso reportado corresponde a un paciente joven, también de 16 años residente en Chile, quien presentó hemorragia pulmonar parenquimatosa y alveolitis necrosante, con historia de tos, expectoración hemoptoica, dificultad respiratoria, epistaxis, fiebre, compromiso del estado general, mialgias, cefalea, emesis y compromiso del estado de conciencia, presentando shock séptico con indicación de intubación orotraqueal poco después de su ingreso hospitalario. En este caso, las complicaciones fueron mortales, haciéndose diagnóstico anatomo-patológico de enfermedad de Weil post-mortém25.
En cuanto a imágenes diagnósticas, en un estudio realizado en Brasil por Matos y colaboradores, en donde contaron con 139 pacientes con diagnóstico de Leptospirosis, se realizaron radiografías de tórax encontrando que un 74,3% presentaron infiltrados alveolares, de los cuales un 54% fueron bilaterales (hallazgo dado en el presente caso) y un 45% inferiores. El derrame pleural solo se presentó en 8,9% de los casos26. Por otro lado, en otro estudio más reciente publicado en el 2016, realizado en el mismo país por Von Ranke y colaboradores, contando con 16 pacientes con hemorragia alveolar difusa secundaria a leptospirosis se encontró en las tomografías de tórax que el 75% presentaba opacidades y patrón en vidrio esmerilado, un 43% consolidaciones y un 12% derrame pleural bilateral27, lo que llama la atención, ya que estos tres hallazgos fueron vistos en la tomografía de nuestro paciente. En este mismo estudio se encontró que los hallazgos en la tomografía más frecuentes en pacientes con hemorragia alveolar difusa fueron vidrio esmerilado, nódulos en el espacio aéreo, nódulos en vidrio esmerilado y consolidaciones. Sin embargo, a pesar que en este caso las imágenes mostraban hallazgos compatibles con hemorragia alveolar, esta puede estar oculta o con pocos hallazgos, hasta un 38,7% se presenta con radiografía normal a pesar de tener lavado broncoalveolar positivo28.
En cuanto al manejo de leptospirosis, este está orientado al uso temprano de antibióticos con terapia de soporte adecuada según sintomatología y gravedad. La penicilina, la doxiciclina y las cefalosporinas parecen tener igual eficacia, sin repercutir en la mortalidad ni duración de la enfermedad según una revisión de Cochrane, que tenía como objetivo evaluar los riesgos y beneficios asociados con el uso de antibióticos, sin embargo, se destaca como ventaja de la doxiciclina su espectro que cubre infecciones por rickettsias15. Así mismo, en un ensayo aleatorizado que contó con 264 pacientes con leptospirosis confirmada, no se encontraron diferencias significativas respecto a mortalidad, defervescencia o el tiempo hasta la resolución de los hallazgos anormales en las pruebas de laboratorio al utilizar alguno de los tres regímenes antibióticos anteriormente mencionados29. Los pacientes con enfermedad severa como del presente artículo, necesitan ser internados en una unidad con vigilancia continua, con medidas generales de hidratación y seguimiento diario de paraclínicos asociado a manejo antibiótico endovenoso15. Finalmente, las altas dosis de corticoesteroides cuando se presenta leptospirosis severa han mostrado diferentes resultados en los estudios realizados, pero no se ha llegado a un consenso de ello y hay poca evidencia de su uso en compromiso pulmonar30.
Conclusiones
Durante el enfoque diagnóstico de un paciente que está cursando por un síndrome febril se deben tener en cuenta etiologías como la leptospirosis, una zoonosis con mayor incidencia en países en vía de desarrollo como Colombia, especialmente cuando se presentan manifestaciones de tipo ictérico-hemorrágicas o se tienen factores de riesgo asociados. Para resaltar, esta patología puede presentar compromiso pulmonar como una manifestación emergente asociada a alta mortalidad durante el curso de la forma más severa de presentación o enfermedad de Weil. El diagnóstico se realiza con alguna de las pruebas disponibles (PCR, titulación de anticuerpos por pruebas IgM o por MAT, cultivo y estudios histopatológicos) y el manejo se basa en antibiótico con medidas generales de soporte según sea la evolución. Se ha presentado un caso de leptospirosis con compromiso pulmonar grave que tuvo buena resolución con el manejo instaurado luego de tener en cuenta esta etiología por factores de riesgo mencionados por el paciente.