Introducción
La Enfermedad Pulmonar Obstructiva Crónica (EPOC) se caracteriza por la presencia de síntomas respiratorios permanentes y por la limitación del flujo de aire debido a anormalidades a nivel alveolar y/o de la vía respiratoria, ocasionadas por la exposición a ciertas sustancias perjudiciales y por la predisposición del paciente1. Para realizar su diagnóstico se tienen en cuenta tres aspectos: sintomatología (disnea, tos crónica y producción de esputo), factores de riesgo (antecedentes ocupacionales, exposición a tabaco o contaminación en ambientes cerrados o abiertos) y valores espirométricos (volumen espiratorio forzado en un segundo/capacidad vital forzada < 0,7)1.
La EPOC ha venido en aumento durante las últimas décadas; para el 2017 fue la Enfermedad Respiratoria Crónica (ERC) más prevalente a nivel mundial y representó el 54,9 % de las ERC. La tasa de incidencia de la EPOC aumentó con la edad en ambos sexos y disminuyó en todos los grupos de edad desde 1990 hasta 2017, excepto en los pacientes mayores de 80 años2,3. Entre 1990 y 2017 el número de casos se incrementó en un 39,5 %2, hasta llegar a posicionarse en la actualidad como la tercera causa de muerte a nivel mundial con 3,2 millones de defunciones durante el 20174. Se estima que esta tendencia ascendente se mantenga durante los próximos años, debido al aumento del consumo de productos de inhalación, contaminantes ambientales y exposiciones ocupacionales4,5. Para el año 2004, en Colombia, la prevalencia de la EPOC según el estudio PREPOCOL6 fue del 8,9 % (diagnóstico realizado por espirometría), y para la ciudad de Bucaramanga fue del 13 %. Hasta el momento, en la bibliografía médica se ha publicado poca literatura nacional actualizada.
En la historia natural de la enfermedad se pueden desarrollar Exacerbaciones Agudas de la Enfermedad Pulmonar Obstructiva Crónica (EAEPOC), las cuales se definen como períodos en donde ocurre un agravamiento agudo de la sintomatología respiratoria, dado principalmente por disnea y aumento en el volumen y purulencia del esputo1; a su vez, puede presentarse obstrucción o secreción nasal, sibilancias, disfagia, tos, fiebre, opresión torácica, fatiga, alteraciones del sueño, etc.7. Las EAEPOC adquieren una gran relevancia clínica, ya que se han relacionado con desenlaces como disminución de la función pulmonar, incremento de la mortalidad, empeoramiento de la calidad de vida, aumento en el número y la periodicidad de exacerbaciones8-10. Debido a la diversidad de presentación de la EAEPOC, es necesario descartar otro tipo de patologías como neumonía, neumotórax, derrame pleural, tromboembolismo pulmonar, arritmias cardíacas, etc., para realizar un tratamiento adecuado1.
Fisiopatológicamente, la EAEPOC se debe a procesos inflamatorios de las vías respiratorias que ocurren en la mayoría de los casos por procesos infecciosos. Los virales son los más frecuentes (Rinovirus, Influenza y Virus sincitial respiratorio), seguido de los bacterianos (Haemophilus influenzae no tipificable, Moraxella catarrhalis, Streptococus pneumoniae y Pseudomona aeruginosa)7,11. No obstante, puede deberse a otros eventos como la exposición a contaminantes ambientales o cambios de la temperatura ambiente7.
Según la guía de la Global Initiative for Chronic Obstructive Lung Disease (GOLD), la gravedad de la EAEPOC se determina según el tratamiento realizado, por ejemplo, en los episodios leves se hace uso de broncodilatadores de corta acción, en los moderados se añaden antibióticos y/o corticoides orales y en los casos graves los pacientes acuden al servicio de urgencias o se hospitalizan y pueden estar asociados a insuficiencia respiratoria1. De acuerdo con las recomendaciones dadas por la GOLD, las indicaciones para el uso de antibióticos son para aquellos pacientes con exacerbaciones moderadas o graves que cumplan con dos de los siguientes criterios: primero, purulencia del esputo y que requieran ventilación mecánica; segundo, aumento de la disnea, volumen y purulencia del esputo.
Una de las complicaciones de la EAEPOC es la insuficiencia respiratoria, en la cual se prefiere utilizar como primera medida la Ventilación Mecánica No Invasiva (VMNI) en lugar de la Ventilación Mecánica Invasiva (VMI), ya que ha surgido como una estrategia de soporte ventilatorio costo-efectiva capaz de reducir el riesgo de muerte hasta en el 46 %, de intubación orotraqueal en el 65 % y el tiempo de estancia hospitalaria12-14. Según la guía GOLD1, se usan los siguientes criterios para su indicación: acidosis respiratoria (PaCO2 ≥ 45 mmHg y pH arterial ≤ 7,35), disnea severa manifestada por fatiga muscular o fatiga de músculos respiratorios e hipoxemia persistente aún con el uso de oxígeno suplementario. Sin embargo, a pesar de ser la modalidad de soporte preferido, hasta el 9 % de los pacientes requieren el uso de VMI desde el inicio, y entre el 5 a 11 % tienen un fracaso o intolerancia a la VMNI inicial15-18. De acuerdo con la guía GOLD1, las indicaciones de uso para VMI son intolerancia a la VMNI, estados postparo, aspiración masiva o vómito persistente, inhabilidad persistente para remoción de secreciones, inestabilidad hemodinámica severa que no responde a líquidos o medicamentos, arritmias severas e hipoxemia que puede ser mortal en pacientes que no pueden tolerar VMNI. No obstante, el requerimiento de VMI aumenta significativamente la mortalidad de la EAEPOC, incluso hasta alcanzar el 30 %, y se ha relacionado con otras complicaciones, tales como la infección nosocomial asociada al ventilador y barotrauma15-18.
Elegir la modalidad de soporte ventilatorio ideal se ha convertido en un reto clínico del manejo de pacientes con EAEPOC, pues, aunque la VMI no es la primera línea de manejo, no debe retrasarse su implementación de ser necesaria1. Y si bien la VMNI es la primera línea de tratamiento en pacientes con insuficiencia respiratoria, puede llegar a tener tasas de fallo de un 9 a un 50 %, lo que podría retrasar el uso de VMI en pacientes con EAEPOC y generar peores desenlaces en salud12.
A pesar de esto, existen factores de riesgo que hacen más probable el uso de VMI en ciertos pacientes y pueden guiar hacia una elección de soporte ventilatorio adecuada, pero en la actualidad no están apropiadamente descritos en la bibliografía científica; por tanto, es de sumo interés el análisis del perfil de los pacientes con EAEPOC grave que requieren de VMI. Es así como la presente investigación tiene el objetivo de describir los factores que se asociaron con mayor necesidad de VMI en una cohorte de pacientes hospitalizados con EAEPOC en un hospital de tercer nivel de Colombia, lo cual aporta a la literatura científica para generar un beneficio clínico en estos pacientes a futuro.
Métodos
Diseño y población
Estudio observacional analítico de corte transversal, con muestreo no probabilístico que incluye todos los pacientes que consultaron a urgencias y fueron hospitalizados por EAEPOC en un hospital de tercer nivel de Santander-Colombia durante el período 2014-2020. Los criterios de inclusión fueron pacientes mayores de 40 años, con diagnóstico de EPOC confirmado por pruebas de función pulmonar, con sospecha de exacerbación aguda; fueron excluidos aquellos con diagnóstico concomitante de neumonía, insuficiencia cardiaca descompensada, síndrome coronario agudo, tuberculosis activa, neumotórax, tromboembolismo pulmonar o fibrosis quística, durante la hospitalización.
Variables
Fueron revisadas de manera retrospectiva 81 historias clínicas, de las cuales se extrajeron variables sociodemográficas (sexo, edad, residencia), antecedentes médicos (asma, tuberculosis, antecedente de exacerbaciones), comorbilidades (cardiopatías, hipertensión arterial, hipertensión pulmonar), exposiciones (humo de tabaco de primera y segunda mano, biomasa, humos y gases ocupacionales) y características clínicas (fiebre, disnea, tos, producción de esputo, aumento de la purulencia del esputo, sibilancias). Además, se recolectaron los valores de las principales pruebas de laboratorio al ingreso, pruebas de función pulmonar, tratamientos y desenlaces durante la hospitalización.
Definiciones
Se incluyeron pacientes con diagnóstico de EPOC, definido según la Global Strategy for Prevention, Diagnosis and Management of COPD (GOLD), la cual incluye la demostración de alteraciones en la espirometría, así como el cuadro clínico concordante y un antecedente de exposición de riesgo. La EAEPOC fue definida según criterios de la guía GOLD1.
Análisis estadístico
Las variables recolectadas fueron descritas según su nivel de medición como medias o medianas para las variables continuas, y proporciones para las categóricas. Se llevó a cabo una comparación de los resultados de todas las variables, y se clasificó la muestra en dos grupos según la modalidad de uso de soporte ventilatorio: aquellos que requirieron ventilación mecánica invasiva (VMI) y los que no la requirieron (No VMI), mediante las pruebas de Mann Whitney o Fisher con sus respectivos valores de p para variables cuantitativas y chi-cuadrado/Fisher para variables cualitativas, considerando diferencias significativas con p menor a 0,05 luego de verificación de normalidad empleando el método Shapiro- Wilk. Aquellas variables en las cuales se encontró diferencia significativa mediante análisis univariado fueron llevadas a uno bivariado, aplicando la prueba de Spearman y regresión logística como análisis de correlación. Fue utilizado el programa estadístico STATA v14.0.
Aspectos éticos
Este estudio cumple con los principios de la Declaración de Helsinki, los estándares regulatorios locales y las pautas universales para la buena práctica clínica. El protocolo fue evaluado y aprobado por el Comité de Ética en Investigación de la Universidad Industrial de Santander. Al tratarse de un estudio meramente descriptivo, sin intervenciones de ningún tipo, se considera libre de riesgos.
Resultados
Se revisó la base de datos de ingresos a urgencias con los códigos CIE10: J440, J441, J448, J449; se identificaron 3560 historias clínicas, de las cuales 2932 presentaron al menos un criterio de exclusión; de los 628 resultantes se incluyeron al estudio 81 pacientes que cumplieron con la condición del diagnóstico confirmatorio espirométrico y con los datos disponibles para análisis (Figura 1).
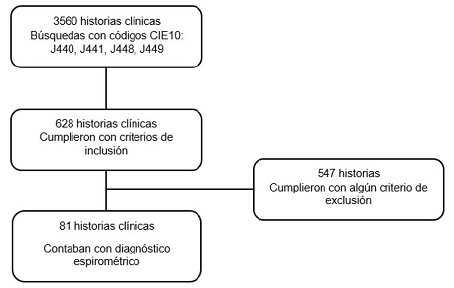
Fuente: autores
Figura 1 Flujograma. J440: Enfermedad pulmonar obstructiva crónica con infección aguda de las vías respiratorias inferiores. J441: Enfermedad pulmonar obstructiva crónica con exacerbación aguda, no especificada. J448: Otras enfermedades pulmonares obstructivas crónicas especificadas. J449: Enfermedad pulmonar obstructiva crónica, no especificada.
De los 81 pacientes, 36 (44,4 %) requirieron VMNI y 12 (14,82 %) recibieron VMI; la población restante no tuvo necesidad de usar soporte ventilatorio. Además, 9 (25 %) de los pacientes con VMNI fallaron a la terapia inicial y demandaron el uso de VMI. Del total de los pacientes incluidos, 28 eran mujeres (35,9 %), la edad promedio de la muestra fue de 71,4 ± 9,12; las más jóvenes en el grupo tratado con VMI corresponden a (68,9 ± 7,71 vs. 71,94 ± 9,32; p < 0,001). Los datos demográficos y comorbilidades se muestran en la tabla 1.
Tabla 1 Variables sociodemográficas, antecedentes y comorbilidades según modalidad de soporte ventilatorio.
| Variable de estudio | Total (n = 81) | VMI (n = 12) | No VMI (n = 69) | Valor p |
|---|---|---|---|---|
| Sexo femenino (%) | 29 (36 %) | 5 (42 %) | 24 (35 %) | 0,64 |
| Sexo masculino (%) | 52 (64 %) | 7 (58 %) | 45 (65 %) | |
| Edad (± DE) | 71,49 ± 9,12 | 68,9 ± 7,71 | 71,94 ± 9,32 | <0,001 |
| Residencia (%) | ||||
| Urbana | 52 (64,2 %) | 7 (41,67 %) | 45 (64 %) | 0,64 |
| Rural | 29 (36 %) | 5 (58,33 %) | 24 (35 %) | |
| Exposición (%) | Total (n = 81) | VMI (n = 12) | No VMI (n = 69) | Valor p |
| Humo de tabaco como fumador directo | 57 (70 %) | 8 (66,67 %) | 49 (71 %) | 0,76 |
| Humo de tabaco como fumador de segunda mano | 3 (3,70 %) | 0 (0 %) | 3 (4 %) | 0,61 |
| Combustión de biomasa | 46 (57 %) | 6 (50 %) | 40 (58 %) | 0,6 |
| Humos y gases ocupacionales | 8 (9,88 %) | 0 (0 %) | 8 (12 %) | 0,26 |
| Estatus de tabaquismo (%) | Total (n = 57) | VMI (n = 13) | No VMI (n = 48) | Valor p |
| Activo | 11 (19,30 %) | 2 (22,22 %) | 9 (16,75 %) | 0,55 |
| Exfumador | 46 (79,63 %) | 7 (77,78 %) | 39 (81,25 %) | |
| Antecedentes de importancia (%) | Total (n = 23) | VMI (n = 2) | No VMI (n = 21) | Valor p |
| Antecedente de asma | 11 (13 %) | 1 (8,33 %) | 10 (14,96 %) | 0,54 |
| Antecedente de tuberculosis | 12 (15 %) | 1 (8,33 %) | 11 (16 %) | 0,46 |
| Comorbilidades (%) | Total (n = 81) | VMI (n = 28) | No VMI (n = 50) | Valor p |
| Cardiopatía | 40 (49,38 %) | 7 (59 %) | 33 (48 %) | 0,5 |
| Hipertensión arterial | 57 (70,30 %) | 7 (58,33 %) | 50 (72 %) | 0,35 |
| Hipertensión pulmonar | 16 (19,75 %) | 3 (25 %) | 13 (19 %) | 0,62 |
| Número de exacerbaciones graves en un año (±DE) | Total (n = 67) | VMI (n = 10) | No VMI (n = 59) | Valor p |
| 1 ± 1 | 1 ± 1 | 1 ± 1 | 0,64 |
DE: Desviación Estándar, VMI: Ventilación Mecánica Invasiva.
Fuente: autores.
Las comorbilidades más frecuentes fueron hipertensión arterial (70,3 %), cardiopatía (49,38 %) e hipertensión pulmonar (19,75 %). Además, 15 % tenía antecedente de tuberculosis (TB), 13 % de asma, 70 % había tenido exposición al tabaquismo como fumador directo, el 57 % exposición a combustión de biomasa y el 9,88 % a gases por exposición laboral. De los fumadores directos (n = 53), el 19,3 % mantenía el consumo de tabaco de forma activa. El número de exacerbaciones promedio por año fue de 1 (DS ± 1). No hubo diferencias significativas entre los grupos respecto a las variables anteriores.
Las variables de presentación clínica y los hallazgos de laboratorio se encuentran en la tabla 2. El síntoma más frecuente fue disnea (100 %); la mayor s proporción de pacientes con disnea severa se presentó en pacientes con VMI comparado con los que no recibieron VMI (100 % vs. 68 %; p < 0,01). La prevalencia de falla respiratoria aguda general al ingreso fue de 53,8 %, y fue del 100 % en VMI y del 45 % en VMNI; la diferencia entre ambos grupos fue estadísticamente significativa. En pacientes que requirieron VMI, el pH en gases arteriales fue significativamente menor (7,3 ± 0,115 vs. 7,37 ± 0,05; p 0,027) y la pCO2 fue mayor (70,05 ± 20,75 vs. 48,85 ± 20,75; p 0,05). La PAFI promedio se encontró en el rango de 200 a 300.
En lo relacionado con el tratamiento, 90,12 % recibieron antibiótico, sin diferencia significativa entre los grupos. Se usaron betalactámicos en la mayoría de los casos, ampicilina sulbactam (70 %), piperacilina tazobactam (42,4 %), de igual forma que meropenem (33,3 % vs. 1,64 %; p 0,004). El grupo VMI requirió en mayor medida escalonamiento antibiótico (50 % vs. 18 %; p 0,025), corticoides sistémicos intravenosos (CSIV) (100 % vs. 41 %; p 0,001) y uso de inhaladores de corta acción combinados SAMA + SABA (91,67 % vs. 49 %; p 0,028). Ver tabla 2.
Tabla 2 Características clínicas, hallazgos de laboratorio según modalidad de soporte ventilatorio y tratamiento
| Variable de estudio | Total (n = 79) | VMI (n = 11) | No VMI (n = 68) | Valor p |
|---|---|---|---|---|
| N.º de días de enfermedad antes de consultar (± DE) | 5 ± 4 | 4 ± 4 | 5 ± 4,5 | 0,52 |
| Síntomas (%) | ||||
| Fiebre | 41 (51 %) | 6 (50 %) | 35 (51 %) | 0,96 |
| Disnea | ||||
| Leve | 3 (3,7 %) | 0 (0 %) | 3 (4 %) | <0,01 |
| Moderada | 19 (23 %) | 0 (0 %) | 19 (28 %) | |
| Severa | 59 (73 %) | 12 (100 %) | 47 (68 %) | |
| Tos | 74 (91 %) | 11 (92 %) | 63 (91 %) | 0,96 |
| Producción de esputo | 56 (69,14 %) | 12 (100 %) | 47 (68 %) | 0,63 |
| Aumento en la purulencia de esputo | 40 (67,8 %) | 7 (77,78 %) | 33 (66,0 %) | 0,39 |
| Sibilancias | 37 (45,685 %) | 4 (33,3 %) | 33 (48 %) | 0,35 |
| Insuficiencia respiratoria al ingreso (%) | 43 (53,08 %) | 12 (100 %) | 31 (45 %) | <0,001 |
| Gases arteriales (± DE) | ||||
| pH | 7,37 ± 0,07 | 7,3 ± 0,115 | 7,37 ± 0,05 | 0,027 |
| pCO2 | 50,5 ± 23,1 | 70,05 ± 20,75 | 48,85 ± 20,75 | 0,05 |
| pO2 | 67,4 ± 22 | 72,7 ± 19,75 | 65,5 ± 24,3 | 0,88 |
| FiO2 | 0,32 ± 0,12 | 0,32 ± 0,2 | 0,32 ± 0,12 | 0,55 |
| PaFi | 223,4 ± 84,64 | 214,7 ± 67,6 | 228,3 ± 93,3 | 0,49 |
| Variable de estudio | Total (n = 81) | VMI (n = 12) | No VMI (n = 69) | Valor p |
| Antibiótico (%) | 73 (90,12 %) | 12 (100 %) | 61 (88 %) | 0,26 |
| Ampicilina sulbactam | 50 (70 %) | 6 (50 %) | 44 (73,33 %) | 0,16 |
| Piperacilina tazobactam | 31 (42,40 %) | 10 (83 %) | 40 (65,57 %) | 0,06 |
| Vancomicina | 2 (2,80 %) | 1 (8,33 %) | 1 (1,64 %) | 0,3 |
| Meropenem | 5 (6,85 %) | 4 (33,30 %) | 1 (1,64 %) | 0,004 |
| Requirió cambio de antibiótico (%) | 17 (23,61 %) | 6 (50 %) | 11 (18 %) | 0,025 |
| Uso de corticoide (%) | ||||
| CSI | 46 (56,70 %) | 8 (33,33 %) | 38 (55 %) | 0,61 |
| CSIV | 40 (49 %) | 12 (100 %) | 28 (41 %) | <0,001 |
| CSVO | 56 (69 %) | 8 (66,7 %) | 48 (70 %) | 0,54 |
| Uso de broncodilatadores (%) | ||||
| Solo SABA | 4 (4,94 %) | 0 (0 %) | 4 (6 %) | 0,028 |
| Solo SAMA | 32 (39,50 %) | 1 (8,36 %) | 31 (45 %) | |
| SABA + SAMA | 45 (55,56 %) | 11 (91,67 %) | 34 (49 %) |
DE: Desviación Estándar, VMI: Ventilación Mecánica Invasiva, CSI: Corticoide Sistémico Inhalado, CSIV: Corticoide Sistémico Intravenoso, CSVO: Corticoide Sistémico Vía Oral, SABA: Agonista beta-2-adrenérgico de corta acción, SAMA: Antimuscarínico de corta acción.
Fuente: autores.
Respecto a la evolución intrahospitalaria y las complicaciones, el grupo que requirió VMI tuvo en mayor proporción alteración del estado de conciencia (41,67 % vs. 3 %; p <0,001), inestabilidad hemodinámica con necesidad de soporte vasopresor (50 % vs. 1 %; p 0,001), necesidad de ingreso a UCI (100 % vs. 16 %; p <0,001), infecciones asociadas al cuidado de la salud (37,5 % vs. 6,25 %; p 0,026) y estancia hospitalaria prolongada (14 + 19 días vs. 7 + 5 días; p 0,03). No se reportó mortalidad intrahospitalaria en ninguno de los grupos durante el estudio (tabla 3).
Tabla 3 Evolución intrahospitalaria y complicaciones según modalidad de soporte ventilatorio
| Variable de estudio | Total (n = 81) | VMI (n = 12) | No VMI (n = 69) | Valor p |
|---|---|---|---|---|
| Alteración del estado de conciencia (%) | 7 (8,64 %) | 5 (41,67 %) | 2 (3 %) | <0,001 |
| Inestabilidad hemodinámica (%) | 7 (8,64 %) | 6 (50 %) | 1 (1 %) | <0,001 |
| Requerimiento de UCI (%) | 21 (25,93 %) | 12 (100 %) | 11 (16 %) | <0,001 |
| Complicaciones (%) | Total (n = 72) | VMI (n = 8) | No VMI (n = 64) | Valor p |
| Neumotórax | 2 (2,78 %) | 0 (0 %) | 2 (3,13 %) | 0,72 |
| Infecciones asociadas al cuidado de la salud | 7 (10 %) | 3 (37,50 %) | 4 (6,25 %) | 0,026 |
| Parada cardíaca/necesidad de RCP | 1 (1,37 %) | 1 (11,11 %) | 0 (0 %) | 0,12 |
| Días de estancia hospitalaria (±DE) | Total (n=75) | VMI (n=9) | No VMI (n=66) | Valor p |
| 7 ± 6 | 14 ± 19 | 7 ± 5 | 0,03 |
DE: Desviación Estándar, VMI: Ventilación Mecánica Invasiva, OR: odds ratio, IC: Intervalo de Confianza, UCI: Unidades de Cuidado
Intensivo, RCP: Reanimación Cardiopulmonar.
Fuente: autores.
El análisis bivariado se presenta en la tabla 4. Los pacientes que recibieron VMI tendían a presentar un estado mental alterado (OR 23,92; p < 0,001), inestabilidad hemodinámica (OR 68; p < 0,001), necesidad de UCI (OR 26,3; p < 0,001), duración de hospitalización mayor a 24 días (OR 6,1; p 0,03), infección adquirida intrahospitalariamente (OR 1,55; p 0,026), alteraciones del pH, con una mayor probabilidad de tener un pH < 7,21 (OR 22,33; p 0,027). Adicionalmente, requirieron un mayor uso de broncodilatadores y de antibióticos de amplio espectro. La pCO2 menor a 69 fue un factor protector para el uso de VMI (OR 0,19; p 0,05).
Discusión
El soporte ventilatorio es uno de los pilares clave en el manejo de la EAEPOC, especialmente en los casos moderados o graves que requieren hospitalización1. El presente estudio tuvo como objetivo describir las características relacionadas con la necesidad de VMI en una muestra de pacientes hospitalizados con diagnóstico de EAEPOC.
El uso de la VMNI en EPOC ha aumentado significativamente desde su debut moderno en 1990, gracias al estudio de Plant et al.14, quienes evaluaron una cohorte retrospectiva en EE. UU., entre 2001 y 2011, de 723 560 pacientes hospitalizados por EAEPOC; se encontró que el uso de VMNI aumentó un 15,1 % anualmente (de 5,9 % a 14,8 %) y el de VMI descendió un 3,2 % anualmente (de 8,7 % a 5,9 %), además se reportó un aumento anual del uso de cualquier forma de VM del 4,4 % (de 14,1 % a 20,3 %).
En nuestro estudio, la prevalencia en el uso de la VMNI fue del 44 %, significativamente mayor que lo reportado en el estudio de Stefan et al.17, donde de una muestra de 3520 cuadros de EAEPOC en pacientes críticos, el 27,7 % recibió VMNI; si bien la indicación de inicio de VMNI es la presencia de falla respiratoria hipercápnica (acidemia respiratoria aguda con pH < 7,35 o CO2 > 45) en ausencia de contraindicaciones claras, no existe un consenso exacto sobre el límite en el cual el beneficio se pierde frente al riesgo de fracaso12,19. En nuestra cohorte, 31 pacientes (38,27 %) presentaban acidemia (pH < 7,35), 52 pacientes (64,19 %) tenían una pCO2 > 45 mmHg y 30 pacientes (37,03 %) cumplían ambos criterios.
En la misma auditoría europea citada previamente se estimaba que de todos los pacientes ingresados por EAEPOC grave con indicación gasométrica para recibir VMNI, aproximadamente la mitad accedían al recurso, así mismo el 28 % de los tratados con esta modalidad de ventilación no cumplían el criterio gasométrico14. De acuerdo con nuestro análisis, prácticamente la totalidad de los pacientes que ingresaron a nuestra institución con insuficiencia respiratoria aguda asociada a hipercapnia recibieron algún tipo de modalidad ventilatoria mecánica, con un alto porcentaje de uso de VMNI. El uso de VMI (14,82 %) también fue significativamente menor al reportado en otros trabajos, por ejemplo, en el estudio de Stefan et al.17 se usó esta modalidad en un 45,8 % de un total de 3495 pacientes con EAEPOC; por otra parte, en el estudio de Tsai et al.20 se encontró que de un total de 67 651 pacientes que acudieron a los servicios de urgencias por presentar una EAEPOC el 22,8 % de los pacientes requirieron VMI. Este hallazgo podría explicarse debido a un mayor uso de la modalidad de VMNI, sumado a una mejor respuesta de los pacientes a este sistema, y debido a la severidad de la enfermedad del paciente una vez llegan al servicio de urgencias.
Sin embargo, aunque los beneficios de la VMNI son claros, la falla de esta impacta directamente en la morbimortalidad 12,14,15. Diversos autores21-24 han desarrollado estudios intentando predecir los factores que predisponen y/o llevan al fracaso de la VMNI. Confalonieri et al.21 realizaron un estudio multicéntrico en centros italianos entre 1998-2000, donde evaluaron 1033 pacientes con EAEPOC tratados con VMNI, de los cuales el 33 % presentó fracaso, con un impacto significativo en la mortalidad. La mortalidad general fue del 13,7 % del total, pero del 60,2 % en aquellos pacientes que fallaron a la VMNI, definida como necesidad de intubación orotraqueal por empeoramiento del pH o de la pCO2, a pesar de la correcta administración de VMNI, necesidad de protección de la vía aérea, presencia de secreciones abundantes, inestabilidad hemodinámica e imposibilidad para tolerar la máscara. Entre los factores que aumentan la probabilidad de fallo, se reportan en diferentes estudios21,25 el APACHE II (Acute Physiology and Chronic Health disease Classification System) >29, puntaje en la escala de Glasgow deteriorado, pH < 7,25, taquipnea >30 y pobre estado nutricional. A pesar de lo anterior, la auditoría europea reportó que el fracaso en la VMNI solo ha disminuido un 1,2 % (17,9 a 16,7 %) en diez años, lo cual sugiere que aún existen serios vacíos en cuanto a factores predictivos de fracaso a la VMNI14.
En el presente estudio la prevalencia de fracaso a la VMNI fue del 25 %, por encima de lo reportado en otras series. Por ejemplo, en el estudio de Stefan et al.17 se reportó una falla de 13,7 % en la VMNI, mientras que Confalonieri et al.21 encontraron un fallo del 22,9 % en este método de ventilación. La mortalidad en aquellos pacientes que no respondieron a la VMNI en los anteriores estudios varió entre el 22,5 hasta el 60,2 %17,21, y puede estar relacionada con la alta prevalencia de falla respiratoria aguda mixta. La presencia concomitante de acidosis metabólica es otro ítem por considerar que no se evaluó en el presente trabajo.
En lo que concierne a cuáles pacientes tienen mayor probabilidad de recibir VMI, se ha reportado la edad y la presencia de comorbilidades como factores determinantes. En el estudio de Nava et al.26, la edad media de los pacientes en los que se usó VMI fue de 68,9 años, y en aquellos en los que se utilizó VMNI fue de 71,9 años, lo cual se relaciona con la idea de que los pacientes ancianos tienden a recibir una atención menos invasiva y costosa. Los pacientes >75 años tenían menor probabilidad de recibir VMI y la probabilidad de falla a la VMNI aumentaba en los pacientes jóvenes27. La anterior tendencia se mantuvo en el presente estudio con los pacientes mayores, quienes recibieron menos VMI. Es importante señalar que uno de los criterios de exclusión que se tuvo en cuenta fue la presencia de neumonía al ingreso, ya que esta es tratada cómo una entidad diferente a la exacerbación de la enfermedad obstructiva crónica.
Adicionalmente, los pacientes que presentaron una infección asociada al cuidado de la salud tenían mayor probabilidad de recibir VMI, requirieron cambiar el esquema antibiótico y el uso de antibióticos de amplio espectro fue más elevado. En esta serie, la antibioticoterapia fue prácticamente universal y muy superior a lo reportado en otros trabajos de la región (Santamaría 2 %28; Morantes-Caballero 64 %29) El uso de corticoide sistémicos fue cercano al 70 %, lo cual representa un cambio favorable respecto a su uso, de acuerdo con las indicaciones dadas por la guía GOLD, comparado con lo encontrado por el grupo de Santamaría28 entre 2012 y 2014 en el mismo centro (38 %), así como en el grupo de Morantes-Caballero29 en Bogotá, e incluso a la par de algunas series de países como Estados Unidos de América30; sin embargo, el manejo con CSI sigue siendo elevado pese a que estos no tienen ningún soporte en el tratamiento EAEPOC.
Respecto a las limitaciones del estudio, estas son inherentes al diseño basado en el registro de historias clínicas, en donde algunas variables no son sistemáticamente descritas y no es posible documentar el seguimiento clínico de los pacientes. A pesar del número relativamente pequeño de pacientes que cumplieron criterios para ser parte del análisis, se proporciona una información valiosa sobre los factores relacionados con la necesidad de VMI en los pacientes con EAEPOC, por lo cual se convierte en una oportunidad para conformar una línea de investigación en nuestra región.
Conclusiones
El presente estudio es novedoso y, según la literatura publicada, uno de los pocos de la región del país que aborda el análisis de las exacerbaciones graves de la EPOC que requirieron VMI.
A pesar de que el estudio tuvo un tamaño muestral limitado, se logró el objetivo planteado, ya que se encontraron diferencias en el perfil de los pacientes con EAEPOC grave que requirieron VMI. Se relacionó de manera estadísticamente significativa el uso de VMI con las siguientes características: edad (68,9 ± 7,71 p < 0,001); presencia de disnea severa (100 % p < 0,01); insuficiencia respiratoria al ingreso (100 % p < 0,001); pH (7,3 ± 0,115 p 0,027); pCO2 (70,05 ± 20,75 p 0,05); uso de meropenem (33,3 % p 0,025); requerimiento de cambio de antibiótico (50 % p 0,025); uso de CSIV (100 % p < 0,001); uso de SABA + SAMA (91,67 % p 0,028); alteración del estado de conciencia (41,67 % p < 0,001); inestabilidad hemodinámica (50 % p < 0,001); requerimiento de UCI (100 % p < 0,001); infecciones asociadas al cuidado de la salud (37,50 % p 0,026) y estancia hospitalaria prolongada (14 ± 19 días p 0,03). Estos resultados, aunado a los demás estudios ya reportados, evidencian la necesidad de individualizar el manejo para esta población y el uso de manera oportuna del VMI, con el fin de obtener un beneficio clínico en el paciente y la disminución de su morbilidad y mortalidad.















