Introducción
La deglución es un evento fisiológico dinámico y neuromuscular complejo1, que involucra más de 25 pares de músculos, cognición intacta, control central en tronco encefálico y corteza cerebral2,3, procesamiento sensorial y sensación faríngea adecuadas, mecanismos de recompensa y motivación, control sensoriomotor, protección de la vía respiratoria y funciones involuntarias indemnes4, la cual permite transferir el bolo alimenticio (sea sólido o líquido) desde la cavidad oral hacia el estómago de forma segura sin que exista aspiración o penetración al sistema respiratorio5. La neurofisiología moderna muestra la deglución como un mecanismo de respuesta modelada que involucra varios niveles del sistema nervioso tanto corticales como subcorticales6.
El trastorno de la deglución o disfagia es la alteración en la actividad fisiológica de tragar, donde hay dificultad para mover el bolo alimenticio (sólido y/o líquido, incluyendo secreciones) de manera segura desde la boca al estómago sin que aparezca aspiración5.
La disfagia es frecuente y común en la población en general, cerca de 1’000 000 de nuevos casos al año son diagnosticados en los Estados Unidos7; considerándose una causa importante de morbimortalidad. Un estudio del año 2014 reportó que los problemas de la deglución afectan anualmente a uno de cada 25 adultos en los Estados Unidos8, con una prevalencia de disfagia en población general cercana al 20%7,9. Una encuesta telefónica realizada en Holanda, publicada en el año 2015, encontró una prevalencia en la población general de disfagia orofaríngea del 12,1%10. La Sociedad Europea de Trastornos de la Deglución menciona desde el año 2016 que la disfagia orofaríngea es de alta prevalencia en la población de mayor edad: 40% en adultos mayores independientes, 44% en pacientes que poseen cuidados geriátricos y hasta un 60% en adultos mayores institucionalizados11. Un metaanálisis publicado en el 2022 calculó una prevalencia global de disfagia orofaríngea del 43,8% (intervalo de confianza del 95%: 33,3% a 54,9%)12.
La Disfagia Orofaríngea Neurogénica (DON) es un reto asistencial, puesto que posee una incidencia mundial entre 400 000 y 800 000 casos/año13; donde los trastornos neurológicos centrales explican alrededor del 70% al 80% de la misma14. En adultos y adultos mayores la disfagia es habitualmente producida por causas neurológicas y neuromusculares, siendo las más frecuentes el Accidente Cerebro-Vascular (ACV), procesos neurodegenerativos, Enfermedad de Parkinson (EP), Trauma Craneoencefálico (TCE) y Esclerosis Múltiple (EM) 15,16.
Por localización clínica la disfagia se agrupa en orofaríngea y esofágica y, al existir múltiples etiologías, estas se clasifican, generalmente, en estructurales, motoras y funcionales3,17. A su vez, la disfagia orofaríngea se puede producir por causas funcionales, estructurales, motoras, iatrogénicas, infecciosas y metabólicas, donde las causas funcionales, estructurales y las iatrogénicas son las más comunes18,19. A diferencia de las causas estructurales (caracterizadas por deterioro físico de la vía deglutoria) y motoras (donde hay problemas en la propulsión esofágica), en la disfagia funcional hay deterioro de la fisiología de la deglución20, ya sea en el control neurológico, reflejo deglutorio, movimientos faríngeos, relajación del Esfínter Esofágico Superior (EES) y/o por alteración muscular21.
En las causas funcionales sobresale la Disfagia Orofaríngea Neurogénica (DON), en la que se altera el control neurológico central de la fase orofaríngea de la deglución, modulación del peristaltismo, coordinación neuromuscular de los esfínteres y acción de los efectores musculares orofaciales, masticadores, linguales, del paladar blando y/o de la faringe5,22,23. En la DON se altera la fase oral y/o faríngea para consistencias líquidas y/o sólidas, ya sea como resultado de enfermedades neurológicas, que fisiopatológicamente se ubican en el sistema nervioso central, o de enfermedades neuromusculares, ubicadas en sistema nervioso periférico y/o músculo. La disfagia en general y, en especial, la DON, es potencialmente peligrosa porque lleva al paciente a varias complicaciones como retraso en el desarrollo motor y cognitivo en la población infantil23,24 a causa de comprometer directamente el ingreso y aporte nutricional e hídrico del niño en proceso de desarrollo. Además, en niños y adultos produce complicaciones respiratorias como neumonía, infecciones respiratorias a repetición, enfermedad respiratoria crónica, obstrucción de vía respiratoria y falla respiratoria25, además de complicaciones nutricionales tipo mala nutrición-hidratación y pérdida de peso.
La disfagia produce una diversidad de síntomas y signos, como prolongación del tiempo para comer, intolerancia oral a ciertas texturas de alimentos, sensación de adherencia al tragar y obstrucción del paso de los alimentos a través de la boca, faringe y/o esófago. Estos signos y síntomas se usan en los métodos de tamizaje, en las evaluaciones formales clínicas de la deglución y en los métodos instrumentales, para detectar la presencia, déficit fisiológico y gravedad de la misma26.
Dentro de las herramientas disponibles para tamizaje sobresale el Eating Assessment Tool-10 (EAT-10)27, que es un instrumento analógico verbal, unidimensional, simple y de aplicación breve, y autoadministrado de puntuación directa28, que permite la evaluación de síntomas específicos de disfagia, el establecimiento inicial de la gravedad del síntoma y valoración del tratamiento de la misma. Se compone de diez preguntas, las cuales indagan sobre pérdida de peso, interferencia para comer fuera de casa, esfuerzo extra para tragar líquidos, sólidos y pastillas, dolor al tragar, afectación del placer de comer, sensación de comida pegada en garganta, tos al comer y estrés asociado al tragar. Cada una se califica de forma subjetiva en una escala de cero a cuatro puntos, donde cero indica la ausencia del problema y cuatro indica un problema serio. El puntaje final se obtiene de sumar las puntuaciones obtenidas en cada uno de los diez ítems, donde las puntuaciones más altas indican mayor percepción de disfagia28. El EAT- 10 fue el instrumento de elección en este trabajo debido a su diseño para cualificar los síntomas de disfagia (autopercepción), ser de fácil aplicación y comprensión por los pacientes, y contar con un estudio de validación en Colombia29.
Sin embargo, la Evaluación Clínica de la Deglución a la Cabecera del Paciente (ECD-CP), que es una evaluación clínica no instrumental que incluye la revisión de los nervios craneales, examen sensorial y motor de la cavidad oral, y evaluación de la deglución orofaríngea usando diferentes alimentos y líquidos30, es la forma más utilizada y habitual de evaluación para diagnosticar la disfagia, como primera línea o a veces como el único método empleado31,32, especialmente en nuestro medio. Usualmente, el diagnóstico de disfagia y caracterización del déficit fisiológico de la deglución a través de la ECD-CP debe ser confirmada mediante un método instrumental33, como Video- Fluoroscopia de la Deglución (VFD)34 o Evaluación Endoscópica Funcional de la Deglución (FEES por sus siglas en inglés)35.
Si bien la disfagia es muy frecuente, considerándose incluso un síndrome geriátrico, hay brechas de conocimiento en cuanto a su tamizaje, diagnóstico oportuno y diferenciación fisiopatológica entre causas estructurales, mecánicas y funcionales. La disfagia como signo, trastorno o síndrome es habitualmente desatendida por los profesionales de la salud36, como es el caso de adultos mayores con enfermedades neurodegenerativas y disfagia significativa (donde se encuentra la DON de causas centrales o periféricas), la cual no es reconocida habitualmente como factor de riesgo de neumonía y desnutrición37, y la disfagia post ACV que es infradiagnosticada38. Por lo tanto, la disfagia en general y la DON son temáticas que requieren sensibilización y formación en profesionales de la salud39,40.
Estudios clínicos sobre disfagia en Colombia son en realidad escasos, especialmente en el tema de DON, donde su incidencia, prevalencia y caracterización semiológica completa se desconoce de manera nacional, regional y local en Colombia41. Un estudio descriptivo del año 2008 realizado en niños con sospecha de trastorno de la deglución, con realización de VFD, reportó que la parálisis cerebral fue la etiología más frecuente42. Nuestro equipo de investigación publicó en el año 2022 una caracterización clínica y etiológica en una muestra de 239 menores de edad y 288 adultos atendidos en dos centros asistenciales, donde la disfagia orofaríngea fue la forma clínica más frecuente (87%) por etiología funcional de origen neurológico con una frecuencia del 39,3%41.
Por lo anterior, el objetivo de este estudio fue realizar una caracterización clínica incluyendo percepción de síntomas de disfagia, en pacientes con disfagia orofaríngea neurogénica de causas neurológicas y neuromusculares en Antioquia, Colombia entre los años 2019 y 2021, para ayudar a los profesionales de la salud en la identificación oportuna de este tipo de disfagia.
Materiales y métodos
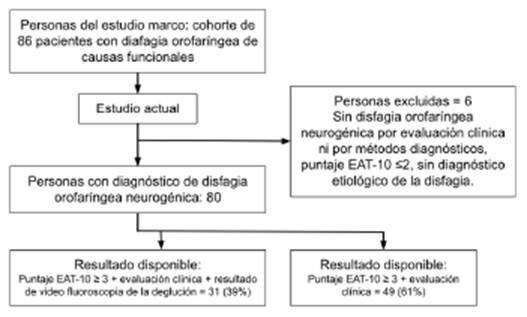
Estudio descriptivo de tipo transversal realizado en pacientes mayores de edad con DON, confirmado por ECD-CP43, que fue realizado por neurología clínica y/o por resultados de VFD, más puntaje ≥3 puntos en el instrumento EAT-10. El punto de corte con mejor equilibrio entre sensibilidad y especificidad en cuanto a identificación de disfagia es ≥3 puntos27,29,44, por eso fue incluido como criterio de inclusión. Se excluyeron pacientes con disfagia esofágica, disfagia orofaríngea de causas mecánicas, en tratamiento activo para cáncer o con irradiación en región facial y/o cervical, con presencia de edema o hematomas en rostro y/o en cuello, con procedimientos quirúrgicos recientes en cuello, hipoxemia grave e implantes de estimulación profunda (en el caso de pacientes con enfermedad de Parkinson).
Muestra y muestreo: los 80 pacientes con DON elegidos para este estudio hacen parte de una investigación tipo cohorte con 86 personas que pretende desarrollar un algoritmo diagnóstico mediante la integración de datos clínicos basados en ECD-CP y señales no invasivas del proceso deglutorio. La investigación marco tiene una muestra calculada de al menos 76 pacientes con disfagia orofaríngea de causas funcionales, la cual se determinó con una sensibilidad del 80%, según literatura de la ECD-CP45, confianza del 95% y potencia del 80%.
Personal médico y de fonoaudiología en deglución de varias instituciones de salud públicas y privadas, consultorios privados de fonoaudiología en deglución y organizaciones de pacientes ubicados en el Área Metropolitana del Valle de Aburrá y Valle de San Nicolás (Antioquia, Colombia) identificaron pacientes con disfagia orofaríngea por causas funcionales, que luego fueron contactados telefónicamente por una fonoaudióloga con entrenamiento en disfagia, para invitarlos a participar del estudio. Aquellos que aceptaron participar se les agendó una consulta de revisión gratuita con neurología clínica, donde se confirmaron criterios de elegibilidad para ingresar o no al estudio, y se realizó una ECD-CP incluyendo EAT- 10, de las cuales se obtuvieron las variables de este estudio. La recolección de la información se realizó entre marzo de 2019 hasta noviembre de 2021.
La pandemia por COVID-19 modificó el plan de reclutamiento y revisión de pacientes con DON, especialmente durante la segunda mitad del primer semestre y segundo semestre de 2020, puesto que los pacientes con disfagia y con comorbilidades neurológicas y respiratorias tienen riesgo de presentar casos moderados y graves de COVID-19. Sin embargo, a partir del proceso de vacunación y capacitación/interiorización de medidas de bioseguridad por parte del equipo de investigación se retomó el proceso de revisión y recolección de información de pacientes durante el año 2021. La pausa y retoma del proyecto descrito no modificó los objetivos ni metodología del proyecto.
Toda la información se recolectó directamente de los pacientes utilizando un cuestionario que contenía información sobre antecedentes, síntomas, forma de alimentación, resultados de VFD, talla, peso y signos al examen físico de la deglución (material suplementario 1). Además, en cada paciente se diligenció la versión del instrumento EAT-10 validada para Colombia27,29, y se identificaron aquellos pacientes con puntaje ≥23 puntos en el EAT-10, puesto que serían aquellos con mayor percepción de síntomas de disfagia, y, según la literatura, los pacientes con disfagia orofaríngea suelen obtener puntajes de 23 o más27,46.
La toma de peso y talla se realizó mediante báscula digital. En los pacientes se realizó una prueba deglutoria con tres consistencias: yogur, agua (volumen de 5, 10 y 20 ml) y galleta (5 gr), con cualificación clínica de la voz pre y posdeglución. La información fue recolectada por una médica neuróloga en compañía de fonoaudióloga con entrenamiento en disfagia.
Se calculó el Índice de Masa Corporal (IMC) y se categorizó según la clasificación de la Organización Mundial de la Salud (OMS)47 en: IMC <18.5 kg/m2 peso insuficiente; entre 18.5 a 24.9 kg/m2 peso normal; entre 25.0 a 29.9 Kg/m2 sobrepeso; IMC entre 30.0 a 34.9 kg/m2 obesidad; entre 35.0 a 39.9 kg/m2 obesidad grave; entre 40.0 a 49.9 kg/m2 obesidad mórbida, y entre 50.0 a 59.9 kg/m2 súper-obesidad.
Plan de análisis: descripción de los resultados mediante frecuencias absolutas y relativas de las características y antecedentes clínicos en toda la muestra, incluyendo cualificación de la voz antes y después de tragar varias consistencias al examen físico. Presentación de frecuencias en cuanto a tolerancia de consistencias alimentarias, síntomas y signos al examen físico agrupadas por causas neurológicas y neuromusculares. Se presentarán los antecedentes, síntomas y signos de los pacientes con puntajes del EAT-10 mayor o igual a 23 puntos, utilizando mediana y rango intercuartil (RIC): percentil 25 y 75. En las variables cuantitativas como puntaje EAT-10, edad, talla, peso e IMC se evaluó normalidad mediante prueba de Shapiro-Wilk para presentar los resultados según promedio y desviación estándar, o mediana con RIC. La prueba de significancia (p valor) en las variables cualitativas se obtuvo mediante Chi cuadrado o test exacto de Fisher, identificando aquellas variables con p valor <0,05. Las variables de síntomas y signos comparadas entre pacientes con DON de causas neurológicas (SNC) versus neuromusculares (SNP y músculo) fueron tratadas como muestras independientes. La variable de cualificación de la voz antes y después de tragar en toda la muestra será mostrada de forma descriptiva (mediante frecuencias absolutas y relativas).
Consideraciones éticas y conflictos de interés
Estudio aprobado por el Comité de Ética de Investigación en Salud de la Universidad Pontificia Bolivariana (acta N°7, junio 1 de 2017), Comité de Ética de Investigación Fundación Hospitalaria San Vicente Paúl (acta N°35-2018, diciembre 21 de 2018) y Comité de Ética en Investigación de la Clínica Somer (acta N°01-2019, febrero 8 de 2019), más el aval de varias instituciones, consultorios particulares y asociaciones de pacientes. En cada persona candidata y evaluada para ingresar al estudio, fue diligenciado y obtenido un consentimiento informado impreso. Los autores declaran inexistencia de conflictos de interés.
Resultados
De 86 personas evaluadas en la investigación marco, se tomaron 80 pacientes con DON de causas neurológicas y neuromusculares para el presente estudio (ver figura 1).
Más de la mitad de los pacientes fueron hombres con un porcentaje del 56,3% (45/80), edad promedio de 56,9 años (DE±17,7). En el 88,8% (71/80) de los pacientes la etiología neurogénica de la disfagia se ubicó en SNC (neurológico), y en el resto en SNP y músculo (neuromuscular). Los diagnósticos principales más frecuentes fueron condiciones neurológicas centrales como la enfermedad cerebrovascular (ECV) y la EP. La comorbilidad más frecuente fue cardiovascular (ver tabla 1).
Tabla 1 Características y antecedentes clínicos de los pacientes con disfagia orofaríngea neurogénica de causas neurológicas y neuromusculares.
| Variables (n=80) | n (%) |
|---|---|
| Sexo | |
| Hombres | 45 (56,3) |
| Mujeres | 35 (43,8) |
| Diagnóstico principal | |
| Enfermedad cerebrovascular | 16 (20) |
| Enfermedad de Parkinson | 14 (17,5) |
| Enfermedad motora degenerativa | 11 (13,8) |
| Esclerosis múltiple | 10 (12,5) |
| Miopatías | 7 (8,8) |
| Trastorno neurocognitivo | 5 (6,3) |
| Trauma encéfalo craneano | 5 (6,3) |
| Parálisis cerebral infantil | 5 (6,3) |
| Ataxia | 3 (3,8) |
| Neuropatías | 2 (2,5) |
| Otros procesos neurológicos | 2 (2,5) |
| Comorbilidades | |
| Comorbilidades cardiovasculares | 32 (40) |
| Comorbilidades endocrinas | 23 (28,8) |
| Comorbilidades respiratorias | 10 (12,5) |
| Comorbilidades gastrointestinales | 8 (10) |
| Comorbilidades psiquiátricas | 6 (7,5) |
| Comorbilidades reumatológicas | 5 (6,3) |
| Comorbilidades enfermedad tumoral/cáncer | 5 (6,3) |
| Presencia de otras deficiencias físicas | 25 (31,3) |
| Otros antecedentes clínicos de importancia | |
| Antecedente de intubación mayor a una semana | 12 (15) |
| Antecedente de neumonía por aspiración | 12 (15) |
| Presencia de gastrostomía | 8 (10) |
| Presencia de sonda de alimentación | 7 (8,8) |
| Antecedente de traqueostomía mayor a seis meses | 6 (7,5) |
| Presencia de traqueostomía | 4 (5) |
| Requerimiento de oxígeno suplementario | 4 (5) |
| Antecedente de neumonía recurrente | 4 (5) |
1 incluye la ELA: esclerosis lateral amiotrófica y PSP: parálisis supranuclear progresiva. 2 incluye distrofia muscular y dermatomiositis. 3 incluye demencias y deterioro cognitivo leve.
4 incluye desmielinizante inflamatoria crónica y Guillain-Barré. 5
incluye otras como talamotomía e hidrocefalia pos infecciosa.
Fuente: autores.
La forma más frecuente de alimentación al momento del estudio en los pacientes fue la vía oral; donde la presencia de gastrostomía, sonda de alimentación y traqueostomía presentaron frecuencias ≤10%.
Solo el 20% (16/80) de los pacientes reportaron tolerancia oral a todas las consistencias de alimentos: 18,3% (13/71) de los pacientes con etiología neurológica y 33,3% (3/9) de los pacientes con etiología neuromuscular. Las consistencias individuales de los alimentos más tolerados por todos los pacientes fueron tipo compota y líquidos espesos. En el grupo de pacientes con etiología neuromuscular las consistencias más toleradas (≥80%) fueron líquidos claros, líquidos espesos y compota, y en aquellos con etiología neurológica fue puré, compota y líquidos espesos. La consistencia menos tolerada en ambos grupos de pacientes fueron los sólidos duros (ver figura 2).
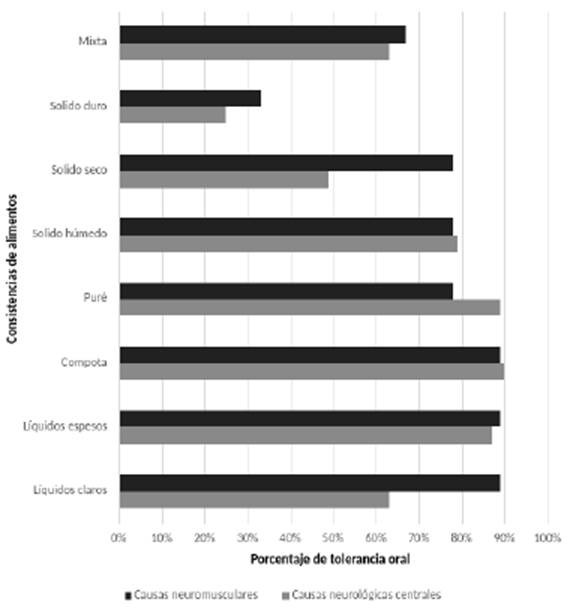
Fuente: autores.
Figura 2 Tolerancia actual de consistencias de alimentos en pacientes con disfagia orofaríngea neurogénica según agrupación de causas.
En general la frecuencia relativa de síntomas de disfagia entre ambos grupos de pacientes fue similar, sobresaliendo por su frecuencia síntomas como sensación de comida pegada y tos después de tragar. En ambos grupos la ubicación más frecuente de la sensación de comida pegada fue en el cuello. La mayor frecuencia de percibir los síntomas de disfagia fluctuantes en el tiempo se obtuvo en el grupo de causas neurológicas con un 73,2% (52/71). En el grupo de causas neuromusculares hay mayor frecuencia relativa de hipogeusia, sensación de llenura continua, náuseas, vómito, acidez, dificultad para masticar, odinofagia y dolor en el pecho. Los síntomas de regurgitación nasal del alimento y hematemesis tuvieron baja frecuencia en ambos grupos de pacientes (ver tabla 2).
Tabla 2 Frecuencia de síntomas en pacientes con disfagia orofaríngea neurogénica según agrupación de causas.
| Síntomas | Pacientes con causas neurológicas n=71 n (%) | Pacientes con causas neuromusculares n=9 n (%) | Valor p |
|---|---|---|---|
| Presencia de problemas para iniciar o comenzar a tragar | 24 (33,8) | 3 (33,3) | 1,000** |
| Sensación de comida pegada unos segundos después de tragar | 56 (78,9) | 8 (88,9) | 0,679** |
| Ubicación de la sensación de comida pegada | |||
| - Boca | 14 (19,7) | 3 (33,3) | |
| - Cuello | 36 (50,7) | 6 (67,7) | |
| - Tórax | 1 (1,4) | 0 (0) | 0,335** |
| - Abdomen | 1 (1,4) | 0 (0) | |
| - No especificado | 19 (26,8) | 0 (0) | |
| Tos antes de tragar | 15 (21,1) | 2 (22,2) | 1,000** |
| Tos después de tragar | 58 (81,7) | 9 (100) | 0,342** |
| Ahogamiento después de tragar | 37 (52,1) | 5 (55,6) | 1,000** |
| Perdida subjetiva de peso | 35 (49,3) | 4 (44,4) | 1,000** |
| Acidez | 29 (40,8) | 6 (66,7) | 0,169** |
| Dificultad para masticar | 27 (38) | 5 (55,6) | 0,472** |
| Hiporexia | 27 (38) | 3 (33,3) | 1,000** |
| Temor para comer | 19 (26,8) | 3 (33,3) | 0,700** |
| Hiposmia | 18 (25,4) | 3 (33,3) | 0,691** |
| Hipogeusia | 17 (23,9) | 5 (55,6) | 0,105** |
| Sensación de llenura continua | 16 (22,5) | 4 (44,4) | 0,217** |
| Náuseas | 15 (21,1) | 5 (55,6) | 0,039** |
| Regurgitación nasal | 13 (18,3) | 2 (22,2) | 0,674** |
| Odinofagia | 7 (9,9) | 4 (44,4) | 0,018** |
| Dolor en el pecho | 7 (9,9) | 3 (33,3) | 0,080** |
| Vómito | 3 (4,2) | 2 (22,2) | 0,095** |
| Síntomas de disfagia fluctuantes en el tiempo | 52 (73,2) | 4 (44,4) | 0,119** |
| Síntomas de disfagia continuos en el tiempo | 19 (26,8) | 5 (55,6) | 0,119** |
* Chi cuadrado. ** Test exacto de Fisher.
Fuente: autores.
En el examen físico se encontró un espectro amplio de signos en los pacientes. Los signos con mayor frecuencia fueron las alteraciones en el nervio olfatorio, sensibilidad táctil y aspectos motores del nervio trigémino, reflejo mandibular alterado, apraxias orofaciales y marcha. En el grupo de pacientes con causas neurológicas hubo mayor presencia de alteraciones en el examen físico de aspectos motores de la lengua, ausencia de reflejo nauseoso y apraxias oro faciales. En el grupo con causas neuromusculares mayor frecuencia en alteraciones en los movimientos mandibulares (ver tabla 3).
3 Frecuencia de signos al examen físico en pacientes con disfagia orofaríngea neurogénica según agrupación de causas.
| Signos | Pacientes con causas neurológicas n=71 n (%) | Pacientes con causas neuromusculares n=9 n (%) | Valor p |
|---|---|---|---|
| Nervio olfatorio alterado | 30 (42,3) | 3 (33,3) | 0,729** |
| Alteración de la sensibilidad en V | 18 (25,4) | 3 (33,3) | 0,691** |
| Alteración en V porción motora oclusión | 5 (7) | 2 (22,2) | 0,176** |
| Alteración en V porción motora diducción | 6 (8,5) | 4 (44,4) | 0,012** |
| Alteración en V porción motora protracción | 10 (14,1) | 3 (33,3) | 0,157** |
| Alteración en V porción motora retracción | 10 (14,1) | 4 (44,4) | 0,045** |
| Reflejo mandibular alterado | 25 (35,2) | 4 (44,4) | 0,716** |
| Alteración V par porción gustativa | 8 (11,3) | 1 (11,1) | 1,000** |
| Reflejo nauseoso derecho ausente | 13 (18,3) | 1 (11,1) | 1,000** |
| Reflejo nauseoso izquierdo ausente | 14 (19,7) | 1 (11,1) | 1,000** |
| Fuerza lingual alterada | 9 (12,7) | 0 (0) | 0,587** |
| Movimiento de elevación lingual ausente | 4 (5,6) | 0 (0) | 1,000** |
| Movimiento de protrusión lingual ausente | 7 (9,9) | 0 (0) | 1,000** |
| Movimiento de retracción lingual ausente | 4 (5,6) | 0 (0) | 1,000** |
| Movimientos laterales de la lengua alterados | 10 (14,1) | 0 (0) | 0,593** |
| Coordinación lingual alterada | 11 (15,5) | 1 (11,1) | 1,000** |
| Fasciculaciones linguales | 12 (16,9) | 1 (11,1) | 1,000** |
| Atrofia lingual | 8 (11,3) | 0 (0) | 0,587** |
| Capacidad de toser alterada | 6 (8,5) | 1 (11,1) | 0,581** |
| Apraxias oro faciales | |||
| Incapacidad de protruir los labios | 16 (22,5) | 0 (0) | 0,192** |
| Incapacidad de sonreír | 13 (18,3) | 0 (0) | 0,342** |
| Incapacidad de llevar labios juntos a los lados | 48 (69,6) | 2 (22,2) | 0,009** |
| Marcha | |||
| Alterada | 39 (54,9) | 4 (44,4) | 0,552* |
| Sin marcha | 5 (7) | 0 (0) | 1,000** |
V3a: tercera rama del trigémino o nervio mandibular. VIIb: nervio facial. * Chi cuadrado. ** Test exacto de Fisher.
La tabla 4 muestra los resultados de la cualificación clínica de la voz antes y después de realizar una prueba de deglución con diferentes texturas y volúmenes de alimentos, siendo la presencia de voz disfónica y húmeda los hallazgos más relevantes después de tragar (ver tabla 4).
Tabla 4 Cualificación de la voz antes y después de tragar diferentes texturas y volúmenes.
| Cualificación de la voz en los 80 pacientes | Antes de tragar | Después de tragar |
|---|---|---|
| n (%) | n (%) | |
| Normal | 15 (18,8) | 8 (10) |
| Disfónica | 29 (36,3) | 23 (28,8) |
| Sin determinar | 28 (35,1) | 24 (30,1) |
| Húmeda | 4 (5) | 18 (22,5) |
| Gangosa | 2 (2,5) | 6 (7,5) |
| Disártrica | 2 (2,5) | 1 (1,3) |
Fuente: autores.
El peso, talla e IMC promedio de los pacientes fue de 59,4 kg, 160 cm y 23,1 Kg/m2 respectivamente, con una mediana de puntaje del EAT-10 de 16 en toda la muestra. El 53,8% (43/80) con IMC en rango peso normal, 26,3% (21/80) con sobrepeso, 13,8% (11/80) con peso insuficiente, 5% (4/80) con obesidad y 1,3% (1/80) con obesidad grave.
La mediana de puntaje más alta del EAT-10 se obtuvo en pacientes con presencia de gastrostomía, antecedente de neumonía y aquellos con síntoma de odinofagia e intolerancia oral a compota y pure. La tabla 5 muestra en detalle las variables de antecedentes y síntomas de disfagia con medianas de puntaje del EAT-10 ≥23 puntos (mayor autopercepción de síntomas de disfagia).
Tabla 5 Antecedentes y síntomas con EAT-10 ≥23 puntos en pacientes con disfagia orofaríngea neurogénica de causas neurológicas y neuromusculares.
| Puntaje EAT-10 | ||||
|---|---|---|---|---|
| Antecedentes y síntomas | n | Mediana | Percentil 25 | Percentil 75 |
| Diagnóstico principal tipo trastorno neuro cognitivo | 5 | 29 | 27 | 31 |
| Diagnóstico principal tipo miopatía | 7 | 25 | 15 | 35 |
| Presencia de sonda de alimentación | 7 | 27 | 16 | 37 |
| Requerimiento de oxígeno suplementario | 4 | 27 | 18 | 34 |
| Presencia de gastrostomía | 8 | 35 | 22 | 36 |
| Antecedente de neumonía recurrente | 4 | 35 | 28 | 38 |
| Antecedente de neumonía por aspiración | 12 | 23 | 19 | 35 |
| Sin tolerancia oral a consistencias tipo | ||||
| Líquidos claros | 27 | 27 | 16 | 32 |
| Líquidos espesos | 10 | 27 | 16 | 34 |
| Compota | 8 | 31 | 24 | 36 |
| Pure | 10 | 31 | 18 | 35 |
| Sólido húmedo | 17 | 28 | 24 | 35 |
| Solido seco | 38 | 23 | 15 | 32 |
| Consistencias mixtas | 29 | 27 | 18 | 34 |
| Presencia de problemas para iniciar o comenzar a tragar | 27 | 27 | 16 | 32 |
| Síntoma de disfagia continuo en el tiempo | 24 | 26 | 15 | 34 |
| Síntomas de disfagia fluctuante en el tiempo | 24 | 24 | 13 | 34 |
| Temor para comer | 22 | 27 | 19 | 32 |
| Síntoma de hipogeusia | 22 | 27 | 16 | 31 |
| Síntoma de regurgitación nasal | 15 | 27 | 16 | 29 |
| Síntoma de odinofagia | 11 | 31 | 13 | 35 |
Fuente: autores.
La mediana de puntaje más alta del EAT-10 acorde a presencia de signos al examen físico se obtuvo en pacientes con alteración del movimiento de oclusión mandibular (tercera rama del trigémino) y alteración del sentido del gusto. La tabla 6 muestra en detalle los signos al examen físico con las medianas de puntaje del EAT-10 más altas.
Tabla 6 Signos al examen físico con puntaje EAT-10 ≥23 puntos en pacientes con disfagia orofaríngea neurogénica de causas neurológicas y neuromusculares.
| Signos | Puntaje EAT-10 | |||
|---|---|---|---|---|
| n | Mediana | Percentil 25 | Percentil 75 | |
| Oclusión V3* alterado/ ausente | 7 | 34 | 33 | 35 |
| Diducción V3* alterado/ ausente | 10 | 27 | 17 | 34 |
| Gusto (sensibilidad VII**) alterado/ausente | 9 | 29 | 15 | 32 |
| Capacidad de toser alterada | 7 | 27 | 19 | 28 |
| Coordinación lingual alterada | 12 | 24 | 17 | 34 |
| Atrofia lingual | 8 | 24 | 14 | 29 |
*V3: tercera rama del trigémino o nervio mandibular. **VII: nervio facial, cuerda del tímpano.
Fuente propia.
La mediana de puntaje EAT-10 entre pacientes con causas neurológicas versus neuromusculares fue similar (mediana de 16 y 17 puntos respectivamente).
Discusión
Este estudio reporta detalladamente un gran conjunto de características clínicas identificadas en un grupo de pacientes con DON de causas neurológicas y neuromusculares. Los principales resultados fueron: 1) En los pacientes con DON la autopercepción de síntomas es amplía, y la tolerancia oral a consistencias alimentarias no es completa. 2) Al examen físico se encontraron varias alteraciones focales incluyendo al nervio olfatorio, sensibilidad táctil y aspectos motores del nervio trigémino (incluyendo el reflejo mandibular), marcha y cualificación de la voz, y en aquellos con causas neurológicas, adicionalmente, alteraciones en aspectos motores y atrofia de la lengua y apraxias orofaciales. 3) Aún en presencia de la DON la vía principal de alimentación es oral con diferentes tolerancias según textura entre pacientes por causas neurológicas y neuromusculares. 4) Se observó una mediana de puntaje de la escala EAT-10 >30 puntos (equivalente a una mayor autopercepción o carga de síntomas de disfagia) en aquellos pacientes con presencia de gastrostomía, antecedente de neumonía, síntomas como odinofagia y alteración en la oclusión mandibular al examen físico.
La DON como forma de disfagia funcional resulta de varias alteraciones que conllevan principalmente a problemas en la motilidad orofaríngea con mala propulsión del bolo, pobre reconfiguración de la faringe al tragar y dificultades en la apertura del EES48. Estas condiciones pueden generar más síntomas que signos al examen físico, aspecto que fue visualizado en los pacientes, un mayor espectro y autopercepción de síntomas de disfagia en vez de una gran y marcada frecuencia de signos o hallazgos al examen físico. Algunos signos al examen físico sugestivos de DON, como ejemplo de disfagia crónica, son las fasciculaciones linguales por enfermedad de neuronas motoras49, voz húmeda por enfermedad de Parkinson y deterioro en el movimiento facial voluntario, respiración y tos cuando hay lesiones cortico-bulbares20. En pacientes con disfagia neurogénica una aparente normalidad en la movilidad lingual y elevación del paladar blando, y presencia o ausencia del reflejo nauseoso, no descarta ni confirma la existencia de disfagia50. Cook en el año 2008 concluyó que el examen físico de orofaringe es usualmente normal o sin hallazgos en los pacientes con disfagia orofaríngea45. De manera que los signos al examen físico son sugestivos, más no confirmatorios de DON.
Los diagnósticos principales más frecuentes en este estudio (ECV, EP, esclerosis lateral amiotrófica- ELA, parálisis supra nuclear progresiva-PSP, y esclerosis múltiple-EM), se ajustan a las causas más usuales de disfagia orofaríngea revisadas por Takizawa y colaboradores en 201651, como el ataque cerebrovascular, EP y lesiones cerebrales traumáticas. Una revisión sobre manifestaciones y diagnóstico de la disfagia orofaríngea realizada por Rommel y Hamdy en 2016, señala que la DON es la consecuencia final y común de varias etiologías individuales que terminan afectando la fisiología de la deglución, especialmente aquellas enfermedades y lesiones del SNC, SNP y unión neuromuscular20. La presencia de disfagia en pacientes neurológicos se puede deber a una respuesta deglutoria tardía o ausente, alteración de la propulsión lingual, reducción de la propulsión faríngea, paresia muscular faríngea uni o bilateral, cierre laríngeo reducido, pobre sensación de residuos y/o disfunción del EES34.
En cuanto a síntomas, tanto en los pacientes con causas neurológicas centrales como en el grupo de pacientes con causas neuromusculares de este estudio, fue frecuente la sensación de comida pegada unos segundos después de tragar especialmente en el cuello, tos y ahogamiento, y cambios en la cualificación de la voz. En los pacientes con causas neurológicas centrales fue más frecuente la percepción de síntomas de disfagia fluctuantes en el tiempo, en cambio en los neuromusculares la percepción de síntomas continuos en el tiempo y sensación de dificultad para masticar fue mayor. En signos al examen físico, en ambos grupos con una frecuencia relativamente similar, se encontró el nervio olfatorio y reflejo mandibular alterados, y compromiso de la marcha. En los pacientes con causas neuromusculares de DON se evidenció una mayor frecuencia de alteraciones en el conjunto de movimientos mandibulares (donde alteraciones en la diducción y retracción mandibular mostraron diferencias estadísticamente significativas), y en los neurológicos, más compromiso en aspectos motores linguales y particularmente la presencia apraxias orofaciales que mostró diferencia estadísticamente significativa. Estas últimas, son semiológicamente simples en su realización o examen (ejemplo: solicitar que la persona realice el gesto de sonreír, de protruir labios o gesto de besar, o de llevar labios juntos a los lados), pero que neurofisiologicamente evalúan la integración entre aspectos cognitivos del control cortical y ejecución motora central de la deglución. En esta misma línea, a partir de un análisis semiológico y neuropatológico tipo reporte de caso de un paciente con ELA, Lobo y colaboradores en el 2013, sugieren que las apraxias orofaciales representan pérdidas del control voluntario en músculos faciales, linguales, faríngeos y/o masticatorios en presencia de función muscular, refleja, espontánea y automática preservadas52.
En un estudio de tipo observacional realizado por Leonard y colaboradores en 2001 se encontró que en entidades neuromusculares como miastenia grave (MG) y distrofia muscular (DisM) hay deficiente propulsión lingual y faríngea, pronunciada debilidad muscularytiempos de tránsito del boloprolongados53. La fatiga muscular, movimientos lentos e inicio tardío de la fase faríngea son déficits característicos de pacientes con DON de origen neuromuscular54,55. En la dermatopolimiositis se reporta por su marcado compromiso de la musculatura estriada, disminución de la fuerza y coordinación de las etapas faríngea y esofágica de la deglución54,56, más xerostomía57, con reflejo deglutorio tras una deglución voluntaria normal, pero con fase faríngea prolongada56.
Los hallazgos anteriores, entre pacientes neurológicos y neuromusculares con disfagia orofaríngea, pueden ser explicados por el alcance anatómico y fisiopatológico de las enfermedades ubicadas en SNC (que pueden comprometer corteza cerebral y/o cerebelosa, ganglios basales, sustancia blanca, estructuras diencefálicas y/o tallo cerebral) y en SNP y músculo (que comprometen raíces nerviosas, plexo, nervio periférico, placa motora y/o músculo). Las entidades neurológicas centrales fuera de comprometer aspectos motores y/o sensitivos (somáticos o viscerales) del proceso deglutorio, pueden afectar otras funciones o circuitos relacionados con la transmisión/procesamiento neurológico más allá de la deglución, como el control postural, marcha, aspectos del lenguaje y dominios cognitivos. Nuevamente la revisión con propósitos clínicos en disfagia orofaríngea realizada por Rommel y Hamdy en 2016 precisa que las deficiencias en el movimiento facial voluntario en pacientes con disfagia orofaríngea pueden indicar la presencia de una enfermedad neurológica de carácter progresivo20. A la fecha no hay trabajos que muestren la asociación o expliquen la alteración de la marcha en pacientes con DON.
Un síntoma cardinal de la disfagia, en general, es la sensación de adherencia y/o dificultad en el tránsito de los alimentos a través del aparato aerodigestivo superior5,58. Se reporta que el signo primordial de la disfagia orofaríngea o de transferencia es la dificultad para iniciar la deglución, además por la mala formación y control del bolo alimenticio en la cavidad oral, se produce retención en la boca, derrame de alimento por los labios, sialorrea y ptialismo (compromiso fase oral), y por problemas en la propulsión lingual, faríngea o del EES, reflejo de deglución tardío/lento o retención del bolo en la faringe (compromiso fase faríngea)20,59, que sintomáticamente genera sensación de comida pegada. En la población de estudio el síntoma de presencia de problemas para iniciar o comenzar a tragar no fue tan frecuente (en general no sobrepasó el 35% en frecuencia); pero la sensación de comida pegada segundos después de tragar, ubicada con mayor frecuencia en cuello o boca, se encontró en ambos grupos de pacientes con una frecuencia en boca del 19,7% y en cuello del 50,7% en pacientes con causas neurológicas y del 33,3% en boca y 67,7% en cuello en aquellos con causas neuromusculares.
Otros síntomas reportados de disfagia orofaríngea son la necesidad de varios intentos para deglutir, presencia de regurgitación nasal durante la deglución, tos frecuente acompañada o no de ahogo inmediatamente después de tragar, aumento de secreciones orales, pérdida subjetiva de peso, lentitud al comer y otros cambios en el hábito de comer34,60,61. Ambos grupos de pacientes (causas neurológicas y neuromusculares) reportaron tos antes y después de tragar (teniendo mayor frecuencia la tos después de tragar), ahogamiento después de tragar y pérdida subjetiva de peso. Llama la atención que el síntoma de regurgitación nasal no fue tan frecuente en los pacientes posiblemente debido a dos aspectos: el primero se trata de pacientes con NOD crónica, donde pudo existir una compensación de este síntoma, que suele presentarse más en fases iniciales de la disfagia; y segundo, puede que los pacientes de este estudio no tengan disfagia grave, sino moderada y leve, lo cual explica también porque la mayoría tenían vía oral presente. De igual manera en esta población de estudio se encontraron otros síntomas de tipo gastrointestinal acompañantes como acidez, hiporexia, hiposmia e hipogeusia, sensación de llenura continua, náuseas, vómito, odinofagia y dolor en el pecho. Teniendo presente que en las comparaciones realizadas entre grupos las náuseas y odinofagia mostraron diferencias estadísticamente significativas (su frecuencia relativa fue mayor en el grupo de pacientes con causas neuromusculares).
Los pacientes del estudio reportaron diferentes frecuencias de tolerancia oral acorde a la consistencia de los alimentos, donde en general el tipo de alimento con mayor dificultad para tragar fueron los sólidos (que incluyen sólidos duros, secos y húmedos) seguidos de ambos (alimentos sólidos y líquidos). Este comportamiento en cuanto a intolerancia oral es consistente con la opinión de expertos clínicos como Reza Shaker en 2006, que desde una visión terapéutica un síntoma orientador de disfagia orofaríngea en los pacientes es la dificultad para tragar en especial solidos62. Otros autores también han observado que los pacientes con disfagia orofaríngea tienden a evitar ciertas texturas de los alimentos20,49, pero dicho síntoma puede ser un síntoma menos obvio de disfagia.
La disfonía, disartria, cambios en la voz (voz confusa o ronca después de comer, y voz nasal) y pérdida de peso se consideran síntomas poco específicos, pero que apoyan la presencia de disfagia orofaríngea45,62,63. A su vez los cambios en la calidad de la voz (voz húmeda o sonidos de gorgoteo) durante o después de tragar, cambios en la articulación del habla, junto a lentitud al comer, evitar comer en situaciones sociales e infecciones torácicas recurrentes se clasifican como síntomas atípicos en pacientes con disfagia orofaríngea20.
La pérdida de peso secundaria a una ingesta reducida es una característica clínica sugestiva de disfagia62,64. Llama la atención que, en los pacientes aquí reportados, la clasificación por IMC fue en rango de peso normal en más de la mitad, y solo el 14% tuvo un peso insuficiente.
Las causas funcionales de disfagia orofaríngea en los pacientes estudiados consisten a su vez en causas funcionales progresivas (como la EP, EM, ELA, PSP) y en no progresivas (como ECV, trauma encéfalo craneano y parálisis cerebral infantil), aspecto que puede explicar la presencia en mayor o menor grado de otros síntomas acompañantes, y a su vez influir en la autopercepción de la magnitud y progresión de los síntomas evaluados por EAT-10, y signos de disfagia al examen físico.
Las enfermedades neurológicas centrales y neuromusculares, independiente de sus particularidades fisiopatológicas, poseen un profundo y variado impacto sobre el tragar16, pudiendo afectar con una gravedad entre leve a profunda la deglución4, aspecto que puede explicar los rangos intercuartiles de puntaje del EAT-10 observados.
En todos los pacientes la mediana de puntaje de la escala EAT-10 fue más alta (punto de corte >30 puntos) en aquellos pacientes con presencia de gastrostomía, antecedente de neumonía recurrente, no tolerancia oral a consistencias tipo compota y pure, y en aquellos que refieren odinofagia. Esta relación observada puede deberse a que varios de estos antecedentes y síntomas pueden estar relacionados con una mayor gravedad fisiopatológica de la disfagia o mayor compromiso de la deglución, y por consiguiente mayor autopercepción por parte del paciente de la magnitud sintomática de la disfagia. Un estudio observacional prospectivo en 482 pacientes con disfagia (entre ellos con disfagia orofaríngea) realizado por Belafsky y colaboradores en 2008, y una revisión sobre tamizaje clínico realizada por Kaspar y Ekberg en 2012, reportan que los pacientes con disfagia orofaríngea suelen tener mayor autopercepción de síntomas de disfagia con puntales en el EAT-10 ≥23 puntos27,46.
El EAT-10 permite detectar disfagia orofaríngea, calificar la gravedad de los síntomas29, evaluar el estado de salud funcional de la persona relacionado con la disfagia27, realizar seguimiento de los síntomas y detectar pacientes con riesgo de aspiración65. No permite identificar la etiología de la disfagia orofaríngea entre causas funcionales, iatrogénicas, mecánicas o motoras, y no debe considerarse equivalente a la evaluación clínica formal o a una evaluación instrumental de la deglución. En el ámbito asistencial la ECD-CP es la primera herramienta de evaluación del paciente con riesgo o sospecha de disfagia, así posea menor sensibilidad y especificidad que las evaluaciones instrumentales tipo VFSS y FEES17,66,67.
Si bien se logró obtener una muestra representativa de pacientes con DON, el estudio presenta una serie de limitaciones como: no poder acceder o conocer en detalle las imágenes diagnósticas e informe de VFSS de todos los pacientes que conformaron la muestra del estudio; y el grupo de pacientes con causas neuromusculares fue pequeño, lo cual afectó el poder estadístico para implementar medidas de asociación; y no se contó con un instrumento estandarizado para estadificar la gravedad de la disfagia.
Conclusiones
Son causas frecuentes de DON la etiología neurológica central como la enfermedad cerebrovascular tipo ACV, enfermedad de Parkinson, esclerosis múltiple y las enfermedades motoras degenerativas como la esclerosis lateral amiotrófica.
La intolerancia oral a una, varias o a todas las consistencias de alimentos es un síntoma y signo para tener presente en la evaluación integral de pacientes con DON. Donde la tolerancia a consistencias tipo compota y líquidos espesos, e intolerancia a sólidos, son congruentes con la presencia de disfagia orofaríngea.
Síntomas como sensación de comida pegada, tos después de tragar y cambios en la voz, y signos como alteración sensitiva y motora en rostro, apraxias orofaciales y dificultades en la marcha son frecuentes en pacientes con DON.
Los hallazgos de este estudio muestran características clínicas (síntomas y signos) que son útiles en el reconocimiento de casos de DON, y apoyan que esta condición genera más síntomas que signos, puesto que las etiologías ubicadas en SNC, SNP o músculo afectan directamente la fisiología deglutoria. Es por ello por lo que el instrumento EAT-10 cobra valor e importancia en el proceso de valoración y seguimiento de pacientes con DON.
Las enfermedades neurológicas y neuromusculares van más allá de la disfagia, generando otra serie de deficiencias motoras, cognitivas y/o sensitivas- sensoriales en las personas que deben ser tenidas en cuenta por parte de los clínicos en su práctica asistencial.
Es necesario continuar con estudios que logren caracterizar el espectro de causas neurológicas y neuromusculares que generan disfagia orofaríngea y esofágica, y su progresión en el tiempo, integrando herramientas clínicas con pruebas instrumentales invasivas y no invasivas de la deglución.