Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.15 no.1 Medellín Jan./Mar. 2002
INVESTIGACIÓN ORIGINAL
Características bioquímicas y capacidad neutralizante de cuatro antivenenos polivalentes frente a los efectos farmacológicos y enzimáticos del veneno de Bothrops asper y Porthidium nasutum de Antioquia y Chocó
RAFAEL OTERO1; VITELBINA NÚÑEZ2; JACQUELINE BARONA3; ABEL DÍAZ4, MÓNICA SALDARRIAGA5
1. Médico Pediatra, Toxinólogo, Investigador Programa de Ofidismo/Escopionismo, Universidad de Antioquia.
2. Bacterióloga, Msc., Coordinadora Programa de Ofidismo/Escopionismo, Universidad de Antioquia.
3. Estudiante de Maestría Programa de Ofidismo/Escopionismo, Universidad de Antioquia.
4. Estadístico, Investigador Programa de Ofidismo/Escorpionismo, Universidad de Antioquia.
5. Médica Veterinaria, Msc., Investigadora Programa de Ofidismo/Escopionismo, Universidad de Antioquia Investigación financiada por la Universidad de Antioquia y el Instituto Bioclón, Laboratorios Silanes S. A. de C. V., México.
EN COLOMBIA, EL 90-95% DE LAS 3000 MORDEDURAS DE SERPIENTES informadas cada año, son ocasionadas por Bothrops spp, con una elevada mortalidad y secuelas. Siguiendo recomendaciones de la OMS, se evaluó la capacidad neutralizante de los efectos farmacológicos y enzimáticos de los venenos de Bothrops asper y Porthidium nasutum de Antioquia y Chocó por cuatro antivenenos; 2 de ellos de IgG completa (polivalente antibothrópico, anticrotálico del Instituto Nacional de Salud INS -Colombia; polivalente antibothrópico, anticrotálico, antilachésico de Laboratorios Probiol -Colombia) y 2 antivenenos de fragmentos F(ab')2 (polivalente antibothrópico, anticrotálico del Centro de Biotecnología de la Universidad Central de Venezuela; y el polivalente antibothrópico, anticrotálico Antivipmyn® del InstitutoBioclón -México). Se determinó la actividad letal, hemorrágica, desfibrinante, edematizante, mionecrosante y hemolítica indirecta de cada veneno, siguiendo métodos ya estandarizados. Las pruebas de neutralización in vitro e in vivo se realizaron por el método de preincubación a 370C de dosis fijas de veneno y dosis variables de antiveneno. Los antivenenos Antivipmyn® de México y polivalente INS de Colombia tuvieron la mayor potencia neutralizante de todos los efectos farmacológicos y enzimáticos del veneno de B. asper y P. nasutum. El antiveneno polivalente Probiol fue el de menor capacidad neutralizante y mayor concentración de proteínas. Los antivenenos de fragmentos F(ab')2 tuvieron más baja concentración de proteínas y solo cantidades menores de proteínas no inmunes por electroforesis.
PALABRAS CLAVE
VENENOS DE SERPIENTES, ACCIDENTE OFÍDICO, ANTIVENENOS, NEUTRALIZACIÓN, BOTHROPS ASPER, PHORTIDIUM NASUTUM
SUMMARY
NINETY TO 95% OF THE SNAKEBITESreported yearly in Colombia are inflicted by Bothrops spp with high mortality and sequelae. Following recommendations of the World Health Organization, the neutralizing ability of four polyvalent antivenoms against several pharmacological and enzymatic effects of Bothrops asper and Porthidium nasutum snake venoms from Antioquia and Chocó, was evaluated. Two of them were of whole IgG (polivalente antibothrópico, anticrotálico, Instituto Nacional de Salud- INS - Colombia; polivalente antibothrópico, anticrotálico, antilachésico, Laboratorios Probiol -Colombia) and two were of F(ab')2 fragments (polivalente antibothrópico, anticrotálico, Centro de Biotecnología, Universidad Central de Venezuela; polivalente antibothrópico, anticrotálico Antivipmyn®, Instituto Bioclon -México). The lethal, hemorrhagic, edema-forming, myonecrotic, defibrinating and indirect hemolytic effects of the venoms were determined. Then, the experiments of neutralization were performed by preincubating different venom/antivenom ratios at 37 °C during 30 minutes. The polyvalent antivenoms Antivipmyn® from México and INS from Colombia, showed the highest neutralizing ability against all toxic effects of the venoms in this study. Polyvalent antivenom from Probiol had the lowest neutralizing ability and the highest protein concentration. The antivenoms composed of F(ab')2 fragments had the lowest protein concentration and minor quantities of nonimmunoglobulin proteins by SDS-PAGE.
INTRODUCCIÓN
LA SEROTERAPIA CONTINÚA SIENDO el tratamiento específico de los envenenamientos ocasionados por mordeduras de serpientes desde su descubrimiento por Calmette (1). Por recomendación de la Organización Mundial de la Salud (OMS), los antivenenos utilizados en un país deben ser evaluados en su capacidad neutralizante no solo del efecto letal sino también de otras actividades farmacológicas y enzimáticas de los venenos de serpientes contra los cuales se va a utilizar el antiveneno (2). Adicionalmente, los ensayos clínicos controlados o pruebas de campo son indispensables para evaluar su eficacia y seguridad en humanos (2).
En Colombia, los géneros Bothrops, Porthidium, Bothriopsis y Bothriechis son los responsables del 90- 95% de los accidentes ofidicos. Bothrops asper y Porthidium nasutum (anteriormente Bothrops nasutus) ocasionan más del 70% de las mordeduras en el noroccidente del país, con una elevada mortalidad (5%) y secuelas (6%) atribuibles a complicaciones generadas por los rápidos efectos de los venenos y por tardía iniciación del tratamiento específico (3). Sus venenos inducen efectos locales tales como edema, hemorragia, ampollas y mionecrosis y signos sistémicos que amenazan la vida, tales como hemorragias distantes del sitio de la mordedura, hipotensión, alteraciones de la coagulación, trombocitopenia y nefrotoxicidad (4,5).
El objetivo de este trabajo, fue evaluar la capacidad neutralizante de 4 antivenenos, 2 de ellos producidos en Colombia y 3 disponibles en el país, frente a los efectos farmacológicos y enzimáticos del veneno de B. asper y P. nasutum de Antioquia y Chocó. Adicionalmente, comparar sus características bioquímicas que inciden en su seguridad.
MATERIALES Y MÉTODOS
Venenos, antivenenos y animales
LOS VENENOS DE B. ASPER Y P. NASUTUM fueron obtenidos por ordeño manual de 40 y 45 ejemplares, respectivamente, procedentes de diferentes regiones de Antioquia y Chocó. El veneno fue centrifugado a 3000 rpm/ 20 minutos, el sobrenadante liofilizado, homogenizado y congelado a -20 °C hasta su uso.
Se evaluaron 2 antivenenos de IgG completa producidos en Colombia: antiveneno polivalente del Instituto Nacional de Salud (INS), Bogotá, lote 150997, expiración febrero de 2001; y el antiveneno polivalente de Laboratorios Probiol, Bogotá, lote 14710, expiración septiembre de 2003. Adicionalmente se evaluaron 2 antivenenos F(ab')2: uno de México (antiveneno polivalente Antivipmyn® del Instituto Bioclón, lote B-8-L03, expiración noviembre de 2002) y otro de Venezuela (antiveneno polivalente del Centro de Biotecnología de la Universidad Central de Venezuela, UCV, Caracas, lote 108, expiración marzo de 2002). Todos los antivenenos fueron utilizados antes de su fecha de vencimiento. Para los experimentos in vivo se utilizaron ratones Swiss Webster (18-20g), machos y hembras.
FARMACOLÓGICOS Y ENZIMÁTICOS DE LOS VENENOS
Letalidad
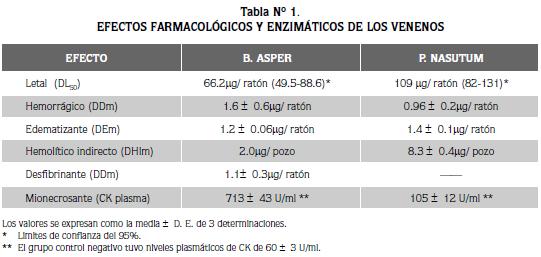
LA LETALIDAD DE LOS VENENOS FUE EVALUADA por inoculación i.p. de dosis variables de cada veneno diluido en 0.5 ml de solución salina en amortiguador de fosfatos (PBS), pH 7.2, a grupos de cuatro ratones / dosis y la dosis letal 50% (DL50) se calculó por el método de Spearman-Karber (6).
Edematizante
LA DOSIS EDEMATIZANTE MÍNIMA (DEm) se definió como la menor cantidad de veneno que, inyectada por vía s.c en la almohadilla plantar del ratón, produjo un edema del 30% en tres horas, siguiendo el método de Yamakawa et al., modificado por Gutiérrez et al.(7,8).
Desfibrinante
SE UTILIZÓ EL MÉTODO DESCRITO por Theakston y Reid, modificado por Gutiérrez et al. (9,10). Grupos de cuatro ratones por dosis, se inocularon por vía i.v. en la vena caudal con diferentes diluciones del veneno en 0.2 ml de PBS pH 7.2. La dosis desfibrinante mínima (DDm) se definió como la menor cantidad de veneno que produjo una anticoagulación del 100% en todos los ratones en una hora, y para toda dosis superior.
Hemorrágico
SE SIGUIÓ EL MÉTODO DE KONDO ET AL., modificado por Gutiérrez et al. (11,12). Se inocularon grupos de cuatro ratones por dosis, por vía i.d. en el abdomen. La dosis hemorrágica mínima (DHm) se definió como la menor cantidad de veneno que produjo un área de hemorragia de 10mm de diámetro en dos horas.
Hemolítico indirecto
SE REALIZÓ SIGUIENDO LA TÉCNICA DESCRITA por Habermann y Hardt, modificada por Gutiérrez et al. (13,14). Se utilizó una suspensión compuesta por 0.3ml de eritrocitos humanos, 0.3 ml de yema de huevo y 0.25 ml de CaCl2 0.01M, la cual se agregó a 25 ml de agarosa al 0.8% en PBS, pH 7.2 a 50± 2 °C. La dosis hemolítica mínima (DHIm) se definió como la menor cantidad de veneno que produjo un halo de hemólisis de 20mm de diámetro en 20 horas.
Mionecrosante
GRUPOS DE 4 RATONES FUERON INYECTADOS en el músculo gastronemio derecho con 50 µg del veneno diluido en 0.1 ml de PBS pH 7.2. Tres horas después se determinaron los niveles plasmáticos de la enzima creatin kinasa (CK) en Unidades Sigma/ml, siguiendo el procedimiento Sigma No. 520 (15). Un grupo control negativo recibió 0.1 ml de PBS i.m.
CAPACIDAD NEUTRALIZANTE DE LOS ANTIVENENOS
LOS ENSAYOS DE NEUTRALIZACIÓN SE REALIZARONpor el método de preincubación de veneno y antiveneno a 37°C durante 30 minutos, empleando dosis fijas de veneno (4DL50, 10DHm, 6DEm, 2DDm,1DHlm y 50 µg para la mionecrosis) y cantidades variables de antiveneno (15). Después de la incubación, se determinaron los efectos farmacológicos y enzimáticos del veneno siguiendo la metodología descrita anteriormente. Se realizaron tres repeticiones de cada ensayo en días diferentes y como controles se utilizaron igual numero de animales a los cuales se les inoculó una cantidad similar de veneno, sin antiveneno.
Los resultados se expresaron como dosis efectiva 50% (DE50) que se definió como la razón antiveneno/ veneno (µl/mg) capaz de neutralizar en un 50% el efecto del veneno. Para la actividad desfibrinante se determinó la DE100 que es la dosis de antiveneno que neutraliza 100% la actividad desfibrinante (15).
CUANTIFICACIÓN DE PROTEÍNAS DE LOS ANTIVENENOS
La concentración de proteínas fue determinada siguiendo el método de Lowry (16).
ELECTROFORESIS
LA ELECTROFORESIS DE LOS ANTIVENENOS se efectuó en geles de poliacrilamida al 10% en presencia de SDS, en una cámara Miniprotean (BIO-RAD) según el método descrito por Laemmli (17). Se utilizaron cantidades de antiveneno que contenían 40 µg de proteína. Paralelamente se corrieron marcadores de peso molecular en el mismo gel.
ANÁLISIS ESTADÍSTICO
LAS DIFERENCIAS OBSERVADAS en los valores de las dosis efectivas se analizaron mediante la prueba de Kruskall y Wallis. Cuando la prueba fue significativa, se utilizó el método de Dunn para comparar los promedios de los rangos. Las diferencias se consideraron significativas cuando µ=0.05.
RESULTADOS
Efectos farmacológicos y enzimáticos de los venenos
AMBOS VENENOS DEMOSTRARON actividad letal, hemorrágica, edematizante, mionecrosante y hemolítica indirecta, aunque con algunas diferencias entre ellos. El veneno de P. nasutum no tuvo actividad desfibrinante (Tabla N° 1).
Capacidad neutralizante de los antivenenos
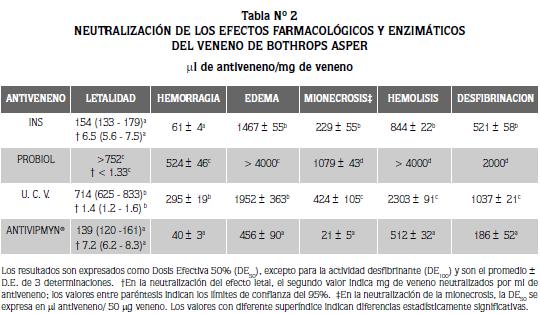
LOS ANTIVENENOS POLIVALENTESINS y Antiivipmyn® tuvieron la mayor eficacia neutralizante no solo contra el efecto letal del veneno de B. asper, sino también contra otros efectos farmacológicos y enzimáticos del veneno (P<0.05). Sin embargo, Antivipmyn® tuvo mayor capacidad neutralizante que el polivalente INS contra los efectos edematizante, mionecrosante, desfibrinante y hemolítico indirecto del veneno (P<0.05). El antiveneno polivalente Probiol demostró la más baja capacidad neutralizante de todos los efectos del veneno de B. asper (P<0.05), y no neutralizó los efectos letal, edematizante y hemolítico indirecto (Tabla 2). El suero polivalente UCV fue menos eficiente que los antivenenos INS y Antivipmyn® para neutralizar cada uno de los efectos, con excepción del edema, en que no hubo diferencia significativa entre los antivenenos INS y UCV (Tabla N° 2).
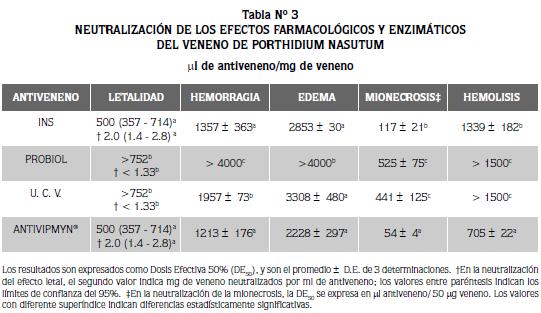
En relación con el veneno de P. nasutum, solo los antivenenos polivalentes INS y Antivipmyn® neutralizaron el efecto letal de este veneno. Estos 2 antivenenos fueron también más eficientes (P<0.05) que el polivalente UCV para neutralizar otros efectos farmacológicos y enzimáticos del veneno de P. nasutum, con excepción del efecto edematizante en que no hubo diferencias estadísticamente significativas entre ellos (Tabla N° 3). El antiveneno polivalente Probiol no neutralizó el veneno de P. nasutum, con excepción del efecto mionecrosante.
Cuantificación de proteínas y electroforesis de los antivenenos
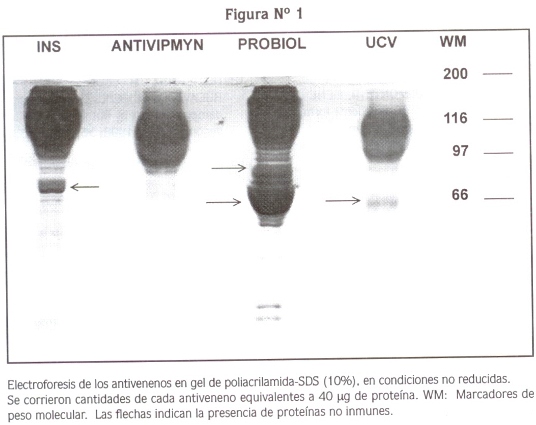
LOS ANTIVENENOS CON MENOR CONCENTRACIÓN de proteínas (p<0.05) fueron los de tipo F(ab')2,, es decir, Antivipmyn® y UCV con valores de 60 ± 5 y 56 ± 8 mg/ml respectivamente. Los antivenenos polivalentes INS y Probiol tuvieron una concentración de proteínas de 147 ± 37 y 230 ± 52 mg/ml, respectivamente. En la electroforesis de los antivenenos se observó una banda principal de 150 kDa correspondiente a la IgG para los antivenenos del tipo IgG completa, o una banda de 100 kDa para los del tipo F(ab')2. Además de esta banda, algunos antivenenos como los de Probiol y UCV exhibieron una banda de 70 kDa que corresponde muy posiblemente a albúmina, más intensa en el polivalente Probiol. Este último y el del INS presentaron además otras bandas entre 90 y 100 KDa que deben corresponder a agregados de proteínas. En los antivenenos UCV y Antivipmyn® también se observó esta banda, pero con menor intensidad (Figura N° 1).
DISCUSIÓN
TRADICIONALMENTE, LA POTENCIA DE UN ANTIVENENO se mide en animales de experimentación, mediante la capacidad de neutralizar el efecto letal del veneno de la especie de serpiente de referencia para el fabricante y el país, en este caso B. asper (2). Sin embargo, si epidemiológicamente hay otras especies que tienen impacto en morbilidad, mortalidad y secuelas, se debe examinar también la capacidad del antiveneno para neutralizar los venenos de ellas. Tal es el caso de P. nasutum en el noroccidente colombiano.
Este estudio demuestra grandes diferencias en la capacidad neutralizante de cuatro antivenenos, tres de ellos distribuidos en Colombia, frente a los efectos farmacológicos y enzimáticos inducidos por los venenos de B. asper y P. nasutum de Antioquia y Chocó. Así, los antivenenos polivalentes Antivipmyn® de México y del INS (Colombia) fueron los de mayor capacidad neutralizante de los diversos efectos de ambos venenos. Por el contrario, el polivalente Probiol tuvo la más baja potencia neutralizante del veneno de B. asper, que dista mucho de ser la indicada por el fabricante en el empaque (100mg / 10ml), y no neutralizó eficientemente el veneno de P. nasutum.
El rápido desarrollo de los efectos locales inducidos por los venenos de víboras (hemorragia, mionecrosis y edema), hace que la neutralización in vivo por los antivenenos sea solo parcial. No obstante, es muy importante que los antivenenos tengan una alta capacidad neutralizante in vitro contra las toxinas responsables de estos efectos y así, en algún grado, se reducirá el daño local (18). El efecto hemorrágico del veneno de B. asper fue neutralizado por todos los antivenenos del estudio con una potencia variable (Antivipmyn® = INS >UCV >Probiol). Antivipmyn® fue el que mejor neutralizó la actividad mionecrosante con una dosis efectiva 50% muy baja (21 µl antiveneno / 50 µg veneno). El polivalente Probiol no neutralizó los efectos edematizante y hemolítico indirecto del veneno de B. asper. Aunque el antiveneno de la UCV neutralizó todos los efectos farmacológicos del veneno de B. asper, la potencia neutralizante fue 2-5 veces más baja que la de los antivenenos INS y Antivipmyn®.
En la seroterapia antiofídica, es importante tener presente la variabilidad en la composición de los venenos que ha sido demostrada entre los más altos niveles taxonómicos tales como familia y género, pero también a nivel de especie en los aspectos geográfico y ontogénico (19). Otros estudios también han demostrado que un antiveneno monoespecífico puede neutralizar por reactividad cruzada el efecto letal y otros efectos tóxicos de venenos de otras especies de serpientes del género Bothrops del mismo país o de otro diferente (20-23).
No obstante la utilización de veneno de B. asper de México y Venezuela en la producción de los antivenenos polivalentes Antivipmyn® y UCV, respectivamente, hubo actividad neutralizante del veneno de B. asper de Colombia, especialmente alta en Antivipmyn®. Resultados similares se han obtenido al examinar los antivenenos producidos en Brasil y Costa Rica, frente a los venenos de serpientes Crotalinae de Centroamérica y Suramérica (incluyendo a B. asper de Colombia), corroborados también en ensayos clínicos aleatorizados realizados en Antioquia y Chocó, lo cual demuestra la existencia de reactividad cruzada y de una adecuada neutralización , independientemente de la variabilidad geográfica en el veneno de la especie B. asper (5, 15, 24 -26). Aunque hubo reactividad cruzada entre los antivenenos antibothrópicos - anticrotálicos INS y Antivipmyn® y el veneno de P. nasutum, se evidenció una reducción en la potencia neutralizante comparada con la del veneno utilizado en la mezcla inmunizante de los caballos (B. asper), según se aprecia en las tablas 2 y 3.
A pesar de los avances en la purificación de inmunoglobulinas, los antivenenos continúan generando reacciones tempranas adversas (RTAS) en el 10% - 82% de los casos, frecuencia que varía según el tipo de antiveneno, su grado de pureza y la naturaleza de la población expuesta. Estas RTAS (primeras 24 horas), son anafilácticas (por IgE), anafilactoides (por activación del complemento) o pirogénicas, siendo las anafilactoides mucho más frecuentes que las anafilácticas (2, 5, 25-27). En los antivenenos del tipo IgG, la porción Fc activa el complemento por la vía clásica. En los del tipo F(ab')2, se activa el complemento por la vía alterna, pero la actividad anticomplementaria es menor que en los de IgG (27). Adicionalmente, la presencia de agregados de proteínas y de albúmina en los antivenenos también puede activar el complemento (26). Es por eso que la OMS viene recomendando desde 1981 la utilización de antivenenos cada vez más purificados, preferiblemente del tipo F(ab')2, y recientemente del tipo Fab (2,27). Sin embargo, el fraccionamiento de la IgG con ácido caprílico permite obtener antivenenos de mayor pureza y seguridad que el sulfato de amonio (25,26).
En la electroforesis realizada a los antivenenos del presente estudio, todos producidos por fraccionamiento con sulfato de amonio, se observó la presencia de bandas correspondientes a proteínas no inmunes (albúmina y agregados de proteínas), especialmente notoria en el lote examinado del suero polivalente Probiol (Figura 1), el cual también tuvo la mayor concentración de proteínas y la menor potencia neutralizante, hechos que se pueden correlacionar en eficacia y seguridad con los hallazgos de un reciente estudio clínico (28).
AGRADECIMIENTOS
AL DR. OSWALDO GRILLO, Director del Centro de Biotecnología de la Universidad Central de Venezuela, por la donación del antiveneno polivalente producido por dicha institución y utilizado en el presente estudio.
BIBLIOGRAFÍA
1. BON C. Serum therapy was discovered 100 years ago. In: Bon C, Goyffon M, editors. Envenomings and their treatments, first ed. Lyon: Editions Foundation Marcel Merieux; 1996. p. 3-9 . [ Links ]
2. World Health Organization. Progress in the characterization of venoms and standardization of antivenoms. Who Offset Public No 58. Geneva 1981. [ Links ]
3. OTERO R, TOBÓN GS, GÓMEZ LF, OSORIO RG, VALDERRAMA R, HOYOS D, et al. Accidente ofídico en Antioquia y Chocó. Aspectos clínicos y epidemiológicos (marzo de 1989-febrero de 1990) Acta Méd Colomb 1992; 17: 229- 249. [ Links ]
4. OTERO R, OSORIO R, VALDERRAMA R, GIRALDO CA. Efectos farmacológicos y enzimáticos de los venenos de serpientes de Antioquia y Chocó (Colombia). Toxicon 1992; 30:611-620 [ Links ]
5. OTERO R, GUTIÉRREZ JM, NÚÑEZ V, ROBLES A, ESTRADA R, SEGURA M, et al. A randomized doubleblind clinical trial of two antivenoms in patients bitten by Bothrops atrox in Colombia. Trans R Soc Trop Med Hyg 1996; 90: 696-700. [ Links ]
6. ROBLES A, GENE JA. Determinación de la dosis letal 50% por el método de Spearman-Karber. Toxicalc. Instituto Clodomiro Picado, Universidad de Costa Rica, San José. Publicación Offset; 1990. p. 1-6. [ Links ]
7. YAMAKAWA M, NOZAKY M, HOKAMA Z. Fractionation of sakishimahabu (Trimeresurus elegans) venom and lethal, hemorrhagic and edema-forming activities of the fractions. In: Ohsaka A, Hayashi K, Sawai Y, editors. Toxins: Animal, Plant and Microbial, first ed. New York: Plenum; 1976. p. 97-109. [ Links ]
8. GUTIÉRREZ JM, ROJAS G, LOMONTE B, GENE JA, CERDAS L. Comparative study of the edema-forming activity of Costa Rican snake venoms and its neutralization by a polyvalent antivenom. Comp Biochem Physiol 1986; 85C: 171-175. [ Links ]
9. THEAKSTON RDG, REID HA. Development of simple standard assay procedures for the characterization of snake venoms. Bull Wld Hlth Org 1983; 61: 949-956. [ Links ]
10. GUTIÉRREZ JM, ROJAS G, CERDAS L. Ability of a polyvalent antivenom to neutralize the venom of Lachesis muta melanocephala, a new Costa Rican subespecies of the Bushmaster. Toxicon 1987; 25:713-720. [ Links ]
11. KONDO H, KONDO S, IKEZAWA H, MURATA R, OHSAKA A. Studies on the quantitative method for determination of hemorrhagic activity of Habu snake venom. Jpn J Med Sci Biol 1960; 13:43-49. [ Links ]
12. GUTIÉRREZ JM, GENE JA, ROJAS G, CERDAS L. Neutralization of proteolytic and hemorrhagic activities of Costa Rican snake venoms by a polyvalent antivenom. Toxicon 1985; 23: 887-893. [ Links ]
13. HABERMANN E, HARDT KL. A sensitive and specific plate test for the quantitation of phospholipases. Analyt Biochem 1972; 50:163-165. [ Links ]
14. GUTIÉRREZ JM, AVILA C, ROJAS E, CERDAS L. An alternative in vitro method for testing the potency of the polyvalent antivenom produced in Costa Rica. Toxicon 1988; 26: 411-413. [ Links ]
15. OTERO R, NÚÑEZ V, OSORIO RG, GUTIÉRREZ JM, GIRALDO CA, POSADA LE. Ability of six Latin American antivenoms to neutralize the venom of mapaná equis (Bothrops atrox) from Antioquia and Chocó (Colombia). Toxicon 33: 809-815. [ Links ]
16. LOWRY OH, ROSEBROUGH NJ, FARR AL, RANDALL RJ. Protein measurement with the folin phenol reagent. J Biol Chem 1951; 193: 265-275. [ Links ]
17. LAEMMLI UK. Cleavage of structural proteins during the assembly of head of bacteriophage T4. Nature 1970; 227: 680-685. [ Links ]
18. GUTIÉRREZ JM, LEÓN G, ROJAS G, LOMONTE B, RUCAVADO A, CHAVES F. Neutralization of local tissue damage induced by Bothrops asper (terciopelo) snake venom. Toxicon 1998; 36:1.529-1.538. [ Links ]
19. CHIPPAUX JP, WILLIAMS V, WHITE J. Snake venom variability: methods of study, results and interpretation. Toxicon 1991; 29:1.279-1.303. [ Links ]
20. DÍAZ-DA-SILVA W, GUIDOLIN R, RAW I, HIGASHI HG, CARICATI CP, MORAIS JF, et al. Cross reactivity of horse monovalent antivenoms to venoms of ten Bothrops species. Mem Inst Butantan 1989; 51:153-168. [ Links ]
21. KORNALICK F, TOBORSKA E. Cross-reactivity of monoand polyvalent antivenoms with Viperidae and Crotalidae snake venoms. Toxicon 1989; 27: 1.135-1.142. [ Links ]
22. DE ROODT A, DOLAB JA, FERNÁNDEZ T, SEGRE L, AND HAJOS SE. Cross-reactivity and heterologous neutralization of crotaline antivenoms used in Argentina. Toxicon 1998; 36:1.025-1.038. [ Links ]
23. FERREIRA ML, MOURA-DA-SILVA AM, MOTA I. Neutralization of different activities of venoms from nine species of Bothrops snakes by Bothrops jararaca antivenom. Toxicon 1992; 30:1.591-1.602. [ Links ]
24. BOGARIN G, MORAIS JF, YAMAGUCHI IK, STEPHANO MA, MARCELINO JR, NISHIKAWA AK, et al. Neutralization of crotaline snake venoms from Central and South America by antivenoms produced in Brazil and Costa Rica. Toxicon 2000; 38: 1.429-1.441. [ Links ]
25. OTERO-PATIÑO R, CARDOSO JLC, HIGASHI HG, NÚÑEZ V, DÍAZ A, TORO MF, et al. A randomized blinded comparative trial of one pepsin digested and two whole IgG antivenoms in Bothrops snake bites in Urabá, Colombia. Am J Trop Med Hyg 1998; 58: 183-189. [ Links ]
26. OTERO R, GUTIÉRREZ JM, ROJAS G, NÚÑEZ V, DÍAZ A, MIRANDA E, et al. A randomized blind clinical trial of two antivenoms prepared by caprylic acid or ammonium sulphate fractionation of IgG, in Bothrops and Porthidium snake bites in Colombia. Correlation between safety and biochemical characteristics of antivenoms. Toxicon 1999; 37: 895-908. [ Links ]
27. CHIPPAUX JP, GOYFFON M. Venoms, antivenoms and immunotherapy. Toxicon 1998; 36: 823-846. [ Links ]
28. OTERO R, GUTIÉRREZ J, MESA MB, DUQUE E, RODRÍGUEZ O, ARANGO JL, et al. Complications of bothropic envenomation in Colombia. A clinical and epidemiological study of 39 cases attended in a university hospital. Toxicon 2001 (enviado) [ Links ].