Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.15 no.3 Medellín July/Sept. 2002
ARTÍCULO DE REVISIÓN
Trombofilias heredadas y pérdida gestacional recurrente
INHERITED THROMBOPHILIA AND RECURRENT PREGNANCY LOSS
SERGUEI A. CASTAÑEDA*; WÁLTER D. CARDONA**; ÁNGELA P. CADAVID***
* Estudiante de Medicina, Joven Investigador
** Bacteriólogo y Laboratorista Clínico, Investigador Asociado.
*** MD, Magíster en Inmunología, Doctora en Ciencias. Programa de Reproducción, Corporación Biogénesis y Grupo de Investigación en Trombosis, Facultad de Medicina. Universidad de Antioquia, Medellín, Colombia.
Una de las causas de pérdida gestacional recurrente es la trombofilia, que se define como una tendencia a la trombosis o hipercoagulabilidad, con variabilidad en las manifestaciones clínicas dependiente de la región vascular afectada por la ausencia de flujo sanguíneo. Las trombofilias se pueden clasificar como heredadas y adquiridas de acuerdo con la naturaleza de su causa. Entre las trombofilias heredadas están el factor V Leiden, la protrombina G20210A, la metilentetrahidrofolato reductasa C677T, las deficiencias de los anticoagulantes naturales antitrombina III, proteína C y proteína S, las disfibrinogenemias y la homocistinuria. En el grupo de las trombofilias adquiridas se encuentran el síndrome antifosfolípido, la resistencia a la proteína C activada sin alteraciones en el gen del factor V y la hiperhomocisteinemia leve o moderada.
Este artículo es una revisión de la literatura de estudios recientes que han buscado la asociación entre las diferentes trombofilias y la pérdida gestacional recurrente. Se incluyen las recomendaciones diagnósticas, profilácticas y terapéuticas para mujeres con trombofilia y pérdida gestacional.
PALABRAS CLAVE
PÉRDIDA GESTACIONAL RECURRENTE, TROMBOFILIA, FACTOR V LEIDENPROTROMBINA G20210A, METILENTETRAHIDROFOLATO, REDUCTASA C677T, HIPERHOMOCISTEINEMIA
SUMMARY
ONE OF THE CAUSES OF RECURRENT PREGNANCY loss is thrombophilia, defined as a tendency to thrombosis or hypercoagulability, with various clinical manifestations dependent on the vascular region affected by the absence of blood flow. Thrombophilias can be classified as inherited or acquired, according to the nature of their cause. The former are factor V Leiden, the prothrombin G20210A, the methilenetetrahydrofolate reductase C677T, deficiencies of the natural anticoagulants antithrombin III, protein C and protein S, dysfibrinogens and homocystinuria. The group of acquired thrombophilias includes antiphospholipid syndrome, activated protein C resistance without alterations in the gene of factor V and mild or moderate hyperhomocysteinemia.
This article reviews several recent studies looking for association between different thrombophilias and recurrent pregnancy loss. Also diagnostic, prophylactic and therapeutic recommendations are included, for women with thrombophilia and pregnancy loss.
INTRODUCCIÓN
LA TROMBOFILIA SE DEFINE COMO UNA TENDENCIA a la trombosis o hipercoagulabilidad, con variabilidad en las manifestaciones clínicas dependiente de la región vascular afectada por la ausencia de flujo sanguíneo. La hipercoagulabilidad ya se había señalado por Virchow en el siglo XIX, como el tercer elemento de la tríada de la trombosis venosa: daño de la pared vascular, estasis y «cambios en la composición de la sangre».
La trombosis venosa es una de las principales manifestaciones de trombofilia, que tiene un espectro de incidencia anual que va de 1 en 100.000 en la edad pediátrica, a 1 en 100 en la edad geriátrica, con un promedio de 1 en 1000 (1). En Colombia, en un estudio realizado en pacientes hospitalizados en servicios de medicina interna, cirugía y ortopedia, se encontró que el 7% de ellos presentaron al menos un episodio de trombosis venosa (2).
Las trombofilias se pueden clasificar como heredadas y adquiridas de acuerdo con la naturaleza de su causa. Entre las trombofilias heredadas están el factor V (FV) Leiden, la protrombina G20210A, la metilenetetrahidrofolato reductasa C677T, las deficiencias de los anticoagulantes naturales antitrombina III (AT-III), proteína C (PC) y proteína S (PS), las disfibrinogenemias y la homocistinuria. En el grupo de las trombofilias adquiridas se encuentran el síndrome antifosfolípido, la resistencia a la proteína C activada (PCa) sin alteraciones en el gen del factor V y la hiperhomocisteinemia leve o moderada.
RESISTENCIA A LA PROTEÍNA C ACTIVADA Y FACTOR V LEIDEN
LA PROTEÍNA C DE LA COAGULACIÓN ES UNA GLICOPROTEÍNA dependiente de vitamina K, sintetizada en el hígado, con una potente actividad anticoagulante. La PC debe ser activada por la trombina para convertirse en Pca; esta activación es más eficiente en presencia de trombomodulina y requiere la PS como cofactor no enzimático. Durante la hemostasia normal la PCa hidroliza el factor V activado (FVa) y el factor VIII activado, lo que lleva a la inactivación de éstos (3).
Por su parte, el FV de la coagulación es una molécula glicoproteica, sintetizada principalmente en el hígado, pero que también se encuentra en plaquetas, monocitos y células epiteliales; al convertirse en FVa, participa en la activación de la protrombina, haciendo parte del complejo protrombinasa (3).
El fenómeno de resistencia a la PCa fue descubierto en 1993 por Dahlbäck y col. (4), quienes identificaron una familia con historia de trombosis venosa. El análisis de los pacientes se realizó mediante un tiempo de tromboplastina parcial activada (TTPa) modificado, y encontraron que, a diferencia del aumento normal en el TTPa que ocurre al adicionar PCa, en estos pacientes no se presentó variación. Esto hizo pensar a los investigadores en una deficiencia congénita de un cofactor de la PCa, desconocido hasta ese momento.
En 1994, Bertina y cols. (5) descubrieron que más del 80% de los casos de resistencia a la PCa se debe a una sustitución del nucleótido guanina (G) por la adenina (A) en la posición 1691 del gen del FV; como consecuencia, la proteína del FV sufre un cambio del aminoácido arginina (R) por glutamina (Q) en la posición 506. Por lo anterior, esta mutación puede denominarse FV G1691A o FV R506Q, aunque comúnmente es llamado FV Leiden en honor a la ciudad de Leiden (Holanda) donde se la descubrió.
Normalmente el FVa se inactiva mediante un corte en la posición arg506, seguido de un segundo corte en la posición arg306. En el caso de la mutación FV Leiden, sólo existe hidrólisis en la posición arg306, lo que conduce a que el corte realizado por la PCa sea 10 veces más lento (resistencia a la PCa), con la consiguiente mayor permanencia del FV en la circulación (5).
El FV Leiden es la anormalidad molecular más comúnmente diagnosticada en el laboratorio a los pacientes con trombosis venosa (6), con una prevalencia de 3% en la población general, 20% en pacientes consecutivos y 45% en pacientes con historia familiar de trombosis (7).
Otras alteraciones del FV que afectan el proceso normal de inactivación por la PCa son:
- FV Cambridge: se da cuando la proteína del FV sufre un cambio de arginina a treonina en el residuo 306; se produce una alteración en el segundo punto de corte por parte de la PCa, lo que da también como resultado la resistencia a la PCa (8).
- FV Hong Kong: se produce por un cambio de arginina a glicina en la posición 306 de la cadena proteica del FV; esta alteración se encuentra primordialmente en la población asiática, pero a diferencia del anterior, no se asocia a resistencia a la PCa (9).
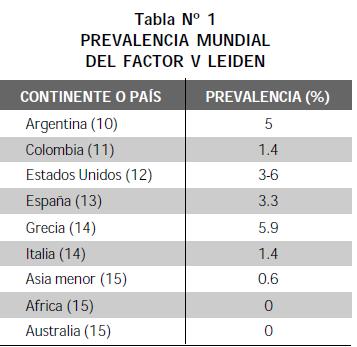
La predisposición genética a trombosis dada por el FV Leiden se ha estudiado en múltiples países, observándose una prevalencia muy variada (10- 15) (Tabla N° 1).
Protrombina G20210A
LA PROTROMBINA O FACTOR II DE LA COAGULACIÓN es una proteína dependiente de vitamina K. Durante la coagulación la protrombina es transformada a trombina por el complejo protrombinasa (FXa, FVa, Ca2+ y fosfolípidos de membrana), para continuar el proceso normal de la coagulación que lleva a la formación de fibrina (3).
En 1996 Poort y cols. (16) analizaron el gen de la protrombina como uno de los posibles genes candidatos responsables de aumentar el riesgo de trombosis venosa; luego de varios estudios encontraron una alteración en el gen de la protrombina que produce un aumento en el riesgo de trombosis, debido a un cambio de G por A en la posición 20210 del gen de la protrombina. La manifestación fenotípica de esta mutación es un aumento del 25% en la concentración de protrombina en el plasma. Esta alteración fue observada en el 18% de los pacientes con historia familiar de trombosis venosa, en un 6.2% de los pacientes con un primer episodio de trombosis venosa profunda y en un 2.3% de las personas del grupo control.
Hiperhomocisteinemia y metilentetrahidrofolato reductasa C677T
LA HIPERHOMOCISTEINEMIA LEVE O MODERADA, como factor de riesgo para tromboembolismo venoso, puede ser atribuible a defectos genéticos o a condiciones adquiridas (17). Los defectos genéticos llevan a una disminución, alrededor del 50%, en la actividad de la cistationina-β-sintasa y la metilentetrahidrofolato reductasa (MTHFR), enzimas encargadas del metabolismo de la homocisteína (aminoácido resultante del metabolismo de la metionina). Otro defecto consiste en una variante termolábil de la MTHFR, que tiene una mutación puntual producida por un cambio del nucleótido citosina (C) por timina (T), en la posición 677 del gen de la proteína, denominada MTHFR C677T. Esta mutación tiene una amplia distribución mundial, relacionada principalmente con hiperhomocisteinemia leve (17).
Entre las condiciones adquiridas de hiperhomocisteinemia se pueden citar las deficiencias de cofactores en el metabolismo de la homocisteína (ácido fólico, cobalamina y piridoxina) y la falla renal crónica (17).
Los estudios de casos-controles y corte transversal muestran una asociación claramente establecida entre trombosis arterial y venosa, y los niveles de homocisteína en sangre, leve o moderadamente elevados; por el contrario, los estudios prospectivos de cohorte muestran resultados que no son concluyentes. Además, se encuentran resultados contradictorios cuando se compara el aumento en la prevalencia homocigótica de MTHFR C677T en pacientes con trombosis venosa y personas sanas; se encuentra un aumento en el riesgo tromboembólico en algunos estudios (18, 19), en tanto que en otros hay evidencia en contra de la asociación (20). Es necesario realizar estudios aleatorizados, doble ciego y controlados con placebo, para despejar las dudas acerca de la relación causaefecto entre la hiperhomocisteinemia y la trombosis, y el impacto en la disminución en los niveles de homocisteína en los eventos circulatorios alterados.
Deficiencias de antitrombina III, proteína C y proteína S
EXISTEN OTRAS CAUSAS MENOS COMUNES DE DIÁTESIS trombótica, como son las deficiencias de los anticoagulantes naturales del sistema de coagulación: AT-III, PC y PS. La deficiencia de AT-III es la más trombogénica de todas las trombofilias heredadas y el 50% de las personas afectadas presentan trombosis venosa a lo largo de su vida (21).
La deficiencia de la PC se encuentra en el 0.8% de la población general, en el 3.1% de los pacientes consecutivos con trombosis venosa y en el 5.7% de los pacientes con historia familiar. Por su parte, la prevalencia de la deficiencia de la PS es de 1.3% en la población general, comparada con pacientes consecutivos y pacientes seleccionados de trombosis venosa, en quienes es de 1.1 y 5.7%, respectivamente (7).
Disfibrinogenemias y homocistinuria
LAS DISFIBRINOGENEMIAS Y LA HOMOCISTINURIA son causas muy raras de trombosis. En el mundo se han reportado más de 50 mutaciones en el gen del fibrinógeno, que se asocian en algunas ocasiones con complicaciones trombóticas, como por ejemplo, los fibrinógenos Dusart y Chapel Hill III (22).
Los pacientes con homocistinuria clásica presentan hiperhomocisteinemia severa, causada en la mayoría de los casos por mutaciones en el gen de la cistationina-β-sintasa, lo que lleva a que el 50% de ellos presenten trombosis arterial o venosa antes de los 29 años (23).
ASOCIACIÓN ENTRE TROMBOFILIAS HEREDADAS Y PÉRDIDA GESTACIONAL
LA PÉRDIDA GESTACIONAL es una alteración que afecta del 12% al 15% de las parejas en edad reproductiva, y es recurrente en el 1% al 2% de ellas (24), lo que se denomina pérdida gestacional recurrente (PGR). Las trombofilias heredadas y adquiridas son una de las causas aceptadas de PGR.
Los eventos trombóticos en la interfase maternofetal se han asociado a la fisiopatología de la PGR. En un estudio de Dizon-Townson y col. (25), en pacientes con complicaciones obstétricas, se encontró que un 42% de las placentas positivas para FV Leiden tenía infartos mayores del 10%.
Brenner y cols. (26), estudiaron mujeres con PGR sin causa aparente, y encontraron que el 49% tenían al menos una de las tres trombofilias heredadas más comunes en individuos caucásicos: FV Leiden, protrombina G20210A o MTHFR C677T. En el grupo control la frecuencia de estas trombofilias fue de 24% (p<0.01). Además, otro estudio realizado por Brenner (27), en 76 pacientes con PGR, muestra que el 8% tenían combinación de mutaciones y sólo 0.9% de los controles; el estudio EPCOT (European Prospective Cohort on Thrombophilia) calculó entre los grupos de individuos mencionados, una razón de disparidad (RD) de 14.3 (28).
Factor V Leiden
VARIOS ESTUDIOS EN MUJERES CON PGR asociada a trombofilia y sus respectivos controles, muestran asociación entre PGR y FV Leiden. En el de Grandone y cols. (29), el grupo de pacientes tenía una frecuencia de 16% comparada con 4% en el grupo control (RD 4.4); en el de Brenner y cols. (26), 32% y 10%, respectivamente para los mismos grupos (RD 4.0), y en el de Ridker y cols. (30), reportaron 8% en pacientes y 3.7% en controles (RD 2.3).
Es importante resaltar entre todas las trombofilias heredadas, al FV Leiden como el de mayor frecuencia e importancia en lo que a pérdidas gestacionales se refiere (27).
Protrombina G20210A
LA MUTACIÓN DE LA PROTROMBINA se evaluó recientemente en varios estudios que compararon mujeres con PGR y un grupo control: Foka y cols. (31) en 80 pacientes y 100 controles, encontraron una prevalencia de 9% y 2% respectivamente (RD 4.6, p=0.038). Por su parte, Deitcher y cols. (32) no encontraron asociación estadísticamente significativa al estudiar 50 pacientes con PGR del primer trimestre y observar la mutación sólo en una paciente, 2% (RD 2.2, p=0.23). Brenner (26) encontró 7.2% de pacientes y 3.2% de los controles con la mutación (riesgo relativo 1.95, p=0.22). A pesar de estos resultados contradictorios en la asociación de PGR con protrombina G20210A, la situación cambia cuando se asocia la mutación de la protrombina con el FV Leiden, donde se cuadruplica el riesgo de PGR (RD 4.6, p=0.001) (27).
Metilentetrahidrofolato Reductasa C677T
LAS MUJERES GESTANTES NORMALES tienen niveles plasmáticos más bajos de homocisteína que las no embarazadas; sin embargo, cuando coexisten deficiencias de los cofactores necesarios para el metabolismo de este aminoácido (especialmente el ácido fólico) y la mutación MTHFR C677T, se puede presentar hiperhomocisteinemia leve o moderada (17).
A pesar de los hallazgos mencionados, varios estudios han fracasado en el intento de asociar la condición de homocigocidad para la variante termolábil de la MTHFR con PGR, pero en otros se muestra evidencia de una posible asociación (27).
RECOMENDACIONES DIAGNÓSTICAS EN PACIENTES CON PÉRDIDAS GESTACIONALES Y TROMBOFILIAS
EL SEXTO CONSENSO DE LA ACCP (33) (American College of Chest Physicians) propone las siguientes conductas:
- Detección de anticuerpos antifosfolípidos a todas las mujeres con más de 3 abortos sin causa evidente.
- Búsqueda de trombofilias heredadas si alguna de las tres pérdidas gestacionales ocurrió en el segundo trimestre o si existen antecedentes de complicaciones obstétricas (preeclampsia recurrente o severa, restricción del crecimiento intrauterino, abruptio o muerte intrauterina de causa desconocida).
Al precisar cuáles de las trombofilias heredadas deben ser evaluadas paraclínicamente, no existen recomendaciones claras y definitivas. Sin embargo, en vista de la importante prevalencia de la resistencia a la PCa y de FV Leiden en pacientes con PGR (34), recomendaríamos iniciar el estudio con éstas.
En Medellín, lo más aconsejable es esperar investigaciones autóctonas que relacionen PGR y trombofilias; sin embargo, los resultados preliminares de prevalencia del FV Leiden en población general y en pacientes con tromboembolismo venoso o accidente cerebrovascular en Colombia, 1.44% y 23%, respectivamente (2,11) dan pie para buscar FV Leiden y resistencia a la proteína C activada, en mujeres con pérdidas gestacionales. Las otras causas de trombofilias heredadas y adquiridas se deberían buscar sólo en casos seleccionados. Cabe mencionar que en la actualidad, en el Programa de Reproducción de la Universidad de Antioquia, se encuentra en curso un estudio para buscar la asociación entre PGR y trombofilias heredadas en nuestro medio.
POSIBILIDADES TERAPÉUTICAS Y PROFILÁCTICAS
EXISTEN ENFERMEDADES QUE AUMENTAN de manera significativa el riesgo de tener PGR; por esta razón se tendrán en cuenta entre las recomendaciones sobre tratamiento farmacológico. Entre ellas se destacan las complicaciones vasculares de la gestación como preeclampsia, restricción del crecimiento intrauterino y abruptio de placenta.
Existen múltiples alternativas para el tratamiento y la profilaxis de la PGR, que van desde aspirina hasta concentrados de AT-III, pasando por las heparinas (no fraccionadas y de bajo peso molecular). Las heparinas de bajo peso molecular muestran resultados muy favorables, al incrementar el porcentaje de nacidos vivos en mujeres con trombofilias heredadas, del 20% (sin tratamiento) al 75% (con 40 mg de enoxaparina una vez al día) (26).
En los casos de hiperhomocisteinemia se recomienda la administración de ácido fólico (1 mg una vez al día) durante el embarazo; sin embargo, no existe evidencia de que con la disminución de los niveles de homocisteína disminuya el riesgo de PGR.
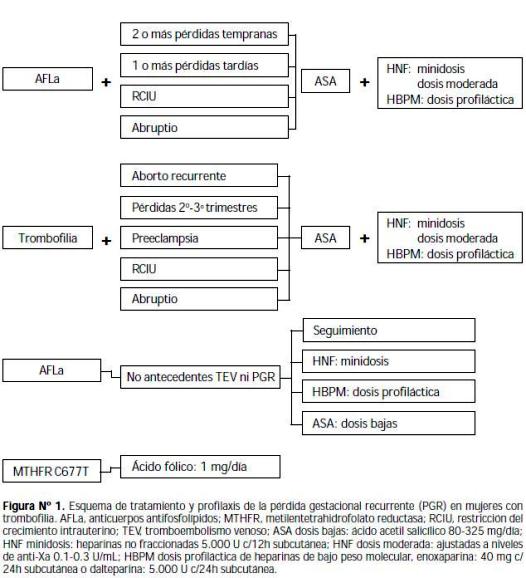
Las recomendaciones del Sexto Consenso del ACCP en lo referente a PGR y trombofilia, se encuentran en la figura N° 1.
BIBLIOGRAFÍA
1. ROSENDAAL FR. Thrombosis in the young: epidemiology and risk factors. a focus on venous thrombosis. Thromb Haemost 1997; 78: 1-6. [ Links ]
2. DENNIS R, ARBOLEDA MN, RODRÍGUEZ MN, SALAZAR MS, POSADA PS. Estudio nacional sobre tromboembolismo venoso en población hospitalaria en Colombia: diferencias entre ciudades y especialidades. Acta Med Col 1996; 21: 55-63. [ Links ]
3. MANN KG. Biochemistry and physiology of blood coagulation. Thromb Haemost 1999; 82: 165-174. [ Links ]
4. DÄHLBACK B, CARLSSON M, SVENSSON PJ. Familial thrombophilia due to a previously unrecognized mechanism characterized by poor anticoagulant response to activated protein C: prediction of a cofactor to activated protein C. Proc Natl Acad Sci USA 1993; 90: 1.004-1.008. [ Links ]
5. BERTINA RM, KOELEMAN BP, KOSTER T, ROSENDAAL FR, DIRVEN RJ, DE RONDE H, et al. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 1994; 369: 14-15. [ Links ]
6. TORRES JD. Resistencia a la proteína C activada: una nueva causa de trombofilia. IATREIA 1997; 10: 114- 119. [ Links ]
7. BERTINA RM. Genetic approach to thrombophilia. Thromb Haemost 2001; 86: 92-103. [ Links ]
8. FRANCO RF, ELION J, TAVELLA MH, SANTOS SE, ZAGO MA. The prevalence of factor V Arg306—Thr (factor V Cambridge) and factor V Arg306—>Gly mutations in different human populations. Thromb Haemost 1999; 81: 312-313. [ Links ]
9. HIYOSHI M, HASHIMOTO S, TAGAWA S, ARNUTTI P, PRAYOONWIWAT W, TATSUMI N. A Thai patient with the mutation of Arg306 of FV gene identical to the Hong Kong but not to the Cambridge type. Thromb Haemost 1999; 82: 1.553-1.554. [ Links ]
10. HERRMANN FH, KOESLING M, SCHRODER W, ALTMAN R, JIMÉNEZ BONILLA R, LOPACIUK S, et al. Prevalence of factor V Leiden mutation in various populations. Genet Epidemiol 1997; 14: 403-411. [ Links ]
11. VARELA A, BILBAO M, GARCÍA CF, DUARTE M, ZERDA R, SALAZAR M, et al. Prevalencia de la mutación del factor V de la coagulación (factor V Leiden) en donantes de banco de sangre en cuatro ciudades colombianas. Acta Med Col 2000; 25: 2-5. [ Links ]
12. RIDKER PM, HENNEKENS CH, LINDPAINTNER K, STAMPFER MJ, EISENBERG PR, MILETICH JP. Mutation in the gene coding for coagulation factor V and the risk of myocardial infarction, stroke, and venous thrombosis in apparently healthy men. N Engl J Med 1995; 332: 912-917. [ Links ]
13. GARCÍA-GALA JM, ALVAREZ V, PINTO CR, SOTO I, URGELLES MF, MENÉNDEZ MJ, et al. Factor V Leiden (R506Q) and risk of venous thromboembolism: a case-control study based on the Spanish population. Clin Genet 1997; 52: 206-210. [ Links ]