Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.15 no.4 Medellín Oct./Dec. 2002
INVESTIGACIÓN ORIGINAL
Leucemia linfoide aguda: estudio citogenético en niños atendidos en el Hospital Universitario San Vicente de Paúl de Medellín en el período 1998-2001
GONZALO VÁSQUEZ PALACIO*; JOSÉ LUIS RAMÍREZ CASTRO**; ÁLVARO POSADA DÍAZ***; MARGARITA SIERRA****; OLGA L. BOTERO*****; NORA E. DURANGO******; CLAUDIA M. CRISTANCHO*******; JUAN C. HERRERA********; JUAN G. TABARES*********
* BIÓLOGO, Especialista en citogenética, Profesor Asistente, Unidad de Genética Médica, Facultad de Medicina, Universidad de Antioquia.
** DOCTOR, Profesor titular, Unidad de Genética Médica, Facultad de Medicina, Universidad de Antioquia
*** DOCTOR, Profesor titular, Departamento de Pediatría, Hospital Universitario San Vicente de Paúl
**** DOCTORA, Pediatra Oncóloga, Hospital Universitario San Vicente de Paúl
***** Bióloga, Unidad de Genética Médica, Facultad de Medicina, Universidad de Antioquia
****** Bacterióloga, Unidad de Genética Médica, Facultad de Medicina, Universidad de Antioquia
******* Bacterióloga, Unidad de Genética Médica, Facultad de Medicina, Universidad de Antioquia
******** Bacteriólogo, Unidad de Genética Médica, Facultad de Medicina, Universidad de Antioquia
********* Estudiante de Medicina, Universidad de Antioquia, Medellín, Colombia.
Proyecto financiado por la Universidad de Antioquia, CODI- CIM 9914
LAS INVESTIGACIONES CITOGENÉTICAS en Leucemia Linfoblástica Aguda (LLA) permiten identificar alteraciones recurrentes específicas en los cromosomas y correlacionarlas con la información biológica. Además, contribuyen a la comprensión de los mecanismos de leucogénesis, como factores pronósticos independientes, y aportan bases para futuras investigaciones terapéuticas.
Se analizaron las alteraciones cromosómicas adquiridas en la médula ósea de 44 niños (entre un mes y 14 años) con LLA, diagnosticada clínica e histopatológicamente entre 1998 y 2001 en la Unidad de Hematología Infantil, Hospital San Vicente de Paúl, de Medellín, y cuyas muestras de médula ósea fueron procesadas y analizadas en la Unidad de Genética Médica, de la Facultad de Medicina de la Universidad de Antioquia.
El estudio reveló que 17 pacientes (41,5%) presentaban cariotipo normal y 24 (58,5%) lo tenían anormal. De estos últimos 18 (75%) tenían un mosaicismo cromosómico, 4 (16,7%) exhibían cariotipos hiperdiploides y 2 (8.3%) presentaban otras alteraciones cromosómicas. No se encontraron asociaciones significativas entre los tipos de leucemia (L1,L2,L3) y el cariotipo.
PALABRAS CLAVE
LEUCEMIA LINFOIDE AGUDA EN NIÑOS, CITOGENÉTICA
INTRODUCCIÓN
LA LEUCEMIA LINFOIDE AGUDA (LLA) se caracteriza por la acumulación de células linfoides malignas linfoides en la médula ósea y en muchos casos en la sangre periférica. Es una enfermedad heterogénea desde los puntos de vista morfológico, citogenético, de análisis de marcadores de superficie celular, de sondas génicas y en sus aspectos clínicos. Es la más común de las neoplasias de los niños y su frecuencia es mayor entre los 3 y 5 años. Además, es más frecuente en niños que en adultos y predominante en hombres. Su incidencia anual es de 3 por 100.000 niños (1,2).
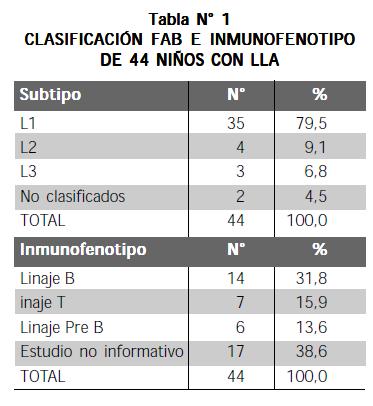
En la actualidad, la clasificación de las leucemias linfoides agudas se hace con base en los criterios establecidos por la Asociación Franco-Americana- Británica (FAB) (3), la cual describe tres subtipos morfológicos: L1, L2 y L3. En este trabajo se usa dicha clasificación.
Aproximadamente el 85% de los niños con LLA tienen linfoblastos con morfología L1 y menos del 15%, linfoblastos L2. Los linfoblastos L3 son idénticos a las células del linfoma de Burkitt y generalmente se asocian con alteraciones del cariotipo (4). Se estima que hasta en el 60% de las leucemias agudas hay alguna alteración cromosómica, principalmente translocaciones, inversiones, deleciones, monosomías o trisomías (5).
Las alteraciones cromosómicas que ocurren en las células malignas de la médula ósea en pacientes con LLA tienen relación con la biología de la enfermedad y pueden indicar la ubicación de genes implicados en la leucogénesis. Tales alteraciones definen subgrupos de pacientes, son importantes para el pronóstico y deben tenerse en cuenta en la selección de la terapia. La identificación exacta de los cambios citogenéticos y genéticos en las células malignas tiene un papel fundamental en el diagnóstico y tratamiento del paciente (6).
Las diferentes alteraciones citogenéticas observadas en niños con LLA proporcionan valiosa información pronóstica. Por ejemplo, las hiperdiploidías se asocian con pronóstico favorable, mientras que la translocación t (9,22) (q34;q11) y las hipodiploidías confieren un pronóstico desfavorable. Se ha observado que cuando se estratifican los pacientes leucémicos según el cariotipo y con esta información se establece el tratamiento, mejora significativamente la supervivencia (7,8).
El objetivo del presente estudio fue analizar la asociación entre el tipo de LLA, y la dotación cromosómica (cariotipo) de las células malignas. Además, establecer las frecuencias de alteraciones cromosómicas y las características inmunofenotípicas.
MATERIALES Y MÉTODOS
EL ESTUDIO INCLUYÓ 44 PACIENTES, 16 niños y 28 niñas con edades de 1 mes a 14 años, atendidos en la consulta de Oncohematología pediátrica del Hospital Universitario San Vicente de Paúl, de Medellín; a estos pacientes se les hizo diagnóstico clínico de LLA. Las LLA se clasificaron de la siguiente forma con base en el número modal de cromosomas: diploidía 46; hipohaploidía memor de 23; hiperhaploidía 24-34; hipodiploidía 35-45; hiperdiploidía 47-57; hipotriploidía 58-68; hipertriploidía 70-80; hipotetraploidía 81-91; hipertetraploidía 93-103. Además, las aneuploidías (2n±1), los mosaicismos (dos líneas celulares) y las alteraciones estructurales (translocaciones).
Para confirmar el diagnóstico se tuvieron en cuenta los siguientes criterios: tamaño celular, forma del núcleo, número y prominencia del nucléolo, cantidad relativa y apariencia del citoplasma. La coloración histoquímica se realizó con Negro Sudán B o mieloperoxidasa. Para su clasificación se tuvieron en cuenta los criterios FAB.
Análisis citogenético
Previo consentimiento informado, se obtuvieron las muestras de médula ósea (MO) para evaluación citogenética antes de iniciar el tratamiento. El procedimiento se hizo aspirando de 1 a 3 mL de MO con jeringa estéril heparinizada y la muestra se envió inmediatamente al Laboratorio de Genética Médica de la Facultad de Medicina de la Universidad de Antioquia, donde se procedió a hacer cultivos directos a las 24 y 48 horas sin estimulación con mitógeno, empleando medio HAN F-12, suero bovino fetal 20%, Origen® 5% y antibióticos (gentamicina, anfotericina B).
Los cultivos se incubaron a 37° C en una atmósfera de CO2 al 5% y se procesaron de la siguiente manera: 5 horas antes de la cosecha se agregó bromodeoxiuridina (200 µg/mL); hora y media antes se adicionó bromuro de etidio (100 µg/mL). Luego se añadió Colcemid® (0,1 µg/mL) durante diez minutos. Después de centrifugar se descartó el sobrenadante, se adicionó solución hipotónica (KCL 0,75M), se resuspendió y se incubó a 37° C por 15 minutos. Se hizo fijación previa con solución de Carnoy (metanol 3 vol: ácido acético 1 vol); se resuspendió, centrifugó y luego se descartó el sobrenadante.
El análisis se efectuó con la técnica de bandas BRG (9,10); para cada muestra, cuando fue posible, se analizaron 20 metafases con bandeo. Se analizó un mínimo de 10 células metafásicas antes de informar un cariotipo como normal. Para cada clon o célula anormal se hizo el ordenamiento de los cromosomas (cariotipo) de por lo menos 2 metafases. La designación de un clon como anormal se hizo cuando 2 o más células metafásicas tenían una alteración estructural o un cromosoma extra del par de homólogos o tres o más metafases con la pérdida de un mismo cromosoma. Las alteraciones cromosómicas se describen con base en el sistema ISCN (11).
Para el análisis estadístico se emplearon los programas Statistica 5® y Excel 2000®. El análisis univariado se hizo por medio de la prueba X2. Las comparaciones estadísticas de asociación se consideraron significativas si p ≤ 0.5.
RESULTADOS
EL GRUPO ESTUDIADO LO FORMARON 16 NIÑOS (36,4%) y 28 niñas (63,6%) con edades entre 1 mes y 14 años (mediana 4.33 años); desde el punto de vista de la clasificación FAB y del inmunofenotipo se halló lo siguiente (Tabla N° 1).
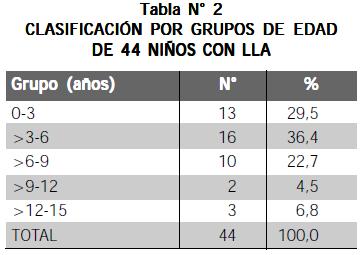
Por grupos de edad se halló la siguiente distribución (Tabla N° 2)
En cuanto al cariotipo, sólo se obtuvieron resultados en 41 de los 44 pacientes; en ellos hubo 17 normales (41,5%) y 24 anormales (58,5%). De los anormales, 18 (75,0%) tenían mosaicismo cromosómico; 4 (16,7%), cariotipos hiperdiploides y 2 (8,3%), otras alteraciones cromosómicas.
El análisis de la asociación entre el tipo de LLA y la dotación cromosómica (cariotipo) no reveló diferencias significativas.
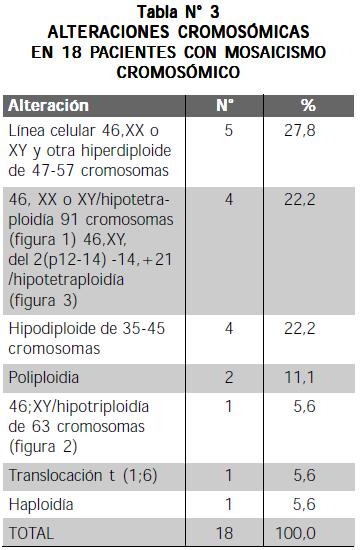
En la tabla N° 3 se detallan las alteraciones de los 18 pacientes con mosaicismo cromosómico.
Entre las alteraciones cromosómicas llaman la atención 46,XY,del(2),-14,+21; 46,XY/46,XY, t(1;6); 46,XX/45, XY,-15 y 46,XX/45,XX,-21. Puede notarse que solamente una ocurrió en forma independiente y las tres restantes en forma de clon. Las anteriores alteraciones clonales y la trisomía 21 son comunes en niños con LLA; la constitución 46,XX,del (2),-14,+21 es más rara.
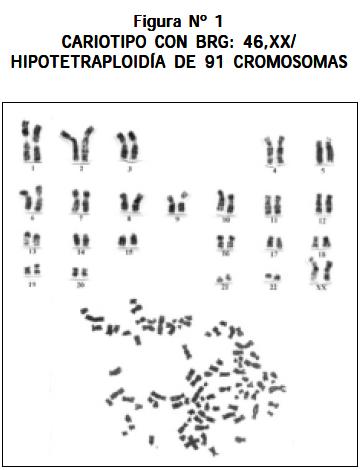
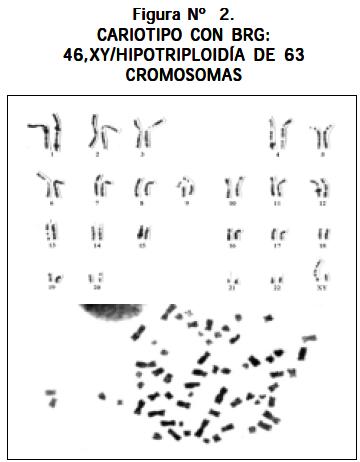
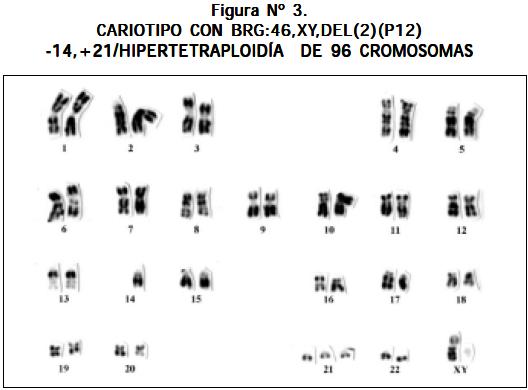
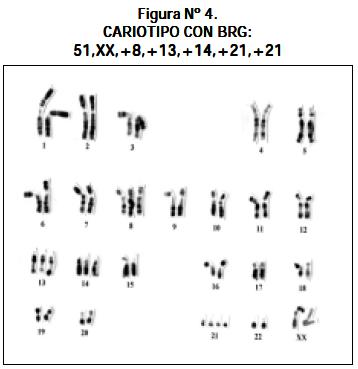
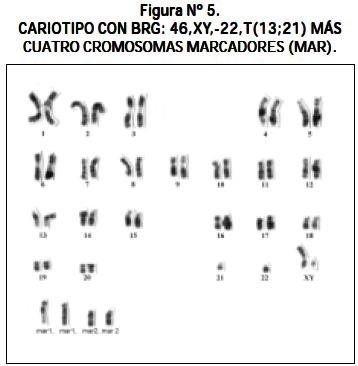
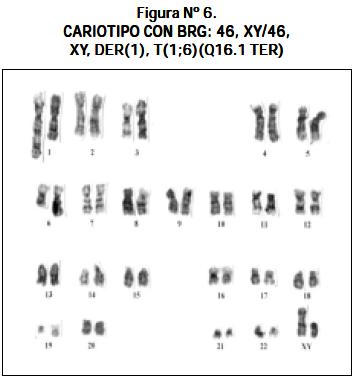
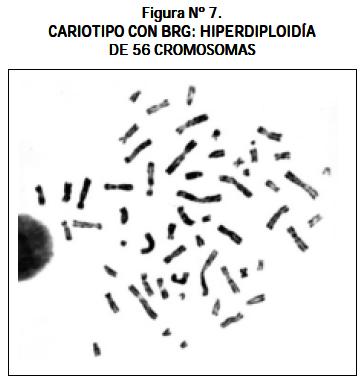
Otros cariotipos que se observaron fueron los siguientes: un paciente con LLA y síndrome de Down 47,XY,+21; un paciente 51,XX,+8,+13,+14,+21,+21 (véase Figura Nº 4); un paciente 46,XY,- 22,t(13;21)+mar1x2,+mar2x2 más cuatro cromosomas marcadores (véase Figura Nº 5); un paciente 46,XY/46,XY,t(1;6)(q16.1ter) (véase Figura Nº 6) y un paciente con hiperdiploidía de 56 cromosomas (véase Figura Nº 7).
Las frecuencias de alteraciones citogenéticas obtenidas en el estudio se comparan en la tabla N°4 con las de pacientes con LLA T informadas en otros estudios. Puede observarse en todos estos informes una variabilidad similar de alteraciones cromosómicas.
DISCUSIÓN
EN LA LITERATURA MUNDIAL se han informado numerosos estudios citogenéticos en niños con LLA (13); en Colombia hay pocos informes al respecto (14).
Esta investigación muestra que la mayoría de los niños con LLA tenían cariotipo anormal. Sólo un paciente (2,3%) mostró trisomía constitucional con características clínicas del síndrome de Down. Dastugue y colaboradores (18) encontraron en un estudio de 49 niños con LLA, 3 con alteraciones constitucionales del cariotipo y 2 con síndrome de Down.
En nuestro estudio se observó gran variabilidad de alteraciones cromosómicas adquiridas. Entre los hallazgos más sobresalientes se encuentran los cariotipos anormales en 24 pacientes (58.5%) lo que coincide con lo informado por otros autores (12-14) en estudios similares, quienes hallan el porcentaje de cariotipos anormales entre 53-58%.
Según lo consultado, las hiperdiploidías mayores de 50 cromosomas son las alteraciones más frecuentes del cariotipo específico de la LLA; tales alteraciones se identificaron en el 20% de los niños estudiados por Petrovic y colaboradores (19), en 16.3% de los de Dastugue y colaboradores (18), en 15.9% de los de Tien y colaboradores (20) y en 21,7% de los de Pui y colaboradores (21), mientras que solamente se hallaron en un 5,4% en el estudio de Chan y colaboradores (22).
Además, las investigaciones indican que niños con edades entre 1-10 años y LLA presentan un porcentaje entre 64-68% de células B (16,17). En esta investigación se observó un porcentaje del 45%, valor inferior al anterior, lo que podría deberse a una sobrestimación por el número reducido de individuos y por no contar con datos de clasificación de 17 pacientes.
En esta investigación la frecuencia de hiperdiploidias fue de 27,8% entre 18 pacientes con mosaicismo, valor semejante al 21,7% informado por Pui y colaboradores (21). En Colombia, en un estudio de Guevara y colaboradores (14) en 191 casos de niños con LLA se halló un 17% de hiperdiploidías.
No se observó asociación entre el subtipo morfológico L1 y el mayor número de hiperdiploidías 13 (29,5%).
Numerosos autores han propuesto que las alteraciones citogenéticas son uno de los factores independientes de riesgo más importantes en la sobrevida de pacientes con LLA. En nuestro grupo, dos años después del diagnóstico y luego de recibir tratamiento según el tipo de leucemia, 28 pacientes aún están vivos (63,6%) y 16 (36.4%) han fallecido. Es de anotar que todos los pacientes recibieron tratamiento, aunque en muchos casos éste no se hizo en forma continua según los protocolos establecidos, debido a que los pacientes no se presentaban en la fecha indicada para la terapia, aduciendo dificultades con los trámites exigidos por instituciones prestadoras de salud. Por esta situación no se pudieron establecer criterios de asociación entre el tipo de leucemia, la alteración citogenética y la sobrevida.
CONCLUSIONES
EN ESTE ESTUDIO NO SE ENCONTRÓ ASOCIACIÓN entre el tipo de leucemia L1 y las alteraciones cromosómicas totales o específicas.
Se confirmó la alta variabilidad de las alteraciones cromosómicas (clones anormales, ploidías, translocaciones), lo que indica la importancia del análisis citogenético de los pacientes con LLA con el fin de conocer sus condiciones iniciales, monitorizar la posible remisión, detectar las recaídas, precisar el diagnóstico y dar información pronóstica.
Los estudios citogenéticos de pacientes con LLA brindan información útil para dilucidar el papel de ciertas alteraciones cromosómicas raras en la causa y desarrollo de esta enfermedad; además, sirven de base a los estudios necesarios para comprender los mecanismos moleculares de la leucogénesis y permiten el seguimiento de nuevos enfoques terapéuticos, tales como el uso del Glivec(r) en pacientes con leucemia mieloide crónica (LMC); con esta investigación se inició la línea en citogenética de enfermedades hematológicas, especialmente LLA, LMC, trastornos mielodisplásicos y anemia de Fanconi. Se espera poder ofrecer estos estudios a pacientes remitidos de diferentes entidades de salud del departamento, y convertir la Unidad de Genética Médica en un centro de referencia para el estudio de dichas enfermedades.
AGRADECIMIENTOS
A los pacientes por su colaboración en esta investigación, al Departamento de Pediatría, Unidad de Hematología, Hospital Universitario San Vicente de Paúl, Medellín, Colombia.
BIBLIOGRAFÍA
1. TRIGG ME, GAYNON PS, UCKUN FM. Acute Lymphoblastic Leukemia in Children. En: HOLLAND JF, BAST RC, MORTON DL, FREI E, KUFE DW, WEICHSEBAUM RR, eds. Cancer Medicine, 4ª ed. Baltimore: Williams & Wilkins; 1996: 2.945-2.948. [ Links ]
2. HEIM S, MITELMAN F. Cancer Cytogenetics, 2ª ed. New York: Wiley-Liss; 1995; p. 181. [ Links ]
3. BENNETT JM, CATOVSKY D, DANIEL MT, FLANDRIN G, GALTON DA, GRALNICK HR, SULTAN C. Proposals for the classification of the acute leukaemias. French- American-British (FAB) Cooperative Group. Br J Haematol 1976; 33: 451-458. [ Links ]
4. MAHONEY DH. Acute lymphoblastic leukemia. En: McMILLAN JA, DeANGELIS CD, FEIGIN RD, WARSHAW JB, eds. Oski's Pediatrics. Principles and Practice, 3ª ed. Philadelphia: Lippincott Williams & Wilkins; 1999; 1.493-1.501. [ Links ]
5. BUENDÍA M, TERSELICH G, LOZANO JM, VIZCAÍNO MP. Acute lymphoblastic leukemia in children: Nonrandomized comparison of conventional vs. intensive chemotherapy at the National Cancer Institute of Colombia. Medical and Pediatric Oncology 1997; 28: 108-116. [ Links ]
6. HARRISON CJ, MARTINEAU M, SECKER-WALKER LM. The Leukemia Research. Fund/United Kingdom Cancer Cytogenetics Group Karyotype Database in acute lymphoblastic leukaemia: a valuable resource for patient management. Br J Haematol 2001; 113: 3-10. [ Links ]
7. FORESTIER E, GUSTAFSSON G, VON HEIDEMAN A, HEIDEMAN A, HEIM S, HERNELL O, et al. Prognostic impact of bone marrow karyotype in childhood acute lymphoblastic leukaemia: Swedish experiences 1986- 91. Acta Paediatrica 1997; 86: 819-825. [ Links ]
8. UCKUN FM, NACHMAN JB, SATHER HN, SENSEL MG, KRAFT P, STEINHERZ PG, et al. Clinical significance of Philadelphia chromosome positive pediatric acute lymphoblastic leukemia in the context of contemporary intensive therapies: a report from the Children's Cancer Group. Cancer 1998; 83: 2.031-2.039. [ Links ]
9. RODRÍGUEZ J. Comunicación personal 1998. Winthrop University Hospital, 259 First Street, Mineola, Long Island, New York. [ Links ]
10. CAMARGO M, CERVENKA J. Pattern of chromosomal replication in synchronized lymphocytes. I. Evaluation and application of methotrexate block. Hum Genet 1980; 54: 47-53. [ Links ]
11. MITELMAN F, ed. ISCN (1995): An international system for human cytogenetic nomenclature. Switzerland: S Karger; 1995. [ Links ]
12. FORESTIER E, JOHANSSON B, GUSTAFSSON G, BORGSTRÖM G, KERNDRUP G, JOHANNSON J, et al. Prognostic impact of karyotypic findings in childhood acute lymphoblastic leukemia: a Nordic series comparing two treatment periods. Brit J Haematology 2000; 110: 147-153. [ Links ]
13. SCHNEIDER NR, CARROLL AJ, SHUSTER JJ, PULLEN DJ, LINK MP, BOROWITZ BM, et al. New recurring cytogenetic abnormalities and association of blast cell karyotypes with prognosis in childhood T-cell acute lymphoblastic leukemia: a Pediatric Oncology Group report of 343 cases. Blood 2000; 96: 2.543-2.549. [ Links ]
14. GUEVARA GP, MEDINA VV, FLÓREZ AL, MARTÍN NN, FRAILE HS. Valor diagnóstico y pronóstico de las alteraciones cromosómicas: análisis de 479 casos. Revista Colombiana de Cancerología 1998; 1: 22-38. [ Links ]
15. ROWLEY JD, RESHMI S, CARLSON K, ROULSTON D. Spectral karyoptype analysis of T-cell acute leukemia. Blood 1999; 93: 2.038-2.042. [ Links ]
16. DEVITA VT, HELLMAN S, ROSENBERG SA. Cancer Principles & Practice of Oncology. 5th ed. Philadelphia: Lippincott-Raven; 1997. [ Links ]
17. MCMILLAN JA, DEANGELIS CD, FEIGIN RD, WARSHAW JB. Oski's Pediatrics. Principles and practice, 3th ed. Lippincott Williams & Wilkins. 1999. [ Links ]
18. DASTUGUE N, ROBERT A, PAYEN C, CLEMENT D, KESSOUS A, DEMUR C, et al. Prognostic significance of karyotype in a 12 year follow-up in childhood acute lymphoblastic leukemia. Cancer Genet Cytogenet 1992; 64: 49-55. [ Links ]
19. PETROVIC I, JOSIP K, NAKIC M, KASTELAN M. Cytogenetic, cytomorphologic and immunologic analysis in 55 children with acute lymphoblastic leukemia. Cancer Genet Cytogenet 1996; 88: 57-65. [ Links ]
20. TIEN HF, WANG CH, LEE FY, LIU MC, CHUAG SM, SHEN YC, et al. Cytogenetic study of acute lymphoblatic leukemia and its correlation whit immunophenotype and genotype. Cancer Genet Cytogenet 1992; 59: 191-198. [ Links ]
21. PUI CH, WILLIAMS DL, ROBERSON PK, RAIMONDI SC, BEHM FG, LEWIS SH, et al. Correlation of karyotype and immunophenotype in childhood acute lymphoblastic leukemia. J Clin Oncol 1988; 6: 56-61. [ Links ]
22. CHAN LC, HA SY, CHIN LM, LEE CP, LAU YL, YUEN P, et al. Cytogenetics and immunophenotypes of childhood acute lymphoblatic leukemia in Hong Kong. Cancer Genet Cytogenet 1994; 76: 118-124. [ Links ]