Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Iatreia
versão impressa ISSN 0121-0793
Iatreia vol.16 no.1 Medellín jan./mar. 2003
ARTÍCULO DE REVISIÓN
Mefloquina
MEFLOQUINE
CAROLINA GIRALDO; SILVIA BLAIR
CAROLINA GIRALDO Joven investigadora, Grupo Malaria, Universidad de Antioquia.
DOCTORA SILVIA BLAIR, MD, Jefa del grupo malaria
EL PROBLEMA DE LA MALARIA EN COLOMBIA Y EN EL MUNDO es aun alarmante y creciente, debido principalmente al aumento de las resistencias del parásito a los fármacos de primera línea, ya que en este país la resistencia a la cloroquina oscila entre67%-97%, a la sulfadoxina –pirimetamina 22% y a la amodiaquina 8%-10%: lo anterior, sumado a la falta de producción de amodiaquina, ha llevado al ministerio de salud de Colombia a proponer la utilización de la mefloquina para el tratamiento de la malaria por P. falciparum no complicada. Por esta razón nosotros realizamos una revisión del fármaco en cuestión, describiendo su historia, química, mecanismo de acción, farmacocinética y farmacodinamia, usos clínicos, efectos adversos y resistencia emergente.
PALABRAS
CLAVE MALARIA, PLASMODIUM, MEFLOQUINA
SUMMARY
Malaria, both in Colombia and worldwide, is an alarming and increasing problem. This in mainly due to factors such as the escalating resistance of the parasite to first-line drugs. In this country, resistance to chloroquine fluctuates between 67%-97%, to sulfadoxine –pyrimethamine is 22% and to amodiaquine, 8%-10%. Aditioally, the lack of productions of amodiaquine. Has resulted in the proposal by the Colombia Ministry of Heal to use mafloquine for treatment of non - complicated P.falciparum malaria. Therefore, we reviewed the history, of mefloquine as well as it chemistry, mechanism of action, pharmacokinestics. Pharmacodynamics, clinical uses, adverse effects and emergent resistance.
HISTORIA
La mefloquina (lariam®) es producto del programa de investigación contra el paludismo establecido en 1963 en The Walter Reed Army Institute of Research para la obtención de nuevos fármacos para combatir cepas de P. falciparum resistentes que surgían con mayor frecuencia especialmente en África central luego de la guerra de Vietnam (1). En 1978 Scmidt y col. (2) demostraron la eficaz actividad antipalúdica del fármaco en cuestión, en modelos animales y posteriormente en seres humanos, evidenciando que se trata de un producto inocuo y eficaz contra P. falciparum multirresistente.
QUÍMICA
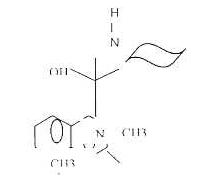
La mefloquina es una 4-aminoquinolina metanol sistémica, estructuralmente relacionada con la quinina (3). Este fármaco puede ser clasificado como un Arylaminoalcohol, similar a los alcaloides de la planta del género Cinchona (4).
El hidrocloruro de mefloquina es un polvo blanco ácido, soluble en agua al que se le ha calculado un peso molecular de 414.78 y tiene la siguiente estructura química:
MECANISMOS DE ACCIÓN
La mefloquina es un medicamento eficaz como esquizonticida sanguíneo; no posee acción contra las formas hepáticas ni contra los gametocitos maduros del P. falciparum ni tampoco contra las formas tisulares latentes del P. vivax (5).
Se desconoce el mecanismo exacto de acción de la mefloquina (5,6): se postula que los fármacos antimaláricos tipo quinolinas (cloroquina, quinina y mefloquina) interfieren con la digestión de la hemoglobina en los estadios sanguíneos del ciclo del P. falciparum. El parásito degrada la hemoglobina en una vacuola alimentaria, produciendo un grupo hem libre y especies reactivas de oxígeno de carácter tóxico; el grupo hem es neutralizado por polimerización, mientras que los radicales libres de oxígeno son detoxificados por numerosos mecanismos antioxidantes (6).
A diferencia de la cloroquina y la quinina, las cuales se acumulan en la vacuola alimentaria e interfieren con la polimerización del hem y la detoxificación de las especies reactivas de oxígeno (6), la mefloquina no inhibe la hem – polimerasa a pesar de que posee gran afinidad por el hem libre (7), aunque esta conclusión se contradice en estudios que afirman que la mefloquina puede inhibir la polimerización de la hematina in vitro (8); se ha sugerido que puede actuar al formar complejos tóxicos con el hem libre, que dañan las membranas e interactúan con otros componentes del plasmodio (11); algunos investigadores sugieren, finalmente, que la interacción de la droga con la polimerización de la hematina no se ha logrado elucidar por completo con este tipo de fármaco(6).
Por otra parte, se ha postulado que la principal alteración ultraestructural producida por la mefloquina en el P. falciparum, es el daño en la turgencia de las vacuolas alimentarias del parásito, mas no su acumulación en estas (6,10), lo que lleva a que pequeñas concentraciones extracelulares de mefloquina incremente el pH intravacuolar del Plasmodium causando su destrucción; sin embargo, el mecanismo mediante el cual dicho medicamento se concentra en los parásitos es aún desconocido (11).
FARMACOCINÉTICA Y RARMACODINÁMICA
- Hay una marcada variación en las propiedades farmacocinéticas de la mefloquina, no solamente entre voluntarios sanos sino también entre grupos étnicos. La biodisponibilidad podría depender del preparado comercial que se use. Esta es una importante diferencia porque la relación dosis-respuesta varía en mucha áreas endémicas, y debido a tal variación es difícil comparar los estudios de farmacocinética y eficacia de este fármaco (4)
- En general, la mefloquina se administra por vía oral, ya que los preparados parentales producen reacciones locales irritantes e intensas (3,5).
- La mefloquina se absorbe lenta pero satisfactoriamente por vía digestiva, proceso estimulado por la presencia de alimentos, debido al aumento del flujo en la circulación enterogástrica y enterohepática que se produce durante el proceso digestivo (4,5).
- Su concentración máxima (Cmax) se alcanza entre las 8-24 horas (promedio 17horas) a una dosis de 15 mg/kg. Debido a esta amplia variación en la biodisponibilidad, en un blanco potencial de interacciones medicamentosas (4.5).
- El fármaco se une ampliamente a las proteínas plasmáticas (aproximadamente 98%) y se concentra en los eritrocitos, que son las células blanco en malaria, pero dichas características lo hacen también un sitio potencial para interacciones farmacológicas (5)
- Su volumen de distribución aparente va de 20 a 40 litros/Kilogramo (promedio 20L/Kg)
- Posee una vida media de eliminación amplia, en un rango de 14-22 días (promedio 20 días). (4.5)
- La mefloquina es transformada por enzimas microsomales hepáticas en su principal metabolito, el ácido 4- carboxílico de la mefloquina, probablemente mediado por la citocromo P 450 isoenzima CYP3A4 (4); el metabolito es inactivo; se ha encontrado que sus valores plasmáticos rebasan los de la propia mefloquina pero disminuyen casi con la misma rapidez(5).
- En seres humanos el fármaco se excreta principalmente por las heces y en la orina solo aparecen cantidades muy pequeñas, situación congruente con los datos de que la mefloquina se excreta por la bilis, a diferencia de otros fármacos antipalúdicos (11)
- los efectos de la malaria en la cinética de la mefloquina no son completamente claros; la C max es alta en pacientes con malaria, pero con un área bajo la curva (AUC) similar y una vida media más corta; esto sugiere que durante la enfermedad aguda el volumen de la distribución es ajustado pero sin cambios en la unión a proteínas plasmáticas. En contraste con lo anterior, se observó que la Cmax fue más baja y la vida media más prolongada en pacientes con malaria severa que en voluntarios sanos (4).
USO CLÍNICO Y DOSIFICACIÓN
A. QUIMIOPROFILAXIS
La mefloquina se ha considerado un medicamento eficaz (1.3.5.12) en la profilaxis de viajeros no inmunes que permanecen por lapsos breves en zonas en que el paludismo es endémico. Protege contra las infecciones causadas por P. falciparum (incluso reciente a la cloroquina) y P.vivax es recomendada por The Centers for Disease Control and Prevention (CDC) para la quimioprofilaxis en todas las áreas palúdicas excepto en aquellas sin resistencia a la cloroquina (donde se prefiere este última) y en algunas aéreas rurales del sureste de Asia (Tailandia) con una alta prevalencia de resistencia a al mefloquina (3).
Un estudio realizado en África (12) mostró que la profilaxis con mefloquina a una dosis semanal de 250mg, es el régimen más apropiado para prevenir la malaria por P. falciparum, dicha conclusión se obtuvo al comparar la efectividad de la profilaxis semanal con mefloquina con la de mefloquina durante dos semanas, cloroquina semanal o proguanil diariamente mas cloroquina. Se menciona a demás que la falla en la profilaxis no necesariamente se debe a resistencia del parásito al fármaco, sino que podría influir la concentración sanguínea inadecuada de la droga, resultante de una distribución alterada o de variaciones en la absorción y eliminación de la encima (12).
Dosificación recomendada para la profilaxis
- adultos y niños que pesen más de 45Kg: se les administra 250mg (1 tableta de mefloquina), una o dos semanas antes de viajar a una zona endémica de malaria; durante su estadía allí deben tomar 250mg (1 tableta) semanales (ojalá el mismo día) y posteriormente una tableta semanal durante 4 semanas luego de regresar del viaje.
- En paciente pediátricos la dosificación indicada es:
*>30 a 45Kg: ¾ tableta
*>20 a 30 Kg ½ tableta
*Menos de 20Kg ¼ tableta
*No se recomienda en niños de menos de 15Kg.
B. TRATAMIENTO DE LA MALARIA AGUDA
La mefloquina está indicada para el tratamiento de la malaria agudade leve a moderada, causada por sepas de P falciparum sensibles o resistentes a cloroquina, o por P.vivax aunque en este último caso hay alto riesgo de recaídas porque la mefloquina es eficaz como esquizonticida sanguíneo pero no elimina los parásitos exoeritrocíticos o que se encuentran en la fase hepática; para evitar dichas recaídas luego del tratamiento inicial con mefloquina, los pacientes deben recibir el esquema de primaquina.
Los datos clínicos son insuficientes para documentar el efecto de la mefloquina en malaria causada por P.ovale y P. malariae. Se debe tener en cuenta que la mefloquina no está aprobada para este propósito por la Food and Drug Administration de los Estados Unidos sino para el tratamiento de malaria por P. falciparum resistente a otras medidas terapéuticas.
Dosificación recomendada para el tratamiento de la malaria
Para el tratamiento de la malaria no complicada por P.falciparum multirresistente, la mefloquina es una alternativa a la quinina y a la halofantrina, con la ventaja de que sólo es necesaria una dosis.
Donde se sabe que las infecciones por P. falciparum son sensibles (esto es en la mayoría de los trópicos), es suficiente una dosis de mefloquina de 15 mg/Kg, pero para las infecciones resistentes se requiere 25mg/Kg (13).
Se han realizado estudios (14) en la frontera entre Tailandia y Burma que corroboran la dosificación indicada anteriormente; en ellos se comparan la eficacia terapéutica y la toxicidad de las dosis altas de mefloquina (25 mg/Kg) con la dosis recomendada de 15mg/Kg, y se demuestra que el régimen de 15mg/Kg se asocia con una tasa de fallas del 48% en niños y del 25% en adulto; a demás, la duración de los síntomas y signos (fiebre, anorexia, malestar, esplenomegalia)y la cinética de la parasistemia fueron más cortas con la dosis alta. Sin embargo, los efectos adversos fueron dosis-dependientes e incluían vértigo, anorexia, nauseas, vómito y fatiga. A pesar de dichos efectos colaterales, los autores concluyeron que la dosis óptima de mefloquina en esta área es de 25mg/Kg, y que esto se puede extrapolar a otras áreas donde va en aumento la aparición de resistencia a al mefloquina y otros fármacos.
REACCIONES ADVERSAS
Los reportes de efectos colaterales de la mefloquina han aumentado a medida que se ha incrementado su uso profiláctico y terapéutico.
A las dosis usadas para el tratamiento de la malaria aguda, no es posible distinguir los síntomas atribuibles a la administración del fármaco de los usualmente presentes en la enfermedad misma, lo que dificulta el análisis certero de los efectos adversos (5).
El fármaco suele ser bien tolerada incluso en dosis únicas ingeridas de 1.500 mg o de 500 mg cada semana pero a menudo se observa reacciones adversas como nauseas, vómito, dolor abdominal, diarrea y mareos, que muestran con frecuencia relación con la dosis y desaparecen de modo espontáneo (5).
Los signos de toxicidad del sistema nervioso central (SNC) tales como mareos, ataxia, cefalea, alteraciones de la función motora o del nivel de conciencia, y perturbaciones visuales y auditivas, se presentan en casi la mitad de las personas que reciben mefloquina pero suelen ser leves y desaparecen de manera espontánea (5.15).
Las relaciones neuropsiquiátricas intensas como desorientación, convulsiones, encefalopatía, y diversas manifestaciones neuróticas y psicóticas son infrecuentes y suelen ser reversibles una vez que se interrumpe el uso del fármaco y con tratamiento sintomático. Dichas complicaciones aparecen en personas que reciben dosis terapéuticas que en las tratadas con dosis profilácticas pero al parecer no guardan relación con las concentraciones plasmáticas del medicamento (5).
En concordancia con lo anterior, estudios realizados por Schwartz y colaboradores (15) demostraron que la mayoría de los efectos adversos estaban relacionados con el SNC (13 de 17 pacientes), independientemente de los nivele sanguíneos de mefloquina y del sexo de los pacientes, lo que sugiere que las reacciones adversas al medicamento se presentan de manera idiosincrática o dependen de diferencias en el metabolismo de los fármacos. Por otra parte, en un estudio de seguimiento a pacientes con un régimen terapéutico de mefloquina, se reportó una frecuencia inesperadamente alta de efectos colaterales en 22 pacientes; se hallaron los siguientes: vértigo (96%), nauseas (82%) y cefalea (73%), y algunos hallazgos bioquímicos y hematológicos como el aumento de los niveles de sodio, cloro, calcio, bilirrubina y LDH (16).
La toxicidad neuropsiquiátrica ha recibido una gran publicidad, pero a pesar de los frecuentes reportes anecdóticos (17.18) de convulsiones y psicosis, en estudios controlados se encontró que la frecuencia de efectos adversos severos por mefloquina no es más alta que con otros regímenes quimioprofilácticos antimaláricos comunes (3). Por ejemplo, en un estudio realizado en Kenya (19) se comparó la profilaxis en 145 pacientes con mefloquina y en 142 con cloroquina-proguanil a las dosis estándar, y los resultados del estudio mostraron que 131 (90%) de los tratados con mefloquina tuvieron algún efecto adverso principalmente dolor abdominal, nauseas, anorexia, pesadillas, úlceras orales y prurito; y que, por otra parte, 126 (89%) de los tratados con cloroquina-proguanil tuvieron algún efecto adverso similar. Sin embargo, esto se contradice con otros hallazgos (20) en los que predominan los efectos adversos sobre el SNC (depresión anciedad) en los pacientes que tomaron mefloquina (20% de 113 pacientes) y los que ingirieron cloroquina proguanil (10% de 81 pacientes).
En otros estudios (21.22), se comparan las complicaciones neuropsiquiátricas producidas por la mefloquina en los dos diferentes esquemas terapéuticos usados; los autores estimaron que 1:250 usuarios del esquema terapéutico (mayor dosis) tuvieron reacciones neuropsiquiátricas, comparados con 1:10.000 a 1:15.000 en los usuarios del esquema profiláctico (menor dosis); así se confirma la presentación más frecuentes de efectos adversos con las dosis terapéuticas de mefloquina. Dichas proporciones se corroboraron con un estudio realizado en Alemania (23), en el cual se estimó que 1:215 usuarios del régimen terapéutico sufrieron algún efecto adverso (convulsiones, psicosis aguda, ansiedad, trastorno del sueño, etc.) y 1:8000 del grupo en profilaxis tuvo alteraciones neuropsiquiátricas ; ello demuestra que el riesgo de sufrir reacciones adversas principalmente del SNC es 60 veces más alto con el uso de las dosis terapéuticas, que con las profilácticas.
Una síntesis de los efectos adversos para tener en cuenta al prescribir mefloquina es la siguiente:
- Eventos adversos más comunes: nauseas, vómito, vértigo, cefalea, somnolencia, insomnio, pesadillas, diarrea y dolor abdominal.
- Eventos adversos menos frecuentes reportados (24):
*SNC y sistema nervioso periférico; convulsiones, depresión, alucinaciones, psicosis, paranoia, ansiedad, agitación, agresión, confusión, ideaciones suicidas.
*Sistema cardiovascular: alteraciones circulatorias (hipotensión, hipertensión y síncope), taquicardia o palpitaciones, bradicardia, pulso irregular, extrasístole y otras alteraciones en la conducción cardiaca.
*Piel : purito, exantema, eritema, urticaria, pérdida del cabello.
*Sistema musculoesquelético : mialgias y artralgias.
*Sintomas generales: astenia, fatiga, fiebre y pérdida del apetito.
*También se han reportado casos aislados de encefalopatía, síndrome de Stevens Johnson bloqueo A/V y eritema multiforme.
*Laboratorios: disminución del hematocrito, elevación de las transaminasas hepáticas, leucopenia y trombocitopenia.
PRECAUCIONES Y CONTRAINDICACIONES
La mefloquina ha demostrado ser teratogénica en ratones a una dosis de 100 mg/Kg/día; en conejos a la dosis de 160 mg/Kg/día fue teratogénica pero no embriotóxica. A pesar de los estudios anteriores, no se han podido sacar conclusiones en mujeres embarazadas porque no se han diseñado estrategias que brinden información; por eso en seres humanos es mejor no usarla con fines profilácticos n terapéuticos durante el embarazo mientras no se cuente con mayores estudios y sobre todo en el primer trimestre. Por eso se considera categoría C de riesgo para el embarazo y se sugiere que las mujeres en edad fértil adopten medidas contraceptivas desde el inicio del tratamiento con mefloquina hasta tres mese después de interrumpirlo. El uso de mefloquina como antipalúdico en el embarazo está justificado solamente si los beneficios superan a los riegos.
Se hicieron estudios de farmacovigilacia en mujeres embarazadas entre 1985 y 1996; se obtuvieron 1.627 notificaciones de exposición al fármaco durante el embarazo, de ellas 1447 fueron seguidas hasta el desenlace: 646 nacimientos, 246 abortos terapéuticos y 555 gestaciones en curso. De los 646 nacimientos, en 26 (4%) se presentaron malformaciones congénitas y en 33 recién nacidos (5.1%) se diagnosticaron otros problemas relacionados con el embarazo. Las malformaciones detectadas fueron variadas sin ningún tipo de patrón: Afectaron el SNC, el musculoesquelético, el aparato circulatorio y, a demás, alteraciones cromosómicas (25). Así se demostró que la frecuencia de malformaciones no fue superior a la observada en la población general (25).
La mefloquina está contraindicada si hay historia de epilepsia, trastornos psiquiátricos, arritmias, trastornos de la conducción cardiaca o sensibilización de fármacos relacionados. (2,5,26). Igualmente, está contraindicada en personas que hayan presentado reacciones adversas a antipalúdicos quinolínicos como quinina, quinidina y cloroquina; es mejor no usar con dichos compuestos porque aumenta el peligro de que surjan convulsiones y cardiotoxicidad ( anormalidades electrocardiográfias). la mefloquina puede ingerirse inocuamente 12 horas después de consumir la última dosis de quinina, pero quizás sea peligroso administrar quinina poco después de la mefloquina porque esta última se elimina con gran lentitud (5). Con respecto a la halofantrina, hay evidencia de que su uso después de la mefloquina causa prolongación del intervalo QT, alteración que no ha sido clínicamente significativa cuando se la ha utilizado sola.
Es controversial una antigua recomendación de evitar el uso de mefloquina en quienes deben que hacer actividades motoras finasy que requieran coordinación (por ejemplo pilotear un avión, conducir un vehículo o manejara una máquina) (3,5).
La quimioprofilaxis con mefloquina debe suspenderse si se desarrollan síntomas neuropsiquiátricos importantes (3).
Poblaciones especiales (26,27)
- Madres lactantes: está contraindicada. La mefloquina se excreta a través de la leche materna a bajas concentraciones (3-4%) seguida de una dosis equivalente de 250 mg.
- Niños: evitarla en los menores de 2 años y en quienes pesan menos de 15 Kg.
- Ancianos: tener precaución con las fallas renal, cardiacas y hepáticas.
- Falla renal: no se dispone de información; probablemente no es necesario reducir la dosis.
- Influencia hepática: ningún fármaco antimalárico tiene actividad hepatotóxica directa pero si la falla hepática es severa puede prolongar la vida media del medicamento.
INTERMEDIACIONES MEDICAMENTOSAS
- Drogas antiarritmicas: hay incremento en el riesgo de arritmias con amiodarona ( la cual no puede ser tomada con mefloquina) y quinina.
- Drogas antiepilépticas: sus efectos anticonvulsivantes son antagonizados por la mefloquina.
- Drogas antipsicóticas: estos fármacos pueden incrementar el riesgo de arritmia.
- Cloroquina y quinina: hay un riesgo incrementado de convulsiones.
- No se recomienda el uso concomitante de mefloquina con bloqueadores de los receptores adrenérgicos (propanolol) ni bloqueadores de los canales de calcio ( verapamilo, diltiazem, nifedipino) porque pueden producir bradicardia y otras alteraciones vasculares.
- Se ha señalado que la mefloquina aumenta el peligro de convulsiones en sujetos epilépticos controlados con ácido valpróico y tal vez reduzca los efectos buscados con la vacuna contra la fiebre tifoidea con microorganismos vivos (5).
- Para evitar la resistencia emergente, que se comenta posteriormente, la convinación de mefloquina con artemisina parece ser una buena opción contra parásitos multirresistentes, e incluso se piensa que dicha mezcla podría retardar el desarrollo de resistencia a la mefloquina donde no se ha usado la monoterapia, tal como ocurre en Vietnam (4). Adicionalmente, cuando hay resistencia a la halofantrina, ésta se asocia a menudo con mefloquina, para contrarrestar la resistencia al primer fármaco y evitar la emergencia de tolerancia al último.
RESISTENCIA
Desde los primeros reportes de P. falciparum resistente a la cloroquina en el sureste de Asia y en Sur América, casi 50 años atrás, y desde los años ochenta con los casos reportados de resistencia a la sulfadoxina –pirimetamina y la mefloquina, los problemas de tratamiento y resistencia se han convertido en un punto clave para el control de la malaria (28).
El parásito de la malaria ha desarrollado mecanismo de resistencia a diversas drogas antimaláricas aumentado de esta forma la morbilidad y la mortalidad por dicha enfermedad (29). A demás de esto la automedicación junto con el tratamiento inadecuado ejercen una presión selectiva para el desarrollo de resistencia (30).
Se debe tener en cuenta que la resistencia se desarrolla entre 10-15 años después de la introducción del antimalárico; por ejemplo, en el caso de la mefloquina que fue introducida en 1977 en África central el primer caso de resistencia fue reportado en 1982en Asia suroriental (28).
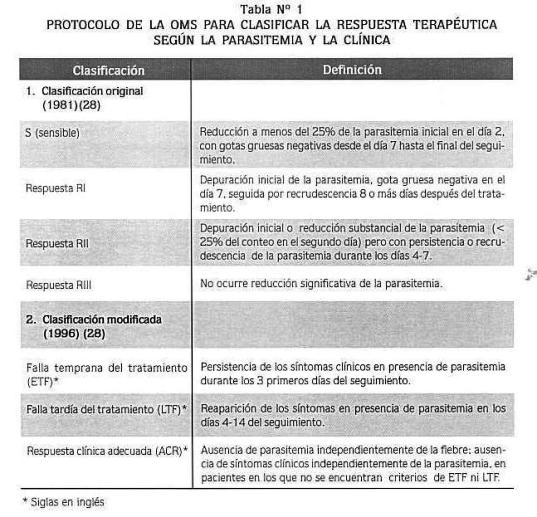
Para áreas donde la transmisión de malaria es baja, la susceptibilidad de la P falciparum a los fármacos antimaláricos se analiza haciendo seguimiento de la respuesta terapéutica (test in vivo). Definida por la OMS en 1981 en términos de la depuración de la parasistemia: sensible (s) y tres grados de reistencia (RI. RII. RIII). Para áreas de intensa transmisión debida a la presencia de altas parasistemias, en ausencia de síntomas y signos clínicos. La OMS realizó un protocolo en 1996, basado en los resultados clínicos, que consideraba falla temprana o tardía al tratamiento y la adecuada respuesta clínica (28), así (tabla n°1).
Determinantes de la resistencia antimalárica
Las mutaciones genéticas que confieren resistencia a los fármacos antimaláricos pueden ocurrir en la naturaleza independientemente de los efectos de las drogas. Mutaciones puntuales únicas o múltiples en el genoma del plasmodio pueden conferir resistencia durante la quimioterapia, aunque también intervienen las interacciones con otros medicamentos, las características del fármaco (cinética, dosificación), los factores del hospedero (inmunidad, resistencia), las características del parásito (mutación, nivel de transmisión), del vector (afinidad por los parásitos) y del medio ambiente (28).
Resistencia a la mefloquina
La resistencia a la mefloquina fue observada en Tailandia –Cambodia en la década de los años 80, posiblemente influenciada por el uso de compuestos químicamente relacionados con la quinina justo antes de la introducción de la mefloquina (28). También se debe tener en cuenta que la mefloquina tiene una vida media prolongada, lo que incrementa la presión de selección y probablemente ésta sea la principal razón para el desarrollo de resistencia a dicho fármaco (4).
Aunque se han introducido nuevas drogas y varias combinaciones de ellas, es importante esclarecer los mecanismos moleculares de resistencia a las aminoquinolinas , para garantizar estrategias terapéuticas apropiadas en malaria.
Una P-glicoproteína homóloga (Pgh1) ha sido amplificada en los fenotipos de la P falciparum resistentes a la cloroquina y mefloquina . dicha glicoproteína está codificada en el gen pfmdr1 y está localizada en la membrana de la vacuola digestiva del parásito (31) por eso se han investigado los polimorfismos y el número de copias del gen pfmdr1 como marcador molecular de la resistencia a la mefloquina. Un estudio realizado en Brasil sugiere que un alto número de copias del gen confiere la resistencia del parásito a la mefloquina (32) pero otros estudios no confirman este hallazgo (31).
Por otra parte, la selección de mutantes de resistencia ocurre normalmente cuando un gran número de parásitos se encuentran a concentraciones submáximas de la droga antimalárica en la sangre. A esas concentraciones, los parásitos resistentes a la droga sobreviven más fácilmente que los susceptibles (30, 33).
La selección de resistencia puede ocurrir por un tratamiento primario inadecuado o cuando se adquiere una nueva infección y todavía hay concentraciones residuales de la droga antimalárica usadas para una infección previa. En este último caso la resistencia de la droga antimalárica puede ser más alta, cuando esta por su lenta eliminación, permanece en la sangre por largo tiempo a niveles subterapéuticos o sea por debajo de la concentración inhibitoria mínima (MIC) (30).
La fase de la eliminación de la droga puede ser biexponencial o triexponencial, lo cula da lugar a a un periodo largo en que las concentraciones de mefloquina están asociadas con una actividad inhibitoria intermedia contra el P. falciparum. Éste es un factor determinante para el desarrollo de resistencia (30), al igual que ocurre con las bacterias.
Estudios anteriores realizados en Tailandia (2) han analizados modelos para el estudio de la mefloquina tanto in vivo como in vitro comparando desarrollos de resistencia a las dos dosis a las que se prescribe esta droga: 15 y 25 Kg de peso. La droga se elimina del cuerpo de forma dosis-dependiente y el tiempo durante el cual la población parasitaria infectante está expuesta a contracciones inhibitorias intermedias también está relacionado con la dosis. Según otro estudio llevado a cabo en 415 pacientes con malaria en Tailandia (2).se considera que la concentración de malaria intermedia en sangre está en el rango de 400-600 ng/mL y que la concentración inhibitoria mínima (MIC) se encuentra por encima de 600 ng/mL.
En el mismo estudio, el total de parásitos en los pacientes que recibieron la dosis de 15mg/Kg fue considerablemente más alto (4.87 x 1010 parásitos) que en los pacientes que recibieron 25mg/Kg de peso (1.152 parásitos); se observó que a dosis bajas de la droga un mayor número de parásitos está expuesto a niveles de actividad submáxima y pueden desarrollar fácilmente resistencia; se demostró que cepas con alto nivel de resistencia (alta MIC), llevan una recrudescencia más temprana de la infección que aquellas con resistencia baja; a demás, el P. falciparum puede llegar a multiplicarse en presencia de una concentración de 638 ng/mL que antes era considerada como adecuada para un tratamiento óptimo (34).
Se han llevado estudios en diferentes zonas: en Cambodia se dio tratamiento de mefloquina a 110 pacientes en dosis de 15 mg/Kg; de éstos, 65 (60%) presentaron resistencia (1). Estudios posteriores revelaron que la eficacia de la mefloquina a dosis de 15mg/kg fue de 38% en el día 42 para un grupo de 53 pacientes (1). Esta eficacia se incrementa al 44% cuando se suministra la dosis de 25mg/Kg (1).
Resultaos similares fueron encontrados por Schmidt et al. (2): el tratamiento con mefloquina a dosis de 15mg/Kg en un grupo de 71 pacientes alcanzó una eficacia del 42% para el día 42. No obstante, a altas dosis (25mg/Kg) se incrementó la eficacia a 73% en un grupo de 68 pacientes.
Por último, antes de considerar que hay resistencia al tratamiento se debe pensar en la falla terapéutica por otros factores que pueden afectar la concentración máxima obtenida del fármaco; la malaria aguda puede influir en la absorción de las drogas porque ella se reduce a la ingestión e los alimentos necesarios para aumentar la biodisponibilidad del fármaco; también porque hay vómito, reducción e la movilidad gástrica y del flujo sanguíneo visceral además de cambios en el volumen de distribución aparente (30)
BIBLIGRAFÍA
1. PETERS W. Chemotherapy and Drug resistance in malaria. London: Academic Press; 1970 1-22. [ Links ]
2. SCHMIDT LH, CROSBY R,RASCO J, VAUGHAN. Antimalarial activities of various 4-quinolomethanols whit especial attention to WR-142,420 (mefloquine). Antimicrob Agents Chemother 1978; 13: 1.011-1.030. [ Links ]
3. KATHZUNG BG. Farmacología básica y clínica. México: Editorial Manual Moderno; 1999: 997-998. [ Links ]
4. PHANT TRONG G, DE VRIES P.J. Pharmacokinetic interactions of animalarial agents. Clin Pharmacikinet 2001; 40: 343-373 [ Links ]
5. GOODMAN & GILMAN. Las bases farmacológicas de la terapéutica. 9a ed. México: Mc Graw-Hill Interamericana; 1996: 1.036-1.038 [ Links ]
6. FOLEY M. TILLEY L. Quinoline antimalarials: mechanisms of action and resistance and new prospects for new agents . In J Parasitol 1997; 27: 231-240. [ Links ]
7. SLATER AF. CERAMI A. Inhibition by chloroquine of a novel haem polymerase enzime activity in malarial trophozoites. Nature 1992; 355: 167-169. [ Links ]
8. DORN A, VIPPAGUNTAS SR, MATILDE H, JACQUET C, VENNERSTROM JL, RIDLEY RG. An assesment of drug and haematin binding as a mechanism for inhibition of haematin polymerization by quinoline antimalarials. Biol Chem Pharmacol 1998; 55: 727-736. [ Links ]
9. PALMER KJ, HOLLYDAY SM, BROGDEN RN. Mefloquine: a review of its antimalarial activity, pharmacoquinetic properties and therapeutic efficacy. Drugs 1993; 45: 430-475. [ Links ]
10. JACOBBS GH, AIKAWA M, MILHOUSE WK, RABBEGE JR. An ultrastructural study of effects of mefloquine on malarial parasites. Am J Trop Med Hyg 1987; 36: 9-14. [ Links ]
11. SCHLESINGER PH, KROGSTAD DJ, HERWALD BL. Antimalarial Agents: Mechanisms of action. Antimicrob Agents Chemother 1998; 32: 793-798. [ Links ]
12. LOBEL HO, MIANI M, ENG T, BERNARD KW, HIGHTOWER AW. Cambell c. Long term malaria prophilaxis whit weeky mefloquine. Then lancent 1998; 341: 848-841. [ Links ]
13. WHITE NJ. Mefloquine. Brit Med J 1994; 308: 286-287. [ Links ]
14. KUILE FO, NOSTEN F, THIEREN M, LUXEMBUERGERC, EDSTEION MD, CHONGSUPHAJAISIDDHI T, et al. High dose mefloquine in the treatment of multidrug resistant falciparum malaria. J Infect Dis 1992; 166: 1.393 -1.400. [ Links ]
15. SCHWARTZ E, POTASMAN I, ROTENBERG M, ALMOG S, SADETZKI S. Serious adverse events of mefloquine in relation to blood level and gender. Am J Trop Med Hyg 2001; 65: 189-192. [ Links ]
16. RENDI-WAGNER P, NOELDL H, WERNSDORFER WH, WIEDERMANN G, MIKOLASEK A, KOLLARITSCH H. Unexpercted frequency , duration and spectrum of adverse events after therapeutic dose of mefloquine in healthy adults. Acta Tropica 2002; 81: 167-163. [ Links ]
17. LYSACK CL, KVERN BL. Asevere adverse reaction to mefloquine and cloroquine prophylaxis. Australian Family Physician 1998; 27: 1.119-1.120. [ Links ]
18. CLATTENBURG RN, DONNELLY. Case study: Neuropsychiatric symptons with the antimalarial agent mefloquine . J Am Acad child Adolescent Psychiatr 1997; 36: 1.606-1.608. [ Links ]
19. ASHLEY C. Toxicity of mefloquine is similar to that of other chemoprophylaxis. Brit Med J 1995; 311: 191-192. [ Links ]
20. CORBETTEL, DOHERTYJF, BEHRENS RH, Adverse events associated with mefloquine . Brit Med J 1996; 313: 1.552-1.553. [ Links ]
21. LEBAIN P, JULIARD C, DAVY JP, DOLLEFUS S. Neuropsychiatric symptoms in preventive antimalarial treatment with mefloquine: Apropos of two cases. Encephale 2000; 26; 67-70. [ Links ]
22. MINEI-RACHMILEWITZT. Neuropsychiatric side effects of malrial prophylaxis with mefloquine (lariam) Drug The Bull 1998; 36: 20-22. [ Links ]
23. WEINKE T. TRAUTMANN M, HELD T, WEBERG, EICHENLAUB D, FLEISCHER K, et al. Neuropsychiatric side affects after the use of mefloquine. Am J Trop Med Hyg 1991; 45: 86-91. [ Links ]
24. HOFFMAN La Roche Ltd. Switserland. Página Web: http//www.lariaminfo.homested.com consulta: septiembre de 2002. [ Links ]
25. MARADIT H, KERR L. Postmarketing suveillance of prophylactic mefloquine use in pregnancy. Am J Trop Med Hyg 1998; 58: 17-21. [ Links ]
26. KAKKILAYA BS. Página web: http//www.malariastite.org Consulta: septiembre de 2002. [ Links ]
27. FONTANET AL, JOHNSTON BD, WALKER AM, ROONEY W, THIMASARM K, STURCHLER D, et al. High prevalence of mefloquine resistant falciparum malaria in eastern Thailand. Bulletin of WHO 1999; 71: 377-383. [ Links ]
28. WONGSRICHANNALAI C, PICKARD AL, WERNSDORF WH, MESHNICK SR. Epidemiology of drugresistant malaria. Lancet 2002; 2: 209-221. [ Links ]
29. MOCKENHAUPT FP, Mefloquine resistance in Plasmodium falciparum: Parasitol Today 1995; 11: 248-253. [ Links ]
30. SIMPSON JA, WATKINS ER, PRICE RN, AARON L, KILE DE, WHITE NJ. Mefloquine pharmacokinetic-pharmacodynamic models: Implications for dosing and resistance. Antimicrob Agents Chemother 2000; 44: 3.414-3.424. [ Links ]
31. CHAIYAROJ SC, BURANAKITI A, ANGKASEKWINAI P, LOOAREESUWAN S, COWMAN A. Analysis of mefloquine resistance and amplification of pfmdr1 in multidrug resistant P: falciparum isolates from Thailand. Am J Trop Med Hyg 1999; 61: 780-783. [ Links ]
32. ZALIS MG, PANG L, SILVERIA MS, MILHOUS WK, WIRTH DF, Characterization of P. falciparum isolated from the Amazon región of Brazil: evidence for quinine resistance. Am J Trop Med Hyg 1998; 58: 630-637 [ Links ]
33. COWMAN A, GALATIS D, THOMPSON JK. Selection for mefloquine resistance in P. falciparum is linked to amplification of the pfmdr1 gene and cross resistance to halofantrine and quinine. Proc Natl Acad Sci 1994; 91: 1.143-1.147. [ Links ]
34. NOXTEN F, KUILE F, CHONGSUPHAJAISIDDHI T, LUXEMBUERGUER C, WEBSTER HK, EDSTEIN M. et al. Mefloquine resistant falciparum malaria on the Thai-burmese border. The Lancet 1991; 337: 1.140-1.143. [ Links ]