Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.17 no.4 Medellín Oct./Dec. 2004
ARTÍCULO DE REFELXIÓN
Cáncer anal en la era del VIH: papel de la citología anal
ANAL CANCER IN THE HIV ERA
JUAN CARLOS CATAÑO CORREA1
1. Médico internista, residente de Enfermedades Infecciosas, Departamento de Medicina Interna, Facultad de Medicina, Universidad de Antioquia
RESUMEN
EL CÁNCER ANAL SOLÍA SER UNA NEOPLASIA INFRECUENTE que afectaba principalmente a mujeres y personas mayores de 65 años, pero recientemente su incidencia ha venido en aumento debido a la pandemia de VIH, fenómeno que tiende a empeorar porque la terapia antirretroviral altamente activa (HAART, por su sigla en inglés) no solo alarga la vida de los pacientes, sino que al mismo tiempo hace posible una prolongada evolución de las lesiones precancerosas que conducen a cáncer anal; además, está plenamente demostrado que la HAART no evita la evolución de las lesiones intraepiteliales escamosas hacia cáncer anal.
La citología anal ha demostrado ser una prueba de tamización poblacional útil y costoefectiva para el diagnóstico de las lesiones precancerosas producidas por Papilomavirus humano en el canal anal de hombres homosexuales y bisexuales, principalmente de aquellos positivos para VIH.
Esta revisión tiene como objetivo llamar la atención sobre la creciente incidencia de cáncer anal en la población de pacientes VIH positivos, y sobre la utilidad del diagnóstico temprano utilizando la citología anal en este grupo de pacientes de riesgo.
PALABRAS CLAVE
CÁNCER ANAL, CITOLOGÍA ANAL, LESIÓN INTRAEPITELIAL ESCAMOSA, NEOPLASIA INTRAEPITELIAL, PAPILOMAVIRUS HUMANO, VIH
SUMMARY
Anal cancer used to be an uncommon neoplasia that affected mainly women and people aged over 65 years, but recently its incidence has been growing, mostly due to the HIV pandemic, and it will become worse because highly active antiretroviral therapy (HAART) at the same time that lengthens life expectancy in HIV positive subjects, will increase the possibility to develop anal cancer; it has already been demonstrated that HAART does not prevent the evolution of intraepithelial squamous lesions to anal cancer.
Anal cytology has demonstrated to be an useful and cost-effective screening tool for detection of precancerous lesions associated with human Papillomavirus (HPV) infection in the anal canal of homosexual and bisexual men, specially in those that are HIV positive. This article is an update of the state of the art about anal cancer, highlighting the benefits of anal cytology for high-risk populations.
KEY WORDS
ANAL CANCER, ANAL CYTOLOGY, HIV, HUMAN PAPILLOMAVIRUS, INTRAEPITHELIAL NEOPLASIA, LESIONS
INCIDENCIA
EL CÁNCER ANAL (CA) CORRESPONDE AL 1.5% de todos los cánceres de las vías digestivas; en el año 2000 se diagnosticaron 3.400 casos nuevos en la población general de Estados Unidos, y es el cuarto cáncer en frecuencia en la población de pacientes VIH positivos (1,2); su incidencia anual en la población general es solo de 1 caso por 100.000 personas, pero con la pandemia debida al VIH, esta incidencia viene en rápido aumento (3-5).
Clásicamente, las poblaciones con el mayor riesgo de desarrollar CA eran las mujeres y los ancianos, pero tan pronto como se lo asoció con el Papilomavirus humano (PVH) y con las relaciones sexuales de riesgo, se empezaron a hacer estudios en hombres que tienen sexo con hombres (HSH) y se encontró una incidencia anual de 35 casos por 100.000 hombres, cifra muy similar a lo que era el cáncer cervical (CC) antes de utilizar la tamización con citología vaginal (1-6).
La prevalencia de lesiones intraepiteliales escamosas en el ano de HSH VIH positivos es del 93% comparada con 60% en HSH VIH negativos; el serotipo 16 de los Papilomavirus es el más frecuente en estas lesiones y se encuentran infecciones simultáneas por varios serotipos en el 73% de los HSH VIH positivos y en el 23% de los HSH VIH negativos (7); a pesar de esto, el CA no se considera una entidad definitoria de SIDA como sí lo es el CC desde 1993; además, los HSH VIH positivos tienen un riesgo relativo de 38 comparados con la población general para desarrollar CA (8), lo cual puede explicarse por una exposición repetida a varios serotipos de PVH o por el consumo de cigarrillo, entre otros factores, y no por el efecto carcinogénico del PVH potenciado por la inmunosupresión del VIH (6).
CARACTERÍSTICAS ANATÓMICAS
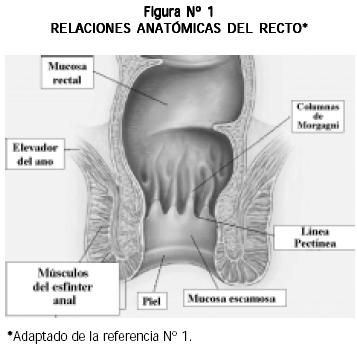
EL CANAL ANAL SE PUEDE DIVIDIR, gracias a la línea pectínea, en dos porciones claramente diferenciables y con características distintas (1):
- Proximal a la línea pectínea: está compuesta por mucosa de transición no queratinizada, de donde se originan los adenocarcinomas y cuyo drenaje linfático se hace hacia los ganglios paravertebrales y perirrectales (Figura N° 1).
- Distal a la línea pectínea: compuesta por epitelio escamocelular queratinizado, del cual se originan los verdaderos CA, y cuyo drenaje linfático se hace hacia los ganglios femorales e inguinales (Figura N° 1).
HISTORIA NATURA
EL PAPEL ONCOGÉNICO DE LOS PVH EN CA Y CC no tiene discusión; el 99% de los carcinomas escamocelulares cervicales y anales son positivos para ADN del PVH (3,5,9). Los pacientes VIH positivos tienen 2 a 6 veces más probabilidad de estar infectados por PVH independientemente de sus prácticas sexuales (10-14) y 7 veces más probabilidad de que la infección por PVH sea persistente (15) debido a que la inmunosupresión les impide eliminar el virus.
Usando los criterios del sistema Bethesda para la evaluación y clasificación del CC según los hallazgos de la citología vaginal, se puede también clasificar el CA según los hallazgos de la citología anal así (16):
- 1 Normal.
- ASCUS por su sigla en inglés (células escamosas atípicas de significado indeterminado).
- LIEB (lesión intraepitelial escamosa de bajo grado o NIA 1).
- LIEA (lesión intraepitelial escamosa de alto grado) que puede ser NIA 2 o NIA 3 (carcinoma in situ).
- Insuficiente (menos de 200 células nucleadas en la placa).
En un estudio realizado en San Francisco (EE. UU.), cuyo objetivo fue conocer la historia natural del CA en HSH VIH positivos y negativos, se encontró que el 32% de los pacientes VIH positivos que no tenían enfermedad anal al comienzo del estudio desarrollaron NIA 1 (neoplasia intraepitelial anal o LIEB) a los 2 años de evolución, comparados con solo 9% en los pacientes VIH negativos (15). En otro estudio en Seattle (EE. UU.), se observó que de los pacientes que al ingreso estaban libres de enfermedad anal, a los 21 meses el 15% de los VIH positivos y el 8% de los VIH negativos desarrollaron NIA 2 ó 3 (17).
Previo al inicio de la era de la terapia antirretroviral altamente activa (HAART, highly active antiretroviral therapy) los individuos solían morir rápidamente a causa de alguna enfermedad relacionada con el VIH, pero con el uso de dicha terapia se ha logrado un gran impacto en la morbimortalidad de los pacientes VIH positivos, lo cual incluye una reducción importante en la incidencia de la mayoría de las infecciones oportunistas y las enfermedades malignas asociadas al VIH (18,19). Existen pocos estudios sobre el impacto que la HAART tiene en la NIA, pero los resultados de algunos de ellos hacen pensar que esta terapia tiene poco o ningún efecto en su evolución (16,20); lo que sí está claro es que los pacientes que reciben HAART, como sobreviven por más tiempo, tienen más oportunidades de desarrollar CA (21).
PATOGÉNESIS
LA PRIMOINFECCIÓN POR PVH se adquiere tempranamente después del inicio de la vida sexual; posteriormente ocurre la infección por VIH, y a medida que se incrementa la actividad sexual, se aumenta el riesgo de infectarse con más de un serotipo de PVH. A medida que progresa la infección por el VIH, se pierde la inmunidad específica contra el PVH con el correspondiente aumento en sus niveles y el desarrollo de los diferentes estadios de NIA; aunque la inmunosupresión se puede ligar con el desarrollo de NIA, su papel en la progresión de NIA a cáncer invasivo es menos claro (21,22).
La respuesta inmune juega un papel muy importante en la eliminación de las células epiteliales que expresan las proteínas del PVH; los serotipos oncogénicos 16 y 18 expresan las proteínas E6 y E7, que son capaces de inducir inestabilidad del genoma al degradar supresores tumorales como p53 y pRb. Una vez que ocurren estos cambios genéticos, se puede estimular la progresión de NIA 1 a 2 ó 3 independientemente del grado de inmunosupresión; por ello la HAART tiene poco o ningún efecto en la progresión de la NIA (23).
TAMIZACIÓN Y DIAGNÓSTICO
APROXIMADAMENTE EL 65% DE LOS PACIENTES que desarrollan CA se curan (24), debido a que cuando aparecen los síntomas usualmente el tumor aún se encuentra confinado en la pelvis. Solo el 30% de los pacientes aqueja alguno de los siguientes síntomas: sangrado, dolor o sensación de masa rectal (21,25-27); por lo general el diagnóstico es casual, en un examen rectal o por la aparición de una adenopatía inguinal.
Está claramente demostrado que la tamización con citología vaginal, para detectar lesiones sugestivas de CC, ha logrado hacer disminuir significativamente el número de mujeres que desarrollan las formas invasivas de esta neoplasia (4). Hasta hoy no se han llevado a cabo estudios similares dirigidos a demostrar una utilidad semejante de la citología anal para detectar lesiones sugestivas de CA, pero sí se sabe que la tamización con citología anal tiene una sensibilidad del 81% y una especificidad del 63%, con un valor predictivo positivo (VPP) del 46% y un valor predictivo negativo (VPN) del 95% para el diagnóstico de lesiones intraepiteliales escamosas (28); además, usando un modelo económico, la citología anal demostró ser costoefectiva en HSH, tanto VIH positivos como negativos (29,30).
La técnica para hacer la citología rectal es sencilla y cualquier médico o enfermera puede ser entrenado con rapidez para realizarla óptimamente (28): el paciente debe haber evitado relaciones anales y enemas en las 24 horas previas a la toma de la muestra; se inserta un aplicador húmedo de dacrón (no algodón) 2 cm a partir del orificio anal, y se lo retira suavemente haciendo movimientos rotatorios y presión contra las paredes del canal anal; la muestra obtenida se extiende en un portaobjetos e inmediatamente se la deposita en un líquido preservativo; otro método igualmente efectivo pero de más fácil interpretación, se efectúa con un aplicador que se deposita en un líquido fijador (PreservCyt®) el cual permite hacer varias placas de citología tipo Thinprep® (31).
Todos los individuos cuyo resultado sea diferente del normal, son remitidos para una anoscopiabiopsia de alta resolución (ABAR) guiadas por la tinción con ácido acético al 3%, y dependiendo del resultado se siguen diferentes algoritmos (Figuras N° 2 y 3) (21).
MANEJO
AÚN NO SE HA DETERMINADO EL TRATAMIENTO ÓPTIMO para la LIEA, pero no existen diferencias entre el tratamiento de los pacientes VIH positivos y negativos. Hasta la fecha no se han hecho estudios prospectivos en gran escala que demuestren que el tratamiento de la LIEA reduce la incidencia de CA. A pesar de todo, en la Universidad de California en San Francisco, han tratado a satisfacción aproximadamente 400 pacientes con displasia anal a lo largo de 8 años; solo han utilizado la ABAR para guiar la terapia pero desafortunadamente, el 75% de los pacientes VIH positivos tienen recaídas al año, sin que se haya presentado ningún caso de enfermedad invasiva (22). Esta dificultad para erradicar la infección por PVH en pacientes VIH positivos ha logrado aumentar el riesgo de desarrollar CA invasivo hasta alcanzar el 1% por año en esta población (6). Las lesiones pequeñas (menores de 1cm), internas o externas, pueden ser tratadas con ácido tricloroacético al 85% o con crioterapia; en cambio, los pacientes con lesiones mayores, o pequeñas pero múltiples, siempre requieren biopsia y cauterización intraoperatoria guiada por ABAR (Figura N° 3) (21).
Cuando el diagnóstico por ABAR deja de ser LIEA para convertirse en CA, el tratamiento óptimo es la combinación por 6 semanas de mitomicina o cisplatino con radioterapia; este tratamiento tiene una tasa de efectividad del 74 al 90% (32), pero en pacientes VIH positivos el problema no es la efectividad sino los efectos tóxicos, cuya frecuencia pasa del 6% al 12% (33-36), y puede llegar hasta el 80% en pacientes con recuentos de células CD4 menores de 200 µL (37), lo cual obliga a disminuir las dosis de los medicamentos utilizados y, por supuesto, a tener una menor efectividad y un mayor número de recaídas.
SEGUIMIENTO
A LOS PACIENTES CON NIA 1 SIN TRATAMIENTO se les hace seguimiento con ABAR cada 6 meses, mientras que a aquellos con NIA 2 ó 3 se les debe hacer seguimiento con ABAR cada 4 meses, todo esto dirigido a determinar signos de progresión hacia CA. En pacientes posquirúrgicos, se debe hacer seguimiento cada 2 meses (21).
BIBIOGRAFÍA
1. RYAN DP, COMPTON CC, MAYER RJ. Carcinoma of the anal canal. N Engl J Med 2001; 342: 792-800. [ Links ]
2. GREENLEE RT, MURRAY T, BOLDEN S, et al. Cancer statistics, 2000. CA Cancer J Clin 2000; 50: 7-33. [ Links ]
3. BECKMAN AM, DALING JR, SHERMAN KJ, e t al. Human papillomavirus infection and anal cancer. Intl J Cancer 1989; 43:1.042-1.049. [ Links ]
4. BOSCH FX, MANOS MM, MUNOZ N, et al. Prevalence of human papillomavirus in cervical cancer: a worldwide perspective IBSCC study group. J Natl Cancer Inst 1995; 87: 796-802. [ Links ]
5. WALBOOMERS JM, JACOBS MV, MANOS MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999;189: 9-12. [ Links ]
6. KLENCKE BJ, PALEFSKY JM. Anal cancer: an HIV associated cancer. Hematol Oncol Clin N Am 2003;17: 859- 872. [ Links ]
7. PALEFSKY JM, HOLLY EA, RALSTON ML, et al. Prevalence and risk factors for human papillomavirus infection of the anal canal in human immunodeficiency virus (HIV)-positive and HIV-negative homosexual men. J Infect Dis 1998; 177: 361-367. [ Links ]
8. FISCH M, BIGGAR RJ, ENGELS EA, et al. Association of cancer with AIDS-related immunosupression in adults. JAMA 2001; 285: 1.736-1.745. [ Links ]
9. TILSTON P. Anal human papillomavirus and anal cancer. J Clin Pathol 1997; 50: 625 634. [ Links ]
10. CAUSSY D, GOEDERT JJ, PALEFSKY JM, et al. Interaction of human immunodeficiency and papilloma viruses: association with anal epithelial abnormality in homosexual men. Intl J Cancer 1990; 46: 214-219. [ Links ]
11. KIVIAT N, ROMPALO A, BOWDEN R, et al. Anal human papillomavirus infection among human immunodeficiency virus-seropositive and seronegative men. J Infect Dis 1990;162: 358-361. [ Links ]
12. PALEFSKY JM, HOLLY EA, RALSTON ML, et al. High incidence of anal high-grade squamous intraepithelial lesions among HIV-positive and HIV-negative homosexual and bisexual men. AIDS 1998;12: 495-503. [ Links ]
13. PALEFSKY JM, MINKOFF H, KALISH LA, et al. Cervicovaginal human papillomavirus infection in human immunodeficiency virus-1 (HIV)-positive and high risk HIVnegative women. J Natl Cancer Inst 1999; 91: 226-236. [ Links ]
14. WILLIAMS AB, DARRAGH TM, VRANIZAN K, et al. Anal and cervical human papillomavirus infection and risk of anal and cervical epithelial abnormalities in human immunodeficiency virus-infected women. Obstet Gynecol 1994; 83: 205-211. [ Links ]
15. PALEFSKY JM, HOLLY EA, HOGEBOOM CJ, et al. Virologic, immunologic, and clinical parameters in the incidence and progression of anal squamous intraepithelial lesions in HIV-positive and HIV-negative homosexual men. J Acquir Immune Defic Syndr 1998;17: 314-319. [ Links ]
16. PIKETTY C, DARRAGH TM, HEARD I, et al. High prevalence of anal squamous intraepithelial lesions in HIV-positive men despite the use of highly active antiretroviral therapy. Sex Trans Dis 2004; 31: 96-99. [ Links ]
17. CRITCHLOW CW, SURAWICS CM, HOLMES KK, et al. Prospective study of high grade anal squamous intraepithelial neoplasia in a cohort of homosexual men: influence of HIV infection, immunosupression and human papillomavirus infection. AIDS 1995; 9: 1.255-1.262. [ Links ]
18. MURPHY E, COLLIER A, KALISH LA, et al. Highly active antiretroviral therapy decreases mortality and morbidity in patients with advanced HIV disease. Ann Intern Med 2001; 135: 17-26. [ Links ]
19. International collaboration on HIV and cancer. Highly active antiretroviral therapy and incidence of cancer in human immunodeficiency virus-infected adults. J Natl Cancer Inst 2000; 92:1.823-1.830. [ Links ]
20. PALEFSKY JM. Anal squamous intraepithelial lesions: relation to HIV and human papillomavirus infection. J Acquir Immune Defic Syndr 1999; 21(Suppl): S42-48. [ Links ]
21. CHIN-HONG PV, PALEFSKY JM. Natural history and clinical management of anal human papillomavirus disease in men and women infected with human immunodeficiency virus. Clin Infect Dis 2002; 35: 1.127-1.134. [ Links ]
22. BERRY JM, PALEFSKY JM, WELTON ML. Anal cancer and its precursors in HIV positive patients: perspectives and management. Surg Oncol Clin N Am 2004; 13: 355-373. [ Links ]
23. PALEFSKY JM, HOLLY E. Molecular virology and epidemiology of human papillomavirus and cervical cancer. Cancer Epidemiol Biomarkers Prev 1995; 4: 415-428. [ Links ]
24. MYERSON RJ, KARNELL LH, MENEK HR. The National Cancer Database report on carcinoma of the anus. Cancer 1997; 80: 805-815. [ Links ]
25. BEAHRS OH, WILSON SM. Carcinoma of the anus. Ann Surg 1976;184: 422-428. [ Links ]
26. SINGH R, NIME F, MITTELMAN A. Malignant epithelial tumors of the anal canal. Cancer 1981; 48: 411-415. [ Links ]
27. SCHNEIDER TC, SCHULTE WJ. Management of carcinoma of the anal canal. Sugery 1981; 90: 729-734. [ Links ]
28. PALEFSKY JM, HOLLY EA, HOGEBOOM CJ, et al. Anal cytology as a screening tool for anal squamous intraepithelial lesions. J Acquir Immune Defic Syndr Hum Retrovirol 1997;14: 415-422. [ Links ]
29. GOLDIE SJ, KUNTZ KM, WEINSTEIN MC, et al. The clinical effectiveness and cost effectiveness of screeening for anal squamous intraepithelial lesions in homosexual and bisexual HIV-positive men. JAMA 1999; 281:1.822-1.829. [ Links ]
30. GOLDIE SJ, KUNTZ KM, WEINSTEIN MC, et al. Costeffectiveness of screening for anal squamous intraepithelial lesions and anal cancer in human immunodeficiency virusnegative homosexual and bisexual men. Am J Med 2000; 108: 634-641. [ Links ]
31. DARRAGH TM, JAY N, TUKELEWICZ BA, et al. Comparison of conventional cytologic smears and ThinPrep preparations from the anal canal. Acta Cytol 1997; 41: 1.167-1.170. [ Links ]
32. BENDELL JC, RYAN DP. Current perspectives on anal cancer. Oncology 2003; 17: 492-497. [ Links ]
33. ALLAL AS, MERMILLOD B, ROTH AD, et al. Impact of clinical and therapeutic factors on major late complications after radiotherapy with or without concomitant chemotherapy for anal carcinoma. Int J Radiat Oncol Biol Phys 1997; 39: 1.099-1.105. [ Links ]
34. CUMMINGS BJ, KEANE TJ, O'SULLIVAN B, et al. Epidermoid anal cancer: treatment by radiation alone or by radiation and 5-fluorouracil with and without mitomycin C. Int J Radiat Oncol Biol Phys 1991; 21: 1.115-1.125. [ Links ]
35. TOUBOUL E, SCHLIENGER M, BUFFAT L, et al. Epidermoid carcinoma of the anal canal: results of curative-intent radiation therapy in a series of 270 patients. Cancer 1994; 73: 1.569-1.579. [ Links ]
36. WAGNER JP, MAHE MA, ROMESTAING P, et al. Radiation therapy in the conservative treatment of carcinoma of the anal canal. Int J Radiat Oncol Biol Phys 1994; 29: 17-23. [ Links ]
37. HOFFMAN R, WELTON ML, KLENCKE B, et al. The significance of pre-treatment CD4 count on the outcome and treatment tolerance of HIV-positive patients with anal cancer. Int J Radiat Oncol Biol Phys 1999; 44: 127-131. [ Links ]
Recibido: 8 de octubre de 2004
Aceptado: 3 de noviembre de 2004