Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Iatreia
versão impressa ISSN 0121-0793
Iatreia v.18 n.1 Medellín jan./mar. 2005
ARTÍCULO DE INVESTIGACIÓN
Evaluación de la expresión de la proteína precursora de amiloide en células sanguíneas de pacientes con la mutación E280A en el gen de la presenilina 1
Expression of amyloid precursor protein in peripheral blood cells of patients with the E280A mutation in the presenilin–1 gene
Carlos Andrés Villegas Lanau1; Gabriel Bedoya Berrío2–4; María Fabiola Toro Castaño2–5; Lucía Madrigal3; Francisco Lopera Restrepo2–6
1 M.D., Estudiante de Doctorado en Neurociencias de la Universidad de Antioquia, Medellín, Colombia
2 Profesores del Postgrado en Ciencias Básicas Biomédicas en la Facultad de Medicina de la Universidad de Antioquia, Medellín, Colombia
3 Psicóloga, estudiante de Doctorado en Neuropsicología de la Universidad de Málaga
4 Biólogo
5 Bacterióloga
6 Neurólogo
La correspondencia puede ser dirigida a Carlos Andrés Villegas Lanau
Dirección: Calle 62 # 52–72; Grupo de Neurociencias de Antioquia, Universidad de Antioquia, Medellín, Antioquia, Colombia.
Teléfono: 2106460 Fax: 5730865
Dirección electrónica: andres.villegas@paeces.udea.edu.co
RESUMEN
La enfermedad de Alzheimer es un problema mundial de salud pública. El estudio de los mecanismos moleculares responsables de su aparición permitirá avances terapéuticos y en las técnicas para la evaluación de las personas afectadas y de las que están en riesgo de desarrollar la enfermedad. La mutación E280A en el gen de la Presenilina 1 (PS1) es responsable de una forma grave de la enfermedad de Alzheimer familiar. Con el fin de conocer su efecto sobre la Proteína Precursora de Amiloide (PPA), se cuantificó la producción de esta por células de sangre periférica (mononucleares y linfocitos B) de individuos portadores de dicha mutación. Se analizaron cultivos celulares (HeLa y CHO) como controles positivos, y sangre periférica procedente de portadores sanos de la mutación, de portadores afectados y de un grupo control sano, no portador. Todas las células (HeLa, CHO, mononucleares y linfocitos B) se analizaron por citometría de flujo para detectar la PPA en la membrana citoplasmática y en el espacio intracelular. Se halló un nivel mayor de expresión de esta proteína en el interior de las células que en la membrana celular. En células HeLa y CHO los niveles de expresión intracelular fueron muy variables mientras que en los mononucleares fueron uniformemente bajos. Otros trabajos han detectado niveles mayores de la proteína en los enfermos, pero nuestros resultados indican que no hay diferencia entre los controles sanos, los portadores sanos y los portadores enfermos, lo cual indica que la mutación E280A de la PS1 no ejerce un papel directo en la expresión de la PPA en células mononucleares de sangre periférica.
PALABRAS CLAVE: citometría de flujo, enfermedad de alzheimer, mutación e280a presenilina, proteína precursora de amiloide
SUMMARY
Alzheimer's disease is a public health problem both in Colombia and worldwide. Study of the molecular mechanisms involved in this disease may allow the development of methods for evaluation and treatment of Alzheimer's disease patients and people at risk. Mutation E280A in the presenilin–1 gene leads to the development of an aggressive form of familial Alzheimer's disease. In order to define the role of such mutation on the expression of Amyloid Precursor Protein in peripheral blood mononuclear cells and B lymphocytes we carried out a study in three groups of people, namely: healthy carriers of the mutation, affected carriers and healthy non–carriers as controls. Flow cytometry was used for the detection of Amyloid Presursor Protein in cell membranes and intracellulary; HeLa and CHO cells were used as positive controls.
Expression level of Amyloid Precursor Protein was higher in the intracellular compartment than in the cell membrane. The levels of expression in the intracellular compartment of HeLa and CHO cells were variable in contrast with those of peripheral blood mononuclear cells in which they were lower but stable. Contrariwise to the results of other authors, who have detected higher levels of Amyloid Precursor Protein in Alzheimer's disease patients, our results revealed no difference between healthy controls and carriers of the E280A mutation in the presenilin–1 gene, either diseased or healthy. Our results show that this mutation does not directly change the expression of Amyloid Precursor Protein in peripheral blood mononuclear cells.
KEY WORDS: alzheimer disease, amyloid precursor protein, e280a mutation, flow cytometry, presenilin
INTRODUCCIÓN
La enfermedad de alzheimer (EA) fue reconocida en 1907 por Alois Alzheimer; actualmente se sabe que es la demencia más frecuente en el mundo, que afecta entre 1–6% de la población mayor de 65 años, y entre 10–20% de los que sobrepasan los 80 años.1,2 En la EA se han definido dos grandes grupos: esporádico, sin historia familiar (EAE), y familiar cuando se presenta en otros miembros de la familia del paciente (EAF). Los casos familiares han permitido identificar genes y proteínas involucrados en la patogénesis de la enfermedad.3 Además, de acuerdo con la edad de inicio, la enfermedad se ha clasificado en temprana o tardía según su aparición antes o después de los 65 años. 4
Los cambios histopatológicos observados en el tejido cerebral, que corroboran el diagnóstico definitivo de la EA, son los ovillos neurofibrilares y las placas seniles; los primeros son acúmulos de fibrillas entrelazadas en el cuerpo neuronal, dependientes de la proteína τ; las segundas son lesiones extracelulares, con un centro compuesto de β amiloide y rodeado de axones y dendritas anormales, además de astrocitos y células gliales. La proteína β amiloide (βA), principal componente de las placas seniles, es un pequeño péptido de 39 a 43 aminoácidos (aa) derivado de una glicoproteína mayor llamada Proteína precursora de β amiloide (PPA). 5 La PPA posee un extremo carboxilo localizado intracelularmente y el extremo amino se encuentra extracelular. El βA está ubicado en la PPA con 28 aa por fuera de la membrana y 12 intramembranales. 6
Aún no se conoce bien la función de la PPA, pero aparentemente es importante en los mecanismos de reparación neuronal y su expresión aumenta en situaciones nocivas para el cerebro como hipoglicemia, isquemia o trauma. 7 Normalmente la PPA es cortada por una enzima entre los aa 612 lisina y 613 leucina, lo cual corresponde a un corte en el βA entre los aa 16–17; la enzima que produce este corte se conoce como secretasa, la cual fue identificada como ADAM9 (por su nombre en inglés 'una desintegrina y metaloproteinasa'); este corte genera en la PPA un fragmento amino extracelular, junto con parte del βA que se secreta, y otro fragmento carboxilo con el resto del βA que permanece anclado en la membrana. 8 Si la PPA se corta por las enzimas BACE (por la sigla en inglés 'enzima que corta en el sitio β de la PPA') y γ secretasa (complejo proteico compuesto por Presenilina, Nicastrina, Pen2 y Aph1) se generan 3 fragmentos: uno con el extremo carboxilo, otro con el extremo amino y uno intermedio que corresponde al péptido βA. 9–11 Las mutaciones puntuales en los exones 16 y 17 de la PPA causan un incremento en la producción del péptido βA. 12–15 Algunos autores localizan la producción del βA en el trans–Golgi y la secreción en el post–Golgi, 16,17 otros informan la generación de βA de 42 aa en el retículo endoplásmico y de 40 aa en el trans–Golgi.18,19 Se han identificado la actividad de la γ secretasa en la membrana lisosomal y la actividad de la α y β secretasas en la membrana citoplasmática. 20 En la membrana de células diferentes a las neuronas se ha encontrado la producción de βA de 40 y 42 aa en cantidades significativas. 21
Se descubrieron otros dos genes involucrados en la EAF que codifican proteínas denominadas presenilinas (PS). 22,23 Las mutaciones en estos genes se relacionan con la aparición temprana de la EA; hasta el momento se han detectado más de 125 mutaciones en el gen de la PS–1 24 involucradas en la EAF. 25,26 Un ejemplo clásico de estas mutaciones es la localizada en el codón 280, la cual parece ser el único factor involucrado en la EAF descubierta en familias del departamento de Antioquia (Colombia). La mutación consiste en una transversión de adenina por citosina, que ocasiona un cambio de ácido glutámico por alanina. El fenotipo resultante es una EAF grave de aparición muy temprana con características clínicas específicas como mioclonus, dificultades del lenguaje, cambios de la personalidad y el comportamiento, debidos a una grave lesión cortical y cerebelosa; en la actualidad este es el grupo con EAF más numeroso en el mundo. 27–29 También se ha identificado un gen en el cromosoma 1 cuyas mutaciones se han relacionado con EAF. Dicho gen posee una alta homología (67%) con el gen de la PS–1, 30 razón por la cual se le dio el nombre de Presenilina 2 (PS–2); las mutaciones en este gen han mostrado un ligamiento del 100% con la EAF. La secuencia de la PS1 consta de 467 aa y a partir de ella, utilizando programas de computador, se obtuvo la configuración más probable, la cual indicaría que la PS puede ser una proteína integral de membrana. 31 Las PS en las neuronas se localizan en las membranas del retículo endoplásmico, el aparato de Golgi y las dendritas. 32–35 Se ha logrado también determinar que la PS–1 sufre un clivaje en la región de los exones 8 y 9, generando 2 fragmentos, uno de 18kDa y otro de 28kDa. 36
Con el fin de conocer el efecto que produce la mutación E280A en la PS1 sobre la expresión de la PPA, usamos la citometría de flujo que permite evaluar en forma cuantitativa y específica las proteínas relacionadas con la EA. La escasez de estudios con células procedentes de pacientes con EA hace difícil extrapolar a la práctica clínica los resultados obtenidos en el laboratorio. El estudio de células de pacientes con una variante de la EA caracterizada molecularmente y estudiada clínicamente, brindaría la posibilidad de dilucidar el comportamiento de estas proteínas en células de fácil acceso tanto en enfermos como en individuos que aún no hayan desarrollado la enfermedad. En el presente trabajo evaluamos la expresión de la PPA, usando como controles células HeLa y CHO, para luego evaluar células mononucleares de sangre periférica de individuos sanos portadores de la mutación E280A en el gen de la PS1, de portadores afectados por la enfermedad y de un grupo control de no portadores sanos.
MATERIALES Y MÉTODOS
Pacientes
En un trabajo previo, realizado por el grupo de Neurociencias de la Universidad de Antioquia, se logró caracterizar clínica, histopatológica y molecularmente la demencia tipo Alzheimer familiar precoz, hallada en Antioquia, Colombia. 27–2 Para tal fin se usaron los criterios clínicos del CERAD (Consortium to Establish a Registry for Alzheimer's Disease), evaluación neurológica, exámenes paraclínicos y diversas técnicas de biología molecular (tipificación por PCR y digestión enzimática). Así se logró identificar la forma familiar de Alzheimer, con la mutación E280A en el gen de la PS1.
Para el presente trabajo se seleccionaron 3 individuos afectados por la EA y portadores de la mutación E280A; otros tres que eran portadores de dicha mutación pero que estaban asintomáticos y un grupo control de 3 individuos sanos que no pertenecían a los grupos familiares identificados para E280A ni tenían historia familiar de demencia. Todos los individuos seleccionados eran mayores de 35 años, teniendo en cuenta que la edad media de inicio de la EA por la mutación E280A es de 45 años. Todos ellos fueron genotipificados para la mutación E280A según el procedimiento previamente descrito 22 y se les extrajeron muestras de sangre periférica para los estudios de expresión de PPA en células mononucleares.
Cultivos celulares in vitro y células de pacientes
Se utilizaron células HeLa y CHO para la estandarización de la técnica, basados en reportes anteriores sobre la expresión de PPA por estas células. 37, 38 Las células HeLa corresponden a una línea celular derivada de carcinoma de cérvix humano y las células CHO son una línea celular derivada de ovario de hámster chino; ambas líneas se obtuvieron del laboratorio de Virología de la Universidad de Antioquia y se mantuvieron a 37º C en medio esencial mínimo Eagle®, suplementado con suero bovino fetal (SBF) al 10%.
Las células mononucleares se obtuvieron al centrifugar muestras de sangre periférica a 1.500 revoluciones por minuto (rpm), durante 10 minutos; se extrajo la capa de células blancas (buffy coat) y se procedió a lavarla en 2 ocasiones con medio de cultivo RPMI (por la sigla de la institución donde fue desarrollado 'Roswell Park Memorial Institute') del laboratorio Sigma; los mononucleares se aislaron por medio de una centrifugación en Histopaque (Sigma) a 1.500 rpm durante 25 minutos a temperatura ambiente y luego se sometieron a 2 nuevos lavados con medio de cultivo RPMI. Para el recuento, se resuspendieron las células en SBF (Gibco) al 100% y luego se distribuyeron en una concentración aproximada de 1.5 x 106 células por tubo; posteriormente se sometieron a 2 lavados con solución tampón salina fosfato (PBS), para iniciar el protocolo de citometría de flujo.
Citometría de flujo
Se hicieron tres lavados con PBS y uno más con PBS adicionada con EDTA al 0.2% para desprender las células de las botellas sin dañar su estructura. Dichos lavados se hicieron a 4º C. Después de desprendidas las células se lavaron con PBS y se resuspendieron en SBF al 100% para proceder al recuento; luego se distribuyeron a una concentración aproximada de 1.5 x 106 células por tubo.
Para la detección de la PPA se utilizó el anticuerpo monoclonal (Chemicon International Inc.), el cual es una IgG1 derivada de ratón que reconoce el epítope aminoterminal previo al péptido A4. Como isotipo se empleó IgG1 de ratón normal (Sigma). Como segundo anticuerpo se utilizó anti–IgG de ratón, preparado en oveja, marcado con isotiocianato de fluoresceína (FITC) (Sigma). La detección de PPA se determinó por la diferencia entre los niveles de fluorescencia de las células que recibieron el anticuerpo contra PPA con respecto a las que recibieron el isotipo. Los linfocitos B se diferenciaron de los demás mononucleares de sangre periférica, mediante marcación con el anticuerpo anti–CD19 conjugado con ficoeritrina (PE) (Sigma), derivado de IgG1 de ratón.
Detección de la PPA en la superficie celular
Las células se sometieron a 2 lavados a 1.400 rpm durante 7 minutos a 4º C, con solución de tinción (PBS, SBF al 1% y azida de sodio a 0.l%; pH 7.4–7.6). Luego se les adicionó el primer anticuerpo (anti–PPA) a una concentración de 2.5 µg/mL disuelto en 100 µL de solución de tinción y se las dejó en incubación por 30 minutos a 4º C en un lugar oscuro. Para los isotipos se procedió de igual forma empleando la misma concentración de anticuerpo (isotipo) que la empleada para el anticuerpo anti–PPA. En el estudio de los linfocitos B, antes de agregar el anticuerpo anti–PPA o el isotipo, se hizo el marcaje con el anticuerpo anti–CD19, usando las mismas condiciones de incubación que para el anti–PPA o el isotipo; luego se hicieron 2 nuevos lavados con solución de tinción y se procedió a agregar el anticuerpo anti–PPA o el isotipo. Después de incubar se hicieron 2 nuevos lavados con solución de tinción y se añadió el segundo anticuerpo marcado con fluorocromo (FITC), a una concentración de 1/200 y se dejó la mezcla en incubación por 30 minutos a 4º C protegida de la luz. Nuevamente se hicieron 2 lavados con solución de tinción y se resuspendieron en 0.5 mL de fijador (PBS y paraformaldehído al 4%, pH 7.4–7.6) para su lectura en el citómetro de flujo (EPICSXL, Coulter); se evaluaron 10.000 eventos en cada lectura.
Detección de la PPA intracelular
Se procedió de igual manera que para detectar la proteína en la membrana celular, con la misma cantidad de células lavadas dos veces en solución de tinción; luego se hicieron dos lavados con la solución de permeabilización, obtenida del kit Cytofix/Cytoperm® (Pharmingen); posteriormente se hizo fijación durante 20 minutos a 4º C en un sitio oscuro utilizando el fijador obtenido del mismo kit Cytofix/Citoperm®; luego se hicieron 2 nuevos lavados con la solución de permeabilización y posteriormente se agregó el primer anticuerpo (anti–PPA) disuelto en solución de permeabilización a una concentración de 10 µg/mL; se dejó en incubación durante 30 minutos en las mismas condiciones que se emplearon con el fijador. Luego se hicieron dos lavados adicionales con la solución de permeabilización; se agregó el segundo anticuerpo disuelto en solución de permeabilización a una concentración de 1/200 y se dejó en incubación en iguales condiciones que el primer anticuerpo. Finalizada la incubación con el segundo anticuerpo se hicieron dos nuevos lavados con solución de permeabilización y un lavado con solución de tinción para concluir fijando la muestra con 0.5 mL de fijador. La lectura se hizo de la misma manera que para detectar la PPA en la membrana celular.
En el caso de los isotipos y para los linfocitos B, la detección de la PPA intracelular se realizó de igual manera que para la detección en la membrana celular, es decir, se usaron los anticuerpos respectivos, a las mismas concentraciones empleadas para el primero y segundo anticuerpos (10 µg/mL y 1/200, respectivamente).
Análisis estadístico
Los resultados obtenidos por citometría de flujo, bajo el programa WinMDI versión 2.5, proporcionaron diversos valores, entre los cuales se encuentra el porcentaje de eventos (señales de fluorescencia detectadas por el equipo) en una zona determinada del diagrama de puntos, para un total de 10.000 eventos detectados. Se tomaron los valores de los porcentajes correspondientes a las zonas en las cuales se obtuvo una señal positiva para la proteína estudiada; a estos valores se les restó el porcentaje encontrado en el control isotipo para la misma zona, lo cual correspondió a la diferencia de porcentaje entre la detección de la muestra y la detección en el isotipo. Las diferencias de expresión entre las muestras de los portadores de la mutación E280A y las de los controles sanos no portadores se sometieron a un análisis estadístico, por medio paramétrico, usando ANOVA de una vía, para determinar si eran significativas. Para establecer la variabilidad entre los grupos se usó la comparación de medias frente a sus respectivas desviaciones estándar.
RESULTADOS
PPA en la membrana de células HeLa y CHO
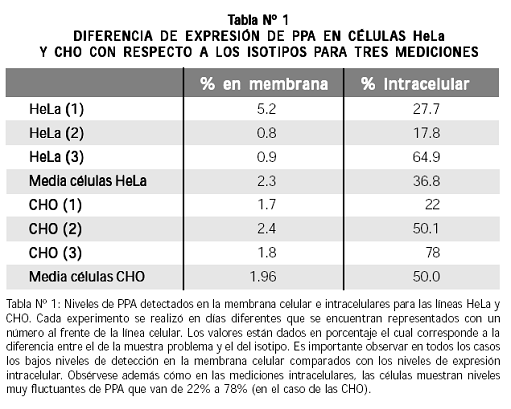
Las mediciones mostraron niveles muy bajos de PPA en la membrana, con valores que variaron entre 1.7% y 2.4% para células CHO y de 0.8% a 5.2% para células HeLa (Tabla Nº 1); por la posibilidad de que estos resultados indicaran ruido de fondo, se repitieron las mediciones en diferentes días y con nuevos cultivos de células HeLa y CHO; se obtuvieron más de 27 mediciones que reproducían los resultados anteriores y en todos los casos el isotipo dio valores inferiores a los de las células tratadas con el anticuerpo anti–PPA.
PPA en la membrana celular de mononucleares y linfocitos B de portadores de la mutación E280A
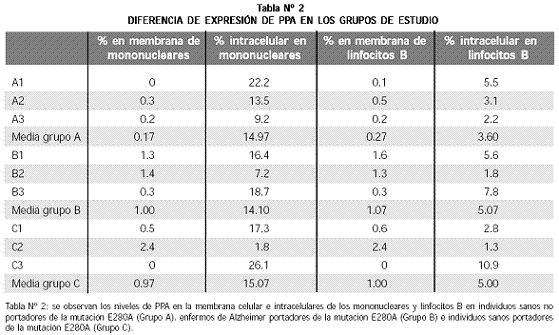
En los tres grupos de pacientes se detectaron niveles muy bajos de expresión en la membrana celular tanto de los mononucleares de sangre periférica como de los linfocitos B (Tabla Nº 2).
Los no portadores de la mutación E280A (Grupo A, controles sanos), mostraron los niveles más bajos de expresión de PPA en la membrana celular, tanto para los mononucleares de sangre periférica (media 0.17%), como para los linfocitos B (media 0.27%); los niveles observados en los portadores de E280A, enfermos (grupo B) o sanos (grupo C) también fueron bajos y muy similares para los mononucleares (media en enfermos 1%, en los sanos 0.97%), como para linfocitos B (media en enfermos 1.07% en portadores sanos, 1%). Sin embargo, no hubo diferencias significativas entre los portadores y los no portadores de la mutación (p = 0.421 para mononucleares y p = 0.470 para linfocitos B). En dos de las mediciones no se encontró diferencia entre la muestra tratada con el isotipo y la tratada con el anticuerpo anti–PPA; una de ellas correspondió a uno de los individuos del grupo control y la otra, a uno de los portadores de la mutación que aún no han desarrollado la enfermedad (Tabla Nº 2).
PPA intracelular en células HeLa y CHO
En estas células los resultados de PPA intracelular fueron bastante variables: se obtuvieron valores de 17.8 a 64.9% en células HeLa y de 22 a 78% en células CHO (Tabla Nº 1). Los niveles altos de PPA intracelular no estuvieron acompañados de niveles altos en la membrana celular.
PPA intracelular de mononucleares y linfocitos B de portadores de la mutación E280A
Los niveles de PPA intracelular fueron menores en los linfocitos B (1.3–10.9%) que en los mononucleares (1.8–26.1%); estos valores fueron también inferiores a los hallados en las células HeLa (17.8–64.9%) y CHO (22–78%). Dado que la población de linfocitos B es parte de la de mononucleares, no se puede afirmar que los primeros expresen mayor o menor cantidad de PPA intracelular que los segundos.
No se hallaron diferencias significativas en los niveles intracelulares de PPA en mononucleares (p = 0.989) ni en linfocitos B (p = 0.856) al comparar los individuos portadores de la mutación con los no portadores, o los enfermos con los sanos, aunque la media para los linfocitos B de los controles sanos, no portadores (3.6%), fue levemente inferior a la de los grupos portadores de la mutación E280A: 5.07% en los portadores enfermos y 5.0% en los portadores sanos.
DISCUSIÓN
La PPA juega un papel fundamental en el desarrollo de la EA; su ubicuidad permite explorar las posibles diferencias de su expresión en células de fácil acceso como los mononucleares de sangre periférica; es concebible que la expresión de PPA en estas células tenga relación con el desarrollo de la enfermedad o con la presencia de la mutación E280A en el gen de la PS1. La existencia de tales diferencias permitiría el estudio clínico y experimental de pacientes con EA o de portadores de mutaciones en el gen de la PS1. En vista de esta posibilidad, usamos la técnica de citometría de flujo por ser rápida, cuantitativa y sensible para detectar la PPA en células no nerviosas, con el fin de tratar de explicar cómo las mutaciones en el gen de la PS1 conducen a una mayor producción de βA, puesto que concentraciones más elevadas de PPA en las células de los individuos con la mutación E280A de la PS1 se constituirían en evidencia de varias posibilidades como son: aumento en la estabilidad de la PPA, sobreexpresión del gen de la PPA o alteración del tráfico intracelular de PPA.
Otros autores han hecho intentos para detectar la PPA por medio de citometría de flujo en la membrana celular de células linfoides, renales y hepáticas, derivadas de murinos, con resultados negativos; por el contrario, la PPA ha sido detectada por citometría de flujo en la membrana celular de las neuronas, la cual se afecta al tripsinizar el tejido nervioso; además se observó que los niveles de PPA en la membrana del tejido neuronal variaban de 20–50% con la presencia de la proteína de adhesión NCAM (por su sigla en inglés 'molécula de adhesión de células nerviosas'), lo cual indica un equilibrio entre la PPA en la membrana y el mecanismo de inserción y endocitosis de vesículas en la membrana. 39
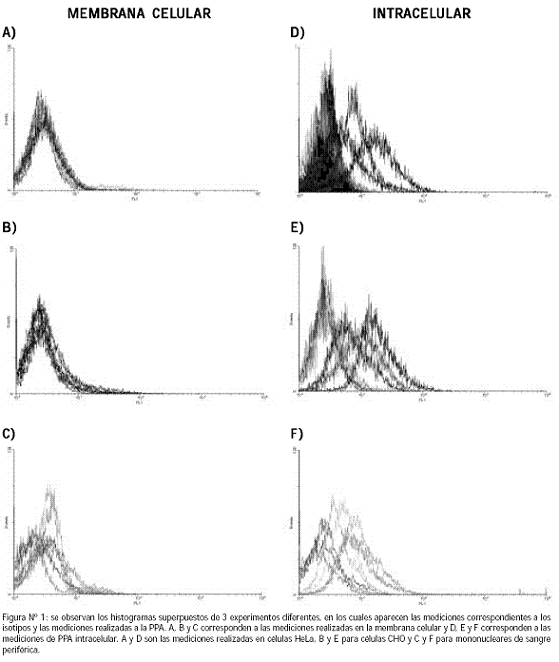
En nuestros experimentos encontramos niveles muy bajos de PPA en la membrana celular con respecto a la PPA intracelular; esta diferencia en las concentraciones se evidencia en los histogramas de la Figura Nº 1: se observa que las mediciones de PPA en la membrana celular muestran escaso desplazamiento, comparadas con las mediciones intracelulares.
Este resultado permite pensar que dicha proteína ejerce un papel intracelular importante y que no es solo una proteína de señalización en la membrana celular, dando a entender que la PPA tiene un destino celular diferente a la membrana citoplasmática. Consideramos que los niveles altos de PPA intracelular encontrados se deben a que, al permeabilizar las células, detectamos la proteína unida a la membrana celular, junto con la localizada en el retículo endoplásmico y la anclada en el gastroplasma. Los niveles de PPA detectados por citometría de flujo fueron muy similares en células HeLa y CHO lo cual no concuerda con lo esperado a la luz de los reportes de alta expresión de PPA en células HeLa y baja expresión en células CHO. 37,38 Una posible explicación de los niveles similares de PPA en las células HeLa y CHO es el hecho de que las segundas provienen de ovario de hámster y las primeras son de origen humano, lo cual puede implicar una interacción del anticuerpo anti–PPA con proteínas en las células CHO que tengan homología con la fracción de PPA reconocida por el anticuerpo, las cuales no se encuentren en las células HeLa.
Los niveles de PPA detectados en mononucleares totales fueron menores que los de las líneas celulares (HeLa y CHO) y además se encontró una alta fluctuación de la expresión en dichas líneas (17,8 a 64,9% para células HeLa y 22 a 78% para células CHO) con respecto a las células de sangre periférica, en las cuales las mediciones variaron de 1,8 a 26,1. La variación en las mediciones de PPA intracelular se ve reflejada en la figura Nº 1, donde se aprecia que los histogramas para las células CHO y HeLa, tienen un claro desplazamiento entre las diferentes mediciones, comparados con las mediciones en mononucleares, que fueron más uniformes. La gran fluctuación en la expresión de PPA detectada en células HeLa y CHO, puede deberse a que estas células son altamente proliferativas y creemos que la PPA, al estar implicada en el ciclo celular,40 puede cambiar su expresión en determinada fase del ciclo celular; por ende los niveles de PPA que se detectan, reflejan el momento del ciclo celular en que se encuentra la mayor proporción de células muestreadas. Los mononucleares, en cambio, no realizan ciclo celular a no ser que sean inducidos por mitógenos; lo que se debe reflejar en una expresión más estable de PPA.
Otros autores han usado citometría de flujo para medir la PPA intracelular en células linfoides de diferentes grupos que incluían pacientes con síndrome de Down, pacientes con EA y controles sanos tanto ancianos como jóvenes. Se ha encontrado mayor expresión de la PPA en los pacientes con síndrome de Down que en los controles sanos jóvenes; además, los pacientes con EA al igual que los controles sanos ancianos mostraron una expresión de PPA más elevada que los controles sanos jóvenes.41 Nuestros resultados no se correlacionan con los de estos autores, porque usamos grupos con edades muy próximas; tampoco encontramos diferencias en los niveles intracelulares de PPA entre quienes tienen EA y quienes no la padecen. Sin embargo, observamos una leve diferencia en los niveles de PPA en la membrana plasmática entre quienes tienen la mutación E280A en el gen de la PS1, y quienes no la tienen, lo cual podría sugerir que las mutaciones en dicho gen pueden estar alterando el tráfico celular de PPA; sin embargo, los niveles que detectamos fueron tan bajos que consideramos deben ser confirmados con células que muestren mayores niveles de expresión de PPA en la membrana celular. Otros autores 42 reportan que la PPA tiene una expresión mayor en la membrana celular de mononucleares de pacientes con EA avanzada comparados con controles pareados sanos y pacientes con EA moderada; en nuestro caso, con mutantes para PS1, no observamos esta diferencia incluso teniendo en cuenta que usamos extremos en el deterioro al tomar muestras de pacientes demenciados que portan la mutación y de individuos que la portan pero aún se encuentran sanos; entre estos dos grupos no encontramos diferencia en los niveles de PPA ni en membrana celular ni intracelulares; esto puede indicar que los enfermos esporádicos presentan un cambio en la expresión de PPA en la membrana citoplasmática, en relación directa con el deterioro; lo cual no tiene el mismo comportamiento para los portadores de la mutación E280A en PS1.
Esta es la primera vez que se detecta la PPA por medio de citometría de flujo en células que portan una mutación en el gen de la PS1. Adicionalmente, se usó esta técnica para la detección de la PPA tanto en la membrana celular como intracelularmente, lo que pone a disposición de los investigadores una importante herramienta para futuros trabajos en el campo de las neurociencias.
AGRADECIMIENTOS
Este trabajo fue realizado gracias a los aportes de Colciencias dentro del proyecto: 'Papel de la mutación E280A de la Presenilina 1 en la patogenia de la Enfermedad de Alzheimer', código número 1115–04–404–98. Los autores agradecen muy sinceramente a los grupos familiares participantes en el estudio; igualmente, a los laboratorios de Virología, Inmunología, Genética médica, Reproducción y Unidad de Citometría de Flujo de la Facultad de Medicina de la Universidad de Antioquia.
REFERENCIAS BIBLIOGRÁFICAS
1. CLARK RF, GOATE AM. Molecular genetics of Alzheimer's Disease. Arch Neurol 1993; 50: 1.164–1.172. [ Links ]
2. SCHELLENBERG GD. Genetic dissection of Alzheimer disease, a heterogeneous disorder. Proc Natl Acad Sci USA 1995; 92: 8.552–8.559. [ Links ]
3. TALBOT C, HARDY J, GOATE A. Unraveling the genetics of Alzheimer's disease. Genome Analysis 1993; 6:101–120. [ Links ]
4. DSM–IV Manual diagnóstico y estadístico de los trastornos mentales. Editorial Masson, S.A. 1995: 145–150. Barcelona–España. [ Links ]
5. KOSIK K. Alzheimer's disease: A cell biological perspective. Science 1992; 256: 780–783. [ Links ]
6. STICHT H, BAYER P, WILLBOLD D, DAMES S, HILBICH C, BEYREUTHER K, et al. Structure of amyloid A4–(1–40)–peptide of Alzheimer's disease. Eur J Biochem 1995; 233: 293–298. [ Links ]
7. BRAMLETT HM, KRAYDIEH S, GREEN EJ, DIETRICH D. Temporal and regional patterns of axonal damage following traumatic brain injury: A beta–amyloid precursor protein immunocytochemical study in rats. J Neuropathol Exp Neurol 1997; 56: 1.132–1.141. [ Links ]
8. ASAI M, HATTORI C, SZABO B, SASAGAWA N, MARUYAMA K, TANUMA S, et al. Putative function of ADAM9, ADAM10, and ADAM17 as APP alpha–secretase. Biochem Biophys Res Commun 2003; 301: 231–235. [ Links ]
9. FORTINI ME. γ–secretase–mediated proteolysis in cellsurface–receptor signalling. Nat Rev Mol Cell Biol 2002; 3: 673–684. [ Links ]
10. EDBAUER D, WINKLER E, REGULA JT, PESOLD B, STEINER H, HAASS C. Reconstitution of γ–secretase activity. Nature Cell Biology 2003; 5: 486–488. [ Links ]
11. HAASS C. Take five–BACE and the γ–secretase quartet conduct Alzheimer's amyloid β–peptide generation. EMBO J 2004; 23: 483–488. [ Links ]
12. STEINER H, HAASS C. Intramembrane proteolysis by presenilins. Nat Rev Mol Cell Biol 2000; 1: 217–224. [ Links ]
13. ANDRAU D, DUMANCHIN–NJOCK C, AYRAL E, VIZZAVONA J, FARZAN M, BOISBRUN M, et al. BACE 1 and BACE 2 expressing human cells: Characterization of βAPP–derived catabolites, design of a novel fluorimetric assay and identification of new in vitro inhibitors. J Biol Chem 2003; 278; 25.859–25.866. [ Links ]
14. KLAFKI HW, ABRAMOWSKI D, SWOBODA R, PAGANETTI PA, STAUFENBIEL M. The carboxyl termini of β–amyloid peptides 1–40 and 1–42 are generated by distinct γ–secretase activities. J Biol Chem 1996; 271: 28.655–28.659. [ Links ]
15. CITRON M, DIEHL T, GORDON G, BIERE A, SEUBERT P, SELKOE D. Evidence that the 42– and 40–amino acid forms of amyloid β protein are generated from the β–amyloid precursor protein by different protease activities. Proc Natl Acad Sci USA 1996; 93: 13.170–13.175. [ Links ]
16. BRONWYN LM, GESINE SF, BUSCIGLIO J, DUKE M, PAGANETTI P, YANKNER BA. Intracellular accumulation of β–amyloid in cells expressing the Swedish mutant amyloid precursor protein. J Biol Chem 1995; 270: 26.727–26.730. [ Links ]
17. XU H, SWEENEY D, WANG R, THINAKARAN G, LO ACY, SISODIA SS, et al. Generation of Alzheimer β–amyloid protein in the trans–Golgi network in the apparent absence of vesicle formation. Proc Natl Acad Sci USA 1997; 94: 3.748–3.752. [ Links ]
18. COOK DG, FORMAN MS, SUNG JC, LEIGHT S, KOLSON DL, IWATSUBO T, et al. Alzheimer's Aβ (1–42) is generated in the endoplamic reticulum/intermediate compartment of NT2N cells. Nat Med 1997; 3:1.021–1.023. [ Links ]
19. TIENARI J, IDA N, IKONEN E, SIMONS M, WEIDEMANN A, MULTHAUP G, et al. Intracellular and secreted Alzheimer β–amyloid species are generated by distinct mechanisms in cultured hippocampal neurons. Proc Natl Acad Sci USA 1997; 94: 4.125–4.130. [ Links ]
20. PASTERNAK SH, BAGSHAW RD, GUIRAL M, ZHANG S, ACKERLEY CA, PAK BJ, et al. Presenilin–1, nicastrin, amyloid precursor protein and gamma–secretase activity are co–localized in the lysosomal membrane. J Biol Chem 2003; 278: 26.687–26.694. [ Links ]
21. HARTMANN T, BIEGER SC, BRÜHL B, TIENARI PJ, IDA N, ALLSOP D, et al. Distinct sites of intracellular production for Alzheimer's disease Aβ40/42 amyloid peptides. Nat Med 1997; 3: 1.016–1.020. [ Links ]
22. The Alzheimer's Disease Collaborative Group. The structure of the presenilin 1 (S182) gene and identification of six novel mutations in early onset AD families. Nat Genet 1995; 11: 219–222. [ Links ]
23. TAKANO T, YAMANOUCHI Y, SAHARA N, SHIRASAWA T, MORI H. Assignment of Alzheimer's presenilin–1 (PS–1) gene to 14q24.3 by fluorescence in situ hybridization. Neurosci Lett 1996; 214: 69–71. [ Links ]
24. http://molgen–www.uia.ac.be/ADMutation/ [ Links ]
25. WRAGG M, HUTTON M, TALBOT C. The Alzheimer's disease Collaborative Group. Genetic association between intronic polymorphism in presenilin–1 gene and late–onset Alzheimer's disease. Lancet 1996; 347: 509–512. [ Links ]
26. SELKOE D. Alzheimer's disease: Genotypes, phenotype, and treatments. Science 1997; 275: 630–631. [ Links ]
27. CORNEJO W, LOPERA F, URIBE C, SALINAS M. Descripción de una familia con Demencia Presenil Tipo Alzheimer. Acta Médica Colombiana 1987; 12: 55–61. [ Links ]
28. LOPERA F, ARCOS M, MADRIGAL L, KOSIK K, CORNEJO W, OSSA J. Demencia tipo Alzheimer con agregación familiar en Antioquia, Colombia. Acta Neurológica Colombiana 1994; 10: 173–187. [ Links ]
29. LOPERA F, ARDILA A, MARTINEZ A, MADRIGAL L, ARANGO J, LEMERE C, et al. Clinical features of earlyonset Alzheimer disease in a large kindred with an E280A presenilin–1 mutation. JAMA 1997; 277: 793–799. [ Links ]
30. NAZNEEN N, SINGER SJ. Specific transcellular binding between membrane proteins crucial to Alzheimer disease. Proc Natl Acad Sci USA 1996; 93: 12.575–12.580. [ Links ]
31. STROOPER B, BEULLENS M, CONTRERAS B, LEVESQUE L, CRAESSAERTS K, CORDELL B, et al. Phosphorylation, subcellular localization, and membrane orientation of the Alzheimer's disease–associated presenilins. J Biol Chem 1997; 272: 3.590–3.598. [ Links ]
32. KOVACS D, FAUSETT H, PAGE K, KIM TW, MOIR R, MERRIAM D, et al. Alzheimer–associated presenilins 1 and 2: Neuronal expression in brain and localization to intracellular membranes in mammalian cells. Nat Med 1996; 2: 224–229. [ Links ]
33. COOK D, SUNG J, GOLDE T, FELSENSTEIN K, WOJCZYK B, TANZI R, et al. Expression and analysis of presenilin 1 in a human neuronal system: Localization in cell bodies and dendrites. Proc Natl Acad Sci USA 1996; 93: 9.223–9.228. [ Links ]
34. ELDER G, TEZAPSIDIS N, CARTER J, SHIOI J, BOURAS C, LI HC, et al. Identification and neuron specific expression of the S182/presenilin I protein in human and rodent brains. J Neurosc Res 1996; 45: 308–320. [ Links ]
35. NARUHIKO S, YU–ICHI Y, HIDEYUKI T, TAKEFUMI K, MASAYASU O, MIHOKO U, et al. Identification and characterization of presenilin I–467, I–463 and I–374. Feder Eur Biochem Soc Lett 1996; 381: 7–11. [ Links ]
36. LAMB BT. Presenilins, amyloid–β and Alzheimer's disease. Nat Med 1997; 3: 28–29. [ Links ]
37. SELKOE DJ, PODLISNY MB, JOACHIM CL, VICKERS EA, LEE G, FRITZ LC, et al. β–amyloid precursor protein of Alzheimer's disease occurs as 110– to 135–kilodalton membrane–associated proteins in neural and nonneural tissues. Proc Natl Acad Sci USA 1988; 85: 7.341–7.345. [ Links ]
38. PÅHLSSON P, SPITALNIK S. The role of glycosylation in synthesis and secretion of –amyloid precursor protein by Chinese hamster ovary cells. Arch Biochem Biophy 1996; 331: 177–186. [ Links ]
39. JUNG SS, NALBANTOGLU J, CASHMAN NR. Alzheimer's beta–amyloid precursor protein is expressed on the surface of immediately ex vivo brain cells: A flow cytometric study. J Neurosci Res 1996; 46: 336–348. [ Links ]
40. LOPEZ N, MULLER U, FRADE JM. Lengthening of G2/mitosis in cortical precursors from mice lacking beta–amyloid precursor protein. Neuroscience 2005; 130: 51–60. [ Links ]
41. PALLISTER C, JUNG SS, SHAW I, NALBANTOGLU J, GAUTHIER S, CASHMAN NR. Lymphocyte content of amyloid precursor protein is increased in Down's syndrome and aging. Neurobiol Aging 1997; 18: 97–103. [ Links ]
42. DAVIES TA, LONG HJ, TIBBLES HE, SGRO KR, WELLS JM, RATHBUN WH, et al. Moderate and advanced Alzheimer's patients exhibit platelet activation differences. Neurobiol Aging 1997; 18: 155–162. [ Links ]
Recibido: 13 de octubre de 2004
Aceptado: 17 de febrero de 2005