Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.18 no.1 Medellín Jan./Mar. 2005
EDUCACIÓN MÉDICA
Plastinación, una técnica moderna al servicio de la anatomía
Plastination: a modern anatomical technique
Ricardo Jiménez Mejía1, Óscar Isaza Castro2
1 Médico y Cirujano, Especialista en Ciencias Básicas Biomédicas, Universidad de Antioquia, Profesor Asistente, Educación Médica, Medellín, Colombia.
2 Tecnólogo en Tanatopraxia, Auxiliar de Anfiteatro, Departamento de Morfología. Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
RESUMEN
La preservación y el mantenimiento de los cadáveres y especímenes anatómicos han llevado a la búsqueda de técnicas diferentes y a la utilización de sustancias distintas al formaldehído con el fin de minimizar los riesgos de exposición a vapores químicos y a agentes biológicos y de disponer de preparados anatómicos con mayor durabilidad, conservando las características anatómicas y facilitando la docencia y la investigación en la disciplina. Una de estas técnicas es la plastinación. Presentamos los resultados obtenidos con ella en la Facultad de Medicina de la Universidad de Antioquia.
PALABRAS CLAVE: curado, deshidratación, especímenes anatómicos, fijación, impregnación forzada, plastinación
SUMMARY
The preservation and maintenance of anatomical specimens and corpses have created the need for new techniques and for the use of substances different from formaldehyde, in order to lessen the risks of exposure to this substance and to biological agents, and to increase the availability and durability of anatomical pieces preserving their characteristics in order to facilitate teaching and research. In the eighth decade of the XX century the German anatomist von Hagens patented the plastination technique that consists of replacing the water of tissues by silicones, polymers or resins. The plastination process includes four steps: fixation, dehydration, impregnating and curing.
There are some difficulties in Colombia regarding the availability of acetone, polymers and silicones as well as a lack of adequate infrastructure for the plastination process; because of this we have modified the technique using other substances at different pressure and temperature conditions; we report the modifications with which we have obtained very good results.
KEY WORDS: anatomical specimens, curing, dehydration, fixation, forced impregnating, plastination
INTRODUCCIÓN
La preservación de cadáveres y especímenes anatómicos es un proceso descrito desde la antigüedad. Los egipcios aportaron al conocimiento médico y de la industria funeraria el uso de sustancias químicas y técnicas para embalsamar; son clásicas las descripciones anatómicas en las obras de Hipócrates, Galeno, Avicena, Vesalio, Leonardo da Vinci, entre otros, y las ilustraciones anatómicas de importantes artistas como el mismo da Vinci, Rembrandt y en la modernidad, Testut Latarget.
En los últimos años, las dificultades para el transporte, la preservación y el mantenimiento de especímenes anatómicos y de cadáveres han ido en aumento; entre ellas se pueden enunciar la contaminación por vapores de formaldehído y otras sustancias químicas empleadas en el proceso de preservación, los riesgos biológicos relacionados con los cadáveres y algunas enfermedades como la tuberculosis, la hepatitis y las encefalitis lentas descritas en la literatura, las enfermedades ocupacionales posiblemente asociadas a la exposición prolongada al formaldehído, la legislación nacional e internacional que cada vez es más rigurosa con relación al transporte, la custodia y el destino final de los cadáveres humanos y la durabilidad de estos y de los especímenes anatómicos por la manipulación frecuente en las diferentes actividades académicas. Estos aspectos fundamentales en el análisis de la problemática, motivaron la búsqueda de técnicas modernas y el uso de otras sustancias químicas durante todo el proceso de preservación de los cuerpos humanos y animales al servicio de la ciencia.
PLASTINACIÓN
La técnica de la plastinación fue inventada por el anatomista alemán von Hagens, quien comenzó a trabajar en su desarrollo desde la década de los años 70 del siglo XX y entre 1980 y 1982 patentó en Europa y Norteamérica los productos diseñados en su laboratorio como la silicona, los polímeros y las resinas de tipo epóxido, así como los catalizadores y los equipos necesarios para la técnica, e igualmente la plastinación como tal; a finales del siglo XX entregó sus conocimientos al servicio de la humanidad y se dedicó a la exposición en diferentes partes del mundo –Pekín, Londres, Berlínde obras artísticas que muestran en su integridad la anatomía humana y animal.
La técnica incluye cuatro etapas: fijación, deshidratación, impregnación forzada y curado.
La fijación se realiza a bajas temperaturas, por debajo de 15º C, mediante la inyección e inmersión del cadáver o espécimen en soluciones de formaldehído a una concentración por debajo del 5%, por un período de 4 a 8 semanas de acuerdo con el tamaño del órgano y la contextura del cadáver; durante esta etapa se recomienda disecar según las estructuras que se quiera demostrar y el objetivo por el cual se va a realizar todo el proceso, así como el uso de soluciones de hierro u otras para la preservación del color natural del órgano o del cadáver.
Para la deshidratación se recomienda la inmersión del preparado o cuerpo en baños de acetona, que deben iniciarse en concentraciones no mayores del 70%; semanalmente se cambia el baño aumentando la concentración del solvente, hasta lograr una deshidratación por lo menos del 99%, la cual se determina mediante el acetanómetro, que no está disponible en nuestro medio. Esta etapa también debe realizarse a bajas temperaturas, por debajo de 15º C, pues de lo contrario (temperatura ambiente), los especímenes o los órganos sufren algún grado de contracción, denominada retracción.
Para la impregnación forzada se debe elegir entre siliconas, polímeros y epóxidos; las siliconas se utilizan para preparados flexibles y los dos últimos para realizar la inclusión de cortes axiales o sagitales de segmentos corporales útiles en la comparación con las imágenes de la tomografía o la resonancia magnética; el proceso se lleva a cabo mediante una cámara y una bomba de vacío: la presión de vacío generada en la cámara facilita la evaporación del solvente y el ingreso a los tejidos de las moléculas del material seleccionado; debe realizarse por un período no menor de 7 días. El proceso de curado varía según el material utilizado: para los especimenes impregnados con silicona se utiliza una cámara de gas por un período de 3 días y luego se mantiene el espécimen hasta por seis meses en un recipiente o una bolsa sellados (el período se determina por el tamaño del órgano o preparado anatómico); para los cortes impregnados con polímeros o resinas de tipo epóxido se recomienda el uso de calor o luz ultravioleta por 24 horas; durante la etapa de curado se deben eliminar los restos del material utilizado.
La dirección de las piezas que se someten a esta última etapa puede haberse llevado a cabo durante las etapas de deshidratación e impregnación.
LA EXPERIENCIA EN LA UNIVERSIDAD DE ANTIOQUIA
En colombia, los controles gubernamentales para la obtención y el manejo de la acetona y los altos costos de importación de la silicona y los polímeros recomendados para la plastinación, han dificultado la realización del proceso; a ello cabe añadir la carencia de una infraestructura adecuada, todo lo cual nos ha movido a variar la técnica mediante el uso de otras sustancias y de diferentes condiciones de temperatura y presión. En la Facultad de Medicina de la Universidad de Antioquia, hemos obtenido buenos resultados utilizando alcohol isopropílico en la deshidratación y resinas de tipo Cristalán 818® en las etapas de impregnación y de curado.
MATERIALES Y MÉTODOS
Se realizaron trabajos de plastinación con cortes de los hemisferios cerebrales, un corte sagital de un feto humano de 18 semanas, aproximadamente, y otros de corazones y pulmones de cerdo.
La fijación del cerebro y del feto se realizó con formol al 10% por un período de 4 semanas y la inmersión, en la solución de Kairseling (formalina con glicerina y acetato de sodio y de potasio), por otras 4 semanas. Para la etapa de deshidratación se sometieron los especímenes a concentraciones crecientes de alcohol isopropílico, con una concentración inicial del 70% por una semana e incrementos a 80, 90, 95 y 100%; en cada concentración se sumergieron los especímenes por una semana. No se determinó el porcentaje de deshidratación por carecer del equipo necesario.
La impregnación forzada de los cortes axiales de cerebro y sagital de feto, se realizó por 24–48 horas utilizando como cámara de vacío un recipiente de cocina debidamente sellado con empaque de silicona y conectado mediante una válvula unidireccional a un equipo aspirador de cirugía con el cual se lograron presiones de 5–12 mmHg. Se utilizó una resina local, Cristalán 818®, mezclada con estireno en proporción 8:2 y MEK–peróxido y cobalto como catalizadores de acuerdo con las recomendaciones de la casa fabricante. Los cortes se incluyeron en doble capa de la resina y el curado se hizo a temperatura ambiente.
La fijación del corazón, llevada a cabo en España, se hizo con formol al 5%, la deshidratación se llevó a cabo a temperatura ambiente por inmersión en acetona 90, 95 y 100%, la impregnación forzada se realizó a –25º C, con control del vacío con silicona alemana Bioudur®; antes de la etapa de curado se hizo disección del preparado; el curado se llevó a cabo en cámara de gas por 3 días y luego 3 meses más en recipiente cerrado.
Los pulmones y un bloque corazón–pulmones de cerdo se utilizaron en fresco; en ambos preparados pulmonares se aplicó aire comprimido hasta que alcanzaron su tamaño natural, dejándolos insuflados por 24 o más horas a temperatura ambiente; se preparó una mezcla de silicona RTV® con su catalizador, se dividió la mezcla en dos partes iguales, y luego una de ellas, a su vez, se subdividió en partes iguales; a una se le adicionó pigmento azul y a la otra, pigmento rojo; la otra mitad de la preparación quedó en su color blanco original. Se canalizaron las cavidades cardíacas, en las derechas se inyectó la silicona con pigmento rojo y en las izquierdas, la que tenía pigmento azul; posteriormente se canalizó la tráquea y se inyectó la silicona RTV® de color blanco. Los especímenes con la silicona inyectada se dejaron por 24 horas al medio ambiente y se sometieron luego a cocción y presión, finalmente se lavaron en agua corriente, se les retiraron manualmente los restos de órganos y se dejaron secar a temperatura ambiente.
RESULTADOS
Se obtuvieron especímenes anatómicos con diferentes presentaciones según el material utilizado para la impregnación:
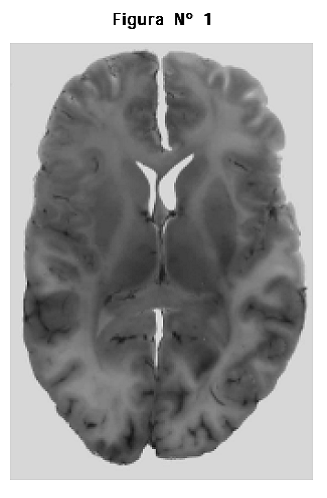
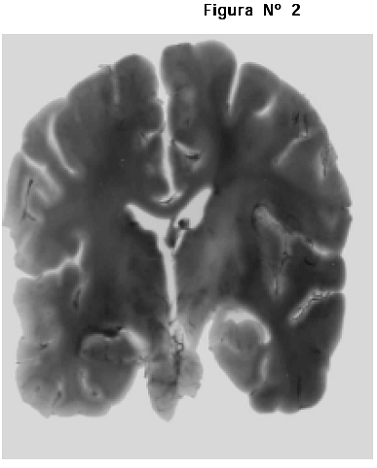
1. Cortes transversales y coronales de los hemisferios cerebrales incluidos en la resina Cristalán 818®; en estos cortes se pudo definir con gran precisión la diferencia entre las sustancias gris y blanca, la presencia de los núcleos basales y en general se obtuvo un buen detalle de la anatomía interna. Se observó que los diferentes cortes presentaron un grado importante de retracción (contracción del tejido) la cual no fue medida (Figuras Nº 1 y 2).
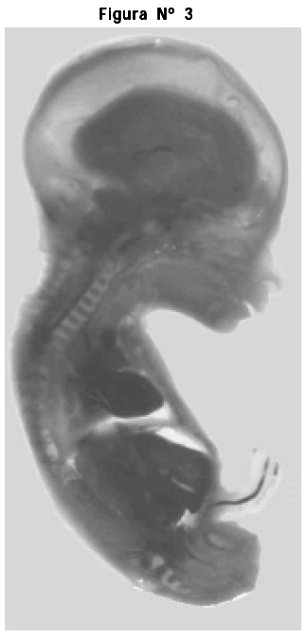
2. Corte sagital de feto incluido en la resina Cristalán 818® se preservaron las relaciones anatómicas, se observaron los distintos elementos que hacen parte de los diferentes sistemas corporales, se presentó un discreto grado de retracción en el tamaño del feto por las estructuras óseas presentes; sin embargo, la retracción de los órganos internos fue mayor (Figura Nº 3)
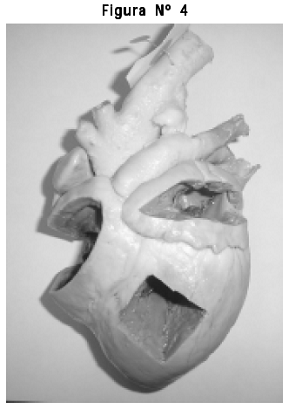
3. Preparado anatómico de corazón, técnica de silicona, impregnación con Bioudur®disección de grandes vasos y apertura de ventanas en ambos ventrículos y aurículas para visualizar la anatomía interna de estas cavidades y la organización del aparato valvular auriculoventricular. No se presentó retracción en el órgano (Figura Nº 4).
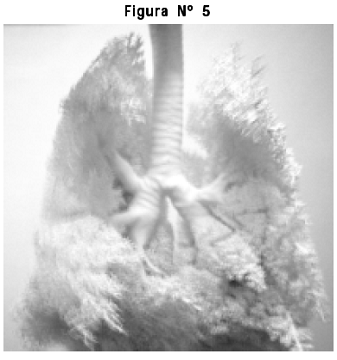
4. Preparado anatómico del árbol traqueobronquial, en silicona RTV®. Se aprecian las divisiones sucesivas desde la tráquea hasta los alvéolos, se definen claramente los bronquios principales, lobulares, segmentarios y la distribución en lóbulos de ambos pulmones (Figura Nº 5).
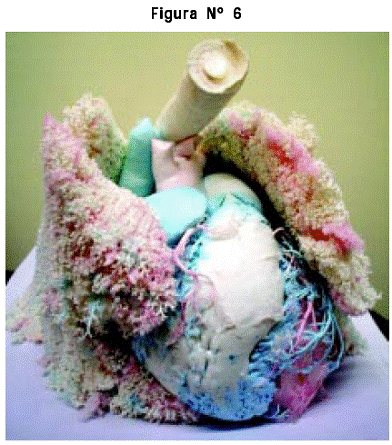
5. Preparado anatómico de cavidades cardíacas, circulación pulmonar y coronaria y árbol traqueobronquial, en silicona RTV®: se demuestran las circulaciones pulmonar, sistémica y coronaria, los lóbulos pulmonares con la división sucesiva del árbol bronquial y la relación entre los vasos sanguíneos arteriales, pigmentados con color azul, y los venosos, de color rosado, dentro del parénquima pulmonar, entremezclados con las divisiones bronquiales (Figura Nº 6).
DISCUSIÓN
Los diferentes trabajos realizados con la técnica de plastinación han permitido demostrar la importancia de esta herramienta innovadora al servicio de la anatomía, mediante la elaboración de preparados anatómicos con el proceso descrito por von Hagens, figuras 4,5 y 6, y evidenciar la posibilidad de múltiples aplicaciones en el aprendizaje de la anatomía y en la exposición permanente de los especímenes anatómicos en la Colección del Ser Humano, del Museo Universitario.
Las dificultades para la obtención y manejo de la acetona en Colombia, por ser un insumo para el procesamiento de la cocaína, se superaron mediante el uso del alcohol isopropílico, el cual es de más fácil acceso y más económico; la retracción encontrada en los preparados realizados se debió principalmente a la temperatura a la cual se llevó a cabo la deshidratación con este solvente; se espera que su empleo a bajas temperaturas permita obtener menor grado de retracción en los preparados anatómicos que se vayan a plastinar.
De otro lado, el uso de resinas locales, como el Cristalan 818®, permitió la obtención de cortes del sistema nervioso y de un feto, figuras 1, 2 y 3, comparables con los especímenes obtenidos en otras partes del mundo, con la técnica de plastinación en polímeros, no disponibles en nuestro medio; se debe continuar trabajando en esta variación de la técnica buscando hacer el vaciado en una sola capa, controlando la reacción exotérmica que se genera al preparar la resina y obteniendo cortes incluidos que no superen el centímetro de espesor total.
La técnica de plastinación es un proceso innovador, que tiene algunas ventajas:
a. Al cerrar completamente los recipientes en que se realiza, disminuye la exposición a vapores de sustancias químicas incluyendo el formaldehído.
b. Por su acabado elimina por completo el riesgo de exposición a agentes biológicos y permite la manipulación sin necesidad de las medidas de bioseguridad del usuario final.
c. Facilita la preservación durante más tiempo.
d. Resiste con mayor facilidad el trato, a veces inadecuado, por parte de los diferentes usuarios.
e. Es la técnica de preservación para la anatomía del siglo XXI.
Nuestros resultados y los trabajos hechos en más de 250 universidades de diversos países facilitaron la realización del proyecto de plastinación en la Facultad de Medicina de la Universidad de Antioquia; se espera, para el año 2005, disponer del laboratorio adecuado para poner esta técnica y sus resultados al servicio de la docencia, la investigación y la extensión, ejes centrales del quehacer universitario.
AGRADECIMIENTOS
El trabajo de plastinación con resinas locales tuvo el apoyo de la Doctora María Cristina Sánchez Palacio, desde la jefatura del Departamento de Morfología, así como el de los decanos, Doctores Alberto Uribe Correa y Luis Javier Castro Naranjo.
Por su participación en los cursos sobre la técnica de Siliconas y en las 11ª y 12ª Conferencias Internacionales de Plastinación, el autor agradece a los Profesores Robert Henry, de la Universidad de Tennesse, y Rafael Latorre, de la Universidad de Murcia, quienes con su experiencia, comprensión y ayuda desinteresada facilitaron la realización de algunos de los especímenes presentados en este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. VON HAGENS G. Heildelberg Plastination Folder. Anatomisches Institut I, Universitat Heildelberg, 1985–1986. [ Links ]
2. JIMÉNEZ R, ISAZA O. Use of polymers in plastination with human specimens. International Plastination Society ISP Journal 2002; 17 (abstract): 6. [ Links ]
3. AMEED R. Using a room–temperature plastination technique in assessing prenatal changes in the human spinal cord. International Plastination Society ISP Journal 2001; 16 (abstract): 5–8. [ Links ]
4. HENRY R, BROWN A, REED RB. Current topics on dehydration. International Plastination Society ISP Journal 1998; 13 (abstract): 27–28. [ Links ]
5. ZHENG T, WEATHERHEAD B, GOSLING J. Plastination at room temperature. International Plastination Society ISP Journal 1996; 11: 33. [ Links ]
6. BROWN MA, REED RB, HENRY RW. Effects of dehydration mediums and temperature on total dehydration time and tissue shrinkage. J Internat Soc Plastination 2002; 17: 28–33. [ Links ]
7. VON HAGENS GK, TIEDEMANN KW. The current potential of plastination. Anatomy Embryology 1975; 175: 411–421. [ Links ]
8. BOHANNON J. Anatomy's Full Month. Science 2003; 301: 1.172–1.175. [ Links ]
9. DENIZ DR, ALP BL, EMSETTIN UE.ef review and suggested guidelines. The Anatomical Record (new anat.) 2002; 269: 194–197. [ Links ]
10. IMBUS HR. A guide to formaldehyde. North Carolina Department of Labor Division of Occupational Safety and Health. Administration –OSHA–. 2003; 4–7. [ Links ]
Recibido: diciembre 7 de 2004
Aceptado: enero 21 de 2005