Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.18 no.3 Medellín July/Sept. 2005
PRESENTACIÓN DE CASO
Púrpura fulminans asociada al embarazo
Pregnancy–associated purpura fulminans (pf)
Luis G. González P. 1; Álvaro M. Quintero Ossa1; Carlos A. Cadavid Gutiérrez1,2; Jorge H. Donado Gómez1,3; Álvaro H. Restrepo C. 1; Juan M. Toro Escobar1; Nora E. Saldarriaga Cartagena1; Martín E. Vásquez. 1; Marisol Bedoya A. 4; Gisela de la Rosa Echavez.1,2
1 Médico internista
2. Médico intensivista
3. Médico Epidemiólogo Clínico
4. Enfermera Unidad de cuidados intensivos
Grupo de Investigación en Cuidados Intensivos (GICI) Hospital Pablo Tobón Uribe, Medellín, Colombia.
RESUMEN
LA PÚRPURA FULMINANS (PF) ES UNA ENFERMEDAD cutánea purpúrica aguda asociada a un síndrome de coagulación intravascular diseminada (CID). Sus causas conocidas incluyen infecciones virales y bacterianas así como trombofilias. Es sabido que durante el embarazo existen alteraciones en los mecanismos hemostáticos, sin embargo, no se ha demostrado que estos fenómenos por sí solos ayuden al desarrollo de la PF.
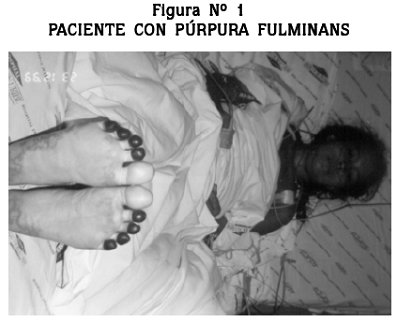
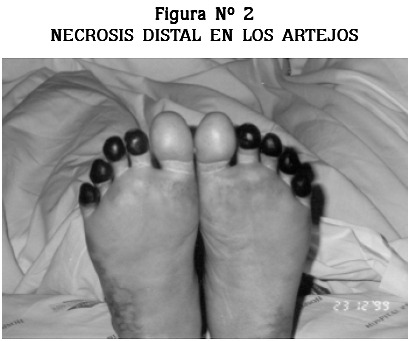
Se describe el caso de una mujer de 22 años, quien tuvo PF en circunstancias inusuales tales como el desarrollo de su cuadro durante el embarazo y el origen probable en una infección por E. coli. Se presentan los hallazgos clínicos, las intervenciones médicas y quirúrgicas y el desenlace. La paciente sobrevivió, pero hubo necesidad de amputarle las falanges distales de tres artejos del pie izquierdo.
PALABRAS CLAVE: coagulación intravascular diseminada, embarazo, escherichia coli, heparina, proteína c, púrpura fulminans
SUMMARY
PF is a serious cutaneous purpuric disease, associated with an intravascular disseminated coagulation syndrome. Among its known causes, besides those of thrombophilia, are viral and bacterial infections, mostly Neisseria meningitidis. During pregnancy there are alterations in the hemostatic mechanism. However, by themselves, they have not been shown to lead to PF.
The case of a 22–year–old woman who developed PF during pregnancy, presumably due to her Escherichia coli urinary tract infection, is presented including clinical, paraclinical, therapeutic and surgical aspects. She recovered but suffered amputation of the distant phalanges of three toes in the left foot.
KEY WORDS: disseminated intravascular coagulation, escherichia coli, heparin, pregnancy, protein c, purpura fulminans
Caso clínico
Mujer de 22 años, con 28 semanas de gestación, quien consultó por fiebre, vómito y disuria. Se le documentó una infección urinaria por Escherichia coli que se trató con ceftriaxona. Un día después presentó parto prematuro con muerte perinatal y fue trasladada a la UCI por hipotensión e hipoxemia refractarias. Ingresó con los siguientes signos vitales: presión arterial 80/57 mm/Hg, frecuencia cardíaca 160/min, frecuencia respiratoria 37/min, saturación arterial de oxígeno 84% y disminución del volumen urinario que evolucionó rápidamente a insuficiencia renal aguda anúrica. Presentaba lesiones purpúricas en los antebrazos, las manos y los pies (Figuras Nº 1,2).
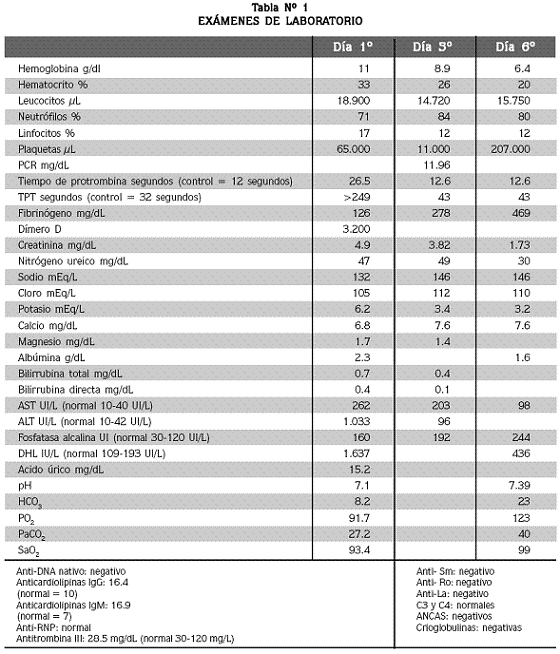
Se iniciaron ventilación mecánica, soporte vasopresor y hemodiafiltración. Ante la sospecha de una púrpura fulminans (PF) se tomaron biopsias de piel y se le administró heparina IV, 500 unidades/hora (Tabla Nº 1, día 1).
Al día siguiente presentó nuevo deterioro de la oxigenación, disminución de la hemoglobina (Tabla Nº 1, día 6) y empeoramiento radiológico; el cepillado y el lavado bronquiales dieron los siguientes resultados: células cilíndricas ciliadas con cambios degenerativos y algunas bien preservadas; eritrocitos e infiltrado inflamatorio de polimorfonucleares neutrófilos, que son positivos a la coloración del hierro (hemosiderófagos). Diagnóstico: hemorragia alveolar. Cuatro días después la paciente presentó mejoría clínica y de las alteraciones de la coagulación (Tabla Nº 1, día 5º), por lo cual se le retiraron el ventilador, el hemofiltro y el soporte vasopresor. Una vez recuperada se le amputaron las falanges distales de los artejos tercero, cuarto y quinto del pie izquierdo. Los cortes histológicos hechos en los especímenes quirúrgicos mostraron la epidermis revestida por epitelio escamoso con hiperqueratosis, paraqueratosis y áreas extensas de ulceración; en la dermis había vasos trombosados con abundantes áreas hemorrágicas y marcada extravasación de eritrocitos. Los hallazgos histológicos fueron compatibles con púrpura fulminans.
El resultado de las biopsias de piel fue el siguiente: epitelio escamoso dentro de límites histológicamente normales. En la dermis se encuentran hemorragia, extravasación de glóbulos rojos al tejido conectivo perivascular y presencia de vasos con trombos de fibrina que ocluyen la luz. En algunas áreas los trombos llevan a cambios isquémicos en el tejido adyacente. Los hallazgos histológicos son compatibles con púrpura fulminans.
DISCUSIÓN
La PF es una enfermedad cutánea aguda asociada a un síndrome de coagulación intravascular diseminada (CID).1 Es el resultado de alteraciones complejas en los mecanismos hemostáticos. Las vías procoagulantes se activan mientras que las vías anticoagulantes naturales y las fibrinolíticas no lo hacen.2 La proteína C es la principal vía de inactivación en la generación de trombina; para que dicha proteína se active, y se inactive la generación de trombina, se requiere la unión a su receptor endotelial y a la trombomodulina. En la PF se reduce la expresión del receptor endotelial y de la trombomodulina, lo cual altera la activación de la proteína C, con incremento de la generación de trombina. Es posible que algunos microorganismos como la Neisseria meningitidis generen mayor alteración en esta vía, lo cual explicaría por qué solo ellos se relacionan con este proceso.3 Se han documentado niveles anormales de proteína C en pacientes con PF asociada a procesos infecciosos.4 A lo anterior se suman otros cofactores que se encuentran disminuidos durante procesos infecciosos y postinfecciosos y no participan en la activación de la proteína C.5,6 Otras causas menos frecuentes son las alteraciones en los niveles de las proteínas C y S en los pacientes que reciben warfarina1 y la disminución de la antrombina III, la que al ser repuesta durante una CID sirve como recurso terapéutico.3
Se puede encontrar el cuadro clínico de la PF en tres escenarios:
- En el período neonatal, como manifestación de un déficit homocigótico de la proteína C o, menos frecuentemente, por deficiencia de la proteína S.
- En individuos con una infección aguda bacteriana o viral. Algunos de los microorganismos implicados son: Neisseria meningitidis, Streptococcus pneumoniae, Streptococcus pyogenes, Staphylococcus aureus, Bacteroides fragilis, Capnocytophaga canimorsus y Fusobacterium sp. y los virus de la varicela, la rubéola, la parotiditis y el exantema viral.
- Como un síndrome postinfeccioso.5–7
La mayoría de los casos han sido descritos en niños. De 10–20% de los pacientes con meningococcemia desarrollan PF; su tasa de mortalidad con solo el tratamiento de soporte es de 60%.3
Las manifestaciones clínicas se caracterizan por petequias y eritema con o sin edema que evolucionan a pápulas purpúricas, dolorosas, bien demarcadas y, finalmente, vesículas y bulas relacionadas con la necrosis hemorrágica.2 Los hallazgos patológicos consisten en trombosis microvascular que compromete la dermis, con hemorragia e infiltrado agudo de células inflamatorias, sin daño endotelial ni vasculitis.3 La frecuencia de necrosis tisular permanente que obliga a amputaciones es del 25%; la PF es una entidad altamente discapacitante o mortal.2
El manejo consiste en el tratamiento de la enfermedad subyacente y en medidas básicas de soporte. Sin embargo, existen otras terapias encaminadas a corregir las alteraciones de la hemostasia, mediante la substitución de los factores deficitarios o la activación local de algunas vías fibrinolíticas.
La heparina puede ser efectiva para prevenir el desarrollo de necrosis de la piel, particularmente en los estados trombóticos o pretrombóticos. Su efecto se monitoriza con la medición del nivel de fibrinógeno y el recuento de plaquetas, los cuales deben mantenerse por encima de 200 mg/dL y 50.000 µL, respectivamente.8 El plasma fresco congelado contiene los factores de la coagulación necesarios para una hemostasia adecuada; sin embargo, sus requerimientos son excesivos para lograr niveles suficientes de muchos de los factores. 7 La administración de proteína C activada exógena a los pacientes con PF relacionada con meningococcemia ha disminuido la mortalidad hasta el 5%. En pacientes con PF que no responden a la administración de heparina y en quienes el nivel de antitrombina III cae por debajo de 35 mg/dL, la administración de esta última permite la activación de la proteína C, con la subsiguiente inactivación de la generación de la trombina.9
La terapia trombolítica en pacientes con PF debe reservarse para cuando hay choque y trombosis de vasos mayores.10
La PF es más frecuente en niños que en adultos pero tiene en estos últimos, altas tasas de morbilidad y mortalidad.11 El amplio espectro de condiciones congénitas y adquiridas relacionadas con el fenómeno, así como las complejas interacciones de las vías de la coagulación y fibrinolítica, que demuestran una actividad simultánea no explicada por un fenómeno único, hacen que hasta ahora haya sido imposible un enfoque terapéutico que evite la aparición y las complicaciones de la enfermedad.12
La paciente se presentó a la consulta con un embarazo de 28 semanas e infección urinaria por Escherichia coli que riginó el estado séptico y el parto pretérmino. La Escherichia coli ha sido propuesta como desencadenante de los mecanismos fisiopatológicos que producen la PF; sin embargo, no está demostrada su participación en el fenómeno y no es un germen identificado con frecuencia en pacientes con esta enfermedad. En el caso de patógenos como la Neisseria meningitidis se han dilucidado algunos eventos endoteliales que favorecen la aparición del cuadro.3 No se sabe si la enfermedad es consecuencia de propiedades patogénicas de cada uno de los virus o bacterias asociados con ella o si es solamente una parte de un síndrome séptico con grandes alteraciones en las vías anticoagulantes y fibrinolíticas.
En condiciones normales el embarazo produce descenso del nivel de proteína S y altera la respuesta de la vía de la coagulación a la proteína C activada; no obstante, no se ha demostrado que estos fenómenos por sí mismos faciliten el desarrollo de la PF. Sin embargo, en el caso que presentamos no había antecedentes clínicos de estados protrombóticos y las determinaciones de laboratorio tampoco sugirieron alteraciones de este tipo, aunque no se puede descartar que las hubiera en la expresión de la trombomodulina y del receptor de la proteína C. Esta última, que usualmente se halla disminuida en la PF 3 y que incluso se postula como eje central de los mecanismos fisiopatológicos, se mantuvo en esta paciente dentro del rango normal.
Los resultados obtenidos con la administración a esta paciente de heparina a bajas dosis 'sustancias que solo afectan uno de los extremos de la cascada fisiopatológica' como único modulador de la cascada de la coagulación, hace suponer que entre los mecanismos desencadenados en desarrollo de la PF hay algunos diferentes del de la proteína C. Con la evidencia actual, es difícil demostrar cuál de ellos está involucrado cuando la etiología es infecciosa o de otro tipo o incluso si son distintos cuando el agente infeccioso implicado no es la N. meningitidis.
REFERENCIAS BIBLIOGRÁFICAS
1. SMITH OP, WHITE B. Infectious purpura fulminans: Diagnosis and treatment. Br J Haematol 1999; 104: 202–207. [ Links ]
2. ESMON CT. The protein C pathway. Crit Care Med 2000; 28: 544–548. [ Links ]
3. FAUST SN, LEVIN M, ODILE B, et al. Dysfunction of endothelial protein C activation in severe meningococcal sepsis. N Engl J Med 2001; 345: 408–416. [ Links ]
4. CORRIGAN JJ. Púrpura fulminante neonatal. En: BEHRMAN R, KLIEGMAN R, ARVIN A, eds. Nelson: Tratado de Pediatría. Madrid; McGraw–Hill; 1997, pp 1793. [ Links ]
5. JACKSON RT, LUPLOW RE. Adult purpura fulminans and digital necrosis associated with sepsis and the factor V mutation. JAMA 1998; 280:1829–1830. [ Links ]
6. AL–ISMAILS S, COLLINS P, NAJIB R, et al. Postinfection purpura fulminans in a patient heterozygous for prothrombin G 20210 A and acquired protein S resistence. Pediatr Hematol Oncol 1999; 16: 561–564. [ Links ]
7. GERSON WT, DICKERMAN JD, BOVILL EG, GOLDEN E. Severe acquired protein C deficiency in purpura fulminans associated with disseminated intravascular coagulation: Treatment with protein C concentrate. Pediatrics 1993; 91: 418–422. [ Links ]
8. CHENAILLE PJ, HOROWITZ ME. Purpura fulminans. A case for heparin therapy. Clin Pediatr 1989; 28: 95–98. [ Links ]
9. FOURRIER F, LESTAVEL P, CHOPIN C, et al. Meningococcemia and purpura fulminans in adults: Acute deficiencies of proteins C and S and early treatment with antithrombin III concentrates. Intensive Care Med 1990; 16:121–124. [ Links ]
10. GARY L. DARMSTADT MD. Acute infectious purpura fulminans: Pathogenesis and medical management. Pedatr Dermatol 1998; 15: 169–183. [ Links ]
11. FAUST SN, HEYDERMAN RS, LEVIN M. Disseminated intravascular coagulation and purpura fulminans secondary to infection. Best Pract Res Clin Haematol 2000; 13: 179–199. [ Links ]
12. SHIMURA M, WADA H, WAKITA Y, et al. Plasma tissue factor and tissue factor pathway inhibitor levels in patients with disseminated intravascular coagulation. Am J Hematol 1996; 52: 165–170. [ Links ]
Recibido: 29 de julio de 2005
Aceptado: 25 de agosto de 2005