Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.19 no.1 Medellín Jan./Mar. 2006
ARTÍCULO DE REVISIÓN
El Bocavirus humano: un nuevo virus respiratorio
Human bocavirus: a new respiratory virus
Carlos A. Aguirre Muñoz1
1. Pediatra Virólogo, Profesor de la Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Correo electrónico: ceaeme@epm.net.co
RESUMEN
LAS INFECCIONES RESPIRATORIAS AGUDAS son una causa muy importante de morbilidad y mortalidad, especialmente en los niños y en los países en desarrollo. Con los métodos de laboratorio actuales, aproximadamente una tercera parte de estas infecciones se queda sin diagnóstico etiológico. Se acepta que los virus juegan un papel cardinal y que más de 200 virus, pertenecientes a seis familias virales están implicados en la génesis de este problema. La familia Parvoviridae se conoce desde mediados del siglo XX. El Parvovirus humano B19, identificado en 1980 y causante de enfermedades febriles y exantemáticas, fue considerado por muchos años como el único miembro de esta familia capaz de afectar a la especie humana. Sin embargo, un grupo de investigadores suecos comandado por Tobías Allander informó en agosto de 2005 el hallazgo de un nuevo Parvovirus, denominado provisionalmente Bocavirus humano, relacionado con infección respiratoria aguda en niños. En este artículo se resumen las características de este nuevo agente, se resalta la importancia de su hallazgo y de la técnica de investigación empleada.
PALABRAS CLAVE: BOCAVIRUS HUMANO, INFECCIÓN RESPIRATORIA AGUDA, PARVOVIRUS
SUMMARY
Respiratory tract infections are a leading cause of morbidity and mortality, mainly in children and also in developing countries. The aethiology of approximately 30% of these infections remains obscure, using current laboratory methods. It has been accepted that viruses play an important role and more than 200 viruses, belonging to 6 viral families are implied in the pathogenesis of this problem. Parvoviridae family has been known since the middle of the XX century. Human Parvovirus B19 was identified in 1980; it causes rashes and febrile diseases and it was considered for many years as the only member of this family able to affect humans. However, Dr. Tobias Allander and colleagues, at Karolinska Institut, have discovered a previously unknown parvovirus, called Human Bocavirus, that has been found to affect children, causing lower respiratory tract infections. This article summarizes the methodology applied, the characteristics of the new viral agent and the importance of this discovery.
KEY WORDS: HUMAN BOCAVIRUS, PARVOVIRUS, RESPIRATORY TRACT INFECTION
INTRODUCCIÓN
LAS INFECCIONES DEL TRACTO RESPIRATORIO inferior son una causa muy importante de morbilidad y mortalidad en todo el mundo, especialmente en los niños y en los países en vías de desarrollo; sin embargo, en el 12 al 39% de los casos no se encuentra el agente causal.1,2 Los virus ocupan un papel cardinal en la génesis de estas enfermedades y entre ellos se destacan el Virus Respiratorio Sincitial (VRS), los Influenzavirus A y B, los Adenovirus (Adv), los Virus Parainfluenza 1, 2 y 3, los Rhinovirus y los Coronavirus, estos últimos, agentes etiológicos del Síndrome Respiratorio Agudo y Grave (SARS–Cov), entre otros.3,4 Hoy se sabe que más de 200 virus, pertenecientes a 6 familias (Orthomyxoviridae, Paramyxoviridae, Picornaviridae, Coronaviridae, Adenoviridae y Parvoviridae) pueden causar infección respiratoria en la especie humana.
La investigación científica ha logrado en los últimos años importantes avances en este campo. Así, Bernadette van den Hoogen y sus colaboradores identificaron en 2001, en secreciones respiratorias de niños lactantes holandeses, un nuevo virus respiratorio, hoy denominado Metapneumovirus humano.5 De otro lado, a partir del descubrimiento del SARS–Cov en 2003 se suscitó un interés creciente en el estudio de los Coronavirus y de otros virus, para tratar de esclarecer la etiología de la infección respiratoria.6 Muchos de los grupos de investigación empeñados en esta tarea están utilizando modernas técnicas de biología molecular.
CARACTERÍSTICAS
Los primeros miembros de la familia Parvoviridae fueron identificados en los decenios de 1950 y 1960 como causantes de enfermedades de interés veterinario, conocidas de antaño en felinos, visones y cricetos y como contaminantes de cultivos de adenovirus.7–9 El nombre de la familia (derivado de parvus, pequeño) fue aceptado oficialmente en 1970.10 Posteriormente los parvovirus fueron encontrados en una amplia gama de animales.11,12 A finales del decenio de 1970 se identificó el Parvovirus canino,13 causante de una gran epizootia de enteritis y miocardits y en 1980 se descubrió otro miembro de esta familia, responsable de la enfermedad aleutiana,14 una dolencia debida a complejos inmunes y prevalente en visones norteamericanos.
A comienzos de la década de 1980 se identificó el Parvovirus humano B19, causante del eritema infeccioso o “quinta enfermedad” y de otras manifestaciones como el eritema macular y purpurino en guantes y calcetines, poliartropatías, crisis aplásticas en personas con disminución de la vida media eritrocitaria e hidropesía fetal no inmune entre otras.8 Pese a que en 1984 se descubrió otro Parvovirus, denominado RA–1, en pacientes con artritis reumatoide,15 su caracterización quedó incompleta y la investigación al respecto no prosperó, por lo cual el Parvovirus B19 permaneció como el único miembro de la familia presente en la especie humana. Sin embargo, en agosto de 2005, el grupo de Tobías Allander publicó el hallazgo de un nuevo Parvovirus causante de infección del tracto respiratorio inferior en niños, el cual fue denominado provisionalmente Bocavirus humano (abreviado como HboV, en inglés).16
La familia Parvoviridae afecta hospederos vertebrados e invertebrados; contiene virus pequeños, desnudos, icosahédricos, con genoma a base de ADN monocatenario, de unos 5kb. En el virión se empacan simultáneamente genomas con polaridades positiva y negativa. La familia comprende dos grupos: los que tienen replicación autónoma y los defectuosos (dependovirus), cuya replicación está sujeta a la de otros virus y en ella se conocen dos subfamilias (Parvovirinae y Densovirinae) y varios géneros, como se muestra en la tabla Nº1.8,17
IDENTIFICACIÓN DEL VIRUS
EL MENCIONADO GRUPO DE ALLANDER,16 desarrolló en el Instituto Karolinska (en Estocolmo, Suecia), una técnica de tamización viral en gran escala de muestras de secreción respiratoria, basada en el tratamiento con ADNasa, digestión con enzimas de restricción, amplificación con una técnica de PCR denominada de secuencia independiente de cebador sencillo (abreviada como DNase–SISPA en inglés o “random PCR”),18 secuenciación y bioinformática. Esta técnica, parecida a la empleada en el análisis del genoma humano, fue aplicada a una colección de 48 muestras de secreción respiratoria (38 de ellas provenientes de niños), obtenidas por aspiración nasofaríngea. Los experimentos iniciales identificaron 7 virus, entre los cuales hallaron un nuevo Coronavirus y un nuevo Parvovirus. La secuencia de aminoácidos de este último resultó muy cercana a la del Parvovirus bovino y a la de un Parvovirus canino (conocido como Virus diminuto de los caninos o MVC), ambos pertenecientes al género Bocavirus, dentro de la familia Parvoviridae. Sin embargo, constataron que el HBoV es diferente de los anteriores y solamente guarda una homología del 43% con el MCV, el más cercano desde el punto de vista filogenético.
Para evaluar la prevalencia del HBoV en muestras de secreción respiratoria y el cuadro clínico asociado, el grupo hizo una serie de experimentos adicionales. En el primero se estudiaron 378 muestras de aspirado nasofaríngeo, con cultivo negativo, recolectadas en varias clínicas servidas por el Laboratorio Universitario Karolinska (266 provenientes de niños y 112 obtenidas en adultos), entre noviembre de 2003 y septiembre de 2004. Se encontraron 7 muestras positivas, todas recolectadas en niños. En segundo lugar se hizo un estudio retrospectivo más amplio, basado en 540 muestras de secreciones respiratorias obtenidas en niños admitidos en el Hospital Universitario Karolinska, entre noviembre de 2003 y octubre de 2004, incluyendo algunas de las muestras analizadas en el estudio previo. El HBoV se encontró en 17 pacientes (3.1%), en 14 de ellos como germen único (en los otros 3 se encontró concomitantemente con VRS o con Adv).
CARACTERÍSTICAS CLÍNICAS
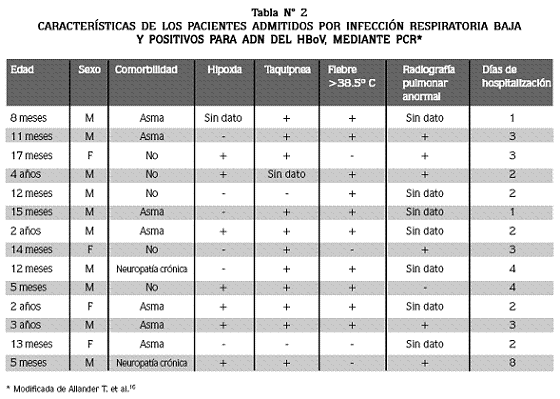
EL ANÁLISIS DE LAS HISTORIAS CLÍNICAS de los 14 niños que solamente tenían infección por HBoV demostró que todos habían sido admitidos por síndrome de dificultad respiratoria aguda, iniciado en el hogar, con 1 a 4 días de duración, como se muestra en la tabla Nº 2.
Las radiografías pulmonares demostraron infiltrados intersticiales y no se encontraron manifestaciones gastrointestinales, conjuntivitis ni exantemas.
CONCLUSIONES
EL GRUPO CONCLUYÓ QUE EL MÉTODO UTILIZADO es útil para el descubrimiento de nuevos agentes virales y que el HBoV es un nuevo patógeno, causante de infección respiratoria baja en niños, aunque no se sabe si es responsable de infecciones sistémicas o del daño de otros órganos.19
Este hallazgo ha sido muy bien recibido por la comunidad científica porque abre las puertas al conocimiento de virus causantes de infecciones respiratorias, a su diagnóstico y tratamiento y amplía el conocimiento de la familia Parvoviridae en general y de los Parvovirus que afectan a la especie humana. La tecnología utilizada (DNase–SISPA) es muy sensible (permite detectar cantidades tan pequeñas como 106 genomas virales por mililitro de muestra); a la vez es muy novedosa y ayudará a la identificación de virus hasta ahora no cultivables ni detectables por los métodos virológicos convencionales.
Recientemente, Teo Sloots y sus colaboradores20 hicieron un estudio etiológico retrospectivo, basado en el análisis de una colección de 324 muestras de secreciones respiratorias de pacientes hospitalizados en Australia por infección respiratoria baja. Mediante la técnica de RT–PCR, el HBoV se encontró en el 5.6% de las muestras, asociado en el 50% de los casos con otros virus respiratorios. La mayoría de las muestras positivas correspondía a niños de 6 meses a 2 años de edad. Este estudio refuerza los hallazgos de Allander y la importancia del HBoV en las infecciones respiratorias agudas
REFERENCIAS BIBLIOGRÁFICAS
1. MURRAY CJL, LÓPEZ AD, MATHERS CD, STEIN C. The global burden of disease 2000 projet: aims, methods and data sources. In: Global programme on evidence for health policy. Geneva: World Health Organization: 2001. [ Links ]
2. DAVIES HD, MATLOW A, PETRIC M, GLAZIER R, WANG EE. Prospective comparative study of viral, bacterial and atypical organisms identified in pneumonia and bronchiolitis in hospitalized Canadian infants. Pediatr Infect Dis J 1996; 15: 371–375 [ Links ]
3. RUIZ M, EWIG S, MARCOS MA. Etiology of community–acquired pneumonia: impact of age, comorbidity, and severity. Am Resp Crit Care Med 1999; 160: 397–405. [ Links ]
4. ESPER F, WEIBEL C, FERGUSON D, LANDRY ML, KAHN JF. Evidence of a novel Human Coronavirus that is associated with respiratory tract disease in infants and young children. J Infect Dis 2005; 191: 492–498. [ Links ]
5. VAN DEN HOOGEN BG, DE JON JC, KUIKEN T, DE GROT R, FOUCHIER RAM, OSTERHAUS D. A newly discovered human pneumovirus isolated from young children with respiratory tract disease. Nat Med 2001; 7: 719–724. [ Links ]
6. AGUIRRE C. El Metapneumovirus humano, un nuevo patógeno respiratorio. Memorias del Curso de actualización y controversias en Pediatría, 2005. Libro electrónico. Medellín, Departamento de Pediatría y Puericultura, Facultad de Medicina, Universidad de Antioquia. [ Links ]
7. WILLS CG. Notes on infectious enteritis of mink and its relationship with feline enteritis. Can J Comp Med 1952; 16: 419–420. [ Links ]
8. BLOOM ME, YOUNG NS. Parvoviruses. In: Knipe DM, Howley PM, Griffin DE, Martin MA, Lamb RA, Roizman B, Straus SE, editors. Fields´ Virology, 4th ed. Philadelphia: Lippincott Williams and Wilkins; 2001: 2.361–2.379. [ Links ]
9. BERNS KI, BOHENSKI RA. Adeno–associated viruses: An update. Adv Virus Res 1987; 32: 246–306. [ Links ]
10. LWOFF A, TOURNIER P. The classification of viruses. In: Clifton C. ed. Ann Rev Microbiol 1996; 20: 45–74. [ Links ]
11. COTMORE SF, TATTERSAL P. The autonomously replicating parvoviruses of vertebrates. Adv Virus Res 1987; 33: 91–174. [ Links ]
12. SIEGL G, Patterns of parvovirus diseases in animals. In: Pattison JR, editor. Parvoviruses and human disease. Boca Raton: CRC Press; 1998: 43–67. (PRIMERA EDICIÓN) [ Links ]
13. TRUYEN U, PARRISH CR. Canine and feline host ranges of canine parvovirus and feline panleukopenia virus. Distinct host cell tropisms of each virus in vitro and in vivo. J Virol 1996; 66: 5.399–5.408. [ Links ]
14. BLOOM ME, KANNO H, RACE RE, WOLFINBARGER JB. Characterization of Aleutian disease virus as a parvovirus. J Virol 1980; 251: 288–296. [ Links ]
15. STIERLE G, BROWN KA, RAINSFORD SG. Parvovirus associated antigen in the synovial membrane of patients with rheumatoid arthritis. Ann Rheum Dis 1987; 46: 219–223. [ Links ]
16. ALLANDER T, TAMMIS MT, ERIKSON M, BJERKNER A, TIVLEJUNG–LINDELL A, ANDERSSON B. Cloning of a human parvovirus by molecular screening of respiratory tract samples. PNAS 2005; 102: 12.891–12.896. [ Links ]
17. Parvovirus. Microbiology @ Leicester. Disponible en: http://www–micro.msb.le.ac.uk/3035/index.html. Consultada en enero de 2006. [ Links ]
18. REYES GR, KIM JP. Sequence–independent, singleprimer amplification (SISPA) of complex DNA populations. Mol Cell Probes 1991; 5: 473–481. [ Links ]
19. The World in Medicine: New respiratory virus. JAMA 2005; 294:1.331. [ Links ]
20. SLOTS T, McERLEAN P, SPEICHER DJ, ARDEN KE, NISSEN MD, McKAY IM. Evidence of human coronavirus HKU1 and human bocavirus in Australian children. J Clin Virol 2006; 35: 99–102. [ Links ]
Recibido: enero 25 de 2006
Aceptado: febrero 28 de 2006