Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.19 no.3 Medellín July/Sept. 2006
ARTÍCULO DE INVESTIGACIÓN
Efecto del micofenolato mofetil (MMF) en el síndrome nefrótico idiopático (SNI) en niños, resistente a otros tratamientos
Micophenolate mofetil (MMF) in the idiopathic nephrotic syndrome (SNI) resistantance to different treatments
Pilar Maritza Amado Niño1, Liliana María Rubio Elorza2, Juan José Vanegas Ruiz3, William Cornejo Ochoa4
1. Pediatra, Residente de Nefrología Pediátrica, Universidad de Antioquia
2. Nefróloga Pediatra, Hospital Universitario San Vicente de Paúl
3. Nefrólogo Pediatra, Docente Universidad de Antioquia
4. Epidemiólogo Clínico, Docente Universidad de Antioquia, Facultad de Medicina, Departamento de Pediatría. Especialización Nefrología Pediátrica, Medellín, 2006. E-mail: amadopilar@hotmail.com
Recibido: junio 5 de 2006
Aceptado: agosto 8 de 2006
RESUMEN
EL INTENTO PARA DISMINUIR LOS EFECTOS ADVERSOS del uso prolongado y de las grandes dosis de esteroides en el tratamiento del síndrome nefrótico idiopático (SNI) corticodependiente o corticoresistente, justifica el uso de inmunosupresores, muchos de los cuales también causan efectos adversos además de producir respuestas variables. El objetivo de este trabajo fue la evaluación retrospectiva de la evolución clínica y de los parámetros de laboratorio en 11 pacientes con SNI (siete corticoresistentes y cuatro corticodependientes), luego de seis meses de tratamiento con MMF. El diagnóstico histopatológico fue glomeruloesclerosis focal y segmentarias (GEFS) en ocho pacientes, glomerulonefritis membranosa (GNM) en dos y glomerulonefritis membranoproliferativa tipo II (GNMP) en uno. El promedio de edad de inicio del SNI fue de 7,8 años (rango 2-14), y el de la edad al inicio del MMF fue de 9,9 años (rango 2,5-16). El MMF se administró en una dosis promedio de 406 mg/m2/12h (rango 186,5-600). Se encontró respuesta parcial al MMF en 4 pacientes y completa en 1; igualmente se observó tendencia a mejor control de la hipertensión arterial y resolución de edemas, manteniendo una función renal estable.
PALABRAS CLAVE: GLOMERULOESCLEROSIS, MICOFENOLATO, SÍNDROME NEFRÓTICO
SUMMARY
THE ATTEMPT TO DIMINISH THE ADVERSE effects of the prolonged use and the great doses of steroids in the treatment of the idiopathic nephritic syndrome (SNI) with dependency and/or resistance to steroids, justifies the use of immunosuppressive drug, many of these with variable answers and also adverse effects. The objective of this work was to evaluate the clinical evolution and of the laboratory parameters in the patients with SNI to the 6 months of treatment with Mycophenolate mofetil. The trial included 11 patients with SNI, 7 with resistance and 4 with dependency to steroids, the histopathology diagnosis were: 8 focal and segmental glomeruloesclerosis (GEFS), 2 membranous glomerulonephritis (GNM), 1 membranoproliferative type II glomerulonephritis (GNMP). The average of age of beginning of the idiopathic nephritic syndrome was 7.8 years (range 2-14), and of the age at the beginning of the MMF range was 9.9 years (2.5-16). Dose average of MMF was: 406 mg/m2/12h (186.5-600). This study shows partial answer to the MMF in 4 patients and completed in 1, also we observed tendency better control of the arterial hypertension, resolution of edemas and maintenance of the stable renal function in all patients.
KEY WORDS: GLOMERULOESCLEROSIS, MICOPHENOLATE, NEPHROTIC SYNDROME
INTRODUCCIÓN
SEGÚN LAS ESTADÍSTICAS DEL SERVICIO de nefrología infantil del Hospital Universitario San Vicente de Paúl (HUSVP), se atendieron 672 pacientes con síndrome nefrótico entre 1959 y 2002, para un promedio de 16 casos por año, con la glomeruloesclerosis focal y segmentaria como el hallazgo histopatológico más frecuente. Las recaídas frecuentes y la dependencia a esteroides e inmunosupresores obligan al uso recurrente y/o por tiempo prolongado de estos fármacos, con los que se han descrito efectos adversos incluida la nefrotoxicidad, y respuesta variable del SNI. 1,4En un intento por disminuir los efectos adversos del uso prolongado y de las grandes dosis de esteroides en el tratamiento del síndrome nefrótico idiopático (SNI) corticodependiente o corticoresistente, se justifica el uso de inmunosupresores, con los que también se producen efectos adversos y respuestas variables. 5-7 El ácido micofenólico, que es la forma activa del MMF, es un inhibidor reversible, no competitivo, de la inosin monofosfato deshidrogenasa, que bloquea la producción de novo de guanosina, con lo que inhibe la proliferación de linfocitos B y T y la generación de células T citotóxicas. 8 En series recientes de pacientes con SIN corticoresistente o corticodependiente tratados con MMF se ha observado reducción de la proteinuria y estabilización de la función renal, hechos asociados a un mejor control de las alteraciones clínicas presentes en el síndrome nefrótico. Estos reportes sin embargo están limitados en su mayoría a poblaciones de adultos o series pequeñas de la población pediátrica, 9-14 lo que nos motivo a evaluarlo en una serie de pacientes menores de 18 años.
MATERIALES Y MÉTODOS
REALIZAMOS UN ANÁLISIS RETROSPECTIVO de las historias clínicas de los pacientes menores de 18 años evaluados en los servicios de nefrología pediátrica en el HUSVP y en el Centro de Terapia Renal Bolivariana, entre el 2000-2005, con diagnóstico de SNI corticoresistente o corticodependiente y que por tal motivo recibieron tratamiento con MMF, incluyendo aquellos que cumplieron un mínimo de seis meses de tratamiento y seguimiento sin interrupción. Se excluyeron aquellos pacientes con enfermedad renal crónica en estadio 4 o más avanzado.
Confirmados los criterios de selección evaluamos el estado clínico y los parámetros de laboratorio (proteinuria, albúmina, creatinina, leucograma y colesterol total), tanto al inicio como a los seis meses del tratamiento.
La expresión de las variables cualitativas al inicio del MMF se hace como proporciones, y las cuantitativas como promedios y desviaciones estándar. Para el análisis de la evolución clínica y de los parámetros de laboratorio se compararon las variables antes y después de la intervención. Para el comportamiento de las variables de tipo cualitativo se utilizó la prueba Chi 2 con nivel de confianza de 95% (p = 0,05), y para los valores de las variables cuantitativas se utilizó la prueba de T-student con intervalo de confianza de 95% (p = 0,05).
RESULTADOS
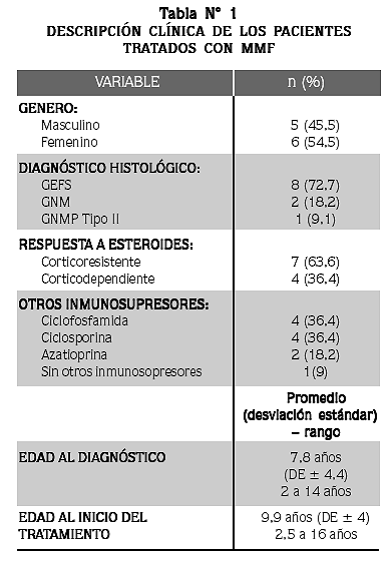
REVISAMOS 20 HISTORIAS CLÍNICAS de pacientes con SNI tratados con MMF; se excluyeron tres pacientes por tratamiento con MMF por un periodo inferior a los seis meses consecutivos, tres por pérdida del seguimiento antes de seis meses, uno por ingreso a hemodiálisis antes de completar tres meses con MMF y dos por diagnóstico histológico de nefropatía por IgA, quedando en total 11 pacientes (Tabla Nº 1), seis de género femenino y cinco masculino.
La edad promedio de inicio del síndrome nefrótico fue de 7,8 años (rango 2-14 años). Según respuesta inicial a los esteroides, 36,4% fueron clasificados como corticodependientes y 63,6% como corticoresistentes. El diagnóstico histológico fue GEFS en ocho pacientes, GNM en dos y GNMP tipo II en uno. El tratamiento con MMF se inició entre los 6 meses a 10 años de evolución del síndrome nefrótico, en promedio 2,18 años (±2,7 años), con una dosis media de 406 mg/m 2 /12h (rango de 186,5 a 600 mg/m2/12h); esta dosis no fue constante durante el seguimiento y fue incrementada en razón de la respuesta terapéutica, sin pasar de 600 mg/m2/12h.
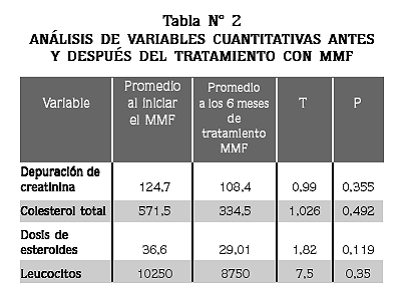
En las variables cuantitativas (dosis de esteroides, creatinina, depuración de creatinina y leucocitos) al inicio y al final del seguimiento, analizadas con la prueba T para muestras pareadas (Tabla Nº 2), y en las variables cualitativas (edema, proteinuria e hipertensión arterial) analizadas por la prueba de Fisher, no se encontraron cambios significativos.
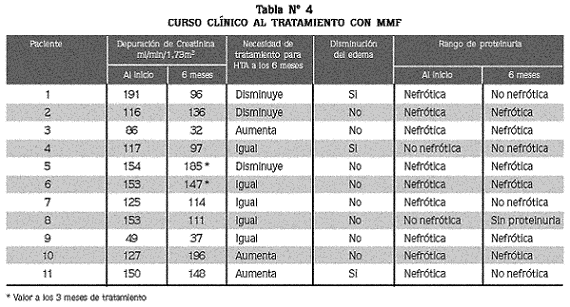
En cuanto a la evolución de la hipertensión arterial, evaluada por la necesidad de medicamentos para su control, seis pacientes continuaron con el mismo número y dosis de antihipertensivos, dos requirieron aumento del tratamiento y tres toleraron la disminución de este en número y dosis; estos resultados no tuvieron relación con la respuesta al MMF a los 6 meses.
Con respecto al edema, luego de 6 meses de observación, persistía en ocho pacientes. La proteinuria como indicador de remisión o de recaída se encontró en rango nefrótico (>40 mg/m 2 /h) al inicio del tratamiento con MMF en nueve pacientes y en dos en rango no nefrótico. De estos 11 pacientes, en seis persistió la proteinuria mayor de 40 mg/m 2 /hora a los seis meses de tratamiento, dos de los cuales no tuvieron remisión en ningún momento, mientras que los otros cuatro tuvieron remisión parcial. De los cinco pacientes restantes, cuatro presentaron remisión parcial (proteinuria < 40 mg/m 2 /h), y uno remisión total (sin proteinuria); tres de estos pacientes con remisión han presentado recaídas. Las recaídas de síndrome nefrótico se presentaron en siete pacientes y se relacionaron con inconsistencia en la administración del MMF en tres pacientes y con infecciones en otros tres; en uno no se determinó la causa.
En la función renal valorada por la depuración de creatinina no hubo cambios significativos, menteniéndose dentro de los límites normales en el tiempo de observación. La depuración de creatinina a los seis meses estaba dentro de límites normales en seis pacientes, con hiperfiltración en uno y falla renal crónica en dos pacientes, quienes desde el ingreso tenían disfunción renal; uno permaneció en estadio 3 y el otro progresó del estadio 1 al 3. No hay datos de la función renal a los seis meses de tratamiento en dos pacientes, los que a los tres meses tenían hiperfiltración.
Con respecto a los efectos secundarios del MMF, en el análisis global de los pacientes no se encontraron cambios significativos en la variación de los leucocitos; en forma individual ninguno presentó leucopenia. En tres pacientes se presentaron infecciones leves que se trataron ambulatoriamente, y síntomas gastrointestinales en cinco pacientes (tres con enfermedad ácido péptica y dos con enfermedad diarreica). Todos estos efectos se resolvieron con tratamiento específico sin que fuera necesario suspender o disminuir la dosis de MMF.
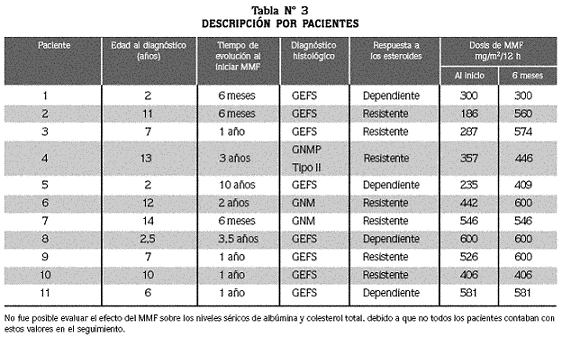
En el análisis individual consideramos que en los pacientes 1, 4, 7, 8 y 11 (Tablas Nº 3 y 4) hubo respuesta al tratamiento con MMF, indicado por la disminución de la proteinuria a rango no nefrótico, asociada además en tres pacientes a resolución del edema; estos cinco pacientes mantuvieron la depuración de creatinina dentro de límites normales.
No se observó asociación entre la respuesta al MMF y el diagnóstico histológico (tres GEFS, uno GNM y uno GNMP II) y tampoco con el tipo de repuesta previa a los esteroides (dos corticoresistentes y tres corticodependientes). Adicionalmente se observó que en estos cinco pacientes el tratamiento con MMF fue más constante, y las recaídas presentadas fueron atribuidas a procesos infecciosos.
DISCUSIÓN
EN LA POBLACIÓN PEDIÁTRICA el porcentaje de pacientes con SNI resistente a esteroides es estimado entre el 7 y 18%, y estos son claramente los que presentan más dificultades en términos de control de síntomas y mayor frecuencia de GEFS y progresión a falla renal. 15,16 Entre los pacientes de nuestro trabajo ingresados con SIN corticorresistente o corticodependiente, la mayoría (72,7%) tenían diagnóstico histológico de GEFS, de los que sólo el 40% responden al tratamiento con esteroides.14-16 Encontramos un caso de glomerulonefritis membranosa que es la principal causa de SNI en adultos, pero muy rara en niños. 17 Dos pacientes tenían diagnóstico histológico de GNMP tipo II, condición usualmente idiopática en niños y adultos jóvenes y que se presenta como una enfermedad primaria sin manifestaciones sistémicas. 17,18 Entre el 85 y 95% de los casos de SNI son debidos a enfermedad de cambios mínimos, de los cuales un 40% son corticoresistentes o corticodependientes. 16-18
En nuestros pacientes encontramos remisión total con el MMF en un paciente con diagnóstico de GEFS, y remisión parcial en cuatro pacientes, dos de ellos con diagnóstico histológico de GEFS, uno con GNM y uno con GNMP II. No hubo correlación entre la respuesta al MMF y el diagnóstico histológico, lo cual está de acuerdo con la serie de Mendizábal y cols. 19 En estas condiciones, la respuesta al MMF en nuestra población fue del 45,5%, indicando resistencia al MMF en el 54,5% de los pacientes. Esta respuesta es diferente a la encontrada en otros estudios debido posiblemente a un mayor porcentaje de pacientes con GEFS en nuestra población, comparado con otros en los que las poblaciones están conformadas en gran parte por pacientes con glomerulonefritis de cambios mínimos; aún así, esta respuesta es similar a la observada en estudios que sólo incluyen pacientes con GEFS resistentes a otros tratamientos. 20-24 Una de las diferencias con el estudio publicado por Montane B y col 15 se relaciona con la modalidad de tratamiento que ellos presentan en nueve niños con GEFS, en los que primero indujeron remisión con bolos de metilprednisolona semanales por 4 a 8 semanas y luego iniciaron el tratamiento con MMF a 250-500 mg/m2/12h, combinado con inhibidores de la enzima convertidora de angiotensina y/o bloqueadores del receptor de angiotensina.
Como datos de respuesta adecuada al tratamiento con MMF observados en otros estudios como en el de Choi MJ, se menciona la tendencia a un mejor control de la hipertensión arterial, lo que fue evidenciado en nuestros pacientes por la menor necesidad de medicamentos antihipertensivos. Otro indicador de buena respuesta es el mantenimiento de la función renal sin deterioro de la depuración de creatinina. En nuestro estudio los dos pacientes con insuficiencia renal estadio 3 a los seis meses tenían alteración de la función renal desde el ingreso y esto pudo haber sido un factor para la no respuesta al MMF y continuar el progreso de la enfermedad. Mendizábal y col 19 observaron igualmente una depuración de creatinina mantenida dentro de límites normales, aunque con un descenso significativo a los seis meses de tratamiento, con un promedio de diferencia de 16,8 ml/min/1,73 m2.
No hay consenso en la dosis de MMF indicada para el tratamiento del SNI resistente, pero en la mayoría de estudios describen dosis entre 250 y 600 mg/m2 /12h, teniendo en cuenta la dosis utilizada en los pacientes con trasplante renal.15,19,25 En nuestra población, los pacientes en los que observamos respuesta adecuada al MMF tenían desde el inicio dosis iguales o mayores a 300 mg/m2/h. Mendizábal y cols, utilizaron dosis de MMF de 415 a 970 mg/m2/h, promedio 624 mg/m2/12h, adecuándolas para obtener niveles séricos de ácido micofenólico entre 1,2 y 5,9 µg/ml, (promedio 2,9 µg/ml), basados en las recomendaciones para pacientes con trasplante renal, obteniendo remisión sostenida en nueve de 21 pacientes; los otros 12 permanecieron con recaídas que se asociaron, aunque sin significancia estadística, a niveles de ácido micofenólico menores de 2,5 µg/ml. 19
Los efectos secundarios en nuestros pacientes fueron mínimos y no hubo necesidad de suspender o disminuir la dosis de MMF para su control. Igual que sucedió en la serie de Mendizábal, hubo tendencia a la disminución de leucocitos pero ningún paciente hizo leucopenia. Las manifestaciones gastrointestinales e infecciosas fueron muy bajas y son comparables con las halladas por otros autores. 115,19,25
CONCLUSIONES
EN NUESTRA REVISIÓN OBSERVAMOS respuesta parcial al MMF en cuatro de los 11 pacientes ingresados en el estudio; uno presentó respuesta completa, datos inferiores a los observados en otros estudios debido probablemente a que se trataba de un grupo heterogéneo y pequeño de pacientes, situación que nos impide determinar cambios estadísticamente significativos. Además de lo anterior, las dosis de MMF en nuestros pacientes fueron menores que las utilizadas en estudios publicados y no siempre se pudo garantizar la continuidad del tratamiento por problemas del Sistema de Seguridad Social.
Con los anteriores resultados pensamos que en los pacientes con SNI corticodependiente o corticoresistente se puede intentar el tratamiento con MMF a dosis de 600 mg/m2/12h, evaluando la respuesta a los tres y seis meses, teniendo en cuenta para ello la exploración clínica, el control de la proteinuria, de la hipoalbuminemia, de la presión arterial, de la hiperlipidemia y de la función renal, vigilando al mismo tiempo la aparición de posibles efectos adversos, para poder determinar en forma adecuada su eficacia y seguridad. Posiblemente seis meses no son suficientes como tratamiento completo para mantener la remisión del síndrome nefrótico y deba prolongarse por más tiempo, lo que se podrá definir más claramente con base en futuras investigaciones.
BIBLIOGRAFÍA
1. Bagga A, Srivastava RN. Pulse methylprednisolone treatment of idiopathic steroid-resistant nephritic syndrome. Pediatr Nephrol 2003; 17: 906-912. [ Links ]
2. Donia AF, Ammar HM, Agroudy A, et al. Long-term results of two unconventional agents in steroiddependent nephrotic children. Pediatr Nephrol 2005; 20: 1420-1425. [ Links ]
3. Habashy D, Hodson EM, Craig JC. Interventions for steroid-resistant nephrotic syndrome: a systematic review. Pediatr Nephrol 2003; 18: 906-912. [ Links ]
4. Ponticelli C, Glassock RJ. Treatment of primary glomerulonephritis. New York: Oxford university press, 1997. [ Links ]
5. Hodson EM, Craig JC, Willis NS. Evidence-based management of steroid-sensitive nephrotic syndrome. Pediatr Nephrol 2005; 20: 1523-1530. [ Links ]
6. Gellermann J, Querfeld U. Frequently relapsing nephrotic syndrome: treatment with mycophenolate mofetil. Pediatr Nephrol 2004; 19: 101-104. [ Links ]
7. Ulinski T, Dubourg L, Saïd MH, Parchoux B, Ranchin B, Cochat P. Switch from cyclosporine A to mycophenolate mofetil in nephrotic children. Pediatr Nephrol 2005; 20: 482-485. [ Links ]
8. Mycophenolate mofetil. In: Mosby's drug consult. 14 ed. St. Louis. Mosby, 2004. [ Links ]
9. Bagga A, Hari P, Moudgil A, Jordan SC. Mycophenolate mofetil and prednisolona therapy in children with steroid-dependent nephrotic syndrome. Am J of Kidney diseases 2003; 42: 1114-1120. [ Links ]
10. Barletta GM, Smoyer WM, Bunchman TE, Flynn JT, Kershaw DB. Use of mycophenolate mofetil in steroiddependent and -resistant nephrotic syndrome. Pediatr Nephrol 2003; 18: 833-837. [ Links ]
11. Bayazit AK, Noyan A, Cengiz N, Anarat A. Mycophenolate mofetil in children with multidrugresistant nephrotic syndrome. Clin Nephrol 2004; 61: 25-29. [ Links ]
12. Chandra M, Susin M, Abitbol C. Remission of relapsing childhood nephrotic syndrome with mycophenolate mofetil. Pediatr Nephrol 2000; 14: 224-226. [ Links ]
13. Novak I, Frank R, Vento S, Vergara M, Gauthier B, Trachtman H. Efficacy of mycophenolate mofetil in pediatric patients with steroid-dependent nephritic syndrome. Pediatr Nephrol 2005; 20: 1265-1268. [ Links ]
14. Jhonson RJ, Feehally J, Rennke H. EN: Johnson RJ, Feehally J, editors. Comprehensive clinical nephrology: Introduction to glomerular disease: pathogenesis and classification. 2nd ed. London: Mosby; 2003: 243-254. [ Links ]
15. Montane B, Abitbol C, Chandar J, Strauss J, Zilleruelo G. Novel therapy of focal glomerulosclerosis with mycophenolate and angiotensin clockade. Pediatr Nephrol 2003; 18: 772-777. [ Links ]
16. Lechner BL, Norman JS. En: Greenberg A, editor. Primer on kidney diseases: Minimal change disease. 4a ed.
17. Jhonson RJ, Feehally J. En Johnson RJ y Feehally J, editors. Comprehensive clinical nephrology: Introduction to glomerular disease: clinical presentations. 2nd ed. London: Mosby; 2003: 255-260. [ Links ]
18. Falk RJ, Jennette JC, Nachman PH. En Barry M. Brenner, editors. The kidney: Primary glomerular disease. 6a ed. United Status of America: Saunders company; 2000: 1263-1270. [ Links ]
19. Mendizabal S, Zamora I, Berdel O, Sanahuja MJ, Fuentes J, Simon J. Mycophenolate mofetil in steroid/ cyclosporine-dependent/resistant nephritic syndrome. Pediatr Nephrol 2005; 20: 914-919. [ Links ]
20. Day CJ, Cockwell P, Lipkin GW, Savage CO, Howie AJ, Adu D. Mycophenolate mofetil in the treatment of resistant idiopathic nephrotic syndrome. Nephrol Dial Transplant 2002; 17: 2011-2013. [ Links ]
21. Moudgil A, Bagga A, Jordan SC. Mycophenolate mofetil therapy in frequently relapsing steroiddependent and steroid-resistant nephrotic syndrome of childhood: current status and future directions. Pediatr Nephrol 2005; 20: 1376-1381. [ Links ]
22. Pesavento TE, Bay WH, Agarwal G, Hernandez RA, Hebert LA. Mycophenolate therapy in frequently relapsing minimal change disease that has failed cyclophosphamide therapy. Am J Kidney diseases 2004; 43: e3-6. [ Links ]
23. Miller G, Zimmerman R, Radhakrishnan J, Appel G. Use of mycophenolate mofetil in resistant membranous nephropathy. Am J Kidney Dis 2000; 36: 250-256. [ Links ]
24. Polenakovic M, Grcevska L, Dzikova S. Mycophenolato mofetil in treatment of idiopathic stages III-IV membranous nephropathy. Nephrol Dial Transplant 2003; 18: 1233-1234. [ Links ]
25. Choi MJ, Eustace JA, Gimenez LF, et al. Mycophenilate mofetil treatment for primary glomerular diseases. Kidney Internacional 2002; 61: 1098-1114. [ Links ]