Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.19 no.3 Medellín July/Sept. 2006
ARTÍCULO DE REVISIÓN
Manifestaciones reumatológicas de la enfermedad inflamatoria intestinal
Rheumatologic manifestations of inflammatory bowel disease
Luis Alberto Ramírez Gómez,1 Gloria María Vásquez Duque,2 Octavio Germán Muñoz Maya3
1. Jefe de la Sección de reumatología, Universidad de Antioquia.2. Docente de la Sección de reumatología y del Grupo de inmunología celular e inmunogenética, Facultad de Medicina, Universidad de Antioquia
3. Residente de Medicina Interna, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
Recibido: marzo 24 de 2006
Aceptado: mayo 24 de 2006
RESUMEN
LA ENFERMEDAD INFLAMATORIA INTESTINAL (EII) se caracteriza por la activación inapropiada del sistema inmune de la mucosa intestinal y sus dos formas de presentación son: la colitis ulcerativa y la enfermedad de Crohn. Las manifestaciones extraintestinales se presentan hasta en el 36% de los pacientes y pueden comprometer cualquier órgano o sistema. La disfunción inmune se caracteriza por el desequilibrio entre los mediadores proinflamatorios y los antinflamatorios y se expresa como una enfermedad sistémica. Las manifestaciones reumatológicas asociadas a la EII son de tres tipos: la artritis periférica, la espondiloartropatía y una tercera categoría que incluye lesiones dérmicas, oftálmicas y del metabolismo óseo, entre otras. El manejo de estas manifestaciones se basa en la terapia sistémica para el control de la actividad inflamatoria local utilizando esteroides, derivados de la 5-ASA, inmunomoduladores y, en los últimos años, terapia anti-TNF.
PALABRAS CLAVE: ARTRITIS PERIFÉRICA, ENFERMEDAD INFLAMATORIA INTESTINAL, ESPONDILOARTROPATÍA, MANIFESTACIONES EXTRAINTESTINALES
SUMMARY
THE MAIN FEATURE OF INFLAMMATORY BOWEL DISEASE (IBD) is the continuous activation of the mucosa-associated immune system; the disease has two major forms of presentation: ulcerative colitis and Crohn's disease. The extraintestinal manifestations are present in 36% of patients, and any organ can be affected. There is an imbalance between proinflammatory and antinflammatory cytokines leading to a systemic disease.
The rheumatologic manifestations of the IBD are: Peripheral arthritis, spondyloarthropathy and a third category that includes dermic and ocular lesions as well as metabolic bone disease. Control of the extraintestinal manifestations is based on systemic therapy with steroids, 5-ASA derivatives and biological anti-TNF therapy.
KEY WORDS: EXTRAINTESTINAL MANIFESTATIONS, INFLAMMATORY BOWEL DISEASE, PERIPHERAL ARTHRITIS, SPONDYLOARTHROPATHY
INTRODUCCIÓN
LA ENFERMEDAD INFLAMATORIA INTESTINAL (EII) es una entidad crónica idiopática, potencialmente incapacitante y asociada a un mayor riesgo de cáncer colorrectal. Sus dos formas de presentación son la colitis ulcerativa (CU) y la enfermedad de Crohn (EC). 1 Estas enfermedades se pueden manifestar desde etapas tempranas de la vida:15 a 20% se presentan en la infancia y los casos restantes tienen dos picos de edad de inicio, el primero entre los 15 y 30 años y el segundo entre los 60 y 80 años. Existe, además, una diferencia considerable en la incidencia, con una división aparente entre norte y sur, particularmente con respecto a la EC. Las tasas de incidencia para CU y EC en los Estados Unidos son de 11 y 7 por 100.000 por año, respectivamente; y en Asia y Suramérica, de 0,5 y 0,08 por 100.000 por año, respectivamente. 2 En los Estados Unidos se estima que un millón de personas tienen EII y cada año se reportan 30.000 casos nuevos.3 Las diferencias en cuanto al sexo son mínimas con una relación hombre:mujer de 1:1 para la CU y de 1.8:1 para la EC; además, se encuentra una mayor prevalencia en las áreas urbanas y en los estratos socioeconómicos altos.
Las manifestaciones extraintestinales de la EII se presentan en el 21 a 36% de los pacientes, y prácticamente cualquier órgano o sistema puede estar comprometido. 4 Esta revisión se enfoca en las manifestaciones reumatológicas de la EII, las cuales poseen las mismas bases patogénicas.
HISTORIA
LA ASOCIACIÓN ENTRE EL COLON y los síntomas musculoesqueléticos fue reconocida desde comienzos del siglo XX. En 1920 Rea Smith, un cirujano general realizó 68 colectomías en pacientes sintomáticos, logrando una notable mejoría de los síntomas articulares, observación que lo condujo a afirmar que “La infección en el colon es responsable del reumatismo”.
En 1935, Hench describió la artritis asociada a CU, notando una relación de proporción directa entre la actividad de las dos enfermedades. En los años subsiguientes se perdió el concepto de manifestaciones extraintestinales y se consideró a la artritis como una enfermedad diferente que coincidía con la EII. Fue en 1959 cuando Wright, Watkinson, Bywaters y Ausell, citados por Gravallede et al.,5 describieron una forma distinta de artritis asociada a EII, y posteriormente describieron sus características clínicas, radiológicas y serológicas.
FISIOPATOLOGÍA
LA EII ES EL RESULTADO de la activación inapropiada y continua del sistema inmune de la mucosa intestinal y esta respuesta aberrante es facilitada probablemente por defectos de la barrera epitelial. 5 Las células epiteliales son productoras de citoquinas que regulan el reclutamiento de las células de la respuesta inflamatoria crónica o aguda; la secreción aberrante de estas citoquinas proinflamatorias es parte integral de la respuesta inmune que inicia y perpetúa la EII.6
Las observaciones clínicas sugieren que factores genéticos contribuyen a la susceptibilidad a la EII; estas observaciones incluyen las variaciones en la incidencia y prevalencia en diferentes poblaciones, la agregación familiar, la asociación a otras enfermedades genéticamente determinadas y la alta tasa de concordancia entre gemelos monocigotos; 7 sin embargo, la ausencia de un modelo hereditario simple demuestra la participación de múltiples genes, entre los que se destaca el IBD1 , localizado en el cromosoma 16, que codifica para la proteína citoplasmática NOD2 (también llamada CARD15) expresada en los macrófagos y que puede servir como receptor para lipopolisacáridos bacterianos con la posterior activación del factor nuclear κβ y de los macrófagos. 8
El desarrollo de la EII depende también de factores ambientales: el desequilibrio de la microflora intestinal, los regímenes alimentarios y el consumo de antinflamatorios no esteroides pueden llevar a la activación de la enfermedad por la alteración de la barrera intestinal; por el contrario, procedimientos quirúrgicos como la apendicetomía temprana se asocian con una incidencia reducida de CU y el tabaquismo es un factor protector contra el desarrollo de CU, pero aumenta el riesgo para EC.5
El resultado final de la susceptibilidad genética asociada a los factores ambientales es la activación local del sistema inmune. En los pacientes con EC la mucosa está infiltrada predominantemente por linfocitos T CD4+ de fenotipo Th1, caracterizados por la producción de interferón gama (IFN γ) e IL2; por el contrario, en pacientes con CU la mucosa es infiltrada por linfocitos T CD4+ de fenotipo atípico Th2 caracterizados por la producción del factor transformador de crecimiento beta (TGF β) e IL5. La respuesta nflamatoria, especialmente la Th1, estimula a los macrófagos, y estos a su vez producen IL12, IL18, factor de necrosis tumoral alfa (TNF α), IL1 e IL6. Posteriormente, la activación de estas poblaciones celulares se acompaña de la producción de una amplia variedad de mediadores inflamatorios no específicos, citoquinas, prostaglandinas, leucotrienos y metabolitos reactivos de oxígeno. 9 Este paradigma clásico ha sido criticado recientemente por reportes que apoyan la hipótesis de que las vías inflamatorias no son mutuamente excluyentes. 7
Una vez iniciada la EII, se perpetúa la respuesta inmune como consecuencia de la activación de los linfocitos T; de esta forma se pierde el equilibrio entre los mediadores proinflamatorios y antinflamatorios lo cual se expresa en el amplio espectro clínico de la enfermedad.
¿CÓMO LAS ARTICULACIONES SE RELACIONAN CON EL INTESTINO?
LA DISFUNCIÓN INMUNE Y EL AUMENTO en la permeabilidad de la mucosa intestinal contribuyen a la morbilidad local, pero es más difícil explicar cómo y cuándo se comprometen las articulaciones. 10
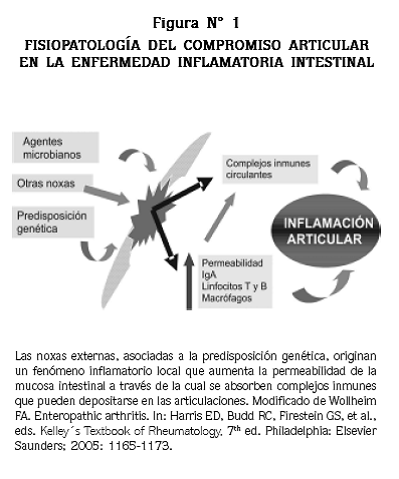
Se desconoce el mecanismo exacto que relaciona el intestino y la artropatía, pero es crítica la recirculación de células T de memoria antígenoespecíficas del intestino a las articulaciones. 11 El sobrecrecimento bacteriano y el incremento en la absorción de complejos inmunes podrían tener un papel patogénico por la circulación de complejos de IgA secretora y antígenos bacterianos. El incremento en la permeabilidad intestinal también ha sido demostrado en otros tipos de artropatías como espondilitis anquilosante, artritis psoriásica y artritis reumatoide juvenil, y se han identificado muchos mediadores inmunes especialmente IL6 y TNF α. 11 (Figura Nº 1).
El aumento en la permeabilidad intestinal y los niveles muy anormales de bacterias que colonizan las lesiones activas en la EII pueden llevar a la absorción de componentes bacterianos proinflamatorios que estimulan una respuesta inmune patológica. Recientemente se han identificado la proteína colónica epitelial y la isoforma 5 de la tropomiosina humana como los blancos más comunes de los autoanticuerpos de los pacientes con EII y manifestaciones extraintestinales. 12 Estas proteínas no solamente se expresan en el colon sino también en los ojos, la piel, las articulaciones y el tracto biliar. Por otra parte, la identificación del gen NOD 2 (CARD 15) podría explicar una importante relación entre el intestino y las articulaciones; lo mismo podría suceder con otros miembros de la familia de receptores Toll-like, aunque estos conceptos aún son controversiales y deben esperar estudios futuros. 13
PRESENTACIONES CLÍNICAS
LAS CONDICIONES REUMATOLÓGICAS asociadas a la EII se pueden dividir en cuatro categorías: una forma de artritis periférica, una de espondilitis, asociada o no a sacroilitis, una de sacroilitis aislada y una cuarta categoría que incluye, entre otras, manifestaciones menos comunes como lesiones dérmicas, oftálmicas, granulomas metastásicos, periostitis, amiloidosis, vasculitis y osteoporosis.5
ARTRITIS PERIFÉRICA
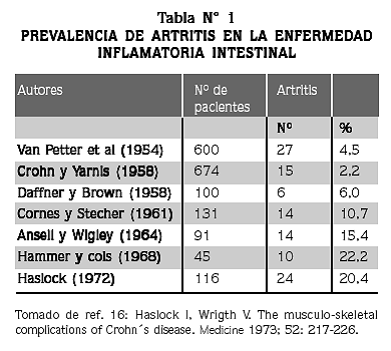
EL COMPROMISO ARTICULAR es la manifestación extraintestinal más común de la EII, con una prevalencia que varía en estudios retrospectivos y prospectivos entre 2 y 26%. 14,16 (Tabla Nº 1). Los estudios iniciales reportaron una mayor frecuencia en hombres (54%) que en mujeres (46%), pero los más recientes demuestran que es igual en ambos sexos. Los datos de la incidencia de artritis en la EC y la CU son disímiles, pues en los estudios iniciales no se aplicaron criterios estrictos para definir las dos entidades. En una cohorte de pacientes reportada por Haslock y col.16 de la unidad de reumatología del Hospital General de Leeds, se identificó la artritis periférica en 20% de los pacientes con EC y en 12% de los que sufrían CU.
La incidencia de la artritis se incrementa con la extensión de la enfermedad y específicamente con el compromiso colónico; por ejemplo: en la EC la artritis se presenta hasta en el 40% de los pacientes con colitis, en el 25% de los que tienen ileocolitis y sólo en el 15% de los que sufren ileítis aislada. 17 También se han reportado casos en los que la artritis precede al compromiso gastrointestinal; sin embargo, de manera típica, la artritis aparece concomitante o posterior a los síntomas intestinales y generalmente la actividad inflamatoria coincide en ambos sitios. 5
Las articulaciones más comúnmente comprometidas incluyen: rodillas, muñecas, tobillos y codos, seguidos por las interfalángicas proximales, metacarpofalángicas y metatarsofalángicas; los hombros y las caderas se comprometen con menor frecuencia en pacientes sin espondilitis asociada.
El comienzo de la artritis es súbito, y logra un pico máximo en las primeras 24 horas; el 90% son poliarticulares y en un 50% de los casos pueden tener un patrón migratorio. La duración de los síntomas en las diferentes series es menor de un mes en el 50% de los casos, 25% duran entre 5 semanas y dos meses, 10%, entre 2 y 6 meses, 10%, entre 6 y 12 meses y solamente un 5% se convierten en artritis crónica.18 En general se acepta como una artropatía no erosiva y no deformante.
Los hallazgos histológicos de las biopsias sinoviales son inespecíficos, incluyendo hipertrofia vellosa, edema, infiltrado linfohistiocitario, hipertrofia sinovial y proliferación vascular. El análisis del líquido sinovial demuestra características inflamatorias con predominio polimorfonuclear; la presentación radiológica es inespecífica y se caracteriza por edema de los tejidos blandos y derrame articular. 19
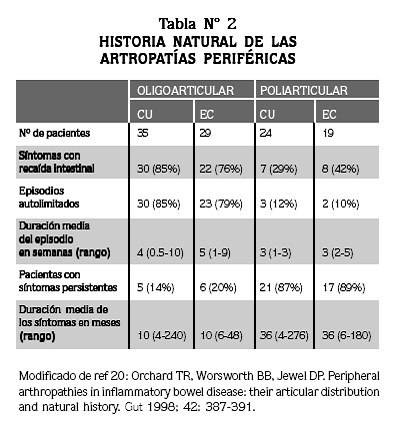
En 1998 Orchard y col.20 describieron la historia natural de la enfermedad articular periférica y la asociación con otras manifestaciones extrarticulares de la EII y su relación con el patrón de compromiso articular. Dividieron a los pacientes en dos tipos, definidos de la siguiente forma: tipo 1: los que tenían menos de 5 articulaciones inflamadas (oligoarticular) y tipo 2 los que tenían 5 o más articulaciones inflamadas (poliarticular); los resultados de su estudio se observan en la tabla Nº 2.
De esta manera se logró subdividir la artropatía periférica enteropática en dos tipos, el oligoarticular o pauciarticular, con síntomas agudos y autolimitados que tienen relación y coinciden con las recaídas de la actividad inflamatoria intestinal, asociados frecuentemente a otras manifestaciones extraintestinales como uveítis, eritema nodoso y úlceras orales; y el tipo poliarticular, con síntomas persistentes independientes de las manifestaciones intestinales y asociados solamente con uveítis. Es probable entonces que la heterogeneidad genética incida en las características fenotípicas, determinando el curso clínico del compromiso articular.
ESPONDILOARTROPATÍA Y COMPROMISO AXIAL
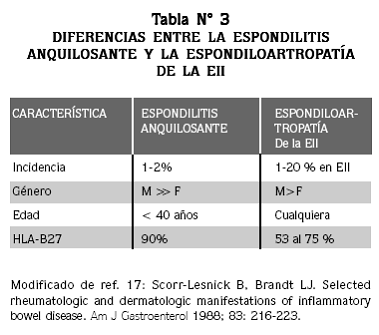
DOS FORMAS DE ARTROPATÍA AXIAL se asocian a la EII, una de ellas idéntica a la espondilitis anquilosante idiopática e indistinguible de ella (Tabla Nº 3) y la segunda una sacroilitis aislada que frecuentemente es asintomática. 15
Las manifestaciones clínicas de la artropatía axial son similares en la EC y la CU. Su prevalencia es difícil de expresar con certeza por las diferencias metodológicas de los estudios, y porque muchos de ellos fueron realizados antes del desarrollo de los criterios de clasificación del Grupo Europeo para el estudio de las espondiloartropatías (ESSG).
La incidencia de espondilitis en asociación con EII varía entre las diferentes series de 1.1 a 6.4% y en estudios recientes ha sido hasta del 25%. En general se acepta que la espondiloartropatía ocurre entre 3 y 12% de los pacientes, y esta manifestación es 10 a 30 veces más frecuente que en la población general. 17 Este compromiso es más común en la EC (5-22 %) que en la CU (2-6 %).
El dolor lumbar es característicamente de comienzo insidioso, difuso, alternante, con rigidez matinal y puramente inflamatorio. Al examen físico se pueden encontrar merma de la flexión de la columna y de la expansión torácica, rectificación de la columna lumbar y dolor en las articulaciones sacroilíacas.
La espondiloartropatía asociada a la EII puede ocurrir a cualquier edad y los síntomas no se relacionan con las exacerbaciones o remisiones de la enfermedad intestinal. Estos síntomas axiales usualmente ocurren después de los intestinales pero los pueden preceder algunas veces por muchos años.15
Radiológicamente la espondilitis asociada a EII es indistinguible de la espondilitis anquilosante y el signo radiológico temprano es la sacroilitis simétrica; sin embargo, los cambios en la columna lumbar pueden aparecer inclusive después de seis años. 21
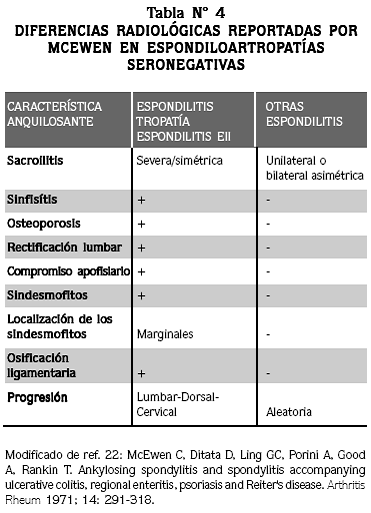
En 1971 McEwen22 publicó las diferencias radiológicas entre la espondilitis enteropática y otras espondiloartropatías inflamatorias, como las asociadas a artritis psoriásica y artritis reactiva, como se aprecia en la tabla Nº 4.
La espondiloartropatía asociada a EII también puede tener compromiso articular periférico, más comúnmente de las caderas y los hombros.
El otro patrón de presentación es la sacroilitis asintomática, la cual se describe entre el 4 y 18% de la población si se detecta por rayos X, o hasta en un 52% si se evalúa tomográficamente; este compromiso es simétrico y puede progresar a una anquilosis completa de la articulación. 23
ANTÍGENOS DE HISTOCOMPATIBILIDAD EN LA ENFERMEDAD INFLAMATORIA INTESTINAL
DEBIDO A QUE ESTAS ENFERMEDADES muestran agregación familiar y una fuerte asociación con el HLA-B27, las bases genéticas de las espondiloartropatías, en particular, han sido motivo de múltiples trabajos de investigación; en los años 70, varios autores sugirieron que esta relación se mantenía para las manifestaciones articulares.
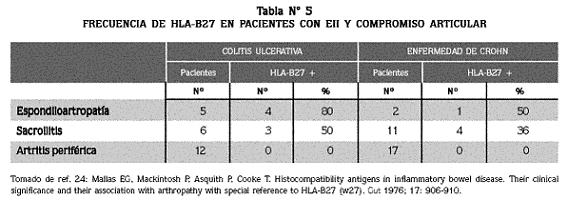
Mallas y col.24 condujeron un estudio en pacientes con CU y EC para determinar la presencia de 24 tipos diferentes de antígenos de histocompatibilidad, y aunque no se encontraron diferencias significativas en cuanto a la presencia de los antígenos en los pacientes y los controles, la incidencia de HLA-B27 fue mayor en los pacientes que presentaron espondiloartropatía; en contraste, ningún paciente con artropatía periférica presentó HLA-B27 (Tabla Nº 5). Este hallazgo sugiere que los antígenos de histocompatibilidad pueden ser un discriminador patogénico en los diferentes tipos de artropatías y pueden tener significado pronóstico con respecto a la gravedad y la extensión de la enfermedad.
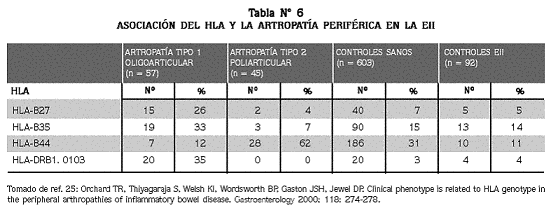
Para el año 2000 ya la artropatía periférica se había dividido en dos tipos, como se definió previamente; basado en esto Orchard y col.25 llevaron a cabo un estudio para identificar la asociación de la artritis periférica oligoarticular y poliarticular con el HLA (Tabla Nº 6) y encontraron que la oligoarticular se asocia con HLA-DRB1*0103 en 33%, B*35 en el 33% y B27 en el 26%; en contraste, la poliarticular se asoció con el HLA-B44 en 62%. Estos datos apoyan la clasificación clínica de las artropatías como dos entidades inmunogenéticamente distintas.
Los resultados del estudio de Orchard y col.25 demostraron una asociación significativa de los antígenos de histocompatibilidad y la artropatía en la EII; sugirieron, además, que los genes del HLA tienen un papel importante en la patogénesis y son un factor determinante del curso clínico de la enfermedad articular.
OTRAS MANIFESTACIONES
MANIFESTACIONES CUTÁNEAS
Las manifestaciones cutáneas asociadas a la EII ocurren en el 15% de los pacientes. 26 Las dos más comunes son el eritema nodoso y el Hypoderma gangrenoso. Existen otras menos frecuentes como la psoriasis, el síndrome de Sweet, la epidermolisis bulosa acquisita y la enfermedad de Crohn metastásica.4
Eritema nodoso
Se reporta la presencia del eritema nodoso en un 10 a 20% de los pacientes con EII. 26 En el estudio de Manitoba publicado por Bernstein y col. 27 se presentó con una frecuencia similar en la EC y la CU, pero fue más común en mujeres (1,9 frente a 0,7%, p = 0,02).
En la serie de Oxford la prevalencia fue de 1% en CU y de 6% en EC, con una incidencia pico entre los 20 y 30 años de edad y una relación mujer:hombre de 6:1.28,29 El eritema nodoso se caracteriza por la aparición súbita de nódulos de aproximadamente 2 cm, múltiples, simétricos, bilaterales, eritematosos, calientes y dolorosos; se localizan frecuentemente en la cara anterior de las piernas, aunque se han descrito también en los glúteos, tobillos, tronco y brazos. 17 Su aparición está relacionada con las exacerbaciones de la EII, pero no expresa la gravedad ni la extensión de ésta. 30 Comúnmente se acompaña de manifestaciones sistémicas como fiebre, malestar general y dolor articular.
El estudio histológico, aunque no es necesario para hacer el diagnóstico, muestra una reacción inflamatoria aguda en la dermis profunda y en el tejido celular subcutáneo, edema, extravasación leucocitaria, linfocitos e histiocitos. Posteriormente se presenta una degeneración fibrinoide y los vasos sanguíneos son invadidos por células inflamatorias sin presentar cambios sugestivos de vasculitis. 31,32 En la mayoría de los casos el curso del eritema nodoso es autolimitado, las lesiones permanecen durante 3 a 6 semanas, ocasionalmente se ulceran y pueden persistir por meses algunos signos residuales; cuando se presenta en el marco de la actividad de la EII, se resuelve con el control de la exacerbación. Adicionalmente, en el manejo se deben incluir medidas generales como reposo y elevación de los miembros inferiores. En pacientes con EII en remisión, el ácido acetilsalicílico y los AINE son de ayuda en el control del dolor. Otros medicamentos utilizados son el yoduro de potasio, la colchicina y la hidroxicloroquina.17 En los casos más graves y resistentes la terapia biológica con infliximab ha demostrado buenos resultados.33
Pioderma gangrenoso
El pioderma gangrenoso ocurre en el 1 a 10% de los pacientes con EII y es más común en la CU que en la EC.34 Ocurre con una frecuencia igual en hombres y en mujeres con un pico de incidencia entre los 25 y 54 años. 17 Puede presentarse antes, durante o después de la EII y ambas enfermedades cursan independientemente la una de la otra. Se han descrito cuatro variantes de pioderma gangrenoso: ulcerativa, pustular, bulosa y vegetativa; las dos primeras se asocian con más frecuencia a EII.
El signo más temprano es el dolor en el sitio de la lesión, en ausencia de otros signos objetivos. La lesión progresa a la formación de una pústula eritematosa y posteriormente a un hematoma fluctuante, para finalmente formar una lesión estéril, ulcerada, de centro necrótico, rodeada por un área violácea y eritematosa. Se localiza comúnmente en los miembros inferiores, especialmente en el dorso del pie, aunque puede encontrarse en cualquier otra parte del cuerpo.17 Los cultivos del material obtenido de las lesiones son estériles o crece flora mixta no patógena. La histopatología no es patognomónica pero muestra características de absceso, con trombosis venosa y capilar, arteritis, hemorragia, necrosis fibrinoide e infiltración celular masiva. 31,32
El pioderma gangrenoso se puede resolver con el tratamiento de la EII; los casos leves responden a la terapia tópica incluyendo los corticoides intralesionales; la terapia sistémica incluye sulfasalazina, dapsona, corticosteroides e inmunomoduladores como azatioprina, ciclofosfamida, ciclosporina, metotrexate, tacrólimus y micofenolato. Los casos refractarios han mostrado mejoría con terapia anti- TNF. 35,36
Otras manifestaciones dermatológicas
Existen otras manifestaciones cutáneas menos frecuentes: el síndrome de Sweet caracterizado por fiebre, leucocitosis, placas o nódulos eritematosos, dolorosos e infiltrado neutrófilo, se puede encontrar asociado a artritis y a manifestaciones oculares; responde al tratamiento con esteroides. La epidermolisis bulosa acquisita que se manifiesta por lesiones ampollosas y cicatriciales también compromete las mucosas y se caracteriza por autoanticuerpos IgG contra el colágeno tipo VII. Las metástasis de la EC tienen la misma apariencia de granulomas no caseificantes y se caracterizan por nódulos ulcerados usualmente en la pared abdominal anterior y en el área submamaria.4 Los pacientes con EII pueden presentar una variedad de lesiones orales como aftas, estomatitis angular y pioestomatitis.
MANIFESTACIONES OFTALMOLÓGICAS
Estas manifestaciones ocurren en 1,6 a 4,6% de los casos de CU y en 3,5 a 6,3% de los de EC; 26 incluyen epiescleritis, escleritis, uveítis, retinitis y neuritis óptica. En la serie de Oxford la uveítis se observó en el 60% y la escleritis en el 30% de los pacientes. 28
La epiescleritis se caracteriza por hiperemia indolora de la esclerótica y la conjuntiva sin pérdida de la visión; en contraste, la uveítis se manifiesta por dolor ocular, visión borrosa, cefalea, fotofobia e iridoespasmo. 34
En la terapia de estas condiciones inflamatorias oculares se han utilizado, con buenos resultados, sulfasalazina, esteroides, micofenolato y terapia anti-TNF. 37
ALTERACIONES DEL METABOLISMO ÓSEO
LA OSTEOPOROSIS Y LA OSTEOPENIA son comunes en la EII y se presentan en 23 a 59% de los pacientes. Los factores que contribuyen a la pérdida de la masa ósea incluyen la terapia con esteroides, la baja actividad física, las citoquinas proinflamatorias y las deficiencias de vitaminas D y K. 34 Las guías de la Asociación Americana de Gastroenterología sugieren que el riesgo de osteopenia y osteoporosis es similar en la CU y la EC sin diferencias con respecto al sexo y que la presencia de osteopenia se asocia con un 40% de aumento en el riesgo de fracturas. 38
La osteomalacia ocurre en el 1 a 5% de los pacientes y generalmente se debe a la deficiencia de vitamina D; además, los pacientes con EII tienen mayor riesgo de presentar osteonecrosis, la cual puede ser bilateral o multifocal, principalmente de las caderas, las rodillas y los hombros. La patogénesis no está bien comprendida, pero los esteroides son un importante factor de riesgo.39
Otras numerosas manifestaciones extraintestinales han sido asociadas a la EII: compromiso cardíaco, pulmonar, hematológico, hepatobiliar, genitourinario y neurológico; aún no está claro el papel etiológico de la EII o la presentación simultánea incidental de algunas de estas enfermedades y la verdadera asociación requiere estudios exhaustivos descartando además los efectos adversos de las medicaciones.
MANEJO DE LAS MANIFESTACIONES ARTICULARES
LAS MANIFESTACIONES EXTRAINTESTINALES de la EII son relativamente comunes. Sin embargo, son pocos los estudios controlados acerca del tratamiento, y las conductas terapéuticas se basan en la opinión de expertos y en reportes de casos. 40 Como regla general, en el manejo de las artritis enteropáticas se puede decir que “lo que es bueno para el intestino también ayuda a las articulaciones”. 41 El tratamiento debe individualizarse en función del número, localización y actividad de las articulaciones afectadas; muchos pacientes se pueden manejar con medidas simples como reposo, férulas, fisioterapia y ocasionalmente esteroides intrarticulares. 15
Para las manifestaciones periféricas, como la actividad de la artritis generalmente es paralela a la actividad inflamatoria intestinal, el control de ésta es el principal objetivo del tratamiento.
La sulfazalasina actúa sobre la mucosa intestinal disminuyendo su permeabilidad y también directamente sobre las articulaciones; ha demostrado ser efectiva en la CU pero la situación es menos clara en la EC.42 Igualmente, como ya se mencionó, tiene mayor efecto en las manifestaciones periféricas que en la enfermedad axial y a su vez la naturaleza esporádica de la artropatía periférica hace difícil valorar su eficacia terapéutica. Son comunes los efectos colaterales que se presentan hasta en el 45% de los pacientes, manifestados por fiebre, malestar general, vómito, dolor epigástrico y diarrea; adicionalmente, el déficit de ácido fólico y las reacciones idiosincráticas alérgicas han llevado al uso de su parte activa, la 5-ASA o mesalazina y la olsalazina, por tener menos efectos secundarios. 43
El uso de los AINE continúa siendo controvertido por su propiedad de desencadenar recaídas del compromiso intestinal en la EII. Evans y col. 44 encontraron que los pacientes con exposición reciente a los AINE tuvieron un OR de 1,77 (IC 95% 1,01-3,10) para la admisión hospitalaria por recaída de la EII. Reinisch y col. 45 publicaron los resultados del uso de rofecoxib, un COX-2 específico, en pacientes con artritis y artralgias asociadas a EII; 41% de los pacientes (13 de 32) mejoraron los índices de dolor e inflamación articular y solamente 2 suspendieron el tratamiento por recaída de la enfermedad intestinal. Este estudio se llevó a cabo en pacientes con EII en remisión y por lo tanto no es aplicable a los pacientes con enfermedad activa. Otros estudios han reportado que los COX2, etoricoxib y celecoxib, son medicamentos seguros en el manejo de las manifestaciones articulares de la EII.46,47
En general, el manejo del compromiso axial no difiere del de otras espondiloartropatías y muchos pacientes pueden responder a los AINE. Otros fármacos como metotrexate y ciclosporina no han sido ampliamente investigados en la artropatía asociada a la EII.
En los últimos años la terapia biológica también ha sido incluida en el manejo de la artritis enteropática. Infliximab, un anticuerpo monoclonal quimérico anti-TNF α , ha demostrado su efecto en la EII y en manifestaciones articulares como espondilitis, sinovitis o entesopatía. El reporte de cuatro casos exitosos por Van Den Bosch y col.48 sugiere que las manifestaciones articulares refractarias de la EC podrían ser una indicación potencial de infliximab. Herfarth y col.49 reportaron una serie de 153 pacientes con EC quienes recibieron infliximab y se logró mejoría de la artritis en el 61% de los casos. Con respecto a etanercept, Marzo-Ortega y col.50 reportaron dos casos en los que se demostró una considerable mejoría sintomática de la artropatía con una resolución paralela de la osteítis demostrada por resonancia nuclear magnética, aunque la inflamación intestinal continuó igual; esto sugiere que el etanercept es eficaz directamente en el sitio de la artropatía, pero no cambia el curso del compromiso intestinal en la EC.
En conclusión, la EII es el resultado de las alteraciones del perfecto equilibrio inmune del intestino; en ella participan la susceptibilidad genética y las agresiones ambientales como factores desencadenantes de la respuesta inflamatoria, que finalmente conducen de una manera aún mal entendida a la presencia de múltiples y variadas manifestaciones extraintestinales, entre las cuales las de tipo reumatológico continúan siendo las más frecuentes.
REFERENCIAS BIBLIOGRÁFICAS
1. Keighley MRB, Stockbrugger RW. Inflammatory bowel disease. Aliment Pharmacol Ther 2003;18 (Suppl. 3): 66-70. [ Links ]
2. Fiedman S, Blumber RS. Inflammatory bowel disease. In: Kasper DL, Braunwald E, Fauci A, Longo D, Jameson JL, eds. HARRISON'S. Principles of Internal Medicine, 16 th ed. New York: McGraw-Hill; 2004: 1776-1789. [ Links ]
3. Hanauer SB. Inflammatory bowel disease: Epidemiology, pathogenesis, and therapeutic opportunities. Inflamm Bowel Dis 2006; 12: 3-9. [ Links ]
4. Hoffmann RM, Kruis W. Rare extraintestinal manifestation of inflammatory bowel disease. Inflamm Bowel Dis 2004;10: 140-145. [ Links ]
5. Podolsky DK. Inflammatory bowel disease. N Engl J Med 2002; 347: 417-428. [ Links ]
6. Bamias G, Nyce MR, De La Rue SA, Cominelli F. New concepts in the pathophysiology of inflammatory bowel disease. Ann Intern Med 2005; 143: 895-904. [ Links ]
7. Ahmad T, Satsanji J, Mcgovern D, Bunce M, Jewell P. Review article: The genetics of inflammatory bowel disease. Aliment Pharmacol Ther 2001;15: 731-748. [ Links ]
8. Orhol M, Munkholm P, Langholz E, Nielsen OH, Sorensen TIA, Binder V. Familial occurrence of inflammatory bowel disease. N Engl J Med 1991; 324: 84-88. [ Links ]
9. Fuss IJ, Neurath M, Boirivant M, et al. Disparate CD4 + lamina propria (LP) lymphokine secretion profiles in inflammatory bowel disease: Crohn’s disease LP cells manifest increased secretion of IFN-γ, whereas ulcerative colitis LP cells manifest increased secretion of IL-5. J Immunoll 1996; 157: 1261-1270. [ Links ]
10. Wollheim FA, Enteropathic arthritis: How do the joints talk with the gut? Curr Opin Rheumatol 2001; 13: 305-309. [ Links ]
11. SHELDON P. Rheumatoid arthritis and gut related lymfocytes: The iteropathy concept. Ann Rheum Dis 1988; 47: 697-700. [ Links ]
12. Danese S, Semeraro S, Papa A, Roberto I, Scaldaferri F, Fedeli G, et al. Extraintestinal manifestations in inflammatory bowel disease. World J Gastroenterol 2005;11: 7227-7236. [ Links ]
13. Bocker U, Sartor RB. Mechanisms of arthritis associated with chronic intestinal inflammation. In: Calin A, Tourog J, eds. The spondylartrhitides. New York : Oxford University Press; 1998. 207-222. [ Links ]
14. Holden W, Orchard T, Wordsworth P. Enteropathic arthritis. Rheum Dis Clin N Am 2003; 29: 513-530. [ Links ]
15. Haslock I, Wright V. The musculo-skeletal complications of Crohn's disease. Medicine 1973; 52: 217-226. [ Links ]
16. Scorr-Lesnick B, Brandt LJ. Selected rheumatologic and dermatologic manifestations of inflammatory bowel disease. Am J Gastroenterol 1988; 83: 216-223. [ Links ]
17. Mcewen C, Lingg C, Kirsner JB. Arthritis accompanying ulcerative colitis. Am J Med 1962; 33: 923-941. [ Links ]
18. Bywaters EGL, Ansell BM. Arthritis associated with ulcerative colitis: A clinical and pathological study. Ann Rheum Dis 1958; 17: 169-183. [ Links ]
19. Orchard TR, Worswor TH, Jewel DP. Peripheral arthropathies in inflammatory bowel disease: their articular distribution and natural history. Gut 1998; 42: 387-391. [ Links ]
20. Helliwell PS, Hickling P, Wrigth V. Do the radiological changes of classic ankylosing spondylitis differ from the changes found in the spondylitis associated with inflammatory bowel disease, psoriasis, and reactive arthritis? Ann Rheum Dis 1998; 57: 135-140. [ Links ]
21. Mcewen C, Ditata D, Ling GC, Porini A, Good A, Rankin T. Ankylosing spondylitis and spondylitis accompanying ulcerative colitis, regional enteritis, psoriasis and Reiter’s disease. Arthritis Rheum 1971;14: 291-318. [ Links ]
22. Münch H, Purrman J, Reis HE. Clinical features of inflammatory joint and spine manifestations in Crohn’s disease. Hepatogastroenterology 1986; 33: 123-127. [ Links ]
23. Mallas EG, Mackintosh P, Asquith P, Cooke T. Histocompatibility antigens in inflammatory bowel disease. Their clinical significance and their association with arthropathy with special reference to HLA-B27 (w27). Gut 1976; 17: 906-910. [ Links ]
24. Orchard TR, Thiyagaraja S, WELSH KI, Wordsworth BP, Gaston JSH, Jewel DP. Clinical phenotype is related to HLA genotype in the peripheral arthropathies of inflammatory bowel disease. Gastroenterology 2000;118: 274-278. [ Links ]
25. Greenstein AJ, Janowitz HD, Sachar DB. The extraintestinal complications of Crohn’s disease and ulcerative colitis: A study of 700 patients. Medicine 1976; 55: 401-412. [ Links ]
26. Bernstein CN, Blanchard JF, Rawsthorne P, Yu N. The prevalence of extraintestinal diseases in inflammatory bowel disease: A population-based study. Am J Gastroenterol 2001; 96: 1116-1122. [ Links ]
27. Orchard TR, Chua CN, Ahmad T. Uveitis and erythema nodosum in inflammatory bowel disease: Clinical features and the role of HLA genes. Gastroenterology 2002; 123: 714-718. [ Links ]
28. Trost LB, Mcdonell JK. Important cutaneous manifestations of inflammatory bowel disease. Postgrad Med J 2005; 81: 580-585. [ Links ]
29. Apgar JT. Newer aspects of inflammatory bowel disease and its cutaneous manifestations: a selective review. Semin Dermatol 1991;10: 138-147. [ Links ]
30. Kelley ML. Skin lesions associated with chronic ulcerative colitis. Am J Dig Dis 1962; 7: 255-272. [ Links ]
31. Johnson ML, Wilson HT. Skin lesions in ulcerative colitis. Gut 1969;10: 255-263. [ Links ]
32. Orchard T. Extraintestinal complications of inflammatory bowel disease. Curr Gastroenterol Rep 2003; 5: 512-517. [ Links ]
33. Su CG, Judge TA, Lichtenstein GR. Extraintestinal manifestations of inflammatory bowel disease. Gastroenterol Clin N Am 2002; 31: 307-327. [ Links ]
34. Juillerat P, Mottet C, Froehlich F, Felley C, Vader JP, Burnand B, Gonvers JJ, Michetti P. Extraintestinal manifestations of Crohn’s disease. Digestion 2005; 71: 31-36. [ Links ]
35. Regueiro M, Valentine J, Plevy S, Fleischer MR, Lichtenstein GR. Infliximab for treatment of pyoderma gangrenosum associated with inflammatory bowel disease. Am J Gastroenterol 2003; 98: 1821-1826. [ Links ]
36. Loftus EV. Management of extraintestinal manifestations and other complications of inflammatory bowel disease. Curr Gastroenterol Rep 2004; 6: 506-513. [ Links ]
37. Bernstein CN, Blanchard JF, Leslie W, Wajda A, Yu BN. The incidence of fracture among patients with inflammatory bowel disease. Ann Intern Med 2000; 133: 795-799. [ Links ]
38. Bernstein CN, Leslie WD, Leboff MS. AGA technical review on osteoporosis in gastrointestinal diseases. Gastroenterology 2003; 124: 795-841. [ Links ]
39. Orchard T. Extraintestinal complications of inflammatory bowel disease. Curr Gastroenterol Rep 2003; 5: 512-517. [ Links ]
40. Wollheim FA, Enteropathic arthritis. In: Harris ED, Budd RC, Firestein GS, Genovese MC, Sergent JS, Ruddy S, Sledge CB, eds. KELLEY’S Textbook of Rheumatology, 7ª ed. Philadelphia: Elsevier Saunders; 2005:1165-1173. [ Links ]
41. Nash CL, Sutherland LR. Medical management of inflammatory bowel disease: Old and new perspectives. Curr Opin Gastroenterol 2001; 17: 336-341. [ Links ]
42. Rodriguez M, Ponce A. Artritis enteropáticas. En: Ruiz AA, García JM, Andreu JL, Rubio JB, Estevez EC. Manual de Enfermedades Reumatológicas de la Sociedad Española de Reumatología. 1ª ed. Madrid. Panamericana; 2001: 424-431. [ Links ]
43. Evans JM, Mcmahon AD, Murray FE. Non-steroidal anti-inflammatory drugs are associated with emergency admission to hospital for colitis due to inflammatory bowel disease. Gut 1997; 40: 619-622. [ Links ]
44. Reinisch W, Miehsler W, Dejaco C. An open-label trial of selective cyclo-oxigenase-2 inhibidor, rofecoxib, in inflammatory bowel disease-associated peripheral arthritis and artrhalgia. Aliment Pharmacol Ther 2003; 17:1371-1380. [ Links ]
45. Sanborn WJ, Stenson WF, Brynskov J. Safety of celecoxib in patients with ulcerative colitis in remission: A randomised double-blind, placebocontrolled study (Abstract). Am J Gastroenterol 2004; 99 (Suppl): S257. [ Links ]
46. Miedany YE, Youssef S, Ahmed I, Gaafary ME. The gastrointestinal safety and effect on disease activity of etoricoxib, a selective Cox-2 inhibitor in inflammatory bowel diseases. Am J Gastroenterol 2006; 101: 311-317. [ Links ]
47. Van Den Bosch F, Kruithof E, De Vos M, De Keyser F, MIelants H. Crohn's disease associated with spondyloarthropathy: effect of TNF-α blockade with infliximab on articular symptoms. The Lancet 2000; 356: 1821-1822. [ Links ]
48. Herfarth H, Obermeier F, Andus T, Rogler G, Nikolaus S, Kuehbacher T, Schreiber S. Improvement of arthritis and arthralgia after treatment with infliximab (Remicade) in a German prospective, open-label, multicenter trial in refractory Crohn’s disease. AJG 2002; 97: 2688-2690. [ Links ]
49. Marzo-Ortega H, Mcgonagle D, O'connor P, Emery P. Efficacy of etanercept for treatment of Crohn's related spondyloarthritis but not colitis. Ann Rheum Dis 2003; 62: 74-76. [ Links ]