Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.19 no.4 Medellín Oct./Dec. 2006
ARTÍCULO ORIGINAL
Clínica de la malaria complicada debida a P. falciparum; Estudio de casos y controles en Tumaco y Turbo (Colombia)
Clinical presentation of severe malaria due Plasmodiun falciparum. Case control study in Tumaco and Turbo (Colombia)
ALBERTO TOBÓN CASTAÑO1,2, JUAN G. PIÑEROS JIMÉNEZ1,3, SILVIA BLAIR TRUJILLO1,4, JAIME CARMONA–FONSECA1,5
- Grupo Malaria, Universidad de Antioquia. http://medicina.udea.edu.co/Investigacion/Grupos/malaria/index.htm
- MD, MSc Epidemiología
- MD, estudiante doctorado Salud Pública, Universidad Nacional de Colombia
- MD ; MSc Historia, Coordinadora Grupo Malaria
- MD, MSc Microbiología Médica, MSc Epidemiología. Dirección para correspondencia: jaimecarmonaf@hotmail.com Investigación financiada por Colciencias, Instituto Departamental de Salud de Nariño y Universidad de Antioquia.
Recibido: septiebre 12 de 2006
Aceptado: octubre 11 de 2006
RESUMEN
ANTECEDENTES Y PROBLEMA : son muy pocos los estudios latinoamericanos sobre malaria por Plasmodium falciparum (P falciparum) complicada y se requiere estudiarla para identificar un patrón propio.
OBJETIVOS : Identificar las complicaciones presentes en pacientes de Tumaco (Nariño) y Turbo (Antioquia) en Colombia, con malaria por P falciparum.
MÉTODOS : Diseño de casos y controles. Se aplicaron los criterios diagnósticos de complicación OMS–2000 (Organización Mundial de la Salud).
RESULTADOS : Se captaron 64 casos (con malaria por P. falciparum complicada) y 135 controles (con malaria por P. falciparum no complicada). El tiempo de evolución de la enfermedad (promedio 5,6 días en los casos y 5,9 en los controles) y la frecuencia de síntomas fueron similares en ambos grupos (p>0,05), pero la dificultad respiratoria y la ictericia fueron más frecuentes en los casos que en los controles (p<0,05). Los valores promedio de glicemia y creatinina fueron similares en ambos grupos, pero los casos tuvieron hemoglobina y recuento de plaquetas menores que los controles (p<0,05) y mayores niveles de nitrógeno ureico, aspartatoaminotransferasa y bilirrubinas total y directa (p<0,05).
Las complicaciones encontradas fueron hiperparasitemia en 48%, disfunción hepática en 44%, síndrome de dificultad respiratoria aguda en 9%, falla renal en 6%, trombocitopenia grave en 5%, anemia grave en 3%, malaria cerebral en 3% e hipoglicemia grave en 2%. Los criterios de complicación malárica de OMS se comparan con otros y se discuten las implicaciones.
PALABRAS CLAVE
COLOMBIA
MALARIA
MALARIA COMPLICADA
MALARIA GRAVE
PLASMODIUM FALCIPARUM
SUMMARY
BACKGROUND : Latin American studies on severe falciparum malaria are scarce, therefore, the pattern of complications of the region is uknown.
OBJECTIVES : To identify characterize severe malaria in patients from Tumaco (Nariño) and Turbo (Antioquia) in Colombia .
METHODS : The 2000 World Health Organization criteria for complicated malaria were applied in a cases and controls study.
RESULTS : 64 cases ( P falciparum complicated malaria) and 135 controls ( P falciparum uncomplicated malaria) were included. The time of evolution of the disease (mean 5.6 days in cases and 5.9 in the controls) and the frequency of most symptoms were similar in both groups (p>0.05).
However, respiratory distress and jaundice was more frequent in the cases (p<0.05). The mean glycemia and creatinina values were similar in both groups; hemoglobin and platelet count were lower in the cases (p<0.05) when compared to controls.
On the other hand, blood ureic nitrogen, aspartatoaminotransferase, and total and direct bilirrubin were lower in controls (p<0.05). The frequency of complications in the cases was as follows: hyperparasitaemia 48%, liver dysfunction 44%, acute; respiratory distress syndrome 9%, kidney failure 6%, severe thrombocytopenia 5%, severe anemia 3%, cerebral malaria 3% and severe hipoglycemia 2%. The WHO criteria for severe malaria were compared with others and the implications are discussed.
KEY WORDS
COLOMBIA
COMPLICATED MALARIA
MALARIA
PLASMODIUM FALCIPARUM
SEVERE MALARIA
INTRODUCCIÓN
La malaria o paludismo es la expresión clínica de la relación agente–hospedero–ambiente sucedida entre un protozoario del genero Plasmodium, el humano y el contexto socionatural específico donde parásito y humanos se encuentran. La infección plasmodial puede cursar desde asintomática, pasando por un cuadro leve de fiebre, escalofrío, sudoración y malestar general, y llegar hasta un síndrome grave o complicado, con hiperpirexia, anemia progresiva, confusión, somnolencia o debilidad extremas y luego presentarse deterioro de la consciencia hasta un coma profundo (malaria cerebral), disturbios hidroelectrolíticos, septicemia (malaria álgida) y disfunción multiorgánica que puede llevar a la muerte.1 La gravedad de la malaria se ha atribuido a características del parásito, del hospedero y del ambiente; aquellas que con más frecuencia se han relacionado son infecciones por Plasmodium falciparum con alta parasitemia o presencia de esquizontes circulantes, edad del paciente, ausencia de inmunidad específica antipalúdica, estado de embarazo, ausencia de quimioprofiláxis y limitado acceso a los servicios de salud que ocasiona demora en el diagnóstico y tratamiento.3–8
La magnitud de la endemia de la zona malárica contribuye a que algunos grupos poblacionales sean más afectados por la enfermedad y a que desarrollen enfermedad complicada o mueran. En zonas hiperendémicas (51–75% de niños de 2–10 años con malaria) y holoendémicas (>75% de niños de un año con malaria)9como en África subsahariana, el paludismo afecta más a los niños menores de cinco años y las mujeres embarazadas, con una alta tasa de anemia grave, malaria cerebral y muerte; en zonas de menor endemicidad, como América Latina y Asia, todos los grupos etáreos se afectan y la forma complicada o grave se presenta más en hombres adultos jóvenes y mujeres embarazadas.4,5,10
La malaria es endémica en 107 países de Asia, África y Latinoamérica; en 2004 se presentó una incidencia mundial estimada de 402 millones de casos, y una mortalidad anual de 3 millones.11 En Colombia se informaron 107.866 casos de malaria en 2005, de los cuales el 34% fueron producidos por P. falciparum, entre quienes fallecieron el 0,03% (28 muertes).12 Es bueno advertir, sin embargo, que la OMS considera que las estadísticas en la mayoría de los países endémicos son bastante imprecisas, sin que Colombia sea la excepción, estimando que el registro de casos en este país solo alcanza 13% del total.11 Aunque en Colombia la mortalidad informada por malaria es baja, únicamente da cuenta de los datos hospitalarios, además de que está afectada por el subregistro.13
Si se asume que la cifra de casos estimada por la OMS para Colombia en 2004 es de 1.337.309 11 y se mantiene la proporción informada de muertes (0,03%), el número de decesos estimado sería de 347, cifra 12 veces mayor que la informada en 2005.
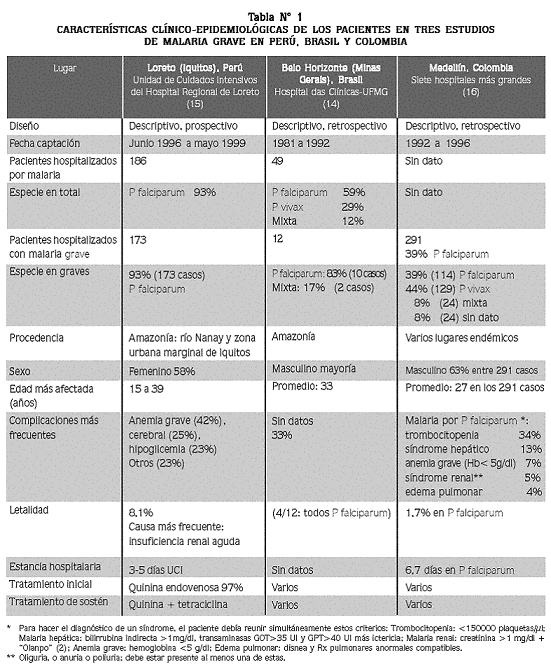
Una búsqueda reciente (4 agosto 2006) en Pubmed con la expresión complicated falciparum malaria Colombia, no halló ninguna referencia, hallazgo que se repitió cuando se hizo la misma búsqueda para cada uno de los países latinoamericanos. La búsqueda en Lilacs con malaria falciparum complicada arrojó varias referencias, pero únicamente dos se refieren de manera efectiva al tema: el trabajo descriptivo retrospectivo de Silva y colaboradores sobre 49 pacientes hospitalizados en Belo Horizonte, Brasil, entre 1981 a 1992,14 y el estudio descriptivo prospectivo de Bardales y asociados, sobre 186 pacientes hospitalizados en Iquitos, Perú, entre 1996 y 1999.14El informe de Perú refiere que las complicaciones más frecuentes fueron anemia grave (42%), cerebral (25%) e hipoglicemia (23%), con una mortalidad de 8%.15 (Tabla N° 1).
En un informe nuestro sobre los resultados de una investigación descriptiva y retrospectiva ejecutada en hospitales de Medellín, donde no hay malaria endémica,16se reportó que en el lapso 1992–1996 hubo 525 casos hospitalizados en los siete hospitales públicos o privados más grandes de la ciudad, de los cuales pudimos revisar 291 historias clínicas; de estos pacientes, 55% (160) residía en Medellín y adquirió la infección durante visita a una zona endémica; 39% de ellos (113 casos) tuvo P falciparum como especie única. En los pacientes con paludismo por P falciparum el tiempo promedio de hospitalización fue de 6,7 días, y la parasitemia de 3.435 ± 6.903 parásitos asexuales/µl (promedio ± desviación estándar); la letalidad fue 1,7% (Tabla N° 1). Los 113 pacientes con malaria por P falciparum que requirieron hospitalización presentaron 78 cuadros diferentes (un paciente puede tener uno o varios síndromes). El síndrome más frecuente fue la trombocitopenia (34%), seguido de la hepatitis malárica (13%).
Conocemos otros dos informes colombianos sobre malaria grave correspondientes a una situación epidémica vivida en la costa del Pacífico del departamento de Nariño,17,18 donde diez municipios son endémicos y albergan a unos 400.000 habitantes, todos ellos expuestos a paludismo, del cual 75% es debido a P. falciparum.17 De 155 pacientes con malaria, 115 (74%) se diagnosticaron como grave;18 el informe no discrimina la frecuencia de malaria grave debida a cada especie plasmodial.
De acuerdo con una revisión reciente sobre malaria grave, las complicaciones incluyen los sistemas nervioso, respiratorio, renal o hematopoyético; la acidosis metabólica y la hipoglicemia son complicaciones sistémicas comunes.19 Los mismos autores afirman que en los países tropicales con alta transmisión palúdica, la malaria grave es predominantemente una enfermedad de niños menores de cinco años de edad, mientras que en los países industrializados las complicaciones ocurren en sujetos no inmunes que viajan a áreas endémicas. Varios estudios sobre factores de riesgo de malaria grave y muerte incluyen la edad mayor de 65 años, el sexo femenino (en especial cuando se asocia con gestación), el estado no inmune, la coexistencia de condiciones médicas, la ausencia de profilaxis malárica, el retardo para instaurar el tratamiento y la gravedad de la enfermedad.19
Para contribuir al conocimiento de la malaria complicada por P falciparum en Colombia, nosotros adelantamos una investigación en Tumaco y Turbo para describir las formas clínicas e identificar factores asociados a la enfermedad grave; este informe presenta los aspectos clínicos y de laboratorio de los pacientes estudiados.
METODOLOGÍA
Clase de estudio
Se diseñó un estudio de casos y controles no pareados, donde el caso correspondió al paciente con paludismo por P falciparum complicado, y el control al enfermo con paludismo por P falciparum no complicado.
Definición de caso. Un caso fue el paciente con síntomas o signos clínicos compatibles con malaria, con parasitemia asexual debida solamente a P falciparum, sin otra causa identificada para explicar su cuadro clínico, y con presencia de uno o más de los signos siguientes, cuya presencia configura una malaria complicada:20
1) Hiperparasitemia: más de 50.000 parásitos/µl13
2) Presencia de una o más de las siguientes manifestaciones:20 coma profundo, valorado por escala de Glasgow < 9, o de Blantyre < 2; convulsiones generalizadas reiteradas; hemoglobina ( Hb) < 5 g/ dl; creatinina sérica > 3,0 mg/ dl, nitrógeno uréico en sangre (BUN) > 40 mg/ dl, bilirrubina total (BT)> 3 mg/ dl, aspartatoaminotransferasa (AST) > 120 UI/l, glicemia < 40 mg/ dl, presión arterial sistólica < 50 mmHg en pacientes con edad menores de cinco años y < 70 mmHg para edad mayores de cinco años, edema pulmonar, hemorragia espontánea con coagulación intravascular diseminada o plaquetas < 20.000/ μl, acidemia o acidosis, respiración acidótica o hemoglobinuria macroscópica.
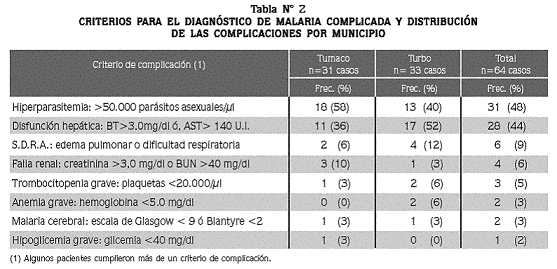
Se adoptaron las siguientes definiciones: 1) Malaria cerebral: coma según las escalas de Glasgow o Blantyre, 2) Disfunción hepática: BT > 3,0mg/ dl ó AST > 140 UI, 3) Falla renal: creatinina > 3,0 mg/ dl o BUN > 40 mg/ dl, 4) síndrome de dificultad respiratoria aguda (SDRA): disnea acompañada de hallazgos radiológicos de edema pulmonar o infiltrados pulmonares, 5) Trombocitopenia grave: plaquetas < 20.000/ μl, 6) Hipoglicemia grave: glicemia < 40 mg/ dl (Tabla N° 2).
Definición de control. Un control fue aquel paciente con síntomas o signos clínicos compatibles con malaria, con parasitemia asexual menor de 50.000 parásitos/ μl debida solamente a P falciparum, sin otra causa identificada para explicar su cuadro clínico y con ausencia de todas las manifestaciones descritas en la definición del caso.
Tamaño de la muestra
Se estableció una muestra de casos de 62 pacientes y de 124 controles, usando estas condiciones y supuestos: 1) Nivel de confianza: 95%, 2) Potencia de la prueba: 80%, 3) Relación controles:casos, 2:1, 4) Frecuencia esperada de exposición al factor de riesgo en los controles: 15%, 5) Valor mínimo de la razón de apuestas ( odds ratio OR, en inglés) para ser detectado: 3,0.
Población de referencia
El trabajo se hizo en dos puertos colombianos: Tumaco (Nariño), en el sur de la costa Pacifica, y Turbo, en el mar Caribe, sobre el golfo de Urabá.
Los pacientes se captaron según el orden de llegada en los respectivos hospitales locales San Andrés y Francisco Valderrama, entre noviembre de 2002 y julio de 2003, y siempre debieron reunir los criterios de inclusión. Los pacientes estudiados son parte de la incidencia de malaria por P falciparum en ambos municipios en el período estudiado.
Evaluaciones médica y de laboratorio
El examen clínico a la totalidad de los pacientes fue practicado por médicos con experiencia en la atención de pacientes con malaria y ellos decidieron sobre el cumplimiento de los criterios de inclusión. Se tomaron muestras de sangre para exámenes de laboratorio clínico, caracterización genética de plasmodios e inmunoglobulinas. Después de ingresar al estudio, los controles fueron tratados en forma ambulatoria, mientras que los casos fueron hospitalizados. Los controles fueron seguidos por tres días en Tumaco y por siete días en Turbo. Los pacientes hospitalizados fueron observados hasta ser dados de alta. Durante el tiempo de observación no ocurrió ninguna muerte. La gota gruesa se hizo según el método establecido por la OMS21 por un laboratorista clínico del respectivo hospital (lector uno), quien estableció la presencia de infección exclusiva por P falciparum e hizo el recuento de parásitos. Todas las láminas fueron enviadas al laboratorio de hemoparásitos de la Facultad de Medicina de la Universidad de Antioquia, donde otro profesional de laboratorio clínico (lector dos), con experiencia en el diagnóstico de malaria, hizo una lectura ciega de las placas y ratificó o corrigió el diagnóstico de especie y la parasitemia.
Aspectos éticos
El estudio fue aprobado por el comité de ética del centro de investigaciones de la Facultad de Medicina de la Universidad de Antioquia y cada paciente firmó el consentimiento informado que en forma escrita se les presentó al ingresar al estudio.
Análisis estadístico de los datos. La información obtenida se procesó en los programas EpiInfo 6.04 y SPSS 10.0. El análisis de los datos siguió esta estrategia:
1. Se hizo análisis de normalidad de cada variable con la prueba de Kolmogorov– Smirnov; 2. Análisis de casos y controles no pareados: se hizo una prueba chi cuadrada según Mantel y Haenszel (o chi cuadrada general para tablas de más de 4 celdas). Para medir la magnitud de la diferencia de riesgo entre casos y controles se calculó la razón de apuestas (OR) y se obtuvo el intervalo de confianza del 95% (IC95%) para cada OR. Las variables métricas o cuantitativas se compararon mediante una prueba de diferencia de medias o de medianas, como la de Mann y Withney y, excepcionalmente, con la prueba t de Student.
Además se hizo análisis descriptivo del comportamiento de las variables clínicas En todos los análisis se consideró estadísticamente significativa una probabilidad menor de 0,05 (cinco por ciento).
RESULTADOS
Se ingresaron al estudio 199 pacientes con malaria por P. falciparum: 64 casos y 135 controles. De los 64 casos, 31 se captaron en Tumaco y 33 en Turbo. Las mujeres representaron 47% de los pacientes, tanto de los casos como de los controles; la edad osciló entre 1 y 82 años (promedio veintiséis años), con promedio de 24 años en los casos (solo 9% con edad inferior a 5 años) y de 27 en los controles. De los 64 casos, 42 (67%) residían en zona rural y en el momento de consultar 56 (88%) procedían de sus municipios de residencia. La permanencia de los casos en zonas endémicas de malaria fue de 16 ± 11 años (promedio ± desviación estándar). Las complicaciones (síndromes diagnosticados en los 64 casos) fueron: hiperparasitemia, disfunción hepática, síndrome de dificultad respiratoria agudo, disfunción renal, trombocitopenia grave, anemia grave, malaria cerebral e hipoglicemia grave. No hubo diferencia estadísticamente significativa en la distribución de las complicaciones según el municipio (Tabla N° 2).La evaluación de las complicaciones en los casos indica que 84% mostró un síndrome y 16% más de uno (Tabla N° 3). Entre los síndromes únicos, la hiperparasitemia fue el diagnóstico más frecuente (39%), seguido de la disfunción hepática (33%) y del SDRA (5%).
Condiciones asociadas a la malaria
Se diagnosticó enfermedad infecciosa concomitante en 22% de los pacientes con paludismo (44/199), repartidos en 25% de los casos y 21% de los controles (p>0,05). El diagnóstico más frecuente fue infección en tracto urogenital (32%), que se presentó en 14 mujeres, 5 de ellas gestantes); otros diagnósticos fueron faringoamigdalitis, conjuntivitis, neumonía, herpes labial, infecciones de piel. De las 94 mujeres, 24 (26%) eran gestantes, 8 de las cuales hacían parte de los 30 casos (27%), y 16 de ellas del grupo de los 64 controles (25%).
En el grupo de los casos el 100% se encontraban en el tercer trimestre de gestación, comparado con 75% del grupo de los controles. No se encontró una mayor probabilidad de estar en embarazo entre las mujeres complicadas frente a las no complicadas.
Características clínicas de la enfermedad
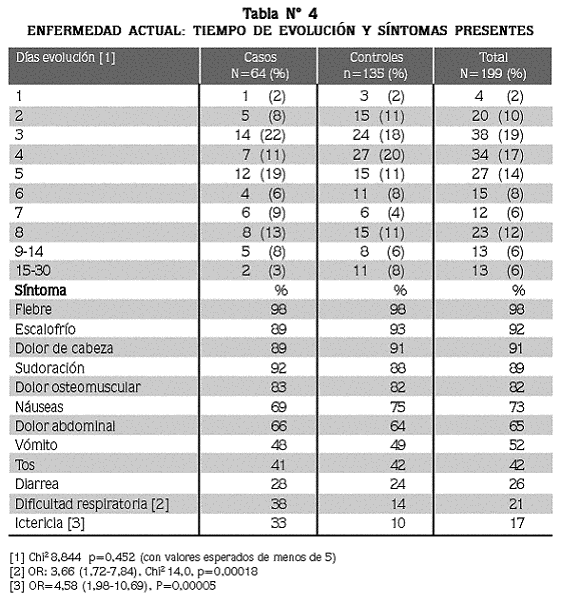
El tiempo de evolución del episodio palúdico actual hasta ingresar al estudio osciló de 1 a 30 días, con promedio de 5,6 ± 3,0 días (mediana= 5) en los casos y de 5,9 ± 4.4) (mediana= 4) en los controles (tabla N° 4).
Los síntomas que presentaron con mayor frecuencia los pacientes durante el actual episodio palúdico fueron fiebre, escalofrío, cefalea, sudoración y debilidad (tabla N° 4), sin que se encontraran diferencia entre los casos y los controles, mientras que para la ictericia (OR=4,58; I.C: 1,98–10,69, p=0,00005) y para la dificultad respiratoria, referida como sentirse alcanzado para respirar, fueron más frecuentes en los pacientes del grupo de los casos (OR:3,7; I.C: 1,7–7.8, p=0,00018).
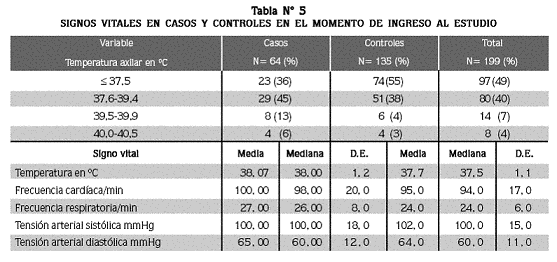
Signos vitales: en el momento de la consulta hubo fiebre en 51% (102) de los pacientes y la temperatura axilar presentó diferencia significativa (p= 0,027) entre los casos (promedio ± D.E= 38,1 C° ± 1.2) y los controles (37,7 C° ± 1.1), hallazgo que se repitió en la frecuencia respiratoria (p= 0,012), que fue 27/minuto ± 8 en los casos, y 24/ min ± 6 en los controles (tabla N° 5). La frecuencia cardíaca y las tensiones arteriales sistólica y diastólica no presentaron diferencia significativa entre los casos y los controles.
Un mayor número de pacientes del grupo de los casos presentó mayor probabilidad que los de los controles de tener algunos signos y síntomas de peligro en el momento del ingreso, como ictericia (OR=4,6; IC95% 2,1–9,9; p=0,000), taquipnea (OR=2,5; IC95% 1,3–4,6; p=0,004), temperatura axilar superior a 39,5 °C (OR= 2,9; IC95% 1,1–7,8; p=0,017) y trastornos neurológicos (somnolencia, irritabilidad) (OR=5,6; IC95% 1,1–29,8; p=0,042).
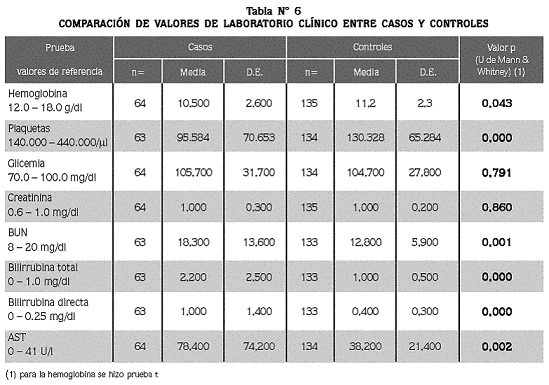
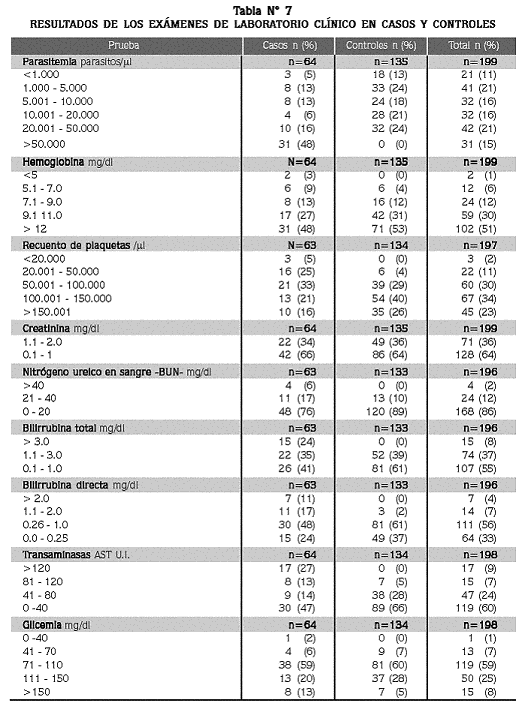
Se exploraron las diferencias de los resultados de laboratorio y de parasitemia entre casos y controles (tablas N° 6 y 7), encontrando un promedio de parasitemia de 51.000/µl en el grupo de los casos, versus 12.338/µl en el de los controles (p=0.000).
En resumen, 85% de los pacientes tenía hasta 50.000 formas asexuales/µl y apenas 5% portaba más de 100.000/µl. Por otra parte, 52% de los del grupo de los casos tenía hasta 50.000 parásitos/µl y apenas 15% de ellos mostraron más de 100.000 parásitos/µl. De los pacientes incluidos en el grupo de los casos, 39% (25/64) se calificaron así solamente por la hiperparasitemia, sin que tuviesen un síndrome clínico asociado; sólo 9% (6/64) fue diagnosticado como complicado por tener hiperparasitemia y uno o varios criterios clínicos, en dos se encontraron esquizontes en la gota gruesa (signo de complicación) y el resto presentó síndrome clínico grave sin hiperparasitemia.
En cuanto el hemograma y la química sanguínea, se encontraron diferencias significativas para los valores de hemoglobina, plaquetas, BUN, bilirrubina total y directa y AST entre los casos y los controles, y no así para los valores glicemia y creatinina. Tanto en el grupo de los casos como en el de los controles los promedios de hemoglobina revelaron anemia, estadísticamente mayor en los primeros. Entre los controles, 4% presentaron valores inferiores a 7 g/ dl, frente a 12% entre los casos, dos de los cuales tuvieron menos de 5 g/ dl; el menor valor encontrado fue 4.2 g/ dl, en un caso.
Con respecto al recuento de plaquetas, hubo trombocitopenia en los dos grupos, aunque más acentuada en los casos (p<0,05); se encontró trombocitopenia grave en 2% de los casos (3/64) con recuentos de 6.000, 19.000 y 20.000/µl . En cuanto a las pruebas de función renal, los promedios de creatinina estuvieron en el rango normal en ambos grupos. Ningún paciente se clasificó como caso con base en el resultado de la creatinina sérica. El promedio de BUN fue normal en los dos grupos, aunque significativamente mayor entre los pacientes del grupo de los casos (18,3 mg/ dl), que en los controles (12,7 mg/ dl). Cuatro pacientes se clasificaron con disfunción renal por tener BUN > 40 m/dl.
Para las pruebas de función hepática, el promedio de BT en los casos fue más del doble del valor máximo normal, mientras que en los controles estuvo en ese límite normal, con diferencia significativa entre los dos grupos. En el grupo de los casos, 41% presentaron BT normal (<1mg/ dl) mientras que 39% de los controles presentaron BT elevada (>1 mg/ dl). El promedio de BD estuvo elevado en ambos grupos, aunque mucho más en los casos (1,0 vs. 0,4 mg/ dl; p<0,05). El promedio de la AST se encontró por encima del límite superior normal en 40% de los casos y 5% de los controles (p<0,05).
Para la glicemia, 8% de los casos (5/64) y 7% de los controles (9/134), presentaron hipoglicemia (<70 mg/ dl), aunque los promedios fueron similares para los dos grupos; uno de los pacientes del grupo de los casos (niño de 12 años de edad, con vómito y con 7.700 parásitos/ µl ) tenía hipoglicemia grave (<40 mg/ dl). La comparación de los valores promedios para los resultados de todas estas pruebas, entre pacientes del grupo de los casos que tenían hiperparasitemia, sin complicación clínica, y los controles, no demostró diferencias (p<0,05), excepto para el recuento de plaquetas que fue de 91.633/µl en los primeros, y de 130.328/ µl< > en los controles (p=0,008), lo que sugiere que la hiperparasitemia pura no es en si una complicación.
DISCUSIÓN
Aunque la muestra está basada en fuentes hospitalarias, consideramos que representó realmente la malaria por P falciparum complicada poblacional, debido a que los pacientes fueron captados en los centros de atención donde consultan casi todos los habitantes de los municipios del estudio.
De acuerdo con las características sociodemográficas, los pacientes se asemejan a los habitantes de otras zonas maláricas en Colombia, sin que hubiese habido diferencias importantes entre casos y controles según su distribución por sexo, edad, zona de residencia, procedencia o tiempo de permanencia en zonas maláricas.
Utilidad de los síntomas–signos palúdicos para diagnosticar complicación
La frecuencia de los síntomas clásicos de la malaria en el grupo de los casos fue alta (fiebre 98%, escalofrío 89%, sudoración 92%), comparada con la encontrada en 291 pacientes palúdicos hospitalizados en Medellín, Colombia (16) (95%, 49% y 37%, respectivamente). En ambos estudios fue similar la frecuencia de vómito (48% vs. 58%) y diarrea (28% vs. 27%).
De otro lado, la frecuencia de síntomas durante la enfermedad, tanto en los casos como en los controles, es similar a la conocida por nosotros en enfermos con malaria por P falciparum no complicada (datos sin publicar), y a lo que informamos en pacientes con malaria por P vivax no complicados (22); en estos últimos los principales hallazgos fueron fiebre (99%), cefalea (99%), escalofrío (91%), sudoración (78%) y vómito (39%).
De acuerdo con todo lo anterior, los signos y síntomas clásicos presentes durante la enfermedad son similares en paludismo no complicado y complicado, pero algunos considerados como signos de peligro si tuvieron mayor probabilidad de presentarse en el paciente complicado, como fueron ictericia, hiperpirexia, taquipnea y alteraciones neurológicas.
Complicaciones maláricas: comparación con otros estudios
El diagnóstico de malaria por P falciparum complicada se estableció en este estudio aplicando los criterios establecidos por la OMS en 2000,20 excepto para la hiperparasitemia, en la que utilizamos el criterio establecido para Colombia por el Ministerio de Salud13, y la trombocitopenia grave, la que definimos como un recuento de menos de 20.000 plaquetas/µl de acuerdo con el criterio de Horstmann et al. (1981)20
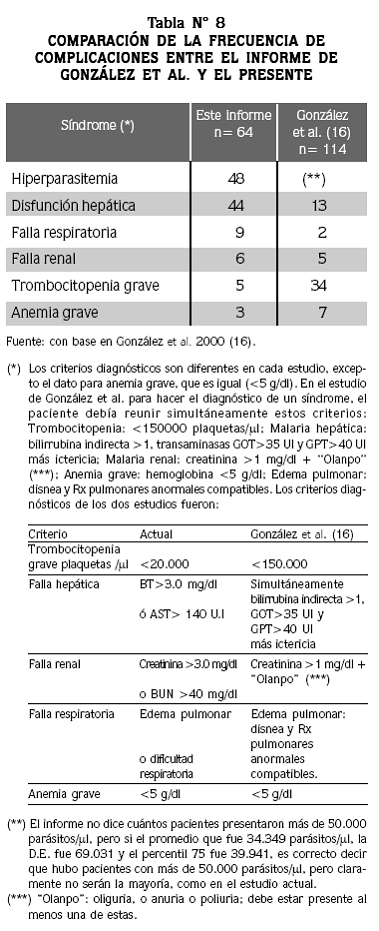
Para comparar la frecuencia de las complicaciones entre varios estudios, más que usar los mismos nombres para diferentes síndromes, es indispensable que se hayan aplicado los mismos criterios diagnósticos. Esto puede ilustrarse con la comparación de dos informes sobre malaria en pacientes hospitalizados y graves, realizados ambos por nosotros: el trabajo de González y colaboradores16 y el presente, en los que la notoria diferencia entre las frecuencias de cada síndrome proviene de la definición de gravedad de los criterios diagnósticos (Tabla N° 8).
En el Pacífico colombiano, en pacientes con malaria por P falciparum hospitalizados18 se encontró que la complicación hepática fue la más frecuente (33%), seguida de complicación renal (31%), hiperparasitemia (22%), malaria cerebral (17%) y anemia grave (13%). La hiperparasitemia sin otra complicación solo se encontró en 3% de los casos y se acompañó de otra complicación en el 19% de los casos, a diferencia del 39% y 9% respectivamente encontrado por nosotros. En siete hospitales de Medellín16 las complicaciones maláricas más frecuentes, usando criterios de diagnóstico diferentes a los de la OMS, fueron trombocitopenia, complicación hepática y anemia grave.
Las diferencias con nuestros hallazgos pueden explicarse porque estos trabajos emplearon criterios de complicación con umbrales inferiores a los establecidos por la OMS, con excepción de la hiperparasitemia que empleó el mismo criterionuestro.
Las complicaciones aquí encontradas difieren de lo informado en otras regiones del mundo,23–25 en las cuales la malaria cerebral, síndrome de dificultad respiratoria y falla renal fueron más frecuentes.
Criterios diagnósticos empleados: necesidad de revisarlos
Tal como se plantea en otros trabajos,4,7 pensamos que los criterios diagnósticos de malaria complicada de la OMS deben ser adaptados a las condiciones epidemiológicas particulares, como es el caso de las regiones de endemicidad baja y transmisión inestable de malaria; esta afirmación se basa en los hallazgos de este trabajo, entre los cuales destacamos lo siguiente:
Hiperparasitemia: no es considerada en si misma por algunos investigadores como signo de gravedad, si no está acompañada de disfunción orgánica,4 pero se considera que una parasitemia baja no impide la presencia de complicación, especialmente en individuos no inmunes,16 tal como sucedió con el 52% de nuestros casos que tuvieron menos de 50.000 parásitos/µl pero presentaron complicación clínica. Según la OMS, el umbral para la definición de hiperparasitemia puede variar entre regiones: en áreas de alta endemicidad, una parasitemia mayor de 200.000 parásitos/µl (4% de glóbulos rojos parasitados –grp–) es criterio de malaria complicada y en zonas de baja endemicidad, entre las que la OMS incluye a Colombia, el punto de corte es un recuento de 100.000 parásitos/ml (aproximadamente 2% de grp).19. Sin embargo, en Colombia se han informado casos complicados con parasitemias menores de 20.000 y 50.000/µl16,26 y, en general, es frecuente encontrar casos graves con parasitemias por debajo de 100.000/µl, lo que llevó a las autoridades sanitarias a fijar el punto de corte en 50.000/µl. De los 64 casos, 48% presentó más de 50.000 parásitos/µl , pero solo 15% mostró más de 100.000 parásitos/µl.
Glicemia inferior a 40 mg/ dl: encontramos cuatro casos con glicemia entre 40–70 mg/ dl, que con los criterios de la OMS no considera complicados. Estos pacientes tenían de 14 a 57 años de edad, un hombre, y tres mujeres en embarazo, éstas con anemia ( Hb ≤ 9,0 g/ dl) e hiperparasitemia (67.360 a 134.800 parásitos/µl).
Falla renal: según la OMS, se establece con un valor de creatinina mayor de 3 mg/ dl o de BUN mayor de 40 mg/dl. Según Harrison,27 los límites de anormalidad (pero no de falla renal) son >1.5 y >20 mg/ dl, respectivamente. Ninguno de los pacientes del grupo de los casos tuvo creatinina >3 mg/ dl, y cuatro tuvieron BUN >40 mg/ dl; por otra parte, otros cuatro del grupo de los casos mostraron creatinina >1.5 mg/ dl y 15 casos presentaron BUN >20 mg/ dl, de los cuales dos presentaron elevadas ambas variables. Combinando la creatinina y el BUN, estos dos últimos pacientes tenían probablemente una falla renal (no sólo pruebas con valores elevados), de acuerdo con los valores de Harrison, pero no según el criterio de la OMS. Se trata de dos hombres de 12 y 42 años con falla multisistémica e índice BUN/ creatinina de 29,5 y 31,5 respectivamente, que superan ampliamente el valor de 20 considerado diagnóstico de falla renal aguda.28
Disfunción hepática: en nuestro estudio, 28 pacientes cumplen el criterio de la OMS, 15 con BT elevada (>3,0 mg/ dl) y 17 con AST elevada (>120 UI); hay 4 pacientes con ambas pruebas elevadas, de los cuales tres tenían ictericia. El criterio de anormalidad (pero no de falla hepática) es de 1,0 mg/ dl para la BT y 40 UI para la AST,27 indica que en nuestros casos hay 47 con alteración hepática, 38 con BT >1,0 mg/ dl, 34 con AST >40 UI y 25 con ambos.
De los 25 casos con anormalidad simultánea en BT y AST, según Harrison, 13 tienen además y en forma concomitante, bilirrubina directa mayor de 0,3 mg/ dl e ictericia; de estos 13 pacientes que reúnen cuatro pruebas anormales de función hepática, apenas tres serían diagnosticados con los criterios de la OMS, que, en consecuencia, parecen demasiado exigentes, por lo cual su sensibilidad es baja. Cabe anotar, sin embargo, que el criterio de la OMS usa una única variable para diagnosticar disfunción hepática y, por ello, coloca valores muy elevados a la BT y a la AST, mientras que nadie haría una diagnóstico de disfunción hepática por tener únicamente elevada la AST, aún en 150 UI, ni en 1,5 mg/ dl la BT. El problema es, entonces, el de hacer tal diagnóstico con tres variables consideradas simultáneamente (BT, BD y AST) y con puntos de corte bajos, frente a hacerlo con una sola variable y con punto de corte muy elevado, como es el criterio OMS.
En conclusión, debe profundizarse en el estudio de los criterios diagnósticos de malaria complicada, porque los propuestos por la OMS parecen ser útiles especialmente en zonas de alta endemicidad, pero no en otras, como la nuestra; con unos criterios más ajustados a nuestras condiciones epidemiológicas podría establecerse un panorama más claro de la malaria complicada en Colombia.
REFERENCIAS
1. WORLD HEALTH ORGANIZATION. Management of severe malaria: a practical handbook. 2ª ed. Geneva : WHO, 2000. [ Links ]
2. Gilles HM. ORGANIZACIÓN MUNDIAL DE LA SALUD. Tratamiento del paludismo grave y complicado, guía práctica. Ginebra: OMS, 1993. [ Links ]
3. Carme B, Plassart H, Senga P, Nzingoula S. Cerebral malaria in african children: Socioeconomic risk factors in Brazzaville, Congo. Am J Trop Med Hyg 1994; 50:131–136. [ Links ]
4. Luxemburger C, Ricci F, Nosten F, Raimond D, Bathet S, White NJ. The epidemiology of severe malaria in an area of low transmission in Thailand . Trans Roy Soc Trop Med Hyg 1997; 91: 256–262. [ Links ]
5. Koram KA, Bennett S, Adiamah JH, Greenwood BM. Socio–economic determinants are not major risk factors for severe malaria in Gambian children. Trans Roy Soc Trop Med Hyg 1995; 89:151–154. [ Links ]
6. Beck HP, Felger I, Genton B, Alexander N, AL–YAMAN F, Anders RF, et al. Humoral and cell–mediated immunity to the Plasmodium falciparum ring–infected erythrocyte surface antigen in an adult population exposed to highly endemic malaria. Infect Imm 1995; 63: 596–600. [ Links ]
7. SchellenberG D, Menendez C, Kahigwa E, Font F, Galindo C, Acosta C, et al. African children with malaria in an area on intense Plasmodium falciparum transmission: features on admission to the hospital and risk factors for death. Am J Trop Med Hyg 1999; 61: 431–438. [ Links ]
8. TDR SPECIAL PROGRAMME FOR RESEARCH IN TROPICAL DISEASES. Impact of early and appropriate treatment of childhood malarial fevers on severe malaria in Burkina Faso . TDR News 2001; 65. [ Links ]
9. Hay SI, Guerra CA, Tatem AJ, Noor AM, Snow RW. The global distribution and population at risk of malaria: past, present, and future. The Lancet 2004; 4: 327–336. [ Links ]
10. WORLD HEALTH ORGANIZATION. Guidelines for the treatment of malaria. WHO/HTM/MAL/2006.1108. [ Links ]
11. Korenromp E. Malaria Incidence estimates at country level for the year 2004. Proposed estimates and draft report. World Health Organization, Roll Back Malaria. Geneva: WHO, 2005. [ Links ]
12. Colombia , Ministerio de la Protección Social. Informe final de malaria, semanas 1 a 52, Colombia . Informe Quincenal Epidemiológico Nacional. 2006; 11(4):49–53. [ Links ]
13. Colombia, Ministerio de la Salud. Resolución no. 00412 de 2000. Guía de atención de la malaria.Bogotá: Minsalud, 2000. [ Links ]
14. Silva FCL, Carmo RA, Bastos SMM. Estudo retrospectivo de 49 casos de malária internados no Hospital das Clínicas – UFMG, de 1981 a 1992. Rev Méd Minas Gerais 1995; 5(4):230–235. [ Links ]
15. Bardales–Tuesta F, DeLa Puente– Olórtegui C. Manejo en UCI de la malaria falciparum severa y complicada. Bol Soc Peru Med Interna 2000; 13: 30–39. [ Links ]
16. González L, Guzmán M, Carmona J, Lopera T, Blair S. Características clínico–epidemiológicas de 291 pacientes hospitalizados por malaria en Medellín (Colombia). Act Med Col 2000; 25:163–170. Disponible en: http://medicina.udea.edu.co/Investigacion/Grupos/malaria/Articulos.htm [ Links ]
17. Colombia, Ministerio de Salud. Situación de la malaria en el Pacífico nariñense durante el año 2001. Informe preliminar. Padilla JC, Piñeros JG. Informe Quincenal Epidemiológico Nacional 2001; 6:269–273. [ Links ]
18. Colombia, Ministerio de Salud. Malaria grave en un hospital de segundo nivel del Pacifico colombiano, 2001. Piñeros JG, Padilla JC, Montoya R, García I. Informe Quincenal Epidemiológico Nacional 2001; 6: 361–366. [ Links ]
19. Trampuz A, Jereb M, Muzlovic I, Prabhu RM. Clinical review: Severe malaria. Critical Care 2003; 7: 315–323. [ Links ]
20. WORLD HEALTH ORGANIZATION, THE ROYAL SOCIETY OF TROPICAL MEDICINE AND HYGIENE. Severe falciparum malaria. Trans Roy Soc Trop Med Hyg 2000; 94 (Supl 1). [ Links ]
21. Lopez Antuñano FJ, Schmunis G. Diagnóstico de malaria. Washington: OMS, 1988. Publicación científica No. 512. [ Links ]
22. Echeverri M, Tobón A, Alvarez G, Carmona–F J, Blair S. Clinical and laboratory findings of Plasmodium vivax malaria in Colombia, 2001. Rev Inst Med trop Sao Paulo 2003; 45: 29–34. Disponible en: http://medicina.udea.edu.co/Investigacion/Grupos/malaria/Articulos.htm [ Links ]
23. Banzal S, Ayoola EA, EL SAMMANI EE, Rahim SI, Subramanian P, Gadour MOE, et al. The clinical pattern and complications of severe malaria in the Gizan region of Saudi Arabia . Ann Saudi Med 1999; 19: 194–198. [ Links ]
24. Bruneel F, Hocqueloux L, Alberti C, Wolff M, Chevret S, Bedos JP, et al. The clinical spectrum of severe imported falciparum malaria in the intensive care unit. Report of 188 cases in adults. Am J Resp Crit Care Med 2003; 167: 684–689. [ Links ]
25. Imbert P, Gerardin P, Rogier C, KA AS, Jouvencel P, Brousse V, et al. Severe falciparum malaria in children: a comparative study of 1990 and 2000 WHO criteria for clinical presentation, prognosis and intensive care in Senegal . Trans Roy Soc Trop Med Hyg 2202; 96: 278–81. [ Links ]
26. Castañeda AM, Daza C. Niveles de parasitemia por Plasmodium falciparum y algunos factores relacionados. Urabá y Bajo Cauca, departamento de Antioquia, 1988–1989. Tesis de posgrado. Universidad de Antioquia. Facultad Nacional de Salud Pública, Medellín, 1989. [ Links ]
27. Kasper D, Braunwald E, Fauci A, Hauser S, Longo D, Jameson L (editores). Harrison´s 2003. Principles of Internal Medicine. 16 ed. Nueva York: Mac Graw–Hill, 2003. [ Links ]
28. Agrawal M, Swartz R. acute; renal failure. American Academy of Family Physicians, News and publications [sitio en internet]. Consultado en: septiembre 10 de 2006. http://www.aafp.org/afp/20000401/2077.html [ Links ]