Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.20 no.1 Medellín Jan./Mar. 2007
Estudio in vitro de la citotoxicidad y genotoxicidad de los productos liberados del acero inoxidable 316L con recubrimientos cerámicos bioactivos
ANDRÉS PAREJA LÓPEZ1, CLAUDIA PATRICIA GARCÍA GARCÍA2, PABLO JESÚS ABAD MEJÍA3, MARÍA ELENA MÁRQUEZ FERNÁNDEZ4
- Zootecnista MsC en Ciencias - Biotecnología
- Ing. Geóloga PhD en Ciencias Químicas - Materiales
- Ing. Civil MSc, en Física. PhD en Física Aplicada
- Bióloga. MSc en Biología - Genética
El presente trabajo se realizo en la Universidad Nacional de Colombia Sede Medellín Investigación Financiada por Colciencias y por la DIME-Universidad Nacional de Colombia Sede Medellín
Recibido: agosto 25 de 2006
Aceptado: noviembre 15 de 2006
RESUMEN
El acero inoxidable AISI 316L es el biomaterial mas utilizado para la fabricación de implantes temporales, pero presenta limitaciones para implantes permanentes debido a la liberación de iones metálicos hacia los tejidos circundantes, produciendo especies reactivas de oxígeno (ERO) y daño en ADN, factores que aumentan el riesgo de aparición de tumores locales y fallas mecánicas del implante. Una estrategia utilizada para disminuir la liberación de iones es la modificación superficial de los implantes metálicos por medio de recubrimientos inorgánicos, cerámicos o vítreos, aplicados por el método sol-gel, el cual presenta una serie de ventajas comparativas con otras técnicas de deposición, como buena adherencia, aplicación sencilla, mínimos problemas de secado, bajas temperaturas de densificación y posibilidad de agregar partículas y/o grupos orgánicos que mejoran la adherencia celular al implante aumentando su biocompatibilidad. En el presente trabajo se evaluaron los efectos citotóxico por medio de la técnica MTT, y genotóxico por electroforesis en gel de células individuales (Ensayo Cometa), sobre células de la línea celular CHO, de los productos liberados en medio MEM por el acero inoxidable 316L sin recubrir, recubierto con una monocapa de vidrio de sílice (MC), o con doble capa que contiene partículas bioactivas de hidroxiapatita (HA), vidrio (V) o vitrocerámico (VC), después de un periodo de 30 días. Los resultados muestran que a los 30 días de envejecimiento en medio MEM no se encuentra ningún efecto citotóxico, pero se encontró efecto genotóxico en las probetas de A y MC que no representa un peligro inminente a sistemas celulares.
PALABRAS CLAVE
ACERO 316L; CITOTOXICIDAD
ENSAYO COMETA
GENOTOXICIDAD
RECUBRIMIENTOS VITREOS
SOL-GEL
SUMMARY
Cytotoxic and genotoxic study of in vitro released productos of stainless steel 316L with bioactive ceramic coatings
The stainless steel AISI 316L is the must used biomaterial for the making of temporal prosthesis, but it presents severe limitations for permanent implants due to the generation and migration of metallic ions to the surrounding peripheral tissues, which produces oxygen reactive species (ERO) and damages of the ADN, increasing the possibility of local tumors and mechanical failure of the implant.
A strategy used to minimize the generation of ions is the superficial modification of the implants by means of inorganic coatings, ceramic or vitreous, applied by the sol-gel process; this method has a series of comparative advantages, compared to other deposition methods, as good adherence, easy application, minimum drying problems, low densification temperatures and the possibility of adding particles and/or organic groups that improve the adhesion of the cell to the implant, increasing the biocompatibility. In the present work, the citotoxic effects were valuated by means of the MTT technique, and the genotoxic ones by electrophoresis of individual cell gels (Cometa test), on CHO cells, of the released products in a MEM media, after a period of 30 days, of the stainless steel 316L with no coat, coated with a coat of silica glass (MC), or with two coats of the same glass, containing bioactive particles of hydroxyapatite (HA), glass (V) or glassceramic powder (VC). The results show that there is not citotoxic effects in a test with an aging of 30 days in MEM media; a genotoxic effect was found in the A and MC samples, but without real risk for cell systems.
KEY WORDS
COMET ASSAY
CYTOTOXICITY
GENOTOXICITY
GLASS COATING
SOL-GEL
STAINLESS STEEL 316L
INTRODUCCIÓN
El acero inoxidable AISI 316L es ampliamente utilizado para la fabricación de implantes ortopédicos temporales, pero no tanto en implantes permanentes debido a su relativamente baja resistencia a la corrosión en medios fisiológicos y a su tendencia a liberar iones metálicos a los tejidos que lo rodean.
Cuando los dispositivos elaborados con este tipo de acero son implantados en el cuerpo humano entran en contacto con los fluidos corporales, los cuales son ricos en agua con oxígeno disuelto, proteínas y una variedad de iones que crean un ambiente agresivo a los metales usados para la implantación, iniciando el proceso de corrosión.
En este proceso se liberan iones de Fe, Cr y Ni en diferentes estados de oxidación, los cuales involucran una gran variedad de efectos adversos, dentro de los cuales podemos resaltar a escala macroscópica, la inflamación de los tejidos vecinos y el rechazo de los dispositivos implantados1,2 y a escala microscópica, la producción de especies reactivas de oxigeno (ERO),3 daño en ADN (incremento de quiebres en la cadena, depurinaciones, ligamientos cruzados y modificaciones en las bases)4,5 deterioro del sistema de reparación del ADN6 y alteraciones en la señalización celular,7 alteraciones fuertemente asociados a la etiología del cáncer.8,9
Con el propósito de mejorar la resistencia a la corrosión y mejorar la biocompatibilidad de los implantes fabricados con este tipo de acero, la estrategia mas comúnmente utilizada para disminuir la liberación de iones es a través de métodos de modificación superficial, entre los que se cuentan la implantación iónica de metales nobles o nitruración, la pasivación de la superficie a través de la oxidación por técnicas como la fusión de la superficie con láser, pulido electroquímico, oxidación térmica o por pasivación con ácido nítrico. Últimamente se han desarrollado recubrimientos inorgánicos cerámicos o vítreos por el método solgel, que presenta una serie de características ventajosas comparadas con otras técnicas de deposición: buena adherencia, aplicación sencilla, mínimos problemas de secado, bajas temperaturas de densificación, y posibilidad de darle diversas funciones a la película mediante el agregado de partículas y/o presencia de grupos orgánicos.13-15
A través de varias organizaciones a nivel mundial se han recomendado una serie de pruebas biológicas para garantizar la biocomapatibilidad de los biomateriales metálicos y satisfacer los estándares de calidad de la mayoría de países.
Dentro de las pruebas recomendadas para la evaluación de la biocompatibilidad se destacan las pruebas de citotoxicidad y genotoxicidad, las que permiten comprender de una manera mas clara los potenciales efectos nocivos que pueda tener un biomaterial.
El potencial efecto citotóxico y genotóxico de un biomaterial es generalmente medido sobre los extractos en diferentes soluciones fisiológicas artificiales, como saliva artificial, soluciones salinas balanceadas de Hank’s, PBS o medios de cultivo (como Eagle´s MEM, alfa MEM o RPMI 1640) que son enriquecidos con aminoácidos, azúcares y vitaminas.16,17
Por esta razón en este trabajo se cuantificó el efecto citotóxico por medio de la técnica MTT, y el genotóxico por electroforesis en gel de células individuales (Ensayo Cometa) de los productos del acero inoxidable 316L sin recubrir, y acero 316L con una monocapa de recubrimientos vítreos (MC) y doble capa más partículas bioactivas de Hidroxiapatita (HA), Vidrio (V) o Vitrocerámico (VC) liberados en medio Eagle´s MEM en un periodo de 30 días.
MATERIALES Y MÉTODOS
Recubrimientos vítreos con partículas bioactivas
Se realizaron recubrimientos por sol-gel de sílice con partículas bioactivas de vidrio, vitrocercerámico e hidroxiapatita, sobre láminas de acero inoxidable 316L de 3 x 4 x 0.5 cm pulidas a espejo. El sol se preparó usando como precursores tetraetilortosilicato (TEOS) y metiltrietoxixilano (MTES), en proporción molar 40/60, como lo describe García en trabajos previos14,15
Las partículas bioactivas se suspendieron en el sol usando hidróxido de tetrapropil amonio como dispersante en el caso del vidrio, y el vitrocerámico y éster de fosfato para el caso de la hidroxiapatita. Se realizaron dos tipos de recubrimientos: un recubrimiento monocapa que se obtiene por la técnica de inmersión de la probeta en el sol de sílice a 4 cm/min, seguido de un tratamiento térmico a 450 °C durante 30 minutos. La segunda capa con partículas bioactivas HA, V o VC fue aplicada de la misma manera sobre las probetas que ya tenían una monocapa de vidrio y tratadas térmicamente a 450 °C por 30 minutos
Prueba de inmersión estática
Todas las probetas de acero 316L desnudo (A), acero 316L recubierto con monocapa de vidrio (MC), acero 316L con doble capa con partículas bioactivas de hidroxiapatita (HA), vidrio (V) o vitrocerámico (VC) fueron esterilizadas en autoclave a 121 °C por 20 min y colocadas en frascos de polipropileno esterilizados de la misma forma. A cada frasco con su correspondiente probeta se le adicionaron 30 ml de medio Eagle-MEM (Sigma) pH=7,3, suplementado con 2 g/l de NaCO3; luego se llevaron a una incubadora con un ambiente a 37 °C y 5% de CO2 por un periodo de 30 días. Una vez finalizado el periodo de envejecimiento se sacaron las probetas de una manera aséptica en cámara de flujo laminar y los extractos se refrigeraron a 4° C hasta el momento de la evaluación de la citotoxicidad y genotoxicidad.
Cultivo celular
Las células CHO derivadas de ovario de hámster chino fueron cultivadas en medio RPMI 1640 (Sigma) con 10% de suero bovino fetal (SBF), 2% de penicilina-estreptomicina (P-S). Los cultivos se mantuvieron en atmósfera humidificada, a 37° C y 5% de CO2; las células confluentes se desprendieron con tripsina al 0,25% y EDTA al 0,05% por cinco minutos. Las células fueron subcultivadas cada tres días a una concentración de 3x104 células/ml.
Prueba de MTT
MTT [3-(4,5-dimetildiazol-2-il)-2,5 difenil tetrazolio Bromuro] (Sigma) es un colorante amarillo soluble en agua derivado de sales de tetrazolio, el cual es reducido por las células vivas a un producto de formazan azul insoluble en soluciones acuosas. La cantidad de formazan generado es directamente proporcional al número de células viables.18 Las células en fase de crecimiento exponencial son expuestas a las sustancias que se desean evaluar y se dejan crecer por dos o tres ciclos con el propósito de distinguir entre las células que permanecen viables y con capacidad de proliferar y aquellas que permanecen viables y son incapaces de proliferar.
La suspensión celular a una concentración de 1x104 células fueron sembradas en cajas de cultivo de 24 pozos, en los extractos de las probetas de acero inoxidable 316L (A), acero 316L recubierto con una capa vítrea (MC), acero 316L con doble capa con partículas bioactivas de HA, V Y VC. El control negativo (C-) se realizó con medio MEM envejecido durante 30 días sin ninguna probeta y el control positivo (C+) adicionando al cultivo 50 µl de etanol grado reactivo. Una vez sembradas las células, se suplementó con 10% de SBF, 0,29 g/l de glutamina y 2% de P-S y se dejaron incubar por un periodo de 48 horas; luego se le adicionaron 100µl de MTT (5 mg/ml en PBS) al cultivo. Las células fueron incubadas en la oscuridad a 37 °C y 5% cuatro horas, posteriormente se removió el medio de cultivo y se adicionaron 2 ml de dimetil sulfóxido (DMSO) a cada pozo para disolver los cristales morados de formazan. La absorbancia fue medida en un espectrofotómetro a una longitud de onda de 540 nm.
Ensayo cometa
La electroforesis en gel de células individuales (Ensayo Cometa) es un método rápido y altamente sensible para determinar la genotoxicidad de un compuesto a través de la detección de quiebres en la cadena de ADN de células individuales.19-23 Esto la convierte en una herramienta de gran utilidad para la investigación de la biocompatibilidad de materiales con aplicaciones biomédicas e industriales.
Las células se obtuvieron de un cultivo en estado logarítmico de crecimiento y se llevaron a una concentración de 1x106 células/ml en 200 μl de los extractos de las probetas de A, HA, V, VC; como control negativo (C-) se utilizaron 1x106 células/ml en medio envejecido sin ninguna probeta, y como control positivo (C+) medio MEM con H2O2 a una concentración final de 50 μM. Cada una de las suspensiones celulares se incubó a 4 °C por 30 minutos.
Una vez finalizado este periodo se mezclaron 10 μl de la suspensión celular con 90 μl de agarosa de bajo punto de fusión (0,5% LMA en PBS libre de Ca++, Mg++), en portaobjetos pre-tratados con 100 µl de agarosa de punto de fusión normal (0.5% NMA en PBS libre de Ca++, Mg++). Los portaobjetos fueron incubados a 4 ºC durante cinco minutos, y una vez solidificada la agarosa fueron colocados en solución de lisis (2,5M NaCl, 0.1 M EDTA, 10 mM Tris-HCl 10% DMSO 1% de Triton X 100 pH=10) por 15 horas a 4 ºC. Posteriormente fueron lavados con PBS frío e incubadas en cuarto oscuro a 4 ºC por 30 minutos, en una cámara de electroforesis con buffer de corrido (0,3 M NaOH, 200 mM, EDTA 1mM, pH=13). El corrido electroforético se realizó a 25 V y 300 mA durante 30 minutos, luego se cubrieron los portaobjetos con buffer neutralizante (0,4 M de Tris HCl pH=7,5) a temperatura ambiente por 15 minutos y deshidratadas con metanol puro; todos los pasos fueron realizados en la oscuridad para prevenir daño adicional al ADN. Por último, los portaobjetos secos se colorearon con bromuro de etidio (2 μg/ml) y se observaron en un microscopio Axiolab-Zeiss provisto por un sistema de fluorescencia, con objetivo 20X, se tomaron 25 fotografías con una cámara CCD SONY (DSC-S85 de 4.1 mega píxeles) las cuales fueron analizadas en el software Comet Score proporcionado gratuitamente en Internet por la empresa TriTek-Corp.24
Las variables evaluadas para determinar el efecto en el ADN fueron el momento de la cola Olive (MCO= producto de la distancia (en dirección X) entre el centro de gravedad de la cabeza y el centro de gravedad (en dirección X) de la cola dividido por el porcentaje de ADN en la cola) y el porcentaje de ADN en la cabeza (% ADN Cabeza).

El análisis de los datos se realizó utilizando un modelo completo al azar con tres repeticiones. Los análisis de varianza y la respectiva comparación de medias se hicieron con ayuda del software SAS.
RESULTADOS
Prueba de MTT
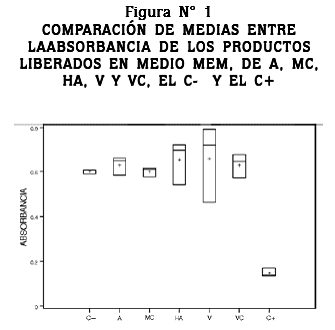
En la figura Nº 1 podemos observar la comparación de medias para la absorbancia de los diferentes tratamientos, donde se puede ver que no se encontró diferencia estadística significativa entre los tratamientos y el C-, pero si se observó una diferencia estadísticamente significativa entre los tratamientos y el C+ (p < 0,05), lo cual indica que los productos liberados en medio MEM, tanto del acero inoxidable 316L desnudo como de las probetas recubiertas con MC, HA, V y VC en un periodo de 30 días, no producen efectos citotóxicos o cito-estáticos sobre células CHO en un periodo de exposición de 48 horas.
Ensayo cometa
El control negativo y todos los tratamientos evaluados por las diferentes variables, tuvieron diferencia significativa con el control positivo (p < 0,05).
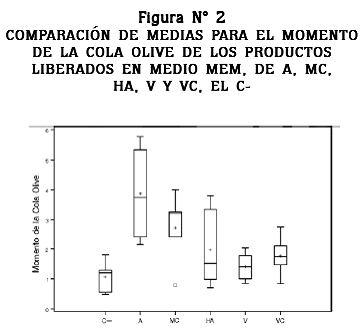
Para el momento de la cola Olive se encontró diferencia significativa entre los tratamientos de A, MC y el control negativo (p < 0,05), pero no se encontró diferencia estadística significativa entre los tratamientos de HA, V, VC y el control negativo, como se puede observar en la figura N° 2.
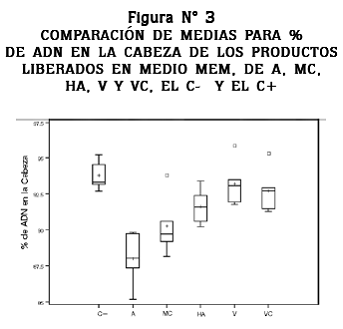
El porcentaje de ADN en la cabeza se ha utilizado por diferentes autores para evaluar el efecto protector de diferentes sustancias sobre el ADN;25 en este trabajo se encontró diferencia significativa entre el A, MC, HA y el control negativo (p < 0,05), pero no se encontró diferencia significativa entre los tratamientos de V, VC y el control negativo; de otro lado, se observa que hay diferencia significativa entre el A y todos los tratamientos, además, se observa la tendencia de las medias a aumentar el porcentaje de ADN en la cabeza, en la medida que aumenta el número de capas vítreas que recubren las placas de acero inoxidable; esto evidencia que los recubrimientos vítreos tienen un efecto positivo en la protección de las células contra los productos liberados por el acero inoxidable 316L, efecto que se puede observar en la figura N° 3.
DISCUSIÓN
El acero inoxidable AISI 316L es el material mas utilizado para la fabricación de dispositivos médicos por sus propiedades mecánicas como una óptima dureza y maleabilidad, lo cual permite moldear fácilmente este material por la técnicas mas comunes, además de que tiene un costo relativamente bajo. No obstante, el acero inoxidable presenta la menor resistencia a la corrosión a largo tiempo comparado con otros biomateriales metálicos, lo que llevaría a la pérdida del implante, inflamación, dolor o aparición de tumores locales debido a la genotoxicidad producida por los iones metálicos de Fe, Cr y Ni 26 liberados. Particularmente la genotoxicidad del Ni y el Fe puede ser consecuencia de la generación de especies reactivas de oxigeno (ERO) y la inhibición de la reparación del ADN, lo cual puede ocasionar la transformación o muerte celular. De otro lado, la carcinogenicidad del Cr está limitada por su solubilidad, pero durante la reducción del Cr(VI) a Cr(III) se genera un gran número de lesiones genéticas que incluyen aductos Cr-ADN,27 ligamientos cruzados entre ADN-proteínas,28 quiebres en cadena sencilla29 y oxidación de bases.30
En el presente trabajo no se halló efecto citotóxico para ninguno de los tratamientos evaluados, pero se encontró un leve incremento en la genotoxicidad de las probetas de A y MC (figura N° 2), que se explica por la mayor liberación de iones metálicos a medios fisiológicos como lo han reportado algunos autores en trabajos previos;31-33 los cuales son capaces de inducir la producción de radicales libres como el radical hidroxilo por las reacciones tipo Fenton y Haber-Weiss, induciendo daño al ADN.34
Para aumentar la resistencia a la corrosión y mejorar la biocompatibilidad del acero 316L se ha empleado una variedad de recubrimientos, entre los que vale la pena resaltar a los recubrimientos de plata, los que además de mejorar la resistencia a la corrosión disminuyen la colonización de bacterias en dispositivos de fijación externos,35 los recubrimientos de hidroxiapatita y dobles recubrimientos hidroxiapatita-titanio36, 37 utilizados en dispositivos para la reparación de fracturas y en procesos de óseo-integración. Los recubrimientos vítreos aplicados por el método sol-gel representan una buena alternativa para la modificación superficial del acero inoxidable ya que confieren mejor resistencia a la corrosión en medios fisiológicos, se pueden aplicar partículas orgánicas que mejoran la biocompatibilidad y protegen a las células del efecto deletéreo de los iones metálicos liberados en el proceso de corrosión.33, 38 Los resultados del presente trabajo corroboran el efecto protector de los recubrimientos vítreos aplicados por el método sol-gel, ya que se encontró que las probetas de acero que tenían recubrimientos de doble capa mas partículas bioactivas tienen un efecto protector contra los productos liberados por el acero inoxidable, disminuyendo así el daño sobre el ADN (figura N° 3). La mejoría en estas características para el acero inoxidable 316L permitirá utilizar este biomaterial para la fabricación de implantes permanentes sin efectos colaterales que puedan limitar su uso.
AGRADECIMIENTOS
Los autores agradecen a Colciencias por la financiación de este trabajo a través del proyecto 1118-12-13724 y al DIME (Universidad Nacional de Colombia - Sede Medellín).
REFERENCIAS
1. Rahilly. G, Price. N, Current Products and Practice Nickel allergy and orthodontics, Journal of Orthodontics 2003; 30: 171-174. [ Links ]
2. Pugh J, Jaffe WL, Jaffe F. Corrosion failure in stainless steel implants. Surg Gynecol Obstet 1975; 141: 199-202. [ Links ]
3. Bal W, Kasprzak KS. Induction of oxidative DNA damage by carcinogenic metals. Toxicol Lett 2002; 127: 55-62. Review. [ Links ]
4. Kasprzak KS, Sunderman FW Jr, Salnikow K. R Nickel carcinogenesis. Mutat Res 2003; 533: 67-97. Review. [ Links ]
5. Faccioni F, Franceschetti P, Cerpelloni M, Fracasso ME. In vivo study on metal release from fixed orthodontic appliances and DNA damage in oral mucosa cells. Am J Orthod Dentofacial Orthop 2003; 124: 687-693; discussion 693-694. [ Links ]
6. Hartwig A, Schwerdtle T. Interactions by carcinogenic metal compounds with DNA repair processes: toxicological implications. Toxicol Lett 2002; 127: 47-54. Review. [ Links ]
7. Harris GK, Shi X. Signaling by carcinogenic metals and metal-induced reactive oxygen species. Mutat Res 2003; 533:183-200. Review. [ Links ]
8. Sunderman FW Jr. Carcinogenicity of metal alloys in orthopedic prostheses: clinical and experimental studies. Fundam Appl Toxicol 1989; 13: 205-216. Review. [ Links ]
9. Avery JK, Goldberg A, Kasprzak KS, Lucas LC, Millard HD, Natiella JR, Rhyne R, Rupp NW, Williams DF, Local tissue reaction and carcinogenesis (Section Report), in: BR Lang HF, Morris ME, Razzoog, (Eds.), Biocompatibility, Toxicity, and Hypersensitivity to Alloy Systems Used in Dentistry, University of Michigan, Ann Arbor, 1986: 262-270. [ Links ]
10. Shabalovskaya SA. Surface, corrosion and biocompatibility aspects of Nitinol as an implant material. Biomed Mater Eng 2002;12: 69-109. Review [ Links ]
11. Trepanier C, Leung TK, Tabrizian M, Yahia LH, Bienvenu JG, Tanguay JF, Piron DL, Bilodeau L. Preliminary investigation of the effects of surface treatments on biological response to shape memory NiTi stents. J Biomed Mater Res 1999; 48: 165-171. [ Links ]
12. Chun-Che Shih, Chun-Ming Shih, Yea-Yang Su, Lin Hui Julie Su, Mau-Song Chang, Shing-Jong Lin, Effect of surface oxide properties on corrosion resistance of 316L stainless steel for biomedical applications. Corrosion Science 2004; 46: 427-441. [ Links ]
13. Galliano PG. Recubrimientos por sol-gel para uso clínico. Cuad de Cerám y vit 1999; 8: 32-35. [ Links ]
14. C. García S, Ceré A. Durán. Bioactive coatings prepared by sol-gel on stainless steel 316L. Journal of Non-Crystalline Solids 2004; 348: 218-224. [ Links ]
15. García C. Stability of Suspensions of Bioactive Particles Using Hybrid Organic_inorganic Solutions as Dispersing Media. Journal of Sol-Gel Science and Technology 2005; 34: 1-7. [ Links ]
16. ISO 10993-3 (1992) and ISO/DIS 10993-3 (2000). Biological evaluation of medical devices-Part 3: tests for genotoxicity, carcinogenicity and reproductive toxicity, Geneva, Switzerland. [ Links ]
17. ISO 10993-12 (1996) and ISO/DIS 10993-12 (2001). Biological evaluation of medical devices-Part 12: sample preparation and reference materials, Geneva, Switzerland. [ Links ]
18. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983; 65: 55-63. [ Links ]
19. Singh NP, Mc Coy MT, Tice RR, & Schneider EL. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research 1988; 184-191. [ Links ]
20. McKelvey-Martin VJ, Green MHL, Schmezer P, Pool-Zobel BL, De Me'o M. P; Collins A. The single cell gel electrophoresis assay (comet assay): a European review. Mutat Res 1993; 88: 47-63. [ Links ]
21. Fairbairn DM, Olive PL, O'Neill KL. The comet assay: a comprehensive review. Mutat Res 1995; 339: 37-59. [ Links ]
22. Collins AR, Ai-guo M, Duthie SJ. The kinetics of repair of oxidative DNA damage in human cells. Mutat Res 1995; 336: 69-77. [ Links ]
23. Chauvel-Lebret DJ, Auroy P, Tricot-Doleux S, Bonnaure-Mallet M. Evaluation of the capacity of the SCGE assay to assess the genotoxicity of biomaterials. Biomaterials 2001; 22: 1795-1801. [ Links ]
24. www.autocomet.com 3 de Mayo de 2005.
25. Hughes CM, Lewis SE, McKelvey-Martin VJ, Thompson W. The effects of antioxidant supplementation during Percoll preparation on human sperm DNA integrity. Hum Reprod 1998 May;13:1240-1247. Erratum in: Hum Reprod 1998; 13: 3284. [ Links ]
26. Gurappa I. Characterization of different materials for corrosion resistance under simulated body fluid conditions, Materials Characterization. 2002; 49: 73-79. [ Links ]
27. Arakawa H, Ahmad R, Naoui M, Tajmir-Riahi HA. A comparative study of calf thymus DNA binding to Cr(III) and Cr(VI) ions. Evidence for the guanine N-7-chromium-phosphate chelate formation, J Biol Chem 2000; 275: 10150-10153. [ Links ]
28. Fornace AJ, Jr, Seres. DS, Lechner JF, Harris CC, DNAprotein cross-linking by chromium salts, Chem Biol Interact 1981; 36: 345-354. [ Links ]
29. Tsapakos MJ, Hampton TH, Sinclair PR, Sinclair JF, Bement WJ, Wetterhahn KE. The carcinogen chromatecauses DNA damage and inhibits drugmediated induction of porphyrin accumulation and glucuronidation in chick embryo hepatocytes. Carcinogenesis 1983; 4: 959-966. [ Links ]
30. Bose RN, Moghaddas S, Mazzer PA, Dudones LP, Joudah L, Stroup D, Oxidative damage of DNA by chromium(V) complexes: relative importance of base versus sugar oxidation. Nucl Acids Res 1999; 27: 2219-2226. [ Links ]
31. Durán. A, Conde A, Gómez Coedo A, Dorado T. García C and Ceré S. Sol-gel coatings for protection and bioactivation of metals used in orthopaedic devices. Journal of Materials Chemistry 2004; 14: 2282- 2290. [ Links ]
32. Assad M, Lemieux N, Rivard CH, Yahia LH. Comparative in vitro biocompatibility of nickeltitanium, pure nickel, pure titanium, and stainless steel: genotoxicity and atomic absorption evaluation. Biomed Mater Eng 1999; 9:1-12. [ Links ]
33. Peláez A, Pareja A, García CP, Márquez ME, Toro A, Castañeda R, Abad P. Genotoxicity Effects of Ceramic Coatings Applied on Metallic Substrates using Single Cell Gel Electrophoresis Assay In Vitro. Key Engineering Materials 2005; 284-286: 593-596. [ Links ]
34. Okazaki Y, Gotoh E, Manabe T, Kobayashi K. Comparison of metal concentrations in rat tibia tissues with various metallic implants. Biomaterials 2004; 25: 5913-5920. [ Links ]