Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.20 no.1 Medellín Jan./Mar. 2007
Epidemiología y factores de riesgo de carcinoma hepatocelular
ALEJANDRA BOTERO TORO1, MARCELA LONDOÑO SANIN2*, MARIA-CRISTINA NAVAS NAVAS3
- Estudiante, XIII semestre de Medicina, Facultad de Medicina, Universidad de Antioquia, estudiante, Grupo de Gastrohepatología, UdeA.
- Estudiante, XII semestre de Medicina, Facultad de Medicina, Universidad de Antioquia, estudiante, Grupo de Gastrohepatología, UdeA.
- Profesora Asociada, Departamento de Microbiología y Parasitología, Grupo de Gastrohepatología, Facultad de Medicina, Universidad de Antioquia
* Autor para correspondencia: ls_marcela@yahoo.es
Recibido: agosto 25 de 2006
Aceptado: octubre 29 de 2006
RESUMEN
El cáncer primario de hígado es en el mundo la quinta neoplasia más común en hombres y la octava en mujeres, con gran impacto debido a su alta mortalidad, ya que representa la tercera causa de mortalidad relacionada con cáncer en población masculina. Se ha descrito una fuerte asociación con factores de riesgo como las hepatitis virales crónicas, las hepatopatías de origen genético, el consumo de alcohol, el tabaquismo y enfermedades metabólicas, entre otras. En este artículo se analizan publicaciones originales y de revisión en las que se evalúan dichos factores y su asociación con el carcinoma hepatocelular (CHC). Además, se recopila información actualizada sobre datos epidemiológicos por regiones del mundo.
PALABRAS CLAVE
AFLATOXINAS
ALCOHOL
CARCINOMA HEPATOCELULAR
DIABETES MELLITUS
EPIDEMIOLOGÍA
ESTEATOHEPATITIS NO ALCOHÓLICA (NASH)
FACTORES DE RIESGO
FACTORES HORMONALES
HEPATOPATÍAS GENÉTICAS
INCIDENCIA
OBESIDAD
PREVALENCIA
TABACO
VIRUS DE LA HEPATITIS B
VIRUS DE LA HEPATITIS C
SUMMARY
Epidemiology and risk factors of hepatocellular carcinoma
Primary liver cancer is the 5th neoplasia more common among men and 8th among women worldwide. It has a great impact because of its high mortality; Liver cancer ranks third amongst the causes of cancer-related deaths in men. It has been associated with some risk factors as chronic viral hepatitis, genetic liver disease, intake of alcohol, use of tobacco, metabolic disease and others. This document corresponds to a review of original papers of evaluation of those factors and its association with liver cancer and also reviewed articles. Additionally, updated epidemiological information of liver cancer worldwide is included.
KEY WORDS
AFLATOXINS
ALCOHOL
DIABETES MELLITUS
EPIDEMIOLOGY
GENETIC LIVER DISEASE
HEPATITIS B VIRUS
HEPATITIS C VIRUS
HEPATOCELLULAR CARCINOMA
HORMONAL FACTORS
INCIDENCE
NON ALCOHOLIC STEATO HEPATITIS (NASH)
OBESITY
PREVALENCE
RISK FACTORS
TOBACCO
EPIDEMIOLOGÍA
Cáncer primario de hígado
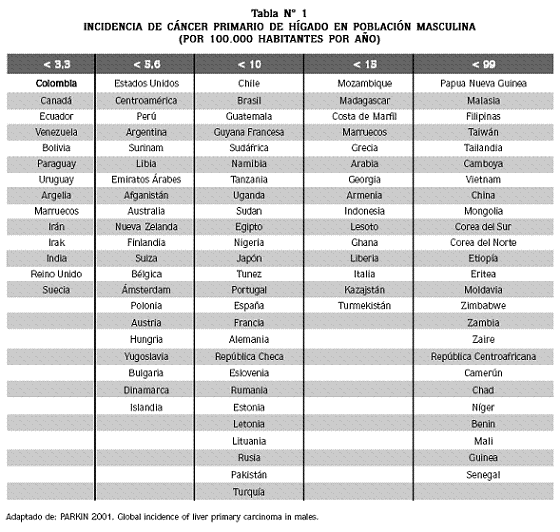
El cáncer primario de hígado es el quinto cáncer más común en el mundo; se estima que en el año 2002 ocurrieron 780.000 casos y un número similar de muertes.1 Es una neoplasia muy frecuente en el sureste de Asia y en África subsahariana; en China se reportan aproximadamente el 50% del total de los casos en el mundo (Ver Tabla N° 1). Allí se ha descrito una alta incidencia, incluso en descendientes de población china que habitan fuera de ese país, lo que sugiere que esa población presenta susceptibilidad genética. En los caucásicos es raro antes de los 40 años de edad y en los africanos e indonesios se presenta generalmente antes de la cuarta década de vida.2,3
Este cáncer es más frecuente en población masculina que femenina; en países desarrollados la tasa de incidencia es de 17,4 en población masculina y 8,7 en población femenina; con una tasa de mortalidad de 16,8 y 8,1 respectivamente; en Japón es la tercera causa de muerte en hombres y la quinta en mujeres.5,6
En Estados Unidos representa entre 0,5 y 2,0 % de los ingresos hospitalarios por cáncer en niños, en quienes se calcula una tasa de incidencia de 0,04 a 0,16 / 100.000 habitantes.4
En Colombia se reportan aproximadamente 1.300 defunciones al año por tumores malignos de hígado y vías biliares intrahepáticas, lo que corresponde a una tasa de mortalidad de 3,18/100.000 en población general, 3,23 y 3,09/100.000 en población masculina y femenina respectivamente, relacionadas con esta neoplasia. Las tasas de mortalidad más altas debidas a este tumor corresponden a los departamentos de Guainía, Quindío, Antioquia, Caldas, Risaralda, Meta, Valle del Cauca y Tolima.7
Se conocen cuatro clases de cáncer primario de hígado: hepatocarcinoma, colangiocarcinoma, angiosarcoma y hepatoblastoma.8 El 98% de los casos de cáncer primario de hígado son de origen epitelial; de éstos, 85% corresponden a carcinoma hepatocelular (CHC), con más de 450.000 casos anuales a nivel mundial.9 Su incidencia y prevalencia varían según área geográfica, género, edad y factores de riesgo.
CARCINOMA HEPATOCELULAR
Más del 80% de los casos de CHC del mundo corresponden a población asiática y africana, y los países con las tasas de incidencia mas altas (20-500) son Japón, China, Corea, Taiwán, Mozambique y Nigeria2,3; entre las naciones con tasas de incidencia intermedia (10-19) se cuentan los países del mediterráneo y Brasil, y con tasas de incidencia bajas, el norte de Europa, Australia, Nueva Zelanda, y la mayor parte de América.10 En Colombia la tasa de incidencia es de 2,2 / 100.000 en hombres y 2,0 en mujeres/100.000.11
Como sucede con el cáncer primario de hígado, la incidencia de CHC es dos a tres veces mayor en hombres que en mujeres, pero en las zonas de alta incidencia puede ser hasta ocho veces mayor en población masculina. Esta regla no parece cumplirse en los países de baja incidencia2 según se deduce de algunos estudios realizados en Suramérica (Colombia, Ecuador y Perú), en los que se registró una relación hombre-mujer cercana a 1:1.13
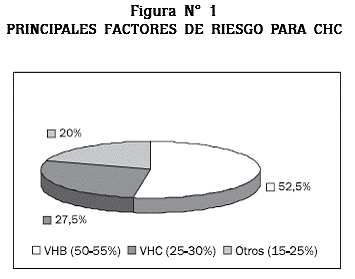
Según un estudio realizado por la Organización Mundial de la Salud (OMS), las prevalencias de la infección por el virus de la hepatitis B (VHB) y de la infección por el virus de la hepatitis C (VHC) en pacientes con CHC tienen una distribución diferente de acuerdo con las regiones del mundo. Es así como el CHC asociado al VHB tiene mayor prevalencia en África, gran parte de América y China, mientras que el CHC asociado al VHC tiene mayor prevalencia en Japón, Estados Unidos, México y gran parte de Europa. Este estudio también mostró de manera global que en 78% de los pacientes con CHC la causa fue atribuible a VHB (53%) y a VHC (25%).14 La distribución etaria de los casos está relacionada principalmente con la edad de adquisición de la infección por VHB o VHC. Según lo descrito en la literatura el riesgo de desarrollar CHC aumenta 2-3 veces por cada década de vida. En países de baja incidencia el mayor número de casos se reportan entre la quinta y la sexta década de vida, mientras que en regiones con alta incidencia los casos se presentan entre la tercera y la cuarta.10 Esta diferencia es debida a que la principal ruta de transmisión de la infección por el VHB es vertical en las regiones de alta incidencia, lo que incrementa el riesgo de desarrollar infección crónica y CHC en edades mas tempranas;15 a su vez, el VHC se adquiere principalmente en la edad adulta a través de trasfusiones e inyecciones, y no es frecuente el contagio a edades tempranas, lo que podría explicar que en regiones donde la infección por este virus es más frecuente, el cáncer se desarrolle más tardíamente.16
El CHC puede ser asintomático por varios años, o presentarse con síntomas confusos que podrían atribuirse a las patologías de base que usualmente lo acompañan, lo que hace que su detección se haga generalmente en estadios avanzados. Desde el momento en que la enfermedad se manifiesta clínicamente, la progresión es rápida; es así como la mayoría de los pacientes sin tratamiento fallecen tres a seis meses después del diagnóstico; cuando es detectado en etapas iniciales la supervivencia puede ser de uno a dos años luego de la resección quirúrgica del tumor, en los casos en los que sea posible realizar este procedimiento.17 El trasplante hepático ofrece supervivencia de 70-75% a cinco años en pacientes con estadificación temprana del tumor, según la clasificación de Milán.18 La quimioterapia no es una técnica de elección en esta neoplasia considerando la pobre respuesta observada.9 El pronóstico reservado y la ausencia de terapias efectivas para el cáncer hepático exigen el desarrollo de programas de prevención en la comunidad.1
Factores de riesgo de CHC
La cirrosis hepática constituye el principal factor de riesgo de CHC; del 60 al 90% de los pacientes con CHC presentan antecedente de cirrosis. Esta hepatopatía corresponde a un estado preneoplásico, independiente de su etiología. En la literatura se reporta que los pacientes con cirrosis tienen 1,93 veces más riesgo de desarrollar cáncer hepático, que los pacientes con hepatitis crónica en ausencia de cirrosis.19 El 20% de los pacientes cirróticos desarrollan cáncer hepático en los 5 años siguientes al diagnóstico.10
La cirrosis es el desenlace final de la gran mayoría de las hepatopatías, por lo que la etiología de estas hepatopatías, como consumo de alcohol, tabaquismo y trastornos asociados a la resistencia periférica a la insulina, se describen como factores de riesgo de CHC.
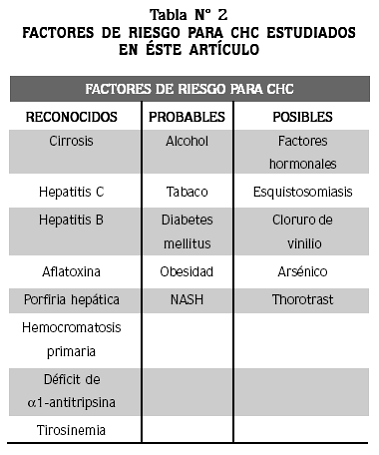
Sin embargo, en algunas patologías asociadas al desarrollo de cirrosis hepática, como las infecciones por el VHB o el VHC y la hemocromatosis, intervienen adicionalmente otros mecanismos oncogénicos directos o indirectos (Ver Tabla N° 2 y Figura N° 1).
Entre los factores de riesgo para CHC se describen:
• Hepatitis Viral Crónica (VHB y VHC): la distribución global del CHC es directamente proporcional a la prevalencia de la infección viral (VHB, VHC y coinfección). En los Estados Unidos la tasa de incidencia de CHC aumentó de 1,4 en el período de 1976-1980 a 2,4 entre 1991 y 1995, debido al aumento de la incidencia de la infección por el VHC.20,21
Un estudio prospectivo y controlado sobre el riesgo de CHC en hombres con infección crónica por VHB mostró que la prevalencia de cáncer era de 0,5%15. Se estima que en países de alta prevalencia el factor de riesgo en el 80% de los pacientes con CHC es la infección por VHB22. La oncogenicidad de este virus posiblemente se da por la alteración de la regulación de la expresión de ciertos genes mediada por la integración del ADN viral, aunque algunos estudios han demostrado la integración cerca de proto-oncogenes. Se sugieren anormalidades en los mecanismos de regeneración tisular causadas por destrucción masiva de hepatocitos (por apoptosis, necrosis o ambas), ya sea debido al daño ocasionado por la gran reacción inflamatoria mediada por linfocitos citotóxicos y citoquinas, o por daño celular producido directamente por el virus. Por otro lado, se ha implicado en la hepatocarcinogénesis del VHB a la proteína viral HBX debido a su actividad transactivadora y a la posible interferencia con la proteína p53 y con proteínas celulares implicadas en los mecanismos de reparación de ADN.23
La infección crónica por el VHC ha ganado importancia como factor de riesgo en los últimos años, pues en algunos países hay mayor incidencia del VHC que del VHB en pacientes con CHC; siete a nueve millones de los 170 millones de personas que están infectadas con VHC morirán de CHC24. En Europa éste virus es responsable del 63% de los casos de este cáncer.22
El mecanismo carcinogénico del VHC no se explica por la integración de su genoma al de la célula del hospedero, puesto que es un virus ARN. El daño oxidativo del ADN provocado por la inflamación crónica inherente a todo proceso inflamatorio de larga evolución favorece la aparición de mutaciones en el ADN y alteraciones en la regeneración del tejido hepático.23
El mecanismo oncogénico parece ser mediado por efectos directos e indirectos del VHC. El efecto directo es producido por tres proteínas virales de transformación celular: Core, NS3 y NS5A. La alteración del gen celular p53 representa uno de los principales blancos de estas proteínas virales.
Estudios han aportado evidencias de la capacidad de transformación celular de la proteína Core del VHC y la habilidad de regular la región promotora del gen p53 modificando la capacidad de unión de p53 al ADN. Se ha demostrado también la interacción de NS5A y la proteína p53 y su co-localización en la región perinuclear, impidiendo su actividad como factor de transcripción de genes como p21, inhibidor universal de quinasas dependientes de ciclina23.
• Exposición a Aflatoxinas: esta toxina es producida por hongos del género Aspergillus que en zonas tropicales y húmedas contaminan los cereales y granos que se encuentran mal almacenados. En África y China, donde las condiciones de almacenamiento no son óptimas, es un factor de riesgo importante para la salud pública. Es uno de los carcinogénicos mas potentes;25,26 la mutación específica en el gen p53 inducida por la aflatoxina B1 consiste en un cambio de guanina (G) por tiamina (T) en la tercera base del codón 249 del gen; cuando esta mutación está asociada a la infección por el VHB se alteran los sistemas de reparación del ADN y se fija la mutación, lo que hace al individuo mas susceptible a daños ocasionados por el VHB; esta mutación ha sido observada en 30-60% de los tumores de las personas que viven en áreas donde la toxina es un problema de salud pública.27,28
• Hepatopatías de origen genético: la Porfirio hepática, la hemocromatosis primaria, el déficit de alfa-1-antitripsina y la tirosinemia son factores que contribuyen a lesión crónica y de bajo grado de los hepatocitos y que incrementan la tasa de mitosis, lo que hace que el ADN celular sea más vulnerable a las alteraciones genéticas.8
La prevalencia de CHC en pacientes con cirrosis asociada a hemocromatosis es 3 a 4%.29 La hemocromatosis hereditaria es un desorden autosómico recesivo caracterizado por un exceso de absorción del hierro dietario y subsecuente acumulación en el parénquima hepático, páncreas, corazón, articulaciones y glándula pituitaria. La gran mayoría de casos están asociados a dos mutaciones: C282Y y H63D en el gen HFE localizado en el cromosoma 6.30 Estudios recientes han demostrado que el riesgo de desarrollar CHC en personas con hemocromatosis hereditaria es 20 veces mayor, comparado con individuos sanos; este riesgo se incrementa en presencia de cofactores como sexo masculino, edad mayor de 50 años, consumo de alcohol, tabaquismo e infecciones por el VHB y el VHC.31
La porfiria es el resultado de deficiencias en enzimas (uroporfirinógeno descarboxilasa y porfobilinógeno desaminasa) de la vía de la biosíntesis del grupo hemo; tanto la Porfirio cutánea tarda como la porfiria aguda intermitente han sido asociadas con un incremento del riesgo de CHC, de 1,7 y 1,8 respectivamente.32
La alfa-1-antitripsina es la principal inhibidora de proteinasas del suero; la mutación en los dos alelos es la causa más común de enfermedad hepática en niños. Los adultos con esta patología, especialmente pacientes de sexo masculino, tienen 7,8 y 20 veces más riesgo de desarrollar cirrosis y CHC, respectivamente, cuando se comparan con población sana.33
• Factores Hormonales: sobre este tema no hay estudios concluyentes; algunos autores postulan que los estrógenos, los progestágenos y la testosterona pueden inducir y promover tumores hepáticos en animales.34,35 Otros estudios han descrito que el riesgo aumenta en mujeres con menarca temprana y menopausia tardía;36 además, algunos reportes de casos muestran que los esteroides anabólicos pueden causar CHC.37
• Alcohol: algunos estudios han documentado la asociación de enfermedad hepática alcohólica y el desarrollo de CHC. Se ha demostrado que el riesgo de desarrollar CHC es dosis dependiente, de tal forma que el riesgo es seis veces mayor en pacientes con consumo de alcohol mayor de 1500 gramos/año,36 mientras que otros autores afirman que hay poca evidencia para los bebedores moderados (1–3 tragos/día).39 Se estima que en Estados Unidos el consumo de alcohol es responsable del 45% de los casos de CHC.22 El mecanismo por el cual el alcohol incrementa el riesgo de CHC no se conoce claramente, pero algunos autores proponen que es debido a la producción de acetaldehído y radicales libres durante su metabolismo.40 No se ha demostrado aún si el alcohol es un factor de riesgo independiente, o si el aumento del riesgo se debe exclusivamente a que induce cirrosis.
• Tabaco: se ha definido que múltiples componentes químicos del cigarrillo son hepatocarcinogénicos.41,42 Aunque no hay resultados concluyentes, se ha postulado que el tabaquismo es un factor de riesgo para CHC;43 algunos estudios reportan incluso que el consumo de más de 20 cajetillas/año aumenta 5 veces el riesgo.38
• Esquistosomiasis: parasitosis hepática endémica en África, Suramérica y Asia, pero solamente se ha relacionado con CHC en humanos al Schistosoma japonicum, endémico en China, Filipinas e Indonesia; además, se ha reportado que es un cofactor para el desarrollo de cáncer en pacientes con hepatopatías crónicas de origen viral.44
• Trastornos asociados a la resistencia periférica a la insulina: patologías de alta prevalencia como la diabetes mellitus, la obesidad y la esteatohepatitis no alcohólica (NASH, por su sigla en inglés: non alcoholic steatohepatitis) se han asociado al CHC en estudios epidemiológicos; sin embargo, no se han demostrado trastornos celulares o moleculares relacionados con estas patologías que se asocien directa o indirectamente en la oncogénesis.
En estudios que comparan personas sanas con pacientes que tenían CHC se demostró que la DM incrementa 2 a 3 veces el riesgo de desarrollar el cáncer,45,46 por otro lado, el riesgo de desarrollar CHC es cuatro veces mayor en los pacientes obesos que en los no obesos.36
El aumento de la resistencia periférica a la insulina, anomalía metabólica presente en los pacientes obesos (IMC > 30 kg/m2) y diabéticos, así como en pacientes con NASH o con NAFLD (por su sigla en inglés: non alcoholic fatty liver disease), por los niveles aumentados de factores de crecimiento similares a la insulina y por cambios oxidativos que la acompañan, podría explicar la proliferación del tumor.47,48
• Otros Factores Asociados: cloruro de vinilio,43 arsénico,49,50 medios de contraste radiográficos como el dióxido de torio (thorotrast)51 entre otros, se describen en la literatura como factores asociados al CHC; sin embargo, no se dispone de estudios concluyentes que los definan como factores de riesgo por la baja frecuencia de presentación de estos casos.
La mortalidad asociada al CHC y el alto porcentaje de casos asociados a infección crónica por VHC y/o VHB, exposición a aflatoxinas y consumo de alcohol amerita el desarrollo de programas de prevención. Estudios adicionales son necesarios para esclarecer el papel de los trastornos asociados a la resistencia periférica a la insulina como factor de riesgo del CHC.
AGRADECIMIENTOS
Las autoras del manuscrito agradecen la lectura crítica de los doctores Sergio Iván Hoyos Duque y John Jairo Zuleta Tobón, profesores de la Facultad de Medicina de la Universidad de Antioquia, y la colaboración de la Profesora Mónica Pineda en la búsqueda y corrección de bibliografía. Esta revisión hace parte del proyecto de sostenibilidad 2006 financiado por el CODI, Universidad de Antioquia.
REFERENCIAS
1. WORLD HEALTH ORGANIZATION. The world health report 2003: Shaping the future. Geneva: World health organization, 2003. Se encuentra en URL: http://www.who.int/whr/2003/en [ Links ]
2. Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol 2001; 2: 533–543. [ Links ]
3. Ferlay J, Bray J, Pisani P, Parkin DM. Globocan 2000—Cancer Incidence, Mortality and Prevalence Worldwide. Lyon: IARC Press; 2001. [ Links ]
4. Walker, Duric, Hamilton, Walker-Smith, Watkins. Pediatric gastrointestinal disease: Pathophysiology, diagnosis, management. 2ª. ed. St. Louis: Mosby; 1996. Cap. 28, Parte 7. [ Links ]
5. Stewart BW, Kleihues P, eds. World cancer report. Lyon: IARC Press, 2003. pp. 203-206. [ Links ]
6. Yu MC, Yuan JM. Environmental Factors and Risk for Hepatocellular Carcinoma. Gastroenterology 2004; 127: S72–S78. [ Links ]
7. González M. Principales causas de mortalidad por cáncer en Colombia. Inf Quinc Epidemiol Nac 2003; 8(3):41-56. [ Links ]
8. Ramzi S C, Vinay K, Tucker C. Tratado de Patología Estructural y Funcional de Robins. 6. ed. Madrid: Mc Graw Hill. Interamericana; 2000. Cap. 19. [ Links ]
9. Devita V, Hellman S, Rosemberg SA. Cancer. Principles and practice of oncology. 7 ed. Philadelphia: Lippincot, Williams & Wilkins; 2005. Cap. 29, Sección 4. [ Links ]
10. Bosch FX, Tabor E, Okuda K. Global epidemiology of hepatocelular carcinoma. Liver Cancer. Estados Unidos: Churchill Livingstone; 1997. pp. 13-28. [ Links ]
11. COLOMBIA.DANE. Dirección de Censos y Demografía. Estadísticas vitales: Registro de nacimientos y defunciones del año 2000. Bogotá: DANE; 2001. [ Links ]
12. Ferlay J, Bray F, Pisani P, Parkin DM. Globocan 2000: Cancer Incidence, Mortality and Prevalence Worldwide. Version 1.0. Lyon, France: IARC Press; 2001. [ Links ]
13. Mcglynn KA, Tsao L, Hsing AW, Devesa SS, Fraumeni JR. JF. International trends and patterns of primary liver cancer. Int J Cancer 2001; 94: 290-296. [ Links ]
14. Perz JF, Armstrong GL, Farrington LA, Hutin YJF, Bell BP. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol 2006; 118: 1403-1408. [ Links ]
15. Beasley RP. Hepatitis B virus, the major etiology of hepatocellular carcinoma. Cancer 1988; 61: 1942–1956. [ Links ]
16. Moradpour D , Cerny A, Heim MH, Blum HE. Hepatitis C: an update. Swiss Med Wkly 2001; 131: 291-298. [ Links ]
17. Bruix J, Llovet JM. Prognostic Prediction and Treatment Strategy in Hepatocellular Carcinoma. Hepatology 2002; 35: 519-524. [ Links ]
18. Mazzaferro V, Regalia E, Doci R, Andreola S, Pulvirenti A, Bozzetti F, Montalto F, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996; 334: 693-699. [ Links ]
19. Tsukuma H, Hiyama T, Tanaka S, Nakao M, Yabuuchi T, Kitamura T, et al. Risk Factors for Hepatocellular Carcinoma among Patients with Chronic Liver Disease. N Engl J Med 1993; 328: 1797-1801. [ Links ]
20. El-Serag HB, Mason AC. Rising incidence of hepatocelular carcinoma in the United States. N Engl J Med 1999; 340: 745-750. [ Links ]
21. El Serag HB, Davila JA, Petersen NJ, Mcglynn KA. The continuing increase in the incidence of hepatocelular carcinoma in the United States: an update. Ann Intern Med 2003; 139: 817-823. [ Links ]
22. Bosch FX, Ribes J, Díaz M, Clèries R. Primary liver cancer: Worldwide incidence and trends. Gastroenterology 2004; 127(suppl 1):S5–S16. [ Links ]
23. Major ME, Rehermann B, Feinstone SF. Hepatitis C Virus. 3. ed. Cap. 34. [ Links ]
24. ORGANIZACIÓN MUNDIAL DE LA SALUD. C Fact Sheet. WHO Fact Sheet (Publicación periódica en línea}. Oct 2005. Se encuentran en URL: http://www.who.int/mediacentre/factsheets/fs164/en/. (consultada 28 de febrero de 2007) [ Links ]
25. Wogan GN. Aflatoxins as risk factors for hepatocellular carcinoma in humans. Cancer Res 1992; 52: 2114s–2118s. [ Links ]
26. Qian GS, Ross RK, YU MC, Yuan JM, Gao YT, Henderson BE, Wogan GN, et al. A follow-up study of urinary markers of aflatoxin exposure and liver cancer risk in Shanghai, People’s Republic of China. Cancer Epidemiol Biomarkers Prev 1994; 3: 3-10. [ Links ]
27. Bressac B, Kew M, Wands J & Ozturk M. SELECTIVE G to T mutations of p53 gene in hepatocelular carcinoma from southern Africa. Nature 1991; 350: 429-431. [ Links ]
28. Hsu IC, Metcalf RA, Sun T et al. Mutational hotspot in the p.53 gene in human hepatocellular carcinomas. Nature 1991; 350: 427-428. [ Links ]
29. Fracanzani AL, Conte D, Fraquelli M, et al. Increased cancer risk in a cohort of 230 patients with hereditary hemochromatosis in comparison to matched control patients with non-iron-related chronic liver disease. Hepatology 2001; 33: 647-651. [ Links ]
30. Feder JN, Gnirke A, Thomas W, et al. A novel MHC class-I like gene is mutated in patients with hereditary haemochromatosis. Nat Genet 1996; 13: 399-408. [ Links ]
31. Deugnier YM, Guyader D, Crantock L, et al. Primary liver cancer in genetic hemochromatosis: a clinical, pathological and pathogenetic study of 54 cases. Gastroenterology 1993; 104: 228-234. [ Links ]
32. Linet Ms, Gridley G, Nyren O, et al. Primary liver cancer, other malignancies, and mortality risks following porphyria: a cohort study in Denmark and Sweden. Am J Epidemiol 1999; 149: 1010-1015. [ Links ]
33. Perlmutter DH. Alpha-1-antitrypsin deficiency. Semin Liver Dis 1998; 18: 217-225. [ Links ]
34. IARC. Hormonal contraception and post-menopausal hormonal therapy. IARC monographs on the evaluation of carcinogenic risks to humans. Lyon: International Agency for Research on Cancer, 1999. Vol. 72 [ Links ]
35. The Collaborative MILTS Project Team. Oral contraceptives and liver cancer: Results of the Multicentre International Liver Tumor Study (MILTS). Contraception 1997; 56: 275-284. [ Links ]
36. Marrero Ja, Fontana Rj, Fu S, Conjeevaram Hs, Su Gl, Lok AS. Alcohol, tobacco and obesity are synergistic risk factors for hepatocellular carcinoma. J Hepatol 2005; 42: 218-224. [ Links ]
37. Tavani A, Negri E, Parazzini F, Franceschi S, La Vecchia C. Female hormone utilisation and risk of hepatocellular carcinoma. Br J Cancer 1993; 67: 635-637. [ Links ]
38. El Serag Hb, Mason AC. Risk factors for the rising rates of primary liver cancer in the United States. Arch Intern Med 2000; 160: 3227-3230. [ Links ]
39. Donato F, Tagger A, Gelatti U. et al. Alcohol and hepatocellular carcinoma: the effect of lifetime intake and hepatitis virus infections in men and women. Am J Epidemiol 2002; 155: 323-331. [ Links ]
40. Seitz HK, Poschl G, Simanowski UA. Alcohol and cancer. Recent Development Alcoholism 1998; 14: 67–95. [ Links ]
41. IARC. Tobacco smoking and involuntary smoking. IARC monographs on the evaluation of carcinogenic risks to humans. Lyon: International Agency for Research on Cancer, 2004. Vol. 83. [ Links ]
42. Hsing AW, Mclaughlin JK, Hrubec Z, Blot WJ, Fraumeni JF Jr. Cigarette smoking and liver cancer among US veterans. Cancer Causes Control 1990; 1: 217-221. [ Links ]
43. Wong RH, Chen PC, Du CL, Wang JD, Cheng TJ. An increased standardized mortality ratio for liver cancer among polyvinyl chloride workers in Taiwan. Occup Environ Med 2002; 59: 405-409. [ Links ]
44. Chou YH, Chiou HJ, Tiu CM, et al. Duplex Doppler ultrasound of hepatic schistosomiasis japonica: a study of 47 patients. Am J Trop Med Hyg 2003; 68: 18-23. [ Links ]
45. Lagiou P, Kuper H, Stuver So, Tzono A, Trichopoulos D, Adami HO. Role of Diabetes Mellitus in the Etiology of Hepatocellular Carcinoma. Journal of the National Cancer Institute 2000; 92: 1096-1099. [ Links ]
46. Lavecchia C, Negri E, Decarli A, Franceschi S. Diabetes Mellitus and the risk of primary liver câncer. Int J Cancer 1997; 73: 204-207. [ Links ]
47. Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: a proposal for grading and staging the histologic lesions. Am J Gastroenterol 1999; 94: 2467-2474. [ Links ]
48. Adami HO, Chow WH, Nyrén O, Berne C, Linet MS, Ekbom A, et al. Excess risk of primary liver cancer in patients with diabetes mellitus. Journal of the National Cancer Institute 1996; 88: 1472-1477 [ Links ]
49. Tsuda T, Babazono A, Yamamoto E, Kurumatani N, Mino Y, Ogawa T, Kishi Y, et al. Ingested arsenic and internal cancer: a historical cohort study followed for 33 years. Am J Epidemiol 1995; 141: 198-209. [ Links ]
50. Lewis DR, Southwick JW, Ouellet-Hellstrom R, Rench J, Calderon RL. Drinking water arsenic in Utah: a cohort mortality study. Environ Health Perspect 1999; 107: 359-365. [ Links ]
51. Mori T, Fukutomi K, Kato Y, et al. 1998 results of the first series of follow-up studies on Japanese. Thorotrast patients and their relationships to an autopsy series. Radiat Res 1999; 152: S72-S80. [ Links ]