Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.20 no.2 Medellín Apr./June 2007
Apolipoproteína A1 para evaluar el estado nutricional en niños con y sin malaria
Evaluation of the nutritional status of children with and without malaria by means of Apolipoprotein A 1
JAIME CARMONA-FONSECA1, GONZALO ÁLVAREZ SÁNCHEZ2, SILVIA BLAIR TRUJILLO3
- Médico, salubrista, epidemiólogo. Profesor titular, Facultad de Medicina y Grupo Malaria, Universidad de Antioquia, Medellín, Colombia Correspondencia: jaimecarmonaf@hotmail.com
- Laboratorista Clínico, especialista en Estadística, epidemiólogo. Investigador asociado del Grupo Malaria, Universidad de Antioquia. Profesor, Facultad de Medicina, Universidad CES (Medellín). Colombia
- Médica, malarióloga. Profesora titular, Facultad de Medicina y Grupo Malaria.
GRUPO MALARIA, UNIVERSIDAD DE ANTIOQUIA (MEDELLÍN, COLOMBIA)
CALLE 62 Nº 52-59, LABORATORIO 610. MEDELLÍN (COLOMBIA) http://medicina.udea.edu.co/Investigacion/Grupos/malaria/index.htm
Recibido: agosto 25 de 2006
Aceptado: noviembre 15 de 2006
RESUMEN
ANTECEDENTES: la apolipoproteína A1 (apoA1) se ha propuesto como indicador del estado nutricional, pero existe controversia al respecto.
OBJETIVO: comparar la apoA1 sérica con la evaluación antropométrica como prueba diagnóstica del estado nutricional de niños (4-11 años) con malaria y sin ella.
METODOLOGÍA: diseño descriptivo, prospectivo y transversal, con uso ciego y simultáneo de las dos pruebas diagnósticas. ApoA1 sérica se midió con método nefelométrico (APOA, Laboratorio Beckman®).
RESULTADOS: fueron evaluados 262 niños. La frecuencia de algún riesgo antropométrico de desnutrición fue 72% en niños maláricos y 70% en niños sin malaria. Dos de cada tres niños presentaron menos de 0,94 g/L (límite inferior normal) de apoA1. No hubo correlación significativa entre apoA1 y cada indicador antropométrico y los coeficientes rho de Spearman fueron siempre menores de 0,1. Entre niños sin malaria, apoA1 tuvo sensibilidad de 31% y especificidad de 83%, comparada con la clasificación nutricional antropométrica. Entre niños con malaria, la sensibilidad de apoA1 subió a 83% y la especificidad cayó a 27%.
CONCLUSIONES: la apoA1 no es una herramienta útil para el diagnóstico del estado nutricional, tanto en niños con malaria como en aquellos sin esta enfermedad.
PALABRAS CLAVE
ANTROPOMETRÍA
APOLIPOPROTEÍNA A1
DESNUTRICIÓN
MALARIA
SUMMARY
BACKGROUND: apolipoprotein-A1 (apoA1) has been proposed as indicator of nutritional state, but controversy exists on the matter.
OBJECTIVE: to compare serum apoA1 with anthropometric evaluation as a diagnostic test to of nutritional state in children with or without malaria.
MATERIAL AND METHODS: descriptive, prospective and cross-sectional design, with blind and simultaneous use of diagnostic tests. Serum ApoA1 was measured with a nephelometric method (APOA, Beckman® Laboratory).
RESULTS: 262 children were evaluated. The frequency of some anthropometric risk of malnutrition was 72% in malaric children, and 70% in the non-malaric ones. Two out of every three children had less than 0,94 g/L (lowest normal limit) of apoA1. There was no significant correlation between apoA1 and each one of the anthropometric indicators, and the Spearman's coefficients were lower than 0,1 in every instance. Sensitivity and specificity of apoA1 were, respectively, 31% and 83% among non-malaric children, as compare with the anthropometrical nutritional classification; the corresponding figures among malaric children were 83% and 27%, respectively.
CONCLUSION: apoA1 is not a useful tool for diagnosis of the nutritional state, either in malaric or nonmalaric children.
KEY WORDS
ANTHROPOMETRY
APOLIPOPROTEIN-A1
MALARIA
MALNUTRITION
INTRODUCCIÓN
La fracción proteica de las lipoproteínas (LP) se llama apolipoproteína, apoproteína o apo. En las LP humanas hay por lo menos trece apoproteínas, entre ellas la apolipoproteína-A1 (apoA1), fundamentalmente asociada a las lipoproteínas de alta densidad (HDL). Las apoproteínas tienen características comunes, incluido el hecho de que las tres cuartas partes de las plasmáticas circulantes se producen en el hígado, pero la mayoría de las apoA1 y apoA4 se producen en el intestino.1-3 La apoA1 hace parte de las llamadas proteínas plasmáticas viscerales (PPV) o proteínas de transporte, que incluyen otras como la prealbúmina de unión de tiroxina (PUT) y la prealbúmina de unión de retinol (PUR), las cuales forman un complejo conocido como transtirretina (TTR): transportador de tiroxina y retinol: PUT + PUR). La TTR forma un complejo mayor con el sistema apoaA1-HDL, por medio de la apoA1, y así circulan en el plasma (HDL-apoA1-TTR).4
Comparada con la TTR, la apoA1 tiene concentración plasmática alta, con valores de 0,98 0,45 g/L en niños de 9-44 meses de edad,5 o de 1,42 ± 0,22 g/L en otros de 9-42 meses,6 o de 0,94 a 1,78 g/L para hombres adultos y 1,01 a 1,98 g/L para mujeres adultas (método nefelométrico; datos de referencia del Laboratorio Clínico de la Congregación Mariana, Medellín, Colombia).
En niños con desnutrición proteicocalórica (DPC) no complicada hay niveles de apoA1 de 0,61 ± 0,21 g/L,5 mientras que en aquellos con DPC asociada a diarrea u otras enfermedades los valores son 0,68 ± 0,22.6 En pacientes con procesos inflamatorios (infecciosos —como malaria— o de otra índole) se produce la llamada respuesta de fase aguda, que ocasiona cambios profundos en los valores de las proteínas del plasma.7-9
La apoA1 tiene un recambio rápido (vida media muy corta), que causa la modificación precoz de su concentración en caso de síntesis deficiente y baja ingestión proteica.5 Su contenido de los aminoácidos esenciales metionina y triptofano es alto,10 lo que explica por qué su concentración plasmática se altera rápidamente por las condiciones nutricionales;5 así, su concentración se afecta mucho por las enfermedades y trastornos hepáticos y por la desnutrición, como sucede con las PPV.
Se ha propuesto usar la medición de alguna o de varias PVV para objetivos como diagnosticar el estado nutricional, evaluar la respuesta al tratamiento nutricional, hacer pronóstico sobre la probabilidad de complicaciones o de muerte cuando se padecen diferentes trastornos (desnutrición, cáncer, enfermedad renal crónica, enfermedad hepática, entre otros). Hay poca duda acerca de la utilidad de estos marcadores bioquímicos para evaluar los dos últimos de los problemas antes mencionados, pero existe seria controversia en cuanto a la capacidad de cualquiera de las PPV, incluida la apoA1, como prueba diagnóstica del estado nutricional, sobre todo en países donde los procesos infecciosos son frecuentes y usualmente están asociados a la desnutrición. Varios autores han propuesto que la apoA1 plasmática es un buen indicador del estado nutricional en niños,5,6,11 pero otros han señalado las dificultades o la franca inconveniencia de usarla, al igual que cualquiera otra PPV, como prueba diagnóstica del estado nutricional, mucho menos si existen procesos infecciosos o inflamatorios asociados.12-18
Nosotros usamos la apoA1 para evaluar el estado nutricional de niños con malaria y sin ella y en este informe: a) se describe el comportamiento de la apoA1 en los niños con y sin malaria, con y sin desnutrición y con ambos o ninguno de los dos problemas; b) se evalúa la capacidad diagnóstica de la apoA1, comparada con los indicadores antropométricos clásicos, que se usaron como prueba patrón para diagnosticar el estado nutricional.
MATERIALES Y MÉTODOS
Tipo de estudio, población de referencia, muestra y unidad de análisis
Tipo de estudio: diseño descriptivo, prospectivo y transversal, con uso ciego y simultáneo de las dos pruebas diagnósticas.
Población de referencia: niños con y sin malaria, con edades entre 4 y 11 años, residentes en las zonas urbana o rural de los municipios de Turbo, El Bagre y Zaragoza (departamento de Antioquia, Colombia), de uno u otro sexo, miembros en general de grupos con deficientes condiciones de vida. Esos niños consultaron al puesto de malaria del respectivo municipio y la gota gruesa fue positiva en unos y negativa en otros.
Unidad de análisis: cada niño estudiado, tuviera o no malaria. Los pacientes se captaron según el orden de llegada a la consulta. Se evaluaron 262 niños en los siguientes sitios:
a) El Bagre y Zaragoza: en la región minera del Bajo Cauca, con índice parasitario anual (IPA) promedio de 156 por mil en 1996-2000;19,20 allí se estudiaron 122 con malaria y 54 sin ella, para un total de 176.
b) Turbo: en la zona bananera de Urabá, con IPA promedio de 39 por mil en 1995-2000;19,20 allí se evaluaron 86 niños (61 con malaria y 25 sin ella).
En todos los lugares y grupos se midió la apoA1 sérica y se calcularon los índices antropométricos de riesgo de desnutrición aguda (peso para la talla P/T), crónica (talla para la edad T/E) y global (peso para la edad P/E).
Criterios de inclusión
Se aplicaron estos criterios de inclusión para los niños con o sin malaria:
a) cualquiera de los sexos, b) edad entre 4 y 11 años, c) residir en área urbana o rural del respectivo municipio, d) el acudiente del niño debió aceptar participar voluntariamente y firmar el acta de consentimiento informado.
Para los niños sin malaria se exigió no tener infección por Plasmodium según la gota gruesa. Para los que tenían malaria se usaron, además, estos criterios: a) tener diagnóstico de malaria no complicada por P. vivax o P. falciparum o ambos; b) tener cualquier valor de parasitemia inferior a 50.000 parásitos/µL; c) ausencia de complicación malárica. El criterio de no complicación que se aplicó fue doble: parasitemia inferior a 50.000 parásitos/µL y ausencia de síntomas y signos clínicos que sugirieran o demostraran una complicación, según la OMS.21
Evaluación parasicológica
Cada uno de los pacientes se evaluó con gota gruesa y extendido de sangre periférica, hechas con las coloraciones de Field y Giemsa, respectivamente, según lo definido por la OPS.22 El recuento de parásitos se hizo en 200 leucocitos con un estándar de 8.000 leucocitos/µL. La densidad parasitaria se expresó en parásitos/µL.
Mediciones antropométricas
Se calcularon los tres índices antropométricos (T/E, P/T y P/E). La edad se tomó en años y meses cumplidos según la declaración verbal de la madre. La medición del peso se hizo con una balanza marca Healt con una sensibilidad de 100 gramos. La estatura se midió en centímetros con un tallímetro de madera con pieza móvil, con sensibilidad de un milímetro. La estatura y el peso se midieron con el niño descalzo y sin ropa exterior. Para la clasificación del estado nutricional en niños menores de 11 años se usaron los indicadores peso para la talla o estatura (P/T), talla para la edad (T/E) y peso para la edad (P/E), a partir de puntajes Z. Con estos puntajes Z se calcularon intervalos en torno a la mediana (mediana de los puntajes Z ±), los cuales se usaron para clasificar el grado de riesgo de desnutrición según Garza et al.23
Riesgo bajo de desnutrición: el puntaje Z observado está en el intervalo entre (-1) y (-2) desviaciones estándar con respecto a la mediana.
Riesgo moderado de desnutrición: el puntaje Z observado está en el intervalo entre (-2) y (-3) desviaciones estándar con respecto a la mediana.
Riesgo alto de desnutrición: el puntaje Z observado está por debajo del valor que corresponda a la mediana menos 3 desviaciones típicas (mediana - 3 D.E).
La clasificación nutricional de los niños mayores de 10 años se obtuvo con el índice de masa corporal IMC (peso/talla2 expresado en kg/m2). Los niños con IMC inferior al percentil 15 se clasificaron con riesgo de delgadez.24
Los datos se procesaron con el módulo Epinut del paquete Epiinfo 6.04, el cual utiliza las tablas del National Center for Health Statistics (NCHS) como población de referencia para comparar el estado nutricional de los individuos.
Evaluación de la apoA1
A cada niño se le extrajo sangre venosa: los sueros fueron separados, mantenidos, transportados y almacenados en nitrógeno líquido a -70 °C hasta su posterior análisis de laboratorio. La determinación de la apoproteína A1 en suero se hizo mediante un método nefelométrico con un estuche comercial (APOA, Laboratorio Beckman® Coulter, Inc. Forschung, Allgemein, DNS-Forschung Laborautomatisierung, Pharmaforschung Deutschland). De acuerdo con los valores de referencia, se consideraron bajas las concentraciones inferiores a 1,01 g/L en niñas y a 0,94 g/L en niños. Todas las mediciones se hicieron en el Laboratorio Clínico de la Congregación Mariana, en Medellín, un centro con un adecuado programa propio de control de calidad, evaluado también en ese campo por un programa internacional.
Variables estudiadas y análisis estadístico
Las variables estudiadas en cada unidad de análisis fueron; presencia de malaria (si, no), sexo, edad (meses y años), peso corporal, talla o estatura, índices peso/talla, talla/edad y peso/edad, especie causal del ataque palúdico actual, parasitemia, cantidad de apoA1 en suero.
Para comparar las medianas de los grupos se usó la prueba no paramétrica de Kruskal y Wallis. La prueba chi cuadrada se empleó para medir la asociación entre variables no métricas. Para establecer si había o no correlación entre dos variables métricas (como cantidad de apoA1 y valores Z de cada índice antropométrico) se procedió a hacer transformación logarítmica de los datos y luego se aplicó la regresión lineal simple. Siempre se tomó como significativo un valor de probabilidad menor de 5%.
Para el análisis estadístico se usaron los programas EpiInfo 6.04 y Statgraphics Plus for Windows.
RESULTADOS
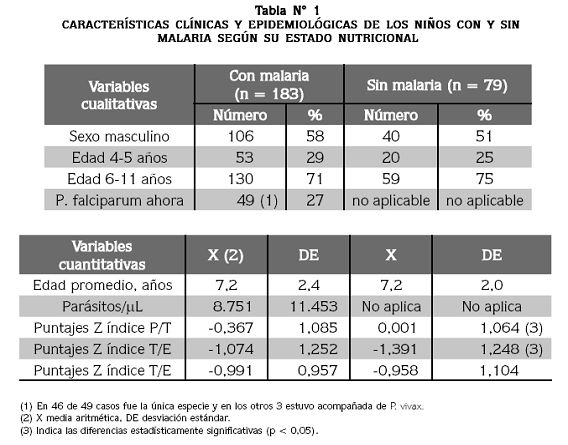
Se estudiaron 183 niños con malaria y 79 niños sin ella; las características principales de los dos grupos se presentan en la tabla Nº 1. El porcentaje de hombres fue similar en los dos conjuntos (58 y 51%) y la edad fue exactamente la misma (promedio: 7,2 años). Plasmodium falciparum causó 27% de las infecciones actuales y la parasitemia promedio fue 8.751 parásitos/µL.
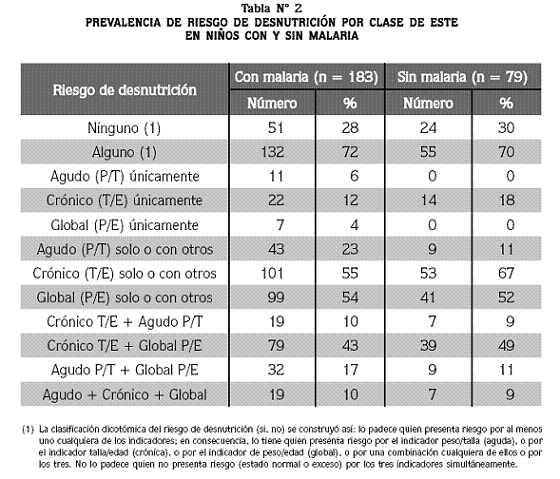
La prevalencia del riesgo de desnutrición según su clase se presenta en la tabla Nº 2. Entre los niños con malaria, la frecuencia de algún riesgo de desnutrición fue 72% y en los niños sin malaria fue 70%. El riesgo de desnutrición crónica (talla/edad) fue mayor en los niños sin malaria (67% vs. 55%), mientras que la aguda fue mayor en los afectados por la protozoosis (23% vs. 11%). En ambos grupos, los riesgos de desnutrición aguda y crónica coexistieron en 9 a 10% de los niños y la misma cifra exhibió simultáneamente los tres riesgos.
La concentración de apoA1 en la población total (maláricos más no maláricos) no tuvo distribución normal (gaussiana) entre los 262 niños estudiados (prueba de Kolmogorov-Smirnov; p = 0,0013621) y las transformaciones logarítmica, exponencial y cuadrática no lograron aproximarla a la normal.
La distribución fue simétrica (p = 0,92884) y francamente platicúrtica (p = 5,26 E-10). El valor mínimo observado fue 0,25 g/L y el máximo llegó a 1,55 g/L; el promedio fue 0,79, la mediana 0,82 y la moda 1,03 g/L; la desviación estándar fue 0,30 y el error estándar fue 0,0185 g/L; el coeficiente de variación fue 38%. En los 262 niños, 64% presentaron valores < 0,94 g/L (límite inferior normal del valor de referencia usado) y únicamente 36% presentaron valores normales, aunque cercanos al límite inferior normal. Los promedios de apoA1 según el sexo no presentaron diferencia significativa entre los niños sin malaria ni entre aquellos con la enfermedad; por esta razón, en adelante se omite la referencia a esta variable y los datos se presentan en forma conjunta para hombres y mujeres.
Los promedios de apoA1 según la presencia de malaria y el riesgo antropométrico de desnutrición se presentan en la tabla Nº 3.
El promedio de apoA1 fue 1,07 g/L en los 24 niños sin malaria y sin riesgo de desnutrición (es decir, con estado nutricional adecuado), lo cual podría considerarse como "valor de referencia provisional" para niños de 4 a 11 años. El otro extremo es el grupo de 132 niños con malaria y con algún grado de riesgo de desnutrición (aguda, crónica o de ambas clases), a la luz de los índices antropométricos); allí, el promedio de apoA1 es de 0,67 g/L. En los grupos de niños con uno u otro problema, los valores de apoA1 fueron intermedios entre los anteriores; así, en los 51 niños con malaria y con estado nutricional adecuado la media de la proteína fue 0,71 g/L y en el grupo de 55 sin malaria y con riesgo nutricional fue 1,04 g/L. La diferencia importante existió en función de la malaria: quienes la padecen tienen valores promedio de 0,64 a 0,71, independientemente del estado nutricional, mientras que entre los que están sin malaria los promedios oscilaron entre 0,96 y 1,07, independientemente del estado de nutrición.
Considerando cualquier riesgo de desnutrición o la combinación de ellos, las comparaciones entre maláricos y no maláricos mostraron, en general, diferencia significativa, mientras que dentro de cada grupo en función de la malaria (maláricos y no maláricos), las diferencias en los promedios de apoA1 fueron no significativas entre desnutridos y no desnutridos; así, por ejemplo, en los niños sin "Ningún riesgo de desnutrición" los promedios fueron 0,71 g/L para los maláricos y 1,07 g/L para los no maláricos, valores muy diferentes; por el otro lado, en los maláricos, las diferencias entre los niños sin "Ningún riesgo de desnutrición" y aquellos con "Algún riesgo de desnutrición" fueron escasas: 0,71 frente a 0,67 g/L; algo similar sucedió entre los no maláricos (1,07 frente a 1,04 g/L).
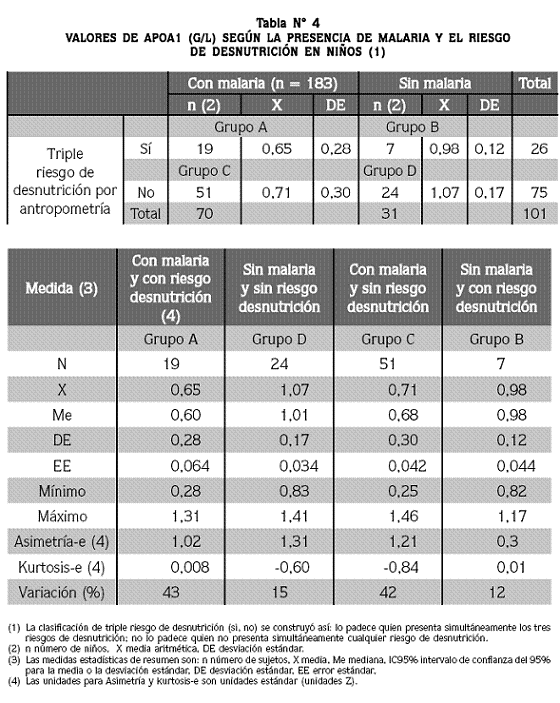
Si se comparan grupos extremos en función de las variables malaria (presente, ausente) y riesgo antropométrico de desnutrición simultáneo por los tres indicadores ("coexisten los tres riesgos en el paciente" frente a "ningún riesgo está en el paciente"), se obtuvo lo que presenta la tabla Nº 4: del total de 101 pacientes clasificados, 18,8% (grupo A) tenían malaria y triple riesgo de desnutrición, 23,7% (grupo D) carecían de ambos problemas, 6,9% (grupo B) padecían triple riesgo de desnutrición y estaban libres de malaria y 50,5% (grupo C) estaban afectados de malaria pero libres de riesgo de desnutrición. Los promedios de los cuatro grupos fueron, en su orden, 0,65; 0,107; 0,98 y 0,71 g/L y difirieron en forma significativa, pero, de nuevo, las diferencias existieron en función de la malaria y no del estado nutricional, como puede deducirse del hecho de que los promedios de apoA1 de los grupos con malaria [A) y C)] fueron casi iguales (0,65 y 0,71 g/L, en ese orden) y lo mismo sucedió entre los promedios de los grupos sin malaria [B) y D)] (0,98 y 1,07 g/L). La diferencia significativa surge entre los grupos A) y D) [con malaria y triple riesgo de desnutrición frente a sin malaria y sin riesgo alguno de desnutrición], por un lado, y entre los grupos B) y C) [sin malaria y con triple riesgo de desnutrición frente a con malaria y sin riesgo alguno de desnutrición], por otra parte.
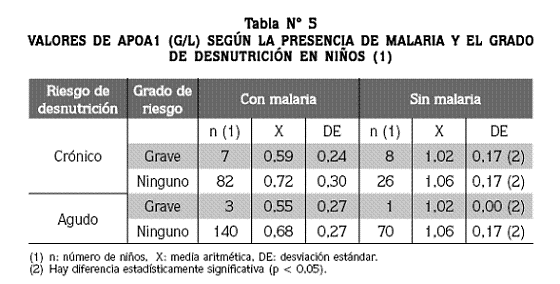
El grado de riesgo de desnutrición (ninguno, leve, moderado, grave) dentro de cada clase de riesgo de desnutrición (agudo, crónico, global) indica la intensidad del riesgo. En cada grupo de malaria (si, no) y dentro de cada clase de riesgo, los promedios de apoA1 entre los cuatro grados de desnutrición fueron, en general, estadísticamente similares, lo que ratifica la incapacidad de la apoA1 para evaluar el estado de nutrición. Si el análisis de la influencia del grado de riesgo se reduce a comparar el grado grave con ningún grado (no hay riesgo de desnutrición) se encuentra lo que presenta la tabla Nº 5: en el riesgo crónico, los niños sin malaria y con grado grave de riesgo de desnutrición tuvieron un promedio de apoA1 de 1,02 g/L, igual al de los niños sin malaria y sin grado alguno de riesgo nutricional. Algo similar acontece en el riesgo agudo.
En el total de individuos (n = 262), el análisis de correlación y de regresión entre apoA1 en función de los puntajes Z de cada indicador antropométrico mostró que los coeficientes rho de Spearman fueron menores de 0,1 en todas la situaciones. La comparación entre las dos pruebas diagnósticas del estado nutricional (indicador antropométrico vs. apoA1), en cada uno de los grupos de malaria (presente, ausente), lleva a lo que aparece en la tabla Nº 6.
El valor de apoA1 usado para definir "baja" y "normal" fue el límite inferior del valor de referencia para hombres, según el laboratorio donde se hizo el análisis, que es 0,94 g/L (el valor normal mínimo para mujeres es 1,01 g/L; se usó el dato masculino por ser algo menor; en los datos observados no se encuentra diferencia significativa por sexo). Entre los niños sin malaria existió riesgo antropométrico de desnutrición en 55 personas, de las cuales la apoA1 clasificó como en riesgo de desnutrición (es decir, con apoA1 baja) únicamente a 17, lo cual indica una sensibilidad de 31%. Entre los 24 niños sin riesgo antropométrico de desnutrición, la apoA1 clasificó como desnutridos a 4 de ellos (16,7%), lo cual equivale a una especificidad de 83%. Por otra parte, entre los 183 niños con malaria, la sensibilidad de la apoA1 sube a 83% y la especificidad cae a 27%, todo ello comparado con el grupo sin malaria.
DISCUSIÓN
En estos niños es muy alta la frecuencia del riesgo de desnutrición de cualquier tipo, evaluado por indicadores antropométricos (71%), lo cual refleja las precarias condiciones socioeconómicas de la población colombiana, mucho más graves en áreas como las aquí estudiadas.25-29 Este hallazgo contrasta radicalmente con los datos de Profamilia para 2000, que hablan de una mejoría en el estado nutricional de los niños colombianos,30 pero esa mejoría se debe, por lo menos en parte, a un cambio en la metodología para cuantificar el problema (los puntos de corte de los intervalos están más alejados de la mediana).
Se entiende que el riesgo de desnutrición crónica infantil refleja los efectos a mediano y largo plazos de la alimentación que, a su vez, los expresa de las condiciones económicas familiares, que en Colombia son desfavorables y mucho más lo son en regiones como Turbo, El Bagre y Zaragoza, muy retrasadas en el desarrollo económico y, sobre todo, social y donde la violencia sociopolítica ha sido intensa, en particular en los últimos quince años, por lo cual cabe esperar que sea alta la frecuencia de riesgo de desnutrición crónica, como en efecto lo es en estos niños, quienes muestran una prevalencia de riesgo de desnutrición del 55 al 69%, según padezcan o no de malaria.
Es importante resaltar que la concentración plasmática de apoA1 en la población (maláricos más no maláricos) no tiene distribución normal (gaussiana) y dista mucho de aproximarse a ella, lo cual debiera ser tenido en cuenta por los investigadores y los clínicos.
Debe notarse que la frecuencia de riesgo de desnutrición medida por indicadores antropométricos es similar entre maláricos y no maláricos (2 de cada 3 niños tienen riesgo de desnutrición agudo, crónico o ambos). Si uno de los objetivos centrales de este trabajo fue comparar la capacidad diagnóstica de la apoA1 frente a la de los indicadores antropométricos para diagnosticar la presencia de riesgo de desnutrición, hay que señalar que la apoA1 no es una herramienta diagnóstica adecuada ni en la población sin malaria ni en la población malárica, tal como necesariamente hay que concluir al analizar su sensibilidad de 31% entre no maláricos y de 83% entre maláricos, lo que significa, de un lado, que entre no maláricos la apoA1 detecta menos riesgo de desnutrición que los indicadores antropométricos y, de otro lado, entre maláricos la apoA1 sobrestima el riesgo de desnutrición. ¿Por cuál razón la sensibilidad de la apoA1 para detectar riesgo de desnutrición en niños con malaria es 2,7 veces su capacidad de hacerlo en niños sin esta enfermedad? Todo indica que se trata de un incremento logrado a expensas de aumentar la proporción de falsos positivos, que es de 85% en niños con malaria, frente a 75% en niños sin paludismo, lo cual puede deberse a que, durante esta infección, los niveles de lípidos y lipoproteínas caen de manera intensa31,32 y, específicamente, se reducen las llamadas PPV o proteínas transportadoras,7,8 y así se reduce el umbral diagnóstico, con lo que aumenta la sensibilidad de la prueba bioquímica.
Con respecto al problema de la escasa asociación entre la apoA1 y los indicadores antropométricos para diagnosticar el estado nutricional, es pertinente recordar que la situación es compleja y poco clara; así, Dao y asociados hallaron correlación positiva entre los indicadores antropométricos y la prealbúmina de unión de tiroxina (PUT),33 otra proteína plasmática postulada como herramienta para evaluar el estado nutricional y cuyas concentraciones se han encontrado de poco a moderadamente correlacionadas con las de la apoA1.5,34 Dao y sus colegas encontraron una buena correlación entre la PUT y los indicadores peso/talla (riesgo agudo) y peso/edad (riesgo global), pero no hallaron asociación con talla/edad (riesgo crónico).33 Mokni y sus colegas identificaron que la transtirretina (TTR), un complejo proteico plasmático formado por PUT y PUR (proteína de unión de retinol), que circula asociado a la HDL mediante la apoA1,4 se correlaciona bien con el indicador talla/edad y mejor todavía con peso/talla;35 ellos afirman que la medición de los niveles de TTR es útil para el diagnóstico del riesgo de desnutrición. En adultos con enfermedad hepática colestática y en pacientes con otras enfermedades, la apoA1 y la prealbúmina tienen una correlación significativa de r = 0,57.34 La albúmina también se ha propuesto como prueba para diagnosticar el estado de nutrición,5,6,36 pero no se ha encontrado correlación entre sus concentraciones y las de apoA1.6 Nosotros encontramos muy escasa correlación entre los valores de apoA1 y los de PUR en 100 niños estudiados en El Bagre, con o sin malaria (datos sin publicar) y en el presente trabajo encontramos muy poca correlación entre la apoA1 y los puntajes Z de cada indicador antropométrico (rho Spearman menor de 0.1 en todas las situaciones).
En 1991, Toure y asociados encontraron que los niños hospitalizados con desnutriciónproteicocalórica(DPC) intensa (marasmo, kwashiorkor) y no complicada tenían niveles de apoA1 muy inferiores a los que mostraban los controles sanos (0.61 ± 0,21 frente a 0,98 ± 0,45 g/L), concluyendo que la apoA1 hace diagnóstico precoz de DPC y encuentra formas muy leves de ella, por lo que afirman que es un marcador útil inclusive en áreas donde son endémicas las infecciones y las enfermedades parasitarias. 5 Nuestros hallazgos no concuerdan con los de estos investigadores, pues no encontramos diferencias entre nutridos y desnutridos en niños sin malaria, pero debemos precisar que nuestros pacientes no tenían los grados extremos de desnutrición (marasmo, kwashiorkor, ambos) que evaluaron estos autores. Tampoco concordamos con Toure y asociados en la afirmación de que la apoA1 es capaz de encontrar formas muy leves de desnutrición, pues nuestras cifras no varían ni siquiera entre quienes tienen riesgo grave y quienes carecen de cualquier riesgo, tanto en niños con malaria como sin ella.
En 1993, en niños hospitalizados con marasmo y diarrea u otra enfermedad infecciosa (es decir, con un proceso inflamatorio asociado), todos los índices antropométricos y la apoA1 fueron significativamente menores que en los controles (niños sin desnutrición, hospitalizados y en espera de cirugía); además, no hallaron correlación entre apoA1 y albúmina ni entre aquella y las proteínas de fase aguda.6 Nosotros coincidimos en el hallazgo de que los valores antropométricos son significativamente menores en los niños con desnutrición, tengan o no malaria, comparados con aquellos sin desnutrición, pero no concordamos en que los valores de apoA1 sean menores en los desnutridos frente a los no desnutridos, bien sea con o sin malaria.
La divergencia frente a Feillet y asociados 6 y frente a Toure y colaboradores5 no es únicamente nuestra. En 1993, en niños hospitalizados con marasmo o kwashiorkor se halló que la apoA1 estaba significativamente más baja en aquellos con marasmo, comparados con controles, pero que quienes padecían kwashiorkor tenían niveles similares a los de los controles.13 En niños (6 a 13 años) normales u obesos, captados en la comunidad, pareados por edad y sexo, no se halló diferencia significativa entre los dos grupos de hombres, pero sí entre los dos grupos de mujeres: los niveles de apoA1 fueron significativamente mayores en las obesas.14
En estudios de niños con infecciones y desnutrición, comparados con otros que tenían sólo infecciones, se ha encontrado que la desnutrición agregada a la inflamación no modifica el índice pronóstico inflamatorio y nutricional,37 frente a lo cual coinciden nuestros datos, pues indican que el estado nutricional no influye en el nivel de apoA1, tanto en presencia como en ausencia de malaria. También se ha encontrado, en estudios de niños con malaria, que las funciones del complejo PUR-TTR no se alteran por la inflamación, en el sentido de que las correlaciones entre PUT y PUR y las de ellas con el retinol se mantienen,9 pero la cantidad de los tres elementos se reduce fuertemente, sin duda alguna,7,8 como también lo indican nuestros datos pasados38 y actuales.
Según el presente estudio, es indudable que el nivel plasmático de la apoA1 es muy bajo, comparado con el estándar usado por el laboratorio; en efecto, 2 de cada 3 niños presentaron cifras inferiores a 0,94 g/L, que es el límite inferior normal del valor de referencia empleado. Este fenómeno de la escasa concentración de la apoA1 afecta tanto a los niños con malaria como sin ella, pero es significativamente menor en los palúdicos (0,68 ± 0,28 g/L frente a 105 ± 17 g/L), mientras que las diferencias según el estado nutricional no son significativas. En conclusión, es la malaria y no la desnutrición la que afecta en forma significativa la concentración de la apoA1, por lo que debemos concluir que la proteína visceral en cuestión no es una herramienta útil para el diagnóstico del estado nutricional, tanto en niños con malaria como en aquellos sin esta enfermedad, conclusión distinta a la de varios de los autores mencionados antes;5,6 nosotros suscribimos la conclusión de quienes dicen que ninguna proteína plasmática usada en forma aislada es adecuada como prueba diagnóstica del estado nutricional, mucho menos si existen procesos infecciosos o inflamatorios asociados.12-18 En 1996, Russell y McAdams señalaron que las proteínas plasmáticas viscerales (PPV) son afectadas por el estrés y que esto limita su valor para evaluar el estado nutricional, pues el estrés agudo puede reducirlas en forma rápida (en unas pocas horas) y puede aparecer un falso estado de desnutrición.15 Golden señaló desde 1982 que de las PPV se piensa que pueden identificar si un déficit proteico corporal se debe o no a una deficiencia proteica en la dieta, olvidando que para que la medición de una proteína transportadora (PPV) sea una medida útil del estado proteico no es suficiente con que responda en forma precisa a una dieta deficiente en proteínas, sino que su disminución debe ser producida por la deficiencia proteica específica de la dieta, al menos en la gran mayoría de los casos encontrados.12
AGRADECIMIENTOS
A la Dirección Seccional de Salud de Antioquia y a la Universidad de Antioquia por la financiación de la investigación.
BIBLIOGRAFÍA
1. Ginsberg HN, Goldberg IJ. Trastornos del metabolismo intermediario. En: Braunwald E, Fauci AS, Kaspers DL, Hauser SL, Longo DL, Jameson JL, eds. Harrison´s Principles of Internal Medicine, 15a ed. USA: McGraw Hill; 2001. p. 2245-2249. [ Links ]
2. Mayes PA. Transporte y almacenamiento de lípidos. En: Murray RK, Granner DK, Mayes PA, Rodwell VW, eds. Bioquímica de Harper, 15a ed. México DF: El Manual Moderno; 2001. p. 309-327. [ Links ]
3. Montgomery R, Conway TW, Spector AA, Chappell D. Bioquímica. Casos y texto, 6a ed. Madrid: Harcourt Brace; 1998. p. 356-389. [ Links ]
4. Sousa MM, Berglund L, Saraiva MJ. Transthyretin in high density lipoproteins: association with apolipoprotein A-I. J Lipid Res 2000; 41: 58-65. [ Links ]
5. Toure M, Sall MG, Gauthier F, Weill J, Mouray H, Fall M. Apoliprotein A1 as an early index of protein-energy malnutrition. Eur J Clin Nutr 1991; 45: 511-514. [ Links ]
6. Feillet F, Parra HJ, Kamian K, Bard JM, Fruchart JC, Vidailhet M. Lipoprotein metabolism in marasmic children of Northern Mauritania. Am J Clin Nutr 1993; 58: 484-488. [ Links ]
7. Koj A, Gordon AH. The acute phase response to injury and infection. New York; Elsevier; 1985. [ Links ]
8. Thurnham DI, Singkamani R. The acute phase response and vitamin A status in malaria. Trans R Soc Trop Med Hyg 1991; 85: 194-199. [ Links ]
9. Rosales FJ, Topping JD, Smith JE, Shankar H, Ross AC. Relation of serum retinol to acute phase proteins and malarial morbidity in Papua New Guinea children. Am J Clin Nutr 2000; 71: 1582-1588. [ Links ]
10. Alaupovic A, Kostner G, Lee DM, Mcconathy WJ, Magani H. Peptide composition of human apolipoprotein A and B and C. Expos Annu Biochim Med 1972; 31: 145-160. [ Links ]
11. Guiro AT, Sall MG, Ndiaye AM. Evolution des teneurs plasmatiques des apolipoproteines A et B et de la prealbumine au cours de la malnutrition preteino-energetique des enfantes senegalais. Afr Med 1988; 265: 337-339. [ Links ]
12. Golden MHN. Transport proteins as indices of protein status. Am J Clin Nutr 1982; 35: 1159-1165. [ Links ]
13. El Harim I, Befort JJ, Balafrej A, Lahrichi M, Girard-Globa A. Lipids and lipoproteins of malnourished children during early renutrition: apolipoprotein AIV as a potential index of recovery. Am J Clin Nutr 1993; 58: 407-411. [ Links ]
14. Moussa MA, Shaltout AA, Nkansa-Dwamena D, Mourad M. Apoplipoproteins A-I and B in Kuwaiti children. Ann Nutr Metab 1998; 42: 202-210. [ Links ]
15. Russell MK, McAdams MP. Laboratory monitoring of nutritional status. En: Matarese LE, Gottchlich MM, eds. Contemporary nutrition support practice. A clinical guide. Philadelphia: Little, Brown and Co, 1996. p. 47-63. [ Links ]
16. Johnson AM. Low levels of plasma proteins: malnutrition or inflamation? Clin Chem Lab Med 1999; 37: 91-96. [ Links ]
17. Dore MF, Laaban JP. Methods of nutritional assessment in chronic obstructive lung diseases. Rev Pneumol Clin 1999; 55: 155-167. [ Links ]
18. Spiekerman AM. Proteins used in nutritional assessment. Clin Lab Med 1993; 13: 353-369. [ Links ]
19. Carmona-Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la respuesta terapéutica antimalárica. Parte 1. Iatreia 2003; 16: 299-318. Disponible en: http://medicina.udea.edu.co/Publicaciones/iatreia/Vol16%20No4%20-Dic%202003/art%EDcul4.pdf [ Links ]
20. Carmona-Fonseca J. La malaria en Colombia, Antioquia y las zonas de Urabá y Bajo Cauca: panorama para interpretar la respuesta terapéutica antimalárica. Parte 2. Iatreia 2004; 17: 34-53. Disponible en: http://medicina.udea.edu.co/Publicaciones/iatreia/Vol17%20No2%20-%20Mar%202004/art%EDculo3.pdf [ Links ]
21. WORLD HEALTH ORGANIZATION, DIVISION OF CONTROL OF TROPICAL DISEASES. Warrell DA, Molineux ME, Beales PF, eds. Severe falciparum malaria. Trans R Soc Trop Med Hyg 1990; 84 (Suppl. 2): 1-65. [ Links ]
22. López F, Schumunis G, eds. Diagnóstico de malaria. Washington: OPS/OMS, 1988. Publicación científica No. 512. [ Links ]
23. Garza L, Yip R. Victora C.G. Physical Status. En: De Onis M, ed. The use and interpretation of anthropometry. Geneve: Unit Nutrition WHO; 1993. p. 5-10, p. 13-16, p. 22-28. [ Links ]
24. Lazarus R, Baur L, Webb K, Blyth F. Body mass index in screening for adiposity in children and adolescents: systematic evaluation using receiver operating characteristic curves. Am J Clin Nutr 1996; 63: 500-506. [ Links ]
25. Correa AM, Guzmán V, Carmona-Fonseca J, Blair S, Morales DM. Alimentación y malaria: unaaproximación biosocial. Invest Educ Enferm 2002; 20: 30-47. Disponible en: http://enfermeria.udea.edu.co/revista/html/modules.php?op=modload&name=Sections&file=index&req= viewarticle&artid=247&page=1 [ Links ]
26. Guzmán V, Correa A, Carmona-Fonseca J, Blair S. Seguridad alimentaria y nutricional en un espacio de riesgo para malaria. Arch Latinoam Nutr 2003; 53: 227-237. [ Links ]
27. Carmona-Fonseca J. Malaria, desnutrición y parasitosis intestinales en los niños colombianos: interrelaciones. Iatreia 2004; 17: 354-369. Disponible en: http://medicina.udea.edu.co/Publicaciones/iatreia/Vol17%20No4%20-%20Dic%202004/IATREIA%2017%20No%5B1%5D.4.pdf [ Links ]
28. Carmona-Fonseca J, Correa AM, Alcaraz GM. Población, alimentación y estado nutricional entre los tules (kunas) del resguardo Caimán Nuevo (Turbo y Necoclí; Antioquia, Colombia), 2003-2004. Iatreia 2005; 18: 259-278. Disponible en: http://medicina.udea.edu.co/Publicaciones/iatreia/Vol18%20No3%20-%20Sep%202005/IATREIA_18_No3.pdf [ Links ]
29. Correa AC, Carmona-Fonseca J, Alcaraz GM. Malaria entre la población Tule (Kuna) del resguardo Caimán Nuevo (Turbo y Necoclí; Antioquia, Colombia), 2003-2004. Invest Educ Enferm 2005; 23: 16-33. Disponible en: http://enfermeria.udea.edu.co/revista/html/modules.php?op=modload&name=Sections&file= index&req=viewarticle&artid=288&page=1 [ Links ]
30. PROFAMILIA. Encuesta Nacional de Demografía y Salud 2000. Bogotá: Profamlia, 2000. [ Links ]
31. Djoumessi S. Serum lipids and lipoproteins during malaria infection. Pathol Biol (Paris) 1989; 37: 909-911). [ Links ]
32. Kittl EM, Diridl G, Lenhart V, Neuwald C, Tomasits J, Pichler H, et al. HDL cholesterol as a sensitive diagnostic parameter in malaria Wien Klin Wochenschr 1992; 104: 21-24. Resumen consultado en Pubmed. [ Links ]
33. Dao H, Delisle H, Fournier P. Anthropometric status, serum prealbumin level and immune response to measles vaccination in Mali children. J Trop Pediatr 1992; 38: 179-184. [ Links ]
34. Floren CH, Franzen J, Albers JJ. Apolipoprotein AI in liver disease. Scand J Gastroenterol 1987; 22: 454-458. [ Links ]
35. Mokni R, Chakar A, Bleiberg-Daniel F, Mahu JL, Walravens PA et al. Decreased serum levels of nutritional biochemical indices in healthy children with marginally delayed physical growth. Acta Paediatr 1993; 82: 539-543. [ Links ]
36. Ingenbleek Y, De Visscher M, De Nayer PH. Measurement of prealbumin as index of proteincaloric malnutrition. Lancet 1972 ; 2: 106-109. [ Links ]
37. Rault JP, Adam F, Simon F. Limites de PINI (index pronostique nutritionnel et inflamatoire) dans l´évaluation du status nutritionnel de l´enfant. Med Trop (Mars) 1995; 55: 343-346. [ Links ]
38. Blair S, Carmona J, Correa A. Malaria en niños: relaciones entre nutrición e inmunidad. Rev Panam Salud Pub 2002; 11: 5-14. [ Links ]