Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Iatreia
Print version ISSN 0121-0793
Iatreia vol.20 no.4 Medellín Oct./Dec. 2007
Tratamiento de las úlceras crónicas en los miembros inferiores con un equivalente cutáneo autólogo y desbridación con larvas de Lucilia sp. (Diptera: Calliphoridae). Reporte de un caso
Chronic lower limb ulcers treatment with autologous skin equivalent and larvae debriding (Diptera Calliphoridae)
MÓNICA ESCOBAR FRANCO1, 3, JULIETA HENAO PÉREZ1,4, MARTA WOLFF2,5, SERGIO ESTRADA MIRA1,6, LUZ MARINA RESTREPO MÚNERA1,5
- Grupo Ingeniería de Tejidos y Terapias Celulares, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
- Laboratorio Colecciones Entomológicas. Grupo Interdisciplinario de estudios Moleculares (GIEM). Universidad de Antioquia, Medellín, Colombia.
- Médica Dermatóloga
- Médica Inmunóloga
- Bióloga, Doctora en Ciencias
- Estudiante de pregrado, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
Recibido: mayo 9 de 2007
Aceptado: junio 13 de 2007
RESUMEN
Introducción: las úlceras en los miembros inferiores constituyen una causa importante de hospitalización y deterioro en la calidad de vida de los pacientes, al interferir con sus actividades laborales y sociales. Estas lesiones obedecen a diferentes enfermedades, la más frecuente de las cuales en Medellín es la insuficiencia venosa; una vez diagnosticadas, existen muchas alternativas de tratamiento, que buscan crear un lecho apropiado para el cierre de la herida.
El uso de larvas para el desbridamiento es una alternativa rápida y de bajo costo, con la cual se logra un tejido de granulación adecuado para la aplicación de equivalentes cutáneos autólogos, que constituyen una opción para pacientes refractarios a otros tratamientos.
Materiales y métodos: se seleccionó y evaluó a una paciente de acuerdo con los criterios de inclusión establecidos para el estudio. Para desbridar la úlcera se recurrió a la aplicación de larvas de Lucilia sp. (Diptera: Calliphoridae), obtenidas a partir de huevos previamente desinfectados con hipoclorito de sodio y sembrados en un medio de cultivo con antibióticos. Se aplicaron las larvas directamente en la lesión y posteriormente se procedió a tapar esta con muselina, permitiendo la obtención de oxígeno y facilitando el drenaje del tejido necrótico. Las larvas se dejaron por 48 horas, al cabo de las cuales se retiraron con una pinza estéril y se descartaron en alcohol al 70%; luego se procedió a evaluar la limpieza de la lesión. Este procedimiento se llevó a cabo en el Laboratorio de Entomología (GIEM) de la Universidad Antioquia.
Se procesó una biopsia de piel de la paciente, obtenida siguiendo un protocolo previamente establecido, para obtener queratinocitos y fibroblastos. Para el cultivo primario de queratinocitos el 90% de las células obtenidas de la biopsia se sembró en cajas de cultivo de 75 cm2, en presencia de 7 x 106 células de la línea 3T3-Swiss tratadas con mitomicina C (10 µg/mL) como capa alimentadora; para el cultivo primario de fibroblastos, se sembró el 10% de las células en cajas de cultivo de 75 cm2 con el medio DMEM suplementado. En la producción del equivalente cutáneo se utilizó un gel obtenido con una mezcla de plasma humano de sangre AB de banco de sangre, 6-7,5 x 104 fibroblastos, CaCl2 y ácido tranexámico. Sobre dicho gel se sembraron luego los queratinocitos provenientes del cultivo primario y se hizo seguimiento del cultivo en microscopio invertido.
Cuando se obtuvo una confluencia celular cercana al 100%, se desprendió el equivalente cutáneo con pinzas estériles para aplicarlo inmediatamente sobre la úlcera.
Se reportan los resultados del tratamiento de una úlcera en el miembro inferior izquierdo de una paciente de 66 años con la terapia combinada de desbridamiento con larvas y cultivo de equivalentes cutáneos autólogos. Después de 15 meses de iniciado el tratamiento, la úlcera continúa cerrada y la paciente no tiene dolor ni impedimentos funcionales en la extremidad.
PALABRAS CLAVE
CULTIVOS CELULARES
DESBRIDAMIENTO CON LARVAS
EQUIVALENTE CUTÁNEO
LARVAS DE LUCILIA SP. (Diptera: Calliphoridae)
Ú LCERAS CRÓNICAS
SUMMARY
Introduction: Lower limb ulcers are an important cause of hospitalization and deterioration of life quality because they affect both the work and social activities of patients. These ulcers are due to different diseases, the most common of which, in Medellín, Colombia, is venous insufficiency. After diagnosis, there are many management options, all of them looking for an appropriate environment for wound healing.
The use of larvae for debridement is a low-cost alternative which minimizes pain and discomfort of patients and stimulates the growth of a healthy granulation tissue for application of an autologous skin equivalent, the choice for patients that have not responded to other treatments.
Materials and methods: The selected patient was evaluated and the requirement of larvae debridement was determined. Lucilia sp. (Diptera: Calliphoridae) larvae were obtained from eggs previously desinfected and seeded in a culture medium with antibiotics. The larvae were applied directly onto the ulcer and then covered with a sterile tulle, that allowed tissue oxygenation and necrotic material elimination. They were left on the ulcer during 48 hours, after which they were discarded in alcohol 70%; debridement was then evaluated. This procedure was carried out at the Entomology Laboratory (GIEM), University of Antioquia, Medellín, Colombia.
Keratinocytes and fibroblasts were obtained from a skin specimen taken according to the established protocol. For keratinocytes primary culture, 90% of the cells obtained from the biopsy were seeded in 75 cm2 culture plates, over a feeding monolayer of 7 x 106 3T3-Swiss cells treated with mitomycin C. For fibroblasts primary culture, 10% of the cells were seeded in 75 cm2 culture plates, containing DMEM supplemented medium. For the production of the skin equivalent, AB human plasma from a blood bank, 6-7,5 x 104 fibroblasts, CaCl2 and tranexamic acid were used in order to obtain a gel; keratinocytes obtained in the primary culture were placed on this gel and the culture was followed-up under an inverted microscope. When cell confluence was near 100%, the skin equivalent was covered with a sterile tulle, and detached for its immediate application on the ulcer.
We report the case of a 66 year old woman treated for a leg ulcer with larvae debridement and autologous skin equivalent. After being followed up for 15 months the ulcer continues closed, no pain has been reported and the leg function is normal.
KEY WORDS
CELL CULTURES
CHRONIC ULCERS
DEBRIDEMENT WITH LARVAE
LUCILIA SP. LARVAE (Diptera: Calliphoridae)
SKIN EQUIVALENT
INTRODUCCIÓN
Las úlceras en los miembros inferiores son una causa mundial importante de morbilidad debido a su cronicidad y recurrencia, que ocasionan hospitalizaciones prolongadas, disminución de la calidad de vida, incapacidad laboral y grandes costos económicos y sociales. A este problema deben enfrentarse diariamente diferentes profesionales como médicos generales, dermatólogos, cirujanos vasculares, geriatras, enfermeras y, en algunas ocasiones, psiquiatras.1-3 Estas úlceras se deben a diferentes enfermedades; las más frecuentes son la insuficiencia venosa crónica, la enfermedad arterial oclusiva crónica y la diabetes mellitus.1,3-7 Se ha reportado que el 5,7% de las consultas dermatológicas del Hospital Universitario San Vicente de Paúl (HUSVP) de Medellín corresponden a úlceras debidas a insuficiencia venosa crónica.8
Luego de establecido el tratamiento de la enfermedad de base, el de la úlcera incluye desbridamiento y limpieza, que se pueden lograr por métodos quirúrgicos, enzimáticos, mecánicos o autolíticos, cuyo uso depende del grado de infección, la profundidad y la extensión de la herida, así como del estado general del paciente.9,10
En la paciente que reportamos se utilizó exitosamente la combinación del desbridamiento con larvas y la aplicación de equivalentes cutáneos autólogos.11 El primero constituye una opción eficaz, rápida, económica y menos dolorosa que otras; además, favorece la cicatrización y la formación de un lecho apropiado para la aplicación de otras terapias.12 Por otro lado, los equivalentes cutáneos han sido utilizados con éxito en otros países para pacientes que no responden a los tratamientos convencionales.13,14
MATERIALES Y MÉTODOS
Presentación de la paciente
Se reporta el caso de una paciente evaluada de acuerdo con los criterios de inclusión establecidos para el estudio, aprobados por el Comité de Bioética de la Facultad de Medicina de la Universidad de Antioquia: tener úlceras con tamaño superior a 2 cm2 , ser mayor de 15 años, no haber respondido bien a los tratamientos convencionales, no presentar enfermedades asociadas que pudieran interferir con el proceso de cicatrización, no tener ningún trastorno mental ni estar recibiendo medicamentos que puedan alterar la cicatrización. Se consignó por escrito el consentimiento para participar.
Aplicación de las larvas
Se aplicaron larvas desinfectadas de Lucilia sp. (Diptera Calliphoridae) en la lesión de la paciente, alrededor de la cual se puso una plantilla de hidrocoloide para aislar la piel sana del contacto con las larvas y servir de soporte en el momento de recubrir la úlcera. En todas las aplicaciones se dejaron las larvas por 48 horas, después de las cuales fueron retiradas y descartadas en alcohol al 70%.12
Toma y procesamiento de la biopsia para la obtención de células
Bajo anestesia local y en campo estéril se obtuvo la muestra de piel; consistió en una elipse tomada de la fosa ilíaca derecha, de 4 x 1 cm, que se depositó en un tubo de 15 mL (Falcon) con 10 mL de DMEM (Dulbecco Modiffied Eagle Medium) (Gibco, Grand Island, NY, USA), con penicilina 100 U/mL y estreptomicina 100 µg/mL (Biowittaker, Walkersville, MD, USA); se llevó la muestra al laboratorio en condiciones de esterilidad. En cabina de bioseguridad clase II A, se pasó el fragmento de piel a una caja de Petri de 100 mm (Falcon), se lavó con tripsina/EDTA (T/E) (Tripsina, ICN Biomedical Inc., Aurora, Ohio; EDTA, Sigma-Aldrich, St. Louis, MO, USA) 0,025%, procediendo a cortarla en fragmentos más pequeños, que se llevaron a un frasco de 125 mL con tapa de rosca (Falcon) con 25-50 mL de T/E en agitación durante 30 minutos a 37 ºC. Se recuperó el sobrenadante y se inactivó la tripsina con solución fosfato tamponada, más suero bovino fetal (SBF) 5% (Biowittaker). Luego de centrifugado el sobrenadante, el botón de células obtenido se resuspendió en medio de cultivo DMEM (Gibco) suplementado con 10% de suero bovino fetal (SBF); luego se hicieron el recuento de células y la medición de su viabilidad, por tinción con azul de tripano. El procedimiento se repitió hasta obtener el mayor número posible de células de la biopsia.15-20
Mantenimiento de la línea celular 3T3-Swiss Albino Se utilizó como capa alimentadora la línea celular 3T3-Swiss; estas células fueron sembradas en frascos de 75 cm2 (Falcon) en DMEM suplementado con 10% de SBF, penicilina-estreptomicina 1% y L-glutamina 2 mM (Biowittaker). Se incubaron a 37 ºC en presencia de CO2 al 5%.
Cultivo primario de queratinocitos
Se sembró el 90% de las células obtenidas a partir de la biopsia en un frasco de cultivo de 75 cm2 en presencia de 7 x 106 células de la línea 3T3-Swiss tratadas con mitomicina C (Sigma) 10 µg/ml. El medio de cultivo utilizado fue DMEM: Ham's- F12 (Sigma) (3:1), suplementado con 10% de SBF, penicilina-estreptomicina 1%, L-glutamina 2 mM (Biowittaker) al 1%, y adenina 24 µg/mL, insulina 5 µg/mL, toxina de cólera 8 ηg/mL, triyodotironina 1,3 ηg/mL, hidrocortisona 0,4 µg/mL (todos de Sigma). Después de 48 horas, se adicionaron 10 ηg/mL de Factor de Crecimiento Epidérmico (EGF) (Becton-Dickinson, Franklin Lakes, NJ, USA).21-25
Cultivo primario de fibroblastos humanos
Luego de procesar la biopsia se tomó el 10% de las células obtenidas y se sembró en un frasco de cultivo de 75 cm2, en medio DMEM, con SBF 10%, 1% de penicilina-estreptomicina y L-glutamina 2 mM al 1%. Entre el quinto y sexto días de iniciado el cultivo primario, se subcultivaron las células, una parte de las cuales se criopreservó en nitrógeno líquido. Los cultivos se expandieron de acuerdo con las necesidades de producción de equivalentes. 19,21,25
Producción de los equivalentes cutáneos
Antes de obtener un 100% de confluencia del cultivo primario de queratinocitos, se trataron las células con T/E. Los queratinocitos obtenidos se utilizaron inmediatamente para el cultivo secundario o se congelaron en nitrógeno líquido para uso posterior.
Para la producción de los equivalentes cutáneos se utilizó plasma obtenido de sangre total de un donante del grupo AB del Banco de Sangre del Hospital Pablo Tobón Uribe (negativo para VIH y para hepatitis B), el cual se mezcló con una suspensión de los fibroblastos obtenidos en el cultivo (6-7,5 x 104 células). Se utilizaron CaCl2 (Sigma) como agente coagulante y ácido tranexámico (Ropsohn Therapeutics Ltda. Bogotá, Colombia) como agente antifibrinolítico; el volumen final (15-20 mL) se completó con solución salina fisiológica y la mezcla se incubó a 37 ºC en presencia de CO2 al 5% para su gelificación. Luego se adicionaron los queratinocitos en su medio de cultivo. El seguimiento se efectuó mediante la observación de los cultivos con microscopio invertido. 25-27
Recuperación del equivalente
Con una confluencia cercana al 100%, se procedió a la apertura del frasco de cultivo en cabina de bioseguridad, se retiró el sobrenadante y se lavó el equivalente con solución salina. Posteriormente se lo cubrió con un tul estéril, fijado al equivalente con pegamento inorgánico (Histoacryl) (Braun Dexon, Tuttllingen, Alemania). Con una espátula se separó el borde lateral de la lámina y con pinzas estériles se desprendió el equivalente del frasco de cultivo. Luego fue depositado en un tubo estéril de 50 mL (Falcon) con solución salina, y llevado para su aplicación a la paciente.25
Descripción del caso
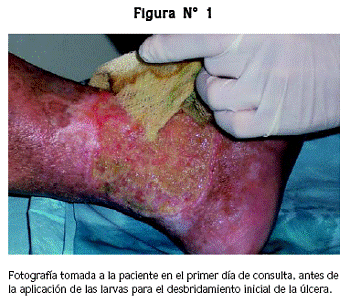
El 7 de octubre de 2005 se recibió en la Clínica de Úlceras del HUSVP, una paciente de 66 años remitida con una úlcera crónica de difícil tratamiento. Al examen físico se encontró una úlcera en la cara anterior del tercio inferior de la pierna izquierda, de 18 por 9 cm, que se extendía desde el maléolo interno hasta el externo, cubierta por abundante fibrina, de bordes deprimidos, con exudado profuso purulento y de mal olor (figura N° 1).
La paciente había presentado úlceras en el mismo sitio desde hacía 40 años, con cierres totales por cortos períodos. La herida por la cual consultó le había aparecido 5 años antes, y venía aumentando progresivamente de tamaño y tornándose dolorosa. En el Tríplex venoso de miembros inferiores realizado en 2001 se hallaron insuficiencia venosa grave de la safena interna izquierda con unión safenofemoral insuficiente, al igual que insuficiencia de las colaterales y perforantes, de la safena externa y de la unión safenopoplítea; en el lado derecho se hallaron insuficiencia venosa profunda y femoropoplítea y trombosis venosa profunda antigua recanalizada y organizada.
El día 20 de octubre de 2005 se hizo la primera aplicación de 25 larvas de Lucilia sp., obtenidas a partir de huevos desinfectados con hipoclorito de sodio y sembrados en agar con antibióticos. Las larvas recién eclosionadas tenían una longitud aproximada de 2 mm; se pusieron una a una directamente en la úlcera con una pinza de punta fina. Una vez aplicada la cantidad necesaria de larvas, se procedió a tapar la úlcera con muselina estéril, fijada con microporo a la piel sana, que permitía la oxigenación de las larvas y facilitaba el drenaje del tejido necrótico.28 Para evitar perder las larvas se las dejó por 48 horas sin cambiar la muselina y al cabo de este tiempo, fueron retiradas con una pinza y descartadas en alcohol al 70%; se procedió luego a evaluar la limpieza de la lesión. Se observó que la herida presentaba un tejido de granulación libre de fibrina y con trasudado citrino.
La paciente no acudió a control durante los tres meses posteriores a la primera aplicación de larvas; por ello, el 3 de febrero de 2006 se le aplicaron nuevamente por tener acumulación de fibrina. Las larvas de este segundo tratamiento murieron por la presencia de crema con antibiótico en la herida, por lo que se efectuó una tercera aplicación el 15 de febrero de 2006. En esta oportunidad se observó, después de retirar las larvas, que la úlcera no tenía signos de infección y presentaba tejido de granulación, ausencia de fibrina y abundante trasudado.
El 6 de febrero de 2006 se tomó una muestra de piel de la fosa ilíaca derecha, de la que se obtuvieron 1.375.000 células, con una viabilidad del 92%, las cuales fueron cultivadas como se describió previamente.
Aplicación de equivalentes cutáneos
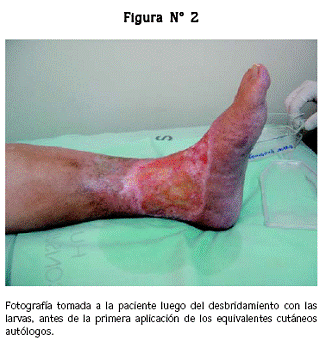
El 17 de marzo de 2006 se llevó a cabo la primera aplicación de los equivalentes. Se observó una herida de 17,4 x 8,5 cm con tejido de granulación desigual, bordes deprimidos y trasudado profuso (figura Nº 2).
Al retirar el equivalente, 3 días después, se encontró que la úlcera tenía tejido de granulación uniforme, islas de piel en la parte central y trasudado profuso. El 21 de marzo de 2006 se hizo una segunda aplicación de dos equivalentes cutáneos; al retirarlos, 4 días después, se encontró la úlcera libre de fibrina, con bordes planos y migración de tejido cicatricial hacia el centro de la herida.
El 3 de abril de 2006 se le aplicaron dos equivalentes cutáneos; en esa oportunidad se encontró disminución de tamaño de la úlcera, aplanamiento de sus bordes y migración de piel nueva desde éstos hacia el centro de la herida. Además, había una banda de piel nueva que unía las partes superior e inferior, dividiendo la herida en dos.
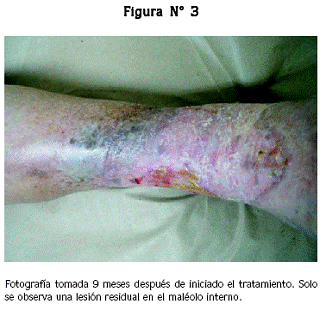
El 21 de abril de 2006 se le aplicó un equivalente cutáneo en la región maleolar interna, el cual se retiró 5 días después; la paciente informó disminución en la trasudación de la herida, lo cual era también clínicamente observable. El último equivalente cutáneo se le aplicó el 28 de abril de 2006, y se le retiró 5 días después; se encontró que las heridas habían disminuido de tamaño y tenían un buen tejido de granulación (Figura N° 3).
El 8 de junio de 2006, 40 días después de la última aplicación, la úlcera maleolar interna había cerrado por completo; solo se observaba una herida de 5 x 4 cm en el maléolo externo, con buen tejido de granulación y libre de trasudado. Siete meses después de finalizado el tratamiento (enero 31 de 2007), la paciente seguía sin dolor, la úlcera remanente había cerrado y no tenía impedimentos funcionales en la extremidad.
DISCUSIÓN
Para el tratamiento de las úlceras en miembros inferiores se han venido utilizando métodos de desbridamiento que promueven un lecho de granulación adecuado para el cierre de la herida;20 con tal objetivo, el método ideal sería uno fácilmente reproducible, que ofreciera los mejores resultados clínicos con menos traumatismo y menores costos.
La aplicación de larvas es una alternativa económicamente viable, que en la mayoría de los casos no genera incapacidad, las molestias son mínimas para el paciente y no se requiere una infraestructura compleja.11,12 La paciente descrita no manifestó en ningún momento malestar o dolor por la presencia de las larvas. En el momento de retirarlas después de una de las aplicaciones se las encontró muertas, debido a la acción de antibióticos tópicos que impidieron su desarrollo normal; por ello se recomienda que durante estos tratamientos no se empleen medicamentos tópicos que puedan afectar la viabilidad de las larvas.
La disponibilidad de larvas para esta terapia está sujeta a la obtención de los huevos de moscas. Con ella se logra un excelente tejido de granulación, que permite hacer un enfoque terapéutico diferente de la lesión. Se ha descrito que, por sí sola, la terapia con larvas puede desencadenar el cierre completo de las heridas cuando son de pequeño tamaño y poca profundidad.
En el caso reportado, debido al tamaño de la úlcera, las larvas se usaron como método de desbridamiento para lograr un lecho apropiado para la posterior aplicación de equivalentes cutáneos autólogos cultivados in vitro. Los desbridamientos con larvas usualmente requieren varios tratamientos, cada uno de los cuales puede demandar un número diferente de larvas según lo extenso de la lesión. En el presente estudio el desbridamiento fue efectivo en la última aplicación, en la cual se usaron 40 larvas en un área de 18 x 9 cm, lo que corresponde a 0,25 larvas/cm2, a diferencia de lo recomendado en la literatura, de 5-10 larvas/cm2 de lesión10,12 Las larvas de Lucilia sp. (Calliphoridae) son en su mayoría especies necrófagas, que además destruyen las bacterias presentes en el sustrato.11 El mecanismo de acción de las larvas consiste en que durante su alimentación producen y liberan enzimas (triptasa, peptidasa y lipasa) que ayudan a desprender la fibrina y el tejido necrótico presentes y dejan un fondo limpio que permite el crecimiento del tejido granuloso.1,9 Los equivalentes cutáneos se integran al lecho de la úlcera, sirven de barrera física contra las infecciones y estimulan la neoformación de tejidos vascular y epitelial,25,29-31 lo cual se evidenció en esta paciente por la presencia de islas de piel en la herida entre la tercera y cuarta aplicaciones; tanto los queratinocitos cultivados presentes en el equivalente cutáneo, como los que se adhieren a la herida liberan factores de crecimiento y citoquinas, entre ellos el factor de crecimiento endotelial (ECGF), moléculas de adherencia intercelular (ICAM), factor de crecimiento derivado de las plaquetas (PDGF), factor de crecimiento de fibroblastos (FGF), factor estimulador de colonias de granulocitos y macrófagos (GM-CFS), factor de crecimiento epidérmico (EGF), interleuquinas 1, 3, 6 y 8, factor de crecimiento transformador (TGFα y TGFβ), que contribuyen a la angiogénesis y a la proliferación y migración de los queratinocitos y fibroblastos desde los bordes de la úlcera hacia su centro. 25,32
La utilización de equivalentes cutáneos autólogos no solo presenta ventajas inmunológicas porque no existe riesgo de rechazo,33 sino que además se evitan la transmisión de enfermedades infecciosas y la necesidad de caracterizar las muestras que se van a utilizar cuando provienen de prepucio o piel de donantes de órganos. Sin embargo, dado que en la mayoría de los casos los queratinocitos y fibroblastos no expresan moléculas del complejo mayor de histocompatibilidad (HLA), esta condición permite el uso de células obtenidas de donantes, que ofrecen ciertas ventajas sobre la piel autóloga, como son el alto potencial de proliferación y la disponibilidad de mayores cantidades de células. Esto garantiza un suministro regular de equivalentes cutáneos, lo que contrasta con los cultivos celulares de pacientes de edad avanzada, en quienes la tasa de crecimiento de los queratinocitos es lenta, lo que retrasa la frecuencia y disminuye el número de aplicaciones de equivalentes y, en consecuencia, se retarda el cierre o la disminución del tamaño de la herida.32
A pesar de la edad de la paciente, en este caso se lograron el cultivo y la proliferación tanto de queratinocitos como de fibroblastos y se pudo mantener un suministro regular de equivalentes, lo cual, asociado a la obtención de un lecho apropiado con el desbridamiento por larvas de Lucilia sp. contribuyó al éxito obtenido.
AGRADECIMIENTOS
Al CODI (proyectos de menor cuantía), por su aporte económico para el desarrollo del proyecto. Al HUSVP por el acceso a la Clínica de Úlceras, al HPTU por el suministro del plasma, a Carolina Rivera, por su ayuda en el proceso de obtención de las larvas, a los estudiantes del componente curricular flexible por su colaboración en la consulta, al doctor Álvaro Meana por el suministro de las células 3T3 Swiss.
REFERENCIAS BIBLIOGRÁFICAS
1. Jukema GN, Menon AG, Bernards AT, Steenvoorde P, Taheri R, van Dissel JT. Amputation-sparing treatment by nature surgical maggots revisited. Brief report. Clin Infect Dis 2002; 35: 1566-1571. [ Links ]
2. Valencia I, Falabella A, Kirsner R, Eaglstein W. Chronic venous insufficiency and venous leg ulceration. J Am Acad Dermatol 2001; 44: 401-421. [ Links ]
3. Franks PJ, Moffatt CJ. Do clinical and social factors predict quality of life in leg ulceration? Int J Low Extrem Wounds 2006; 5: 236-243. [ Links ]
4. Dinh TL, Veves A. Treatment of diabetic ulcers. Dermatol Ther 2006; 19: 348-355. [ Links ]
5. Nelson EA, Cullum N, Jones J. Venous leg ulcers. Clin Evid 2006; 15: 2607-2626. [ Links ]
6. Nelzen O, Bergquist D, Lindhagen A. Venous and nonvenous leg ulcers: clinical history and appearance in a population study. Br J Surg 1994; 81: 182-187. [ Links ]
7. Wollina U, Andel MB, Hansel G, Helm C, Koch A, Konrad H, et al. Leg ulcers are a diagnostic and therapeutic challenge. Int J Low Extrem Wounds 2005; 4: 97-104. [ Links ]
8. Sanclemente G, Mahecha M, Guzmán C. Enfermedades de la piel más frecuentes en la consulta externa dermatológica del Hospital Universitario San Vicente de Paúl y del Hospital Infantil. Acta Méd Colomb 2001; 26: 240-244. [ Links ]
9. Sherman RA, Hall MJR, Thomas S. Medical maggots: An ancient remedy for some contemporary affictions. Annu Rev Entomol 2000; 45: 55-81. [ Links ]
10. Fitzpatrick M. Tiny "surgeons" prove surprisingly effective. Medical News & Perspectives , JAMA, 2000; 284: 2306-2307. [ Links ]
11. Mumcuoglu KY, Millar J, Mumcouglu M, Friger M, Tarsitos M. Destruction of bacteria in the digestive tract of the maggot of Lucilia sericata (Diptera: Calliphoridae). J Med Entomol 2001; 38: 161-166. [ Links ]
12. Wolff H, Hansson C. Larval therapy: an effective method of ulcer debridement. Clin Exp Dermatol 2000; 28: 134-137. [ Links ]
13. Dini V, Romanelli M, Piaggesi A, Stefani A, Mosca F. Cutaneous tissue engineering and lower extremity wounds (part 2). Int J Low Extrem Wounds 2006; 5: 27-34. [ Links ]
14. Jones J, Nelson E. Skin grafting for venous leg ulcers. Cochrane Database System Rev 2007; CD001737. [ Links ]
15. Gallico G, O´Connor E, Compton C, Kehrade O, Green H. Permanent coverage of large burn wounds with autologous cultured human epithelium. New Engl J Med 1984; 311: 448-451. [ Links ]
16. Leigh IM, Purkis PE. Culture grafted leg ulcers. Clin Exp Dermatol 1986; 11: 650-652. [ Links ]
17. Gallico G, O´Connor E, Compton C, Remens JP, Kehinde O, Green H. Cultured epithelial autografts for giant congenital nevi. Plast Reconstr Surg 1989; 84: 1-9. [ Links ]
18. Higgins C, Navsaria H, Stringer M. Use of two stages keratinocytes-dermal grafting to treat the separation site in conjoined twins. J R Soc Med 1994; 87: 108-109. [ Links ]
19. Eaglstein W, Falanga V. Tissue engineering for skin: An update. J Am Acad Dermatol 1998; 39: 1007-1010. [ Links ]
20. Kirsner R, Falanga V, Kerdel F, Katz M, Eaglstein W. Skin grafts as pharmacological agents: pre-wounding of the donor site. Brit J Dermatol 1996; 135: 292-296. [ Links ]
21. Kaiser H, Stark G, Kopp J, Balcerkiewica A, Spilker G, Kreysel H. Cultured autologous keratinocytes in fibrin glue suspension, exclusively and combined with STS-allograft (preliminary clinical and histological report of a new technique). Burns 1994; 20: 23-29. [ Links ]
22. Andreassi L. History of keratinocytes cultivation. Burns 1992; 18: 2-4. [ Links ]
23. Rheinwald J, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell 1975; 6: 331-344. [ Links ]
24. Pellegrini G, Ranno R, De Luca M. The control of epidermal stem cells (holoclones) in the treatment of massive full-thickness burns with autologous keratinocytes cultures on fibrin. Transplantation 1999; 68: 868-879. [ Links ]
25. Camblor L, Meana A, Llaneza JM, Vaquero F, Gómez S, López D. Tratamiento de úlceras vasculares crónicas con equivalentes cutáneos obtenidos mediante ingeniería tisular. Angiología 2003; 55: 21-33. [ Links ]
26. Buckley R, Breazeale E, Edmond J, Brzezienski M. A simple preparation of autologous fibrin glue for skin-graft fixation. Plast Reconstr Surg 1999; 103: 202-206. [ Links ]
27. Sheridan R, Tompkins R. Skin substitutes in burns. Burns 1999; 25: 97-103. [ Links ]
28. Sherman RA, Tran JMT, Sullivan R. Maggot therapy for venous stasis ulcers, Arch Dermatol 1996: 132: 254-256. [ Links ]
29. Dean SJ, Nieber S, Hickerson WL. The use of cultured epithelial autografts in a patient with idiopathic pyoderma gangrenosum. Ann Plast Surg 1991; 26: 194-195. [ Links ]
30. Naughton G, Mansbridge J. Human-based tissue engineered implants for plastic and reconstructive surgery. Clin Plast Surg 1999; 26: 579-586. [ Links ]
31. Martin P. Wound healing aiming for perfect skin regeneration. Science 1997; 276: 75-81. [ Links ]
32. Myers SR, Navsaria HA, Brain AN, Purkis PE, Leigh IM. Epidermal differentiation and dermal changes in healing following treatment of surgical wounds with sheets of cultured allogeneic keratinocytes. Clin Pathol 1995; 48: 1087-1092. [ Links ]
33. Prada S, Salazar M, Muñoz A, Álvarez L. Tratamiento de úlceras venosas con factores de crecimiento derivados de plaquetas autólogas. Rev Asoc Colomb Dermatol Cirug Dermatol 2000; 8: 122-128. [ Links ]